Похожие презентации:
Электронные оболочки атомов
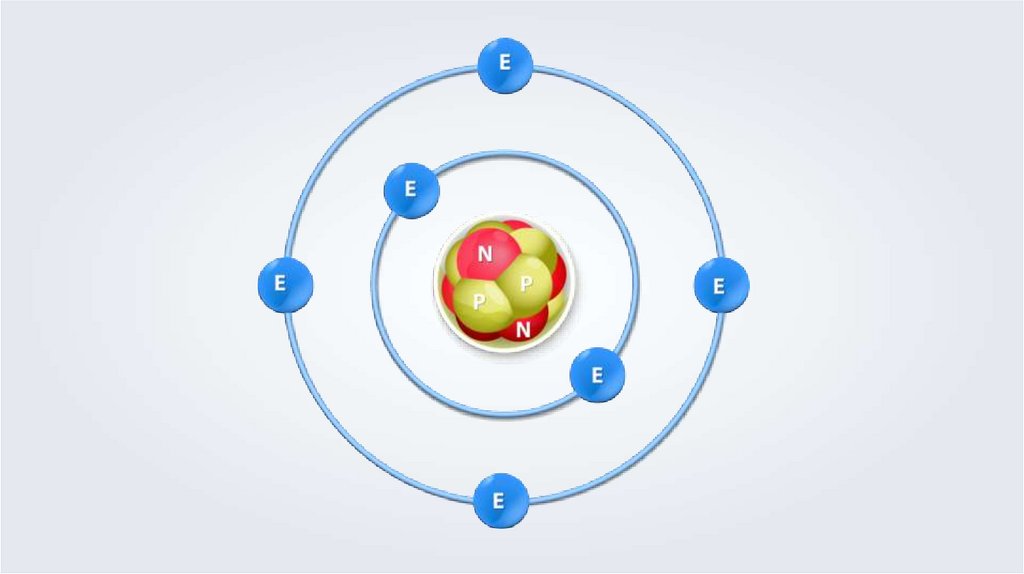
1.
2.
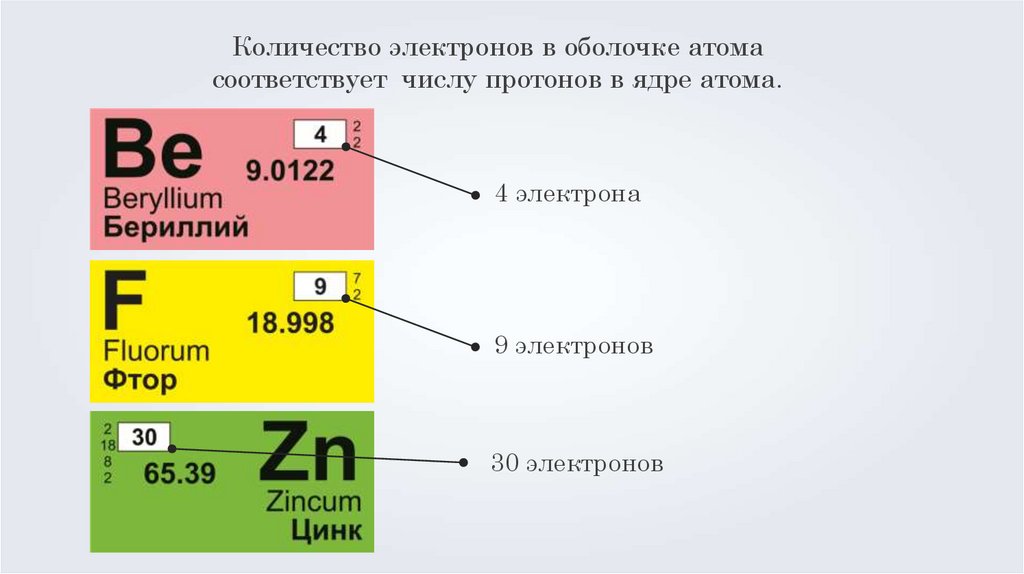
Количество электронов в оболочке атомасоответствует числу протонов в ядре атома.
4 электрона
9 электронов
30 электронов
3.
Орбиталь — пространство вокруг ядраатома, где наиболее вероятно
нахождение данного электрона
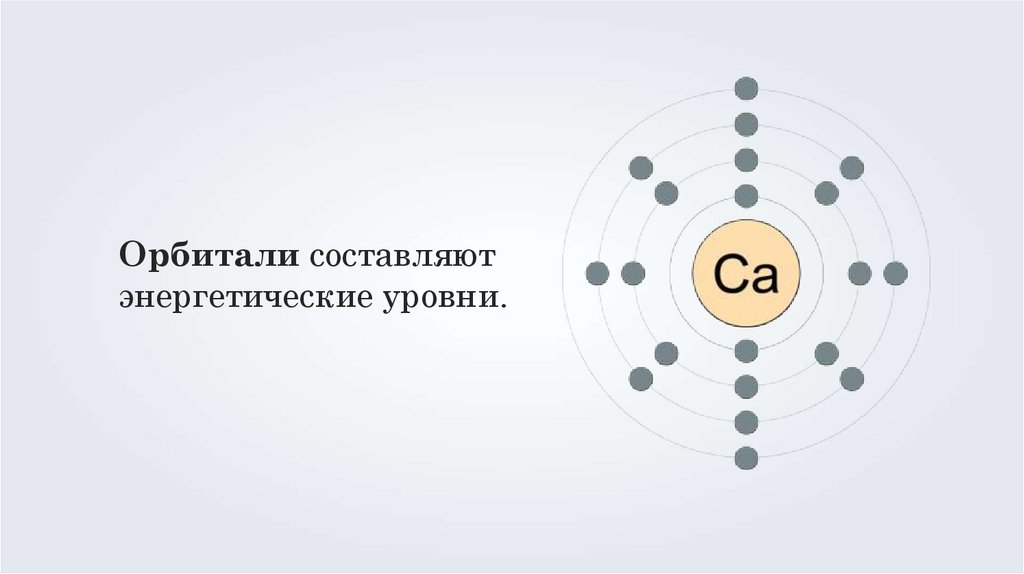
4.
Орбитали составляютэнергетические уровни.
5.
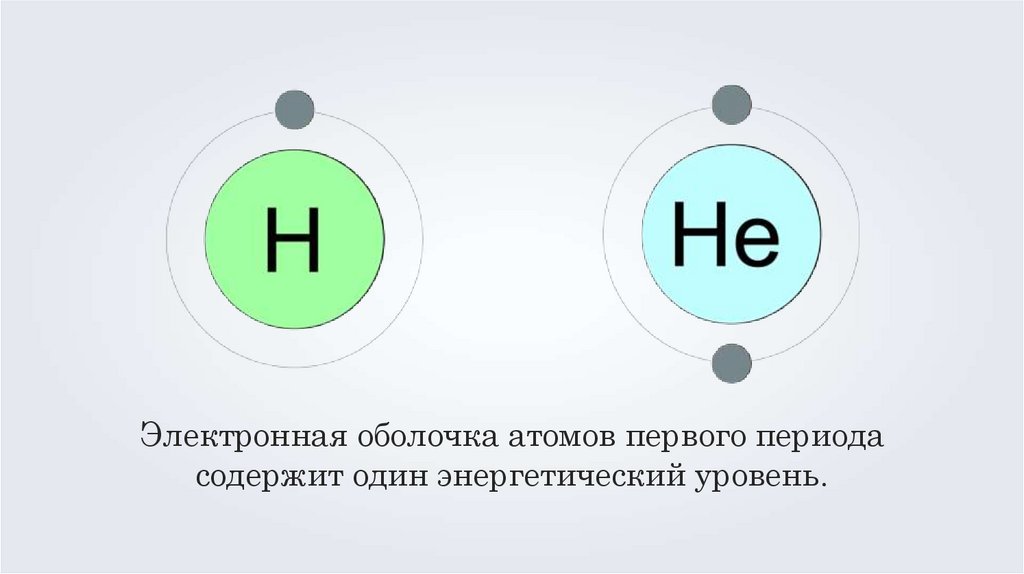
6.
Электронная оболочка атомов первого периодасодержит один энергетический уровень.
7.
Электронная оболочка атомов второго периодасодержит по два энергетических уровня.
8.
Электронная оболочка атомов третьего периодасодержит по три энергетических уровня.
9.
Сколько электронных оболочек имеют атомымагния (Mg), меди (Cu), серебра (Ag)
3 энергетических
уровня
10.
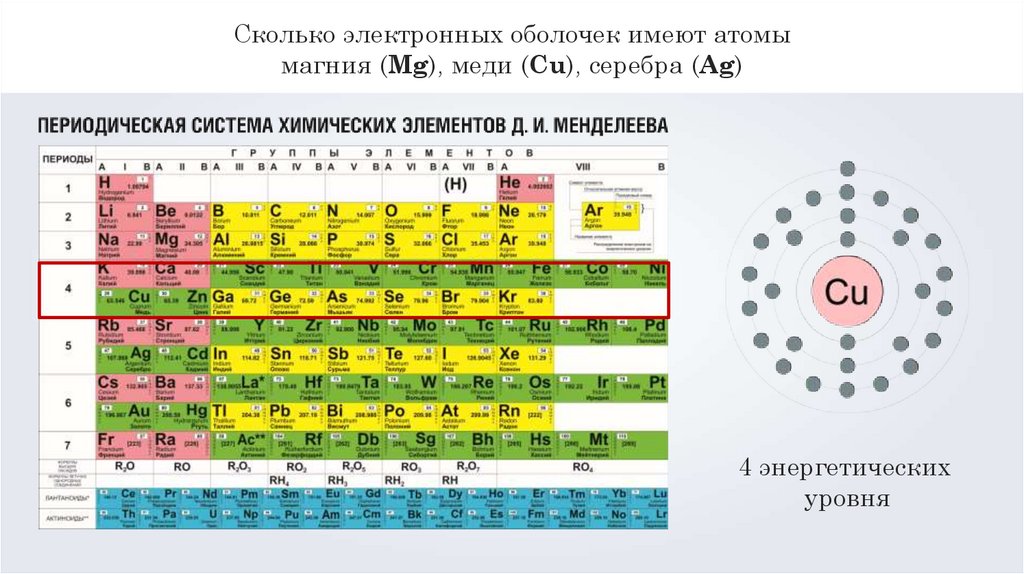
Сколько электронных оболочек имеют атомымагния (Mg), меди (Cu), серебра (Ag)
4 энергетических
уровня
11.
Сколько электронных оболочек имеют атомымагния (Mg), меди (Cu), серебра (Ag)
5 энергетических
уровней
12.
Максимальное число электронов, находящихся на энергетическомуровне можно определить по следующей формуле:
2n2
номер энергетического уровня
13.
Максимальное количество электронов на первом уровне:2⋅12= 2
Максимальное количество электронов на втором уровне:
2⋅22= 8
Максимальное количество электронов на третьем уровне:
2⋅32= 18
Максимальное количество электронов на четвёртом уровне:
2⋅42= 32
14.
15.
Один электрон навнешнем уровне
16.
Три электрона навнешнем уровне
17.
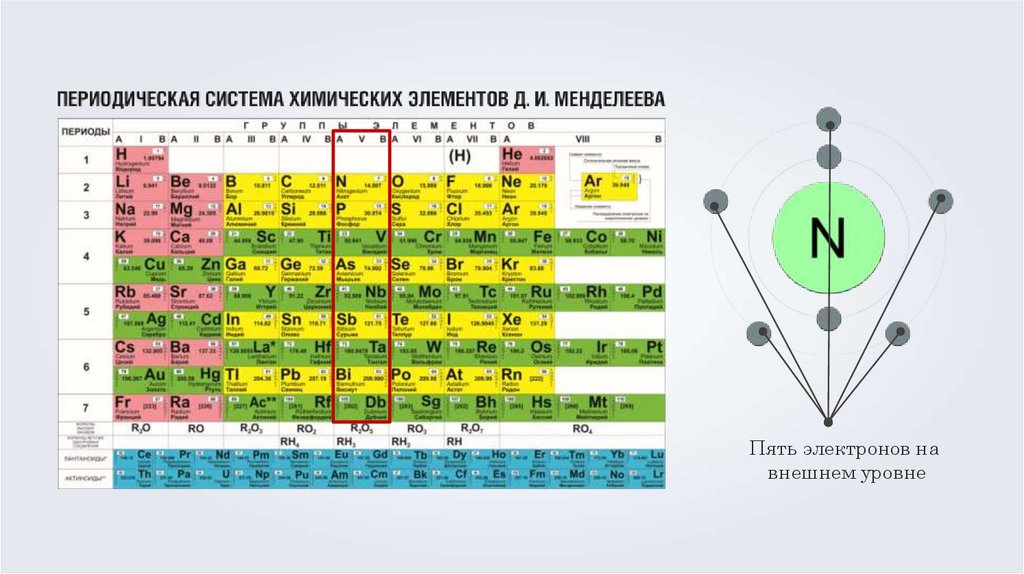
Пять электронов навнешнем уровне
18.
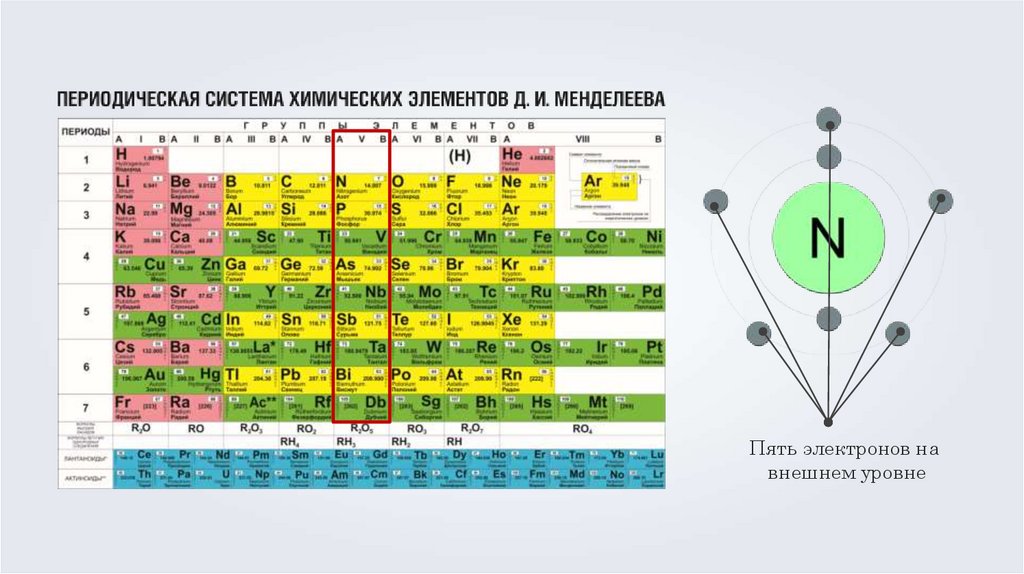
Пять электронов навнешнем уровне
19.
Пять электронов навнешнем уровне
20.
Построение схемы строения электронных оболочекна примере гелия (Не), бора (B), кислорода (O), фтора (F)
1. Определим общее число электронов
в электронной оболочке по
порядковому номеру элемента в
Периодической таблице:
гелий (Не) – имеет два электрона,
бор (B) – имеет пять электронов,
кислород (O) – имеет восемь
электронов,
фтор (F) – имеет девять электронов.
21.
Построение схемы строения электронных оболочекна примере гелия (Не), бора (B), кислорода (O), фтора (F)
Определим число заполняемых
электронами энергетических уровней в
электронной оболочке по номеру
периода:
гелий (Не) – один энергетический
уровень, заполненный двумя
электронами,
бор (B), кислород (O) и фтор (F) – два
энергетических уровня, заполненных
свойственным им количеством
электронов.
Гелий
Бор
Кислород
Фтор
22.
Построение схемы строения электронных оболочекна примере гелия (Не), бора (B), кислорода (O), фтора (F)
А теперь определим число электронов
на каждом энергетическом уровне на
наших примерах:
Гелий (Не) – два электрона на
единственном энергетическом уровне.
Гелий
23.
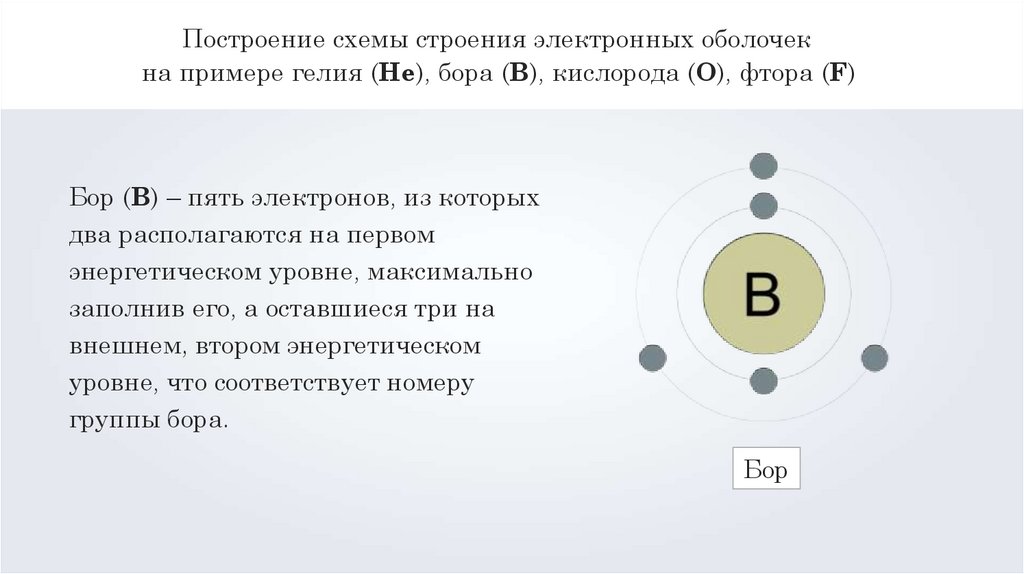
Построение схемы строения электронных оболочекна примере гелия (Не), бора (B), кислорода (O), фтора (F)
Бор (B) – пять электронов, из которых
два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся три на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы бора.
Бор
24.
Построение схемы строения электронных оболочекна примере гелия (Не), бора (B), кислорода (O), фтора (F)
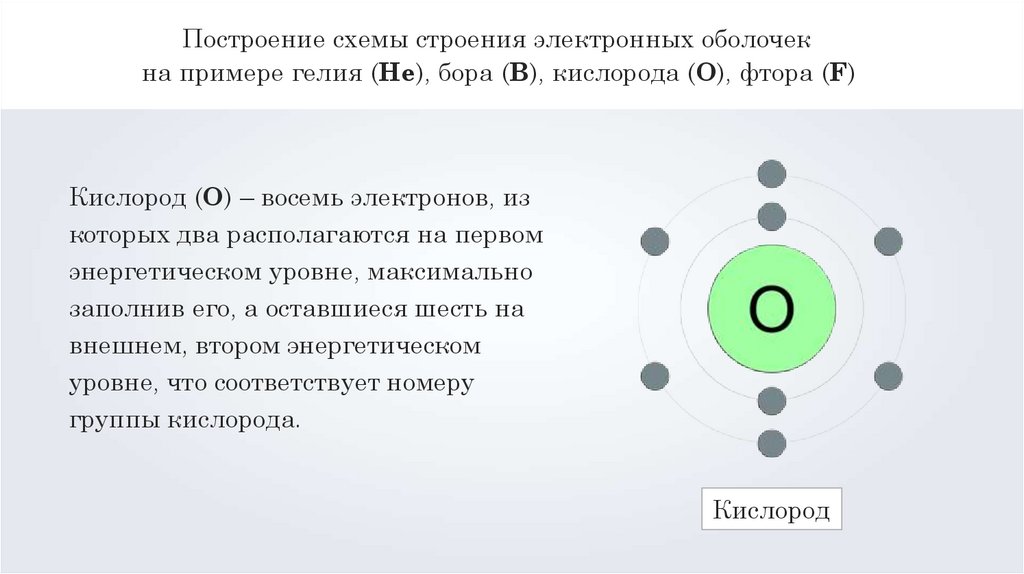
Кислород (O) – восемь электронов, из
которых два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся шесть на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы кислорода.
Кислород
25.
Построение схемы строения электронных оболочекна примере гелия (Не), бора (B), кислорода (O), фтора (F)
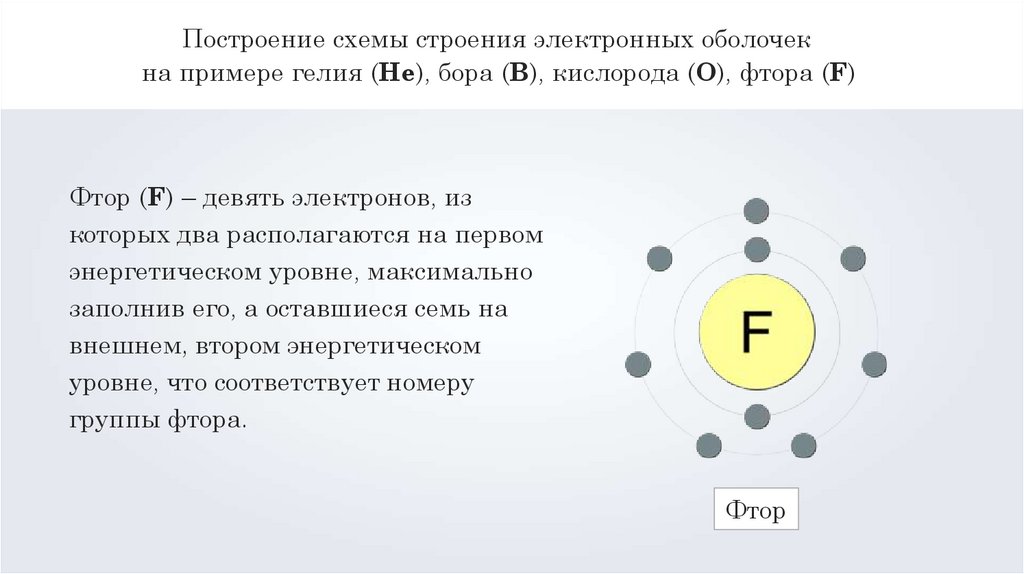
Фтор (F) – девять электронов, из
которых два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся семь на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы фтора.
Фтор
26.
zz
y
y
x
x
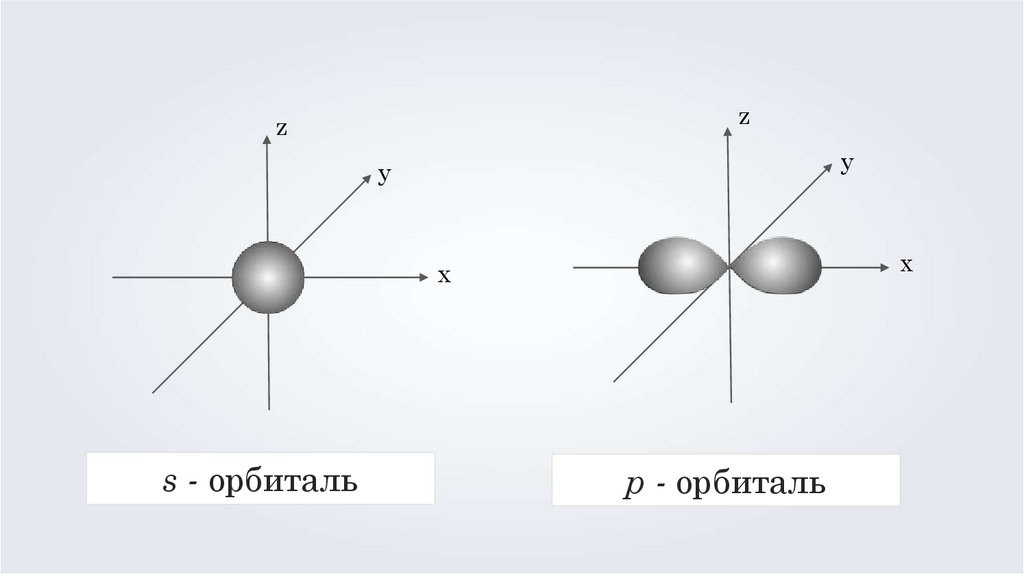
s - орбиталь
p - орбиталь
27.
s – орбиталь Водородаs – орбиталь Гелия
28.
Электронные формулы атомов химических элементовН – 1S1
He – 1S2
Li – 1S22S1
Mg – 1S22S22p63S2
B – 1S22S22p1
29.
Электронные формулы химическихэлементов первых трёх периодов
Н – 1S1
He – 1S2
Li – 1S22S1
Ne – 1S22S22p6
Be – 1S22S2
Ar – 1S22S22p63S23p6
B – 1S22S22p1
AI – 1S22S22p63S23p1
C – 1S22S22p2
Si – 1S22S22p63S23p2
N – 1S22S22p3
P – 1S22S22p63S23p3
O – 1S22S22p4
S – 1S22S22p63S23p4
F – 1S22S22p5
CI – 1S22S22p63S23p5


















 Химия
Химия








