Похожие презентации:
Строение электронных оболочек атомов
1.
Строение электронныхоболочек атомов
П. 40.
2.
Строение атомаЧто
интересно
Химикам
Физикам
3.
Что мы уже знаем• Число электронов равно порядковому
номеру элемента.
• Заряд ядра определяется числом протонов
в ядре атома и равен порядковому номеру
элемента.
• Атом – мельчайшая химически неделимая,
электронейтральная частица вещества.
• Число электронов и протонов в атоме
равны.
4.
Как распределяются электроны ватоме?
• Планетарная модель
1911г Э. Резерфорд
На каждом уровне
(слое) определенное
количество электронов.
Число электронных
уровней = номеру
периода в таблице
Менделеева.
• Период- горизонтальная
строка в периодической
таблице Менделеева.
5.
Первый период: Н и Не• На первом уровне max число электронов 2
• У элементов Н и Не только один уровень:
У водорода 1 электрон, а у гелия -2 электрона.
6.
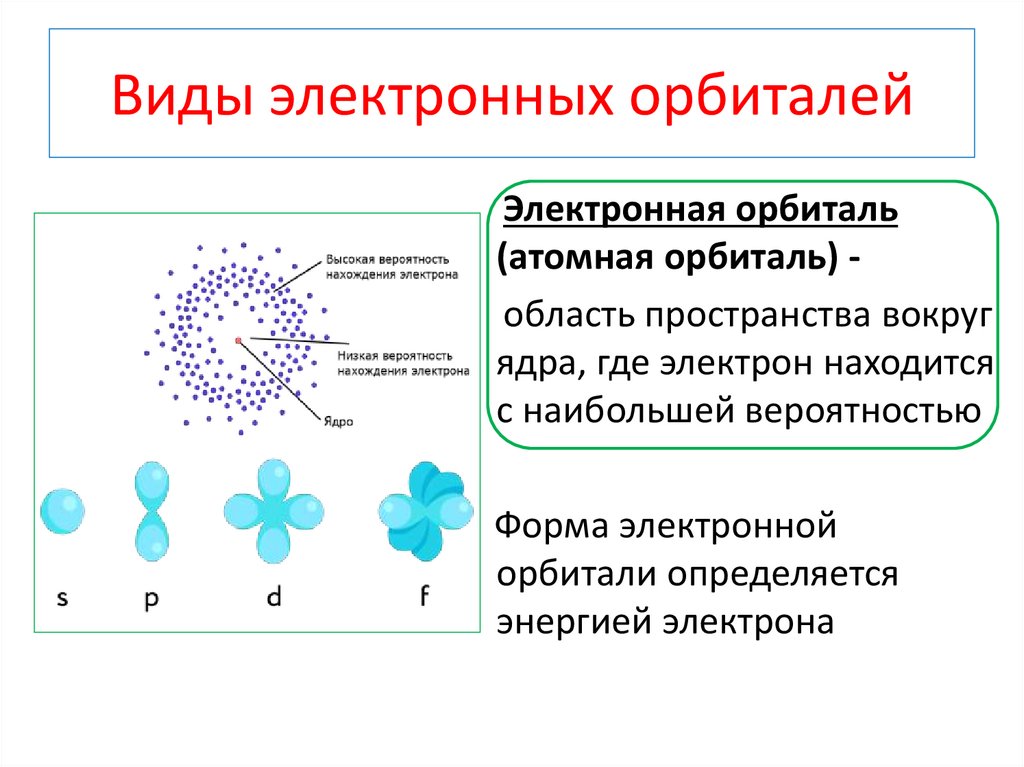
Виды электронных орбиталейЭлектронная орбиталь
(атомная орбиталь) область пространства вокруг
ядра, где электрон находится
с наибольшей вероятностью
Форма электронной
орбитали определяется
энергией электрона
7.
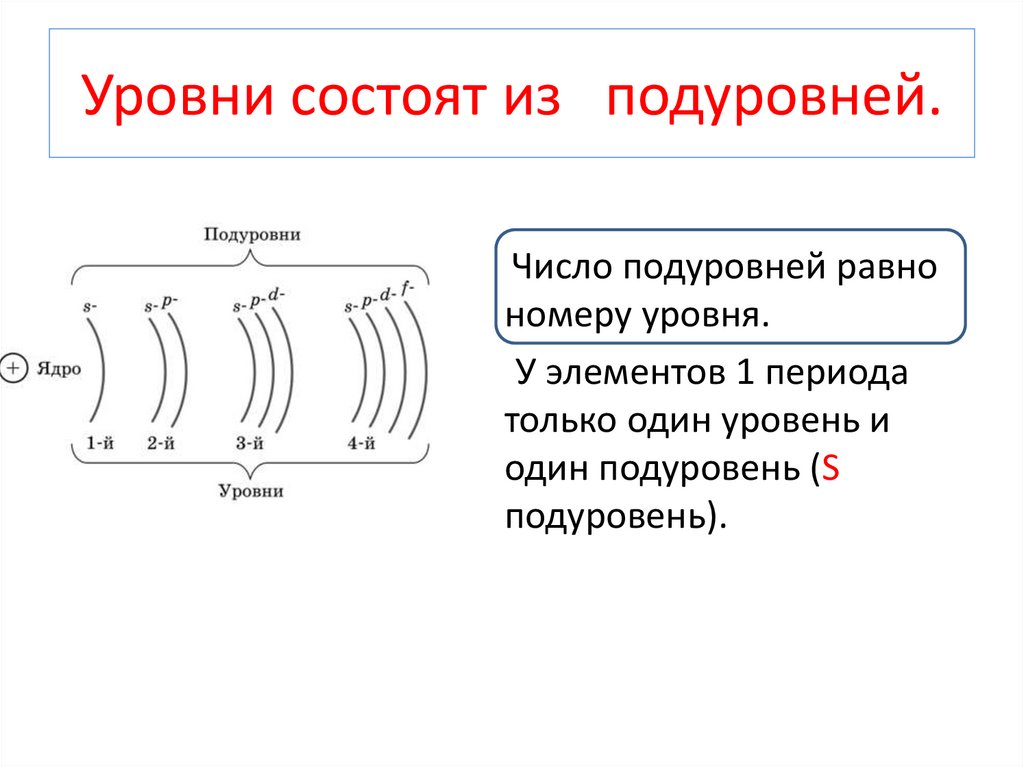
Уровни состоят из подуровней.Число подуровней равно
номеру уровня.
У элементов 1 периода
только один уровень и
один подуровень (S
подуровень).
8.
Второй период: Li Be B C N O F Ne• У элементов 2 периода два уровня:
на первом один подуровень (S подуровень),
на втором –два подуровня (s и p)
9.
Второй период: Li Be B C N O F Ne1s22S22P1 1s22S22P2
1s22S22P3 1s22S22P4
• У элементов 2 периода два уровня:
на первом один подуровень (S подуровень),
на втором –два подуровня (s и p)
10.
Второй период: Li Be B C N O F Ne• Li 1s22s2
• B 1s22s22p1
• O 1s22s22p4
• F 1s22s22p5
• Число электронов на
внешнем энергетическом
уровне у элементов главных
подгрупп равно номеру
группы.
• Группа –вертикальный
столбик в периодической
таблице Менделеева.
11.
Третий период:Na Mg Al Si P S Cl Ar
• Na 1s22s22p63s1
• Mg 1s22s22p63s2
• Al 1s22s22p63s23p1
• Si 1s22s22p63s23p2
• P 1s22s22p63s23p3
• S 1s22s22p63s23p4
• Cl 1s22s22p63s23p5
• Ar 1s22s22p63s23p6
• Число электронов на
внешнем
энергетическом
уровне у элементов
главных подгрупп
равно номеру группы.
12.
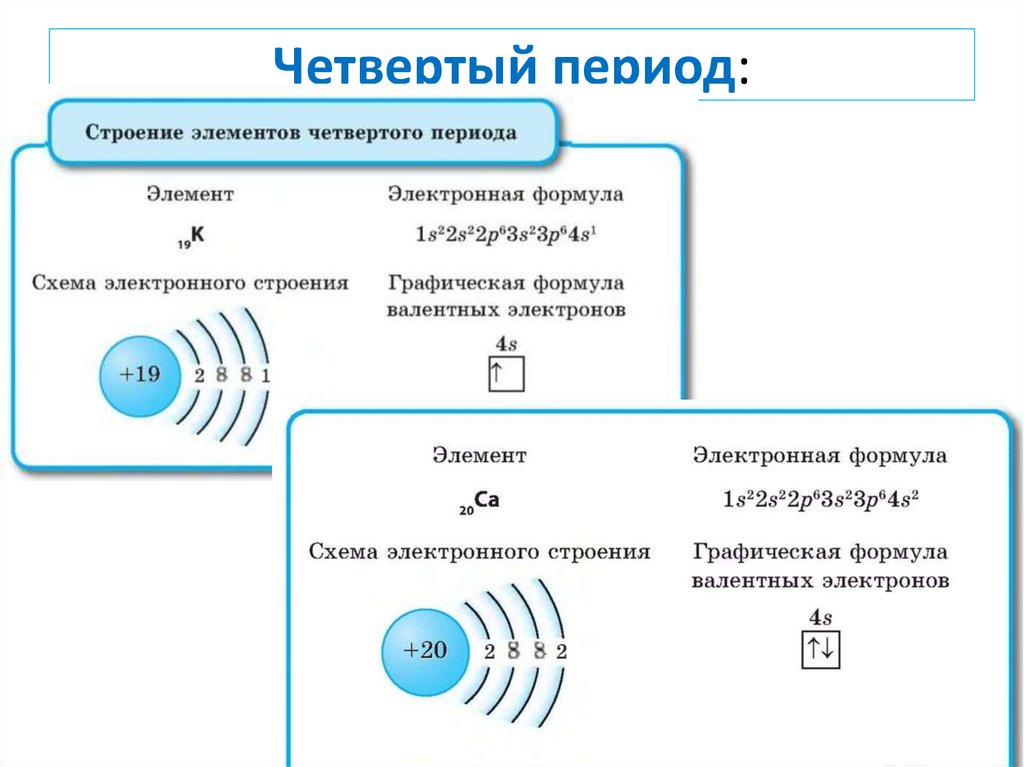
Четвертый период:13.
Домашнее задание• 1. Прочитайте параграф 40
• 2. Выполните упражнения на стр. 171 (2-4)
письменно.
• Заучите наизусть определения из
презентации.










 Химия
Химия








