Похожие презентации:
Биохимия. Химический состав организма
1. БИОХИМИЯ
• БИОХИМИЯ изучает химические ифизико-химические процессы, которые
протекают в живых организмах и лежат в
основе всех проявлений
жизнедеятельности. 2
2. Биохимия изучает:
Химический состав организма.
Функцию различных молекул –
глюкоза, холестерин – изучает
метаболизм.
Регуляцию химических процессов в
организме.
3. Биохимия включает ряд направлений
БИОХИМИЯ СПОРТА
БИОХИМИЯ ПИТАНИЯ
БИОХИМИЯ ЛЕКАРСТВ
БИОХИМИЯ КОСМИЧЕСКАЯ
БИОХИМИЯ ЖИВОТНЫХ
БИОХИМИЯ МИКРООРГАНИЗМОВ
4.
• Предметом изучения биохимии являетсяхимия биологических молекул,
процессы, протекающие в живых
организмах в норме. Медицинская
биохимия ИССЛЕДУЕТ ИЗМЕНЕНИЯ,
ВОЗНИКАЮЩИЕ ПРИ
ПАТОЛОГИЧЕСКИХ СОСТОЯНИЯХ,
ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С
ДЕФЕКТОМ МОЛЕКУЛ.
5. КУРС БИОХИМИИ
1. Структура и функции биомолекул. Это
такие разделы как химия белков, ферменты,
витамины, мембраны, нуклеиновые кислоты.
2. Биоэнергетика и метаболизм клеток –
основное «блюдо» биохимии. Это процессы,
приводящие к освобождению энергии при
окислении углеводов, белков, жиров, а также
процессы синтеза этих соединений в
организме.
6. КУРС БИОХИМИИ
3. Биохимия человека – биохимия
отдельных органов – эндокринной
системы, мышечной системы, крови.
Патогенез патологических изменений
на уровне отдельных молекул.
7. Роль биохимии среди медицинских дисциплин
Биохимия является
фундаментом медицины. Корни
медицины – анатомия,
физиология, гистология. Вся
медицина говорит терминами
биохимическими.
8. Исследуются различные жидкости:
кровь
моча
желчь
спинномозговая жидкость
биоптаты
различные пунктаты
9. Виды желтух
• гемолитическая (отравление грибами инекоторыми ядохимикатами)
• вирусный гепатит (болезнь грязных рук и
парентеральный путь заражения)
• закупорка желчных протоков (камни желчного
пузыря)
• Дифференциальный диагноз можно поставить
только проведя биохимические исследования
крови и мочи больного – определение
билирубина.
10. ПРИЧИНЫ ГИПЕРГЛИКЕМИИ
Алиментарная гипергликемия
Сахарный диабет
Адреналовый тип.
11. История биохимии
• Первая кафедра физиологической химиибыла организована 150 лет назад в
Московском университете. Немного
позднее такая же кафедра была открыта в
Казанском университете. Развивалось
направление статической биохимии –
изучали состав живых организмов.
12.
• В начале 20-го века стала развиватьсядинамическая биохимия – биохимия
обменных процессов. Белок «уреаза»
был получен в кристаллическом виде в
1926 году.
• В 1937 году ученый Кребс открыл
процесс «цикл трикарбоновых кислот».
13.
• 1937 г. - Браунштейн открылреакции переаминирования
аминокислот и показал возможность
синтеза заменимых аминокислот.
• 1953 г. – Уотсон и Криг
предложили модель молекулы
ДНК
14.
• В дальнейшем были открыты иустановлена роль в обмене веществ
таких молекул как протстагландины
(вещества, близкие к гормонам,
вырабатываются в мембранах клеток)
• опиоидные пептиды – короткие
молекулы, состоят из аминокислот
• энкефаланы – состоят из 5 аминокислот,
снимают боль (по типу морфина),
выделяются при патологии.
15. Уровни изучения обменных процессов
Организменный – кровь, моча, желчь,
биоптаты. Животным можно вводить
вещества, меченные радиоактивным
изотопом – глюкоза, меченная по углероду.
Органный – можно изучать почку, печень,
другие органы. При операциях – удаляется
часть щитовидной железы – исследуют
удаленную часть органа
16. Уровни изучения обменных процессов
Клеточный – взять срез (например кожа,
соскоб слизистой). Изучается слой клеток.
Молекулярный уровень – изучают молекулы
белка, нуклеиновых кислот и их свойства.
Обнаруживается молекулярная патология –
серповидно-клеточная анемия. При этом
заболевании в молекуле основного белка
эритроцитов – гемоглобине –
обнаруживается замена в 6-м положении бета
цепи- аминокислота глутамат заменена
валином.
17. Методы биохимии
Исследования на целом организме in
vivo – метод нагрузок – сахарная
нагрузка.
Аналитические методы – берут
образцы тканей, клеток – обработка –
получают различные фракции методом
центрифугирования.
18. Значение биохимии в медицине
Биохимия – теоретическая основа медицина.
Знание биохимии важно для понимания
патогенеза заболеваний.
Диагностическое значение биохимии –
знание нормативов позволяет правильно
поставить диагноз (инфаркт миокарда – боль,
ЭКГ, биохимические маркеры – определяют
внутриклеточные белки, которые поступают
в кровь.
Мировоззренческая роль – понимание
процессов в медицине.
19.
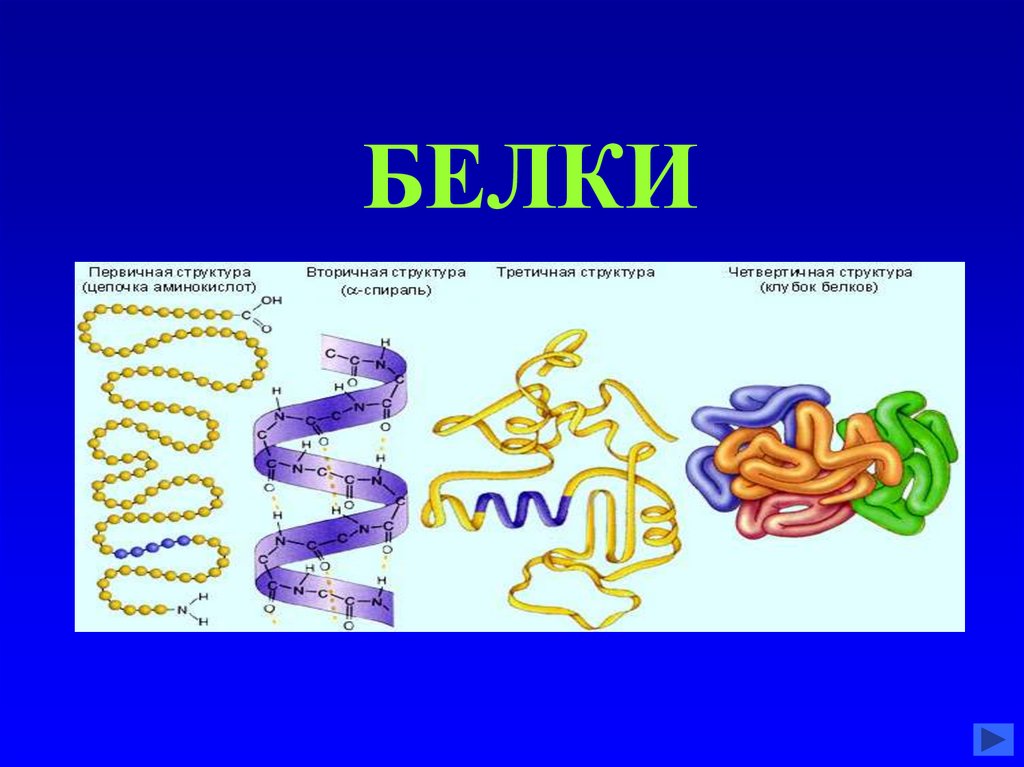
БЕЛКИ20. Химический состав организма человека
Белок – 19,6%. Вода 58,8%.Жир14,7%. Углеводы – 1%.
• Белки – синоним протеины
преобладают по количеству среди
других органических веществ у
человека.
21. Функции белков
• Ферментативная – многие белкиявляются ферментами. Все ферменты по
определению белки. Белки-ферменты
участвуют практически во всех реакциях
организма.
22. Функции белков
• Структурная – многие белки образуютволокна. Они выполняют опорную или
защитную функцию. Главным
компонентом хрящей и сухожилий
является белок коллаген. Связки и кожа
содержат белок эластин.
23. Функции белков
Транспортные белки – связывают ипереносят специфические молекулы или
ионы из одного органа в другой.
Гемоглобин переносит кислород.
Липопротеины переносят липиды. Белок
трансферрин переносит металлы. Белок
церулоплазмин переносит медь.
24. Функции белков
• Защитные белки – иммуноглобулиныили антитела. Это специфические
белки образуются в лимфоцитах и
обладают способностью распознавать
проникающие в организм бактерии и
нейтрализовать их. Фибриноген и
тромбин – белки участвуют в
свертывании крови, предохраняют
организм от потери крови при
повреждении сосуда.
25. Функции белков
• Регуляторные белки – гормоны инсулин,паратгормон
• Энергетическая роль 100 г – 4,1 ккал
(17,2 Кдж). Расходование белков при
голодании.
• Другие функции
26. СОСТАВ БЕЛКОВ
СОСТАВ БЕЛКОВ
99% С, O, H, N, P, S
C более 50%
N – 16,5 % используется при
определении белка по азоту
27. Виды гидролиза белка
кислотный
щелочной
Ферментативный
Продукты гидролиза 20 аминокислот
28. Основные различия в строении белковых молекул
По количеству аминокислот
По соотношению количества различных
аминокислот. Например, в белке
соединительной ткани коллагене 33% от
общего количества аминокислот
составляет глицин, а в молекуле
белкового гормона инсулина,
вырабатываемого в поджелудочной
железе, содержание глицина гораздо
меньше – всего 8%.
29. Основные различия в строении белковых молекул
Различная последовательность чередования
аминокислот. Это означает, что даже при
одинаковом соотношении разных аминокислот в
каких-нибудь двух белках порядок их
расположения этих аминокислот различен, то это
будут разные белки.
Количество полипептидных цепей в различных
белках может варьировать от 1 до 12, но если
больше единицы, то обычно четное (2, 4, 6 и т.п.)
По наличию небелкового компонента, который
называется «ПРОСТЕТИЧЕСКАЯ ГРУППА».
Если ее нет, то это – простой белок, если есть –
сложный белок
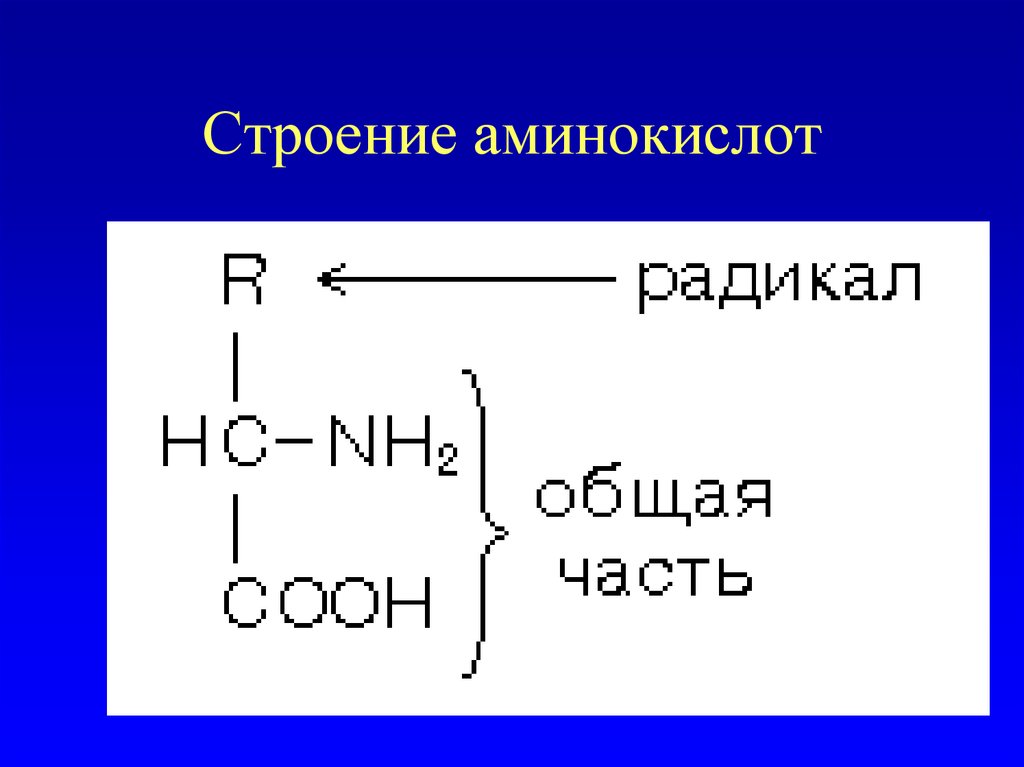
30. Строение аминокислот
31. общие свойства аминокислот
• 1. Все они являются альфааминокислотами. Аминогруппа общейчасти всех аминокислот присоединена к
альфа-углеродному атому.
• 2. По стереохимической конфигурации
альфауглеродного атома все они
принадлежат к L-ряду. Следовательно, все
эти 20 аминокислот имеют совершенно
одинаковый фрагмент молекулы.
Различаются они по строению радикалов.
32. общие свойства аминокислот
• 3. Хорошая растворимость в воде благодаряналичию общего фрагмента молекулы.
Общий фрагмент обладает полярными
свойствами, потому что содержит
карбоксильную группу –COOH (при
физиологическом значении pH эта группа
заряжена отрицательно), и аминогруппы NH2 (при физиологическом значении pH
заряжена положительно).
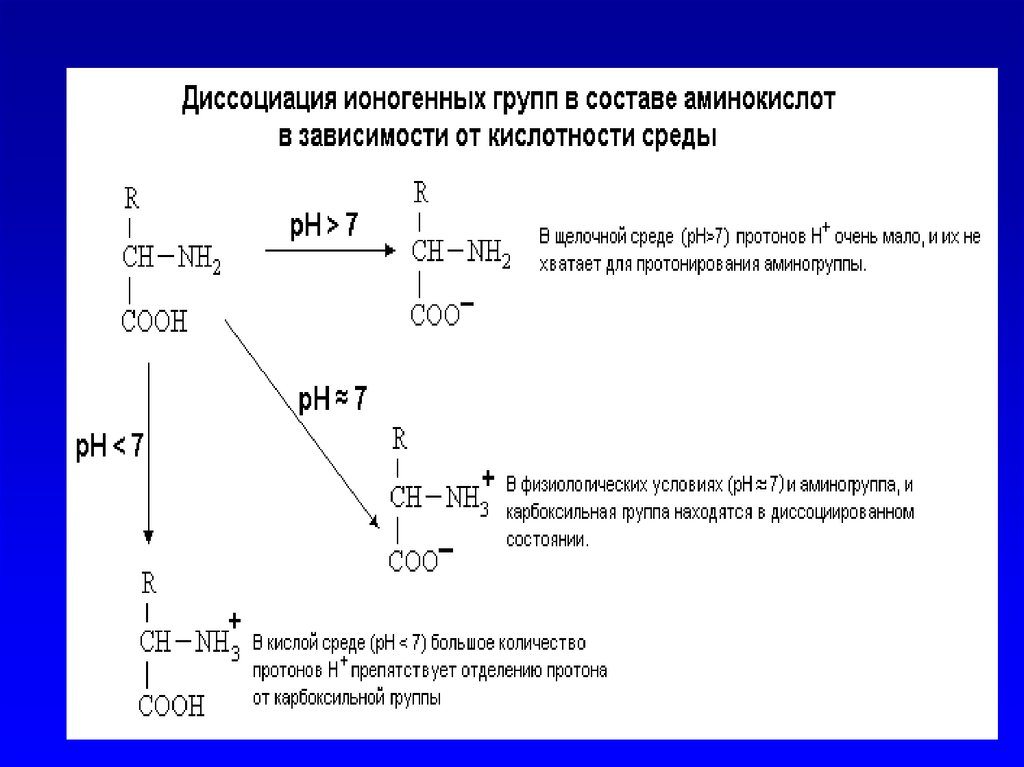
33. общие свойства аминокислот
• 4. Способность к электролитическойдиссоциации. Аминокислоты
существуют в водном растворе в виде
амфионов (биполярных ионов). В
целом такая молекула при
нейтральном значении pH (при pH=7)
электронейтральна.
34. общие свойства аминокислот
• 5. Наличие ИЗОЭЛЕКТРИЧЕСКОЙТОЧКИ (ИЭТ, pI). (ИЭТ) - это
значение pH среды, при котором
молекула амфотерного вещества
(например, аминокислоты) находится
в электронейтральном состоянии.
35. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
Гидрофобные аминокислоты (неполярные).
Компоненты радикалов содержат обычно
углеводородные группы, где равномерно
распределена электронная плотность и нет
никаких зарядов и полюсов. В их составе могут
присутствовать и электроотрицательные
элементы, но все они находятся в углеводородном
окружении. Например, в радикале метионина
сера окружена углеводородными группировками,
которые не позволяют этому элементу проявлять
своих электроотрицательных свойств: -(CH2)2-SCH3. Аналогичная ситуация наблюдается,
например, и в отношении азота, находящегося в
составе радикала триптофана.
36. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
• Гидрофобные аминокислоты(неполярные).
• Глицин
• Аланин
• Валин
• Лейцин
• Изолейцин
• Пролин
37. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
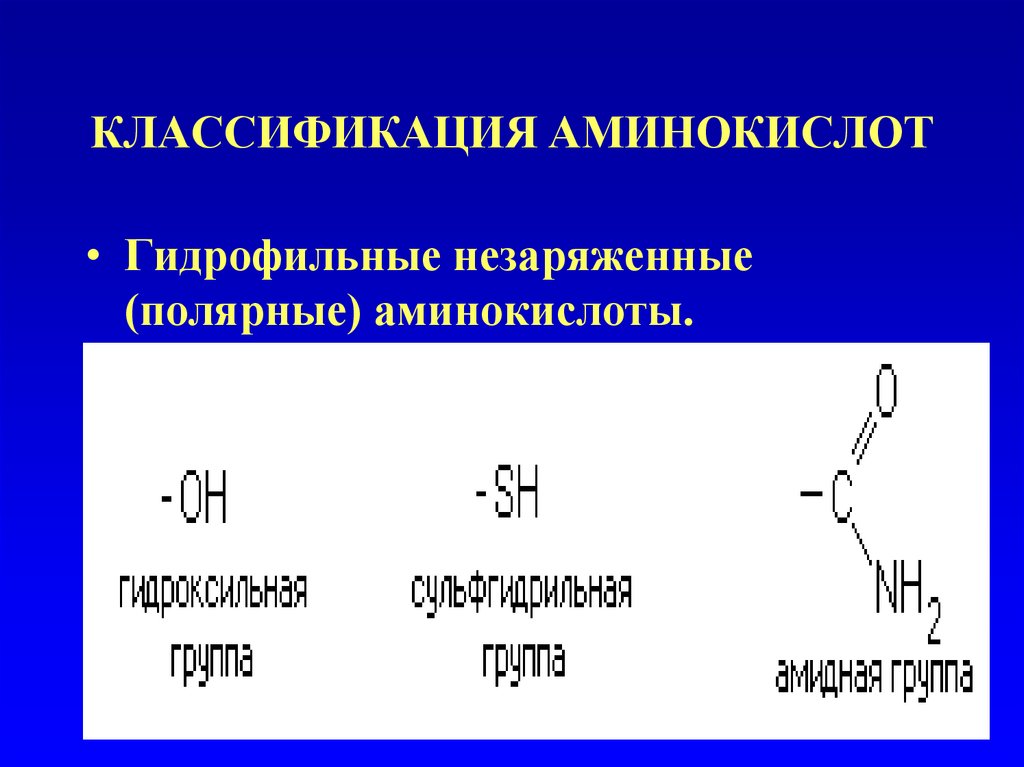
–Гидрофильные незаряженные
(полярные) аминокислоты. Радикалы
таких аминокислот содержат в своем
составе полярные группировки:
Эти группы взаимодействуют с
дипольными молекулами воды,
которые ориентируются вокруг них.
38. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
• Гидрофильные незаряженные(полярные) аминокислоты.
39. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
• Гидрофильные незаряженные (полярные)аминокислоты.
• Серин
• Треонин
• Цистеин
• Метионин
• Аспарагин
• Глутамин
40. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
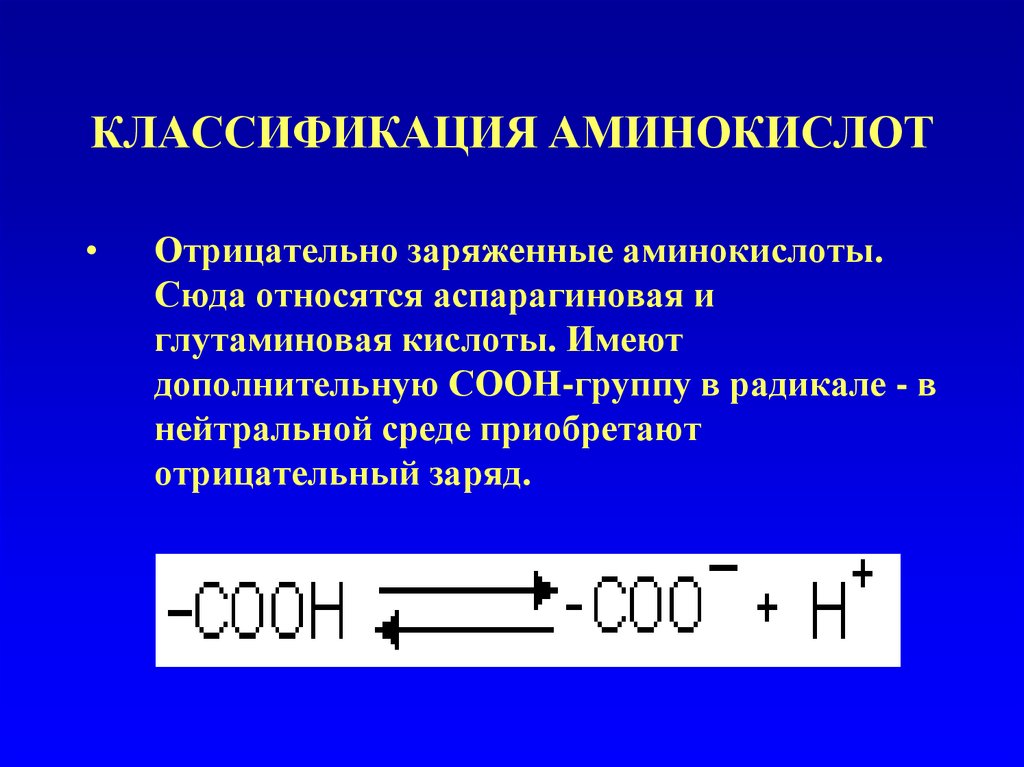
Отрицательно заряженные аминокислоты.
Сюда относятся аспарагиновая и
глутаминовая кислоты. Имеют
дополнительную СООН-группу в радикале - в
нейтральной среде приобретают
отрицательный заряд.
41. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
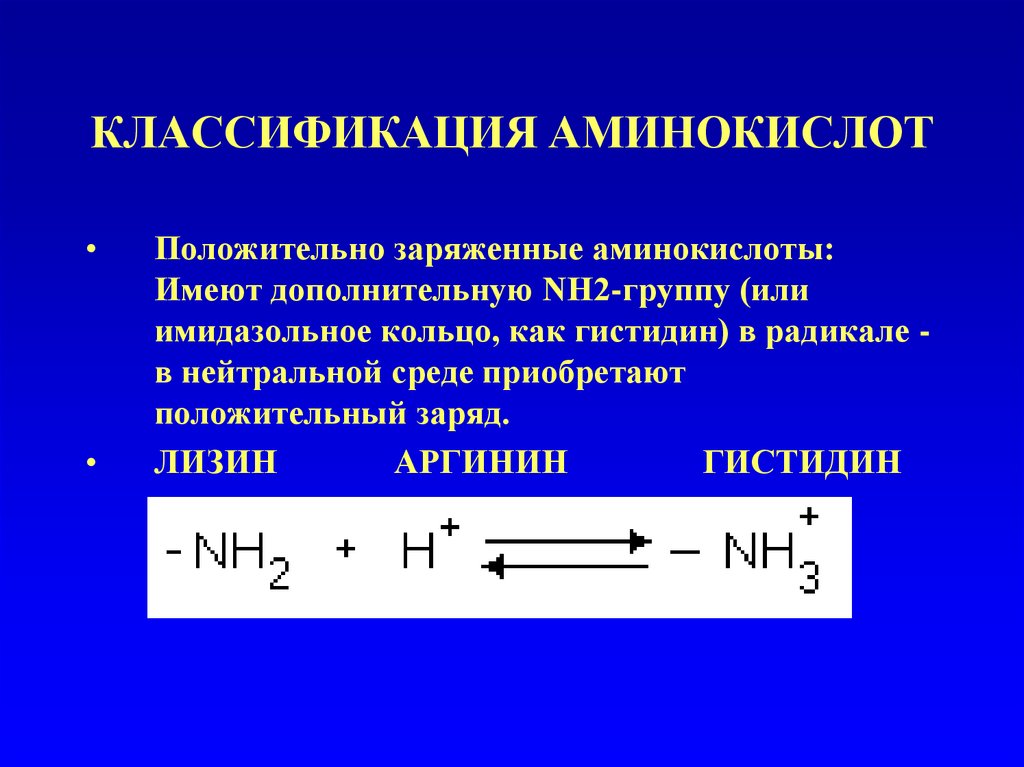
Положительно заряженные аминокислоты:
Имеют дополнительную NH2-группу (или
имидазольное кольцо, как гистидин) в радикале в нейтральной среде приобретают
положительный заряд.
ЛИЗИН
АРГИНИН
ГИСТИДИН
42. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
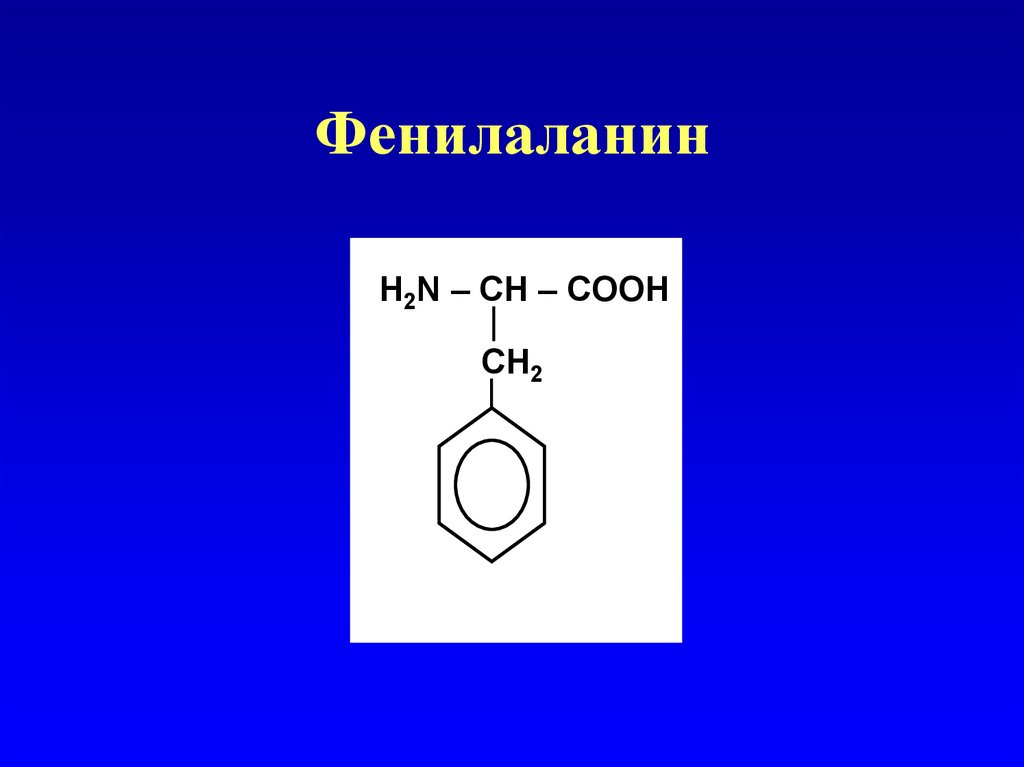
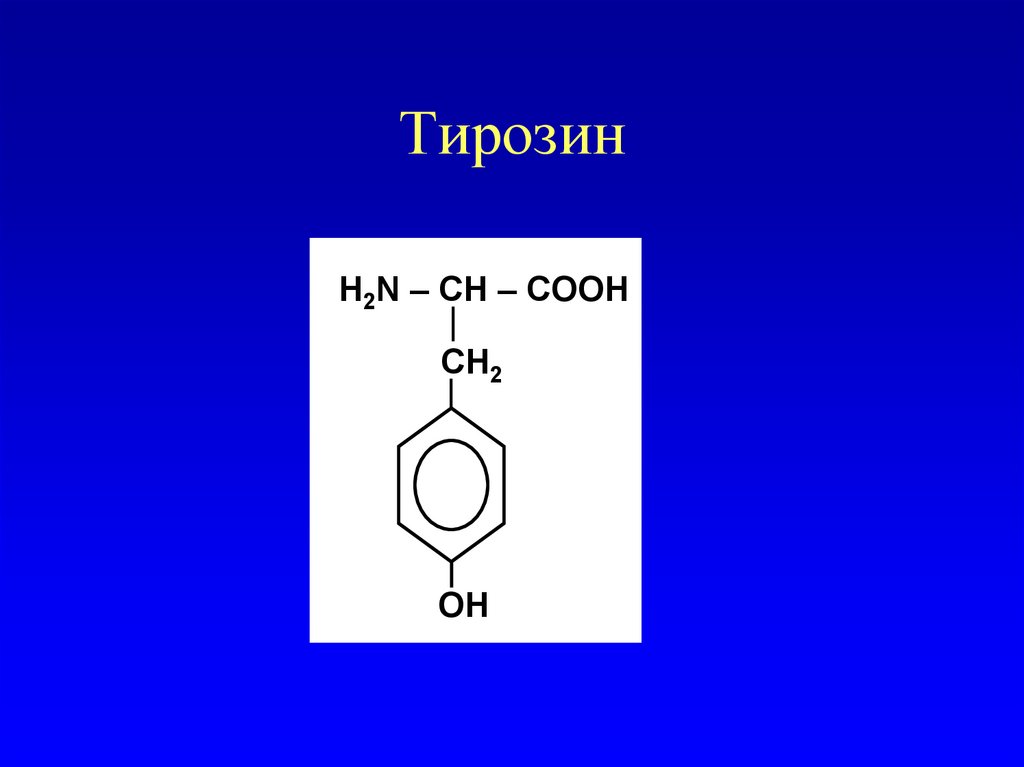
Ароматические аминокислоты
Фенилаланин
Тирозин
Триптофан
43. Биологическая классификация.
• Незаменимые аминокислоты, их ещеназывают "эссенциальные". Они не могут
синтезироваться в организме человека и
должны обязательно поступать с пищей. Их
8 и еще 2 аминокислоты относятся к
частично незаменимым.
• Незаменимые: метионин, треонин, лизин,
лейцин, изолейцин, валин, триптофан,
фенилаланин.
• Частично незаменимые: аргинин, гистидин.
44. Биологическая классификация
• Заменимые (могут синтезироваться ворганизме человека). Их 10:
глутаминовая кислота, глутамин,
пролин, аланин, аспарагиновая
кислота, аспарагин, тирозин, цистеин,
серин и глицин.
45.
46. Методы определения молекулярной массы белков 13.09.
Методы определениямолекулярной массы белков
• Ультрацентрифугирование
(седиментационный анализ)
• Расчет по химическому компоненту
• Гельфильтрация
13.09.
47. Фенилаланин
H2N – СН – COOHСН2
48. Тирозин
H2N – СН – COOHСН2
OН
49. Цистеин
H2N – СН – COOHСН2
SН
50. Метионин
H2N – СН – COOHСН2
СН2
S
СН3
51.
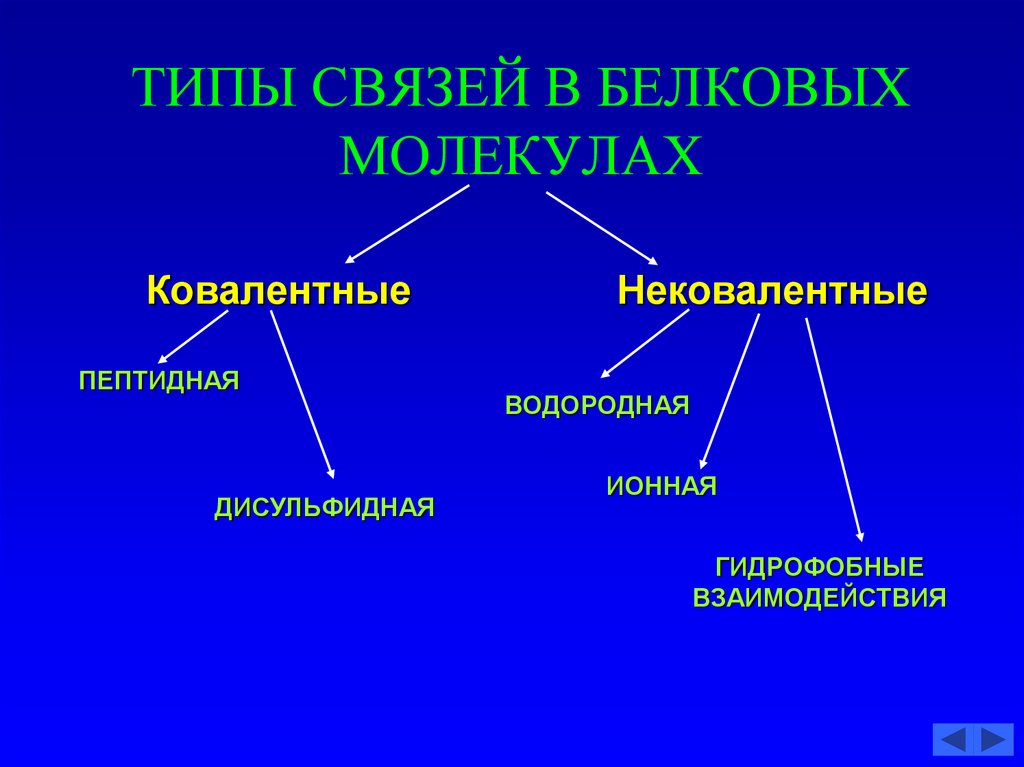
52. ТИПЫ СВЯЗЕЙ В БЕЛКОВЫХ МОЛЕКУЛАХ
КовалентныеПЕПТИДНАЯ
ДИСУЛЬФИДНАЯ
Нековалентные
ВОДОРОДНАЯ
ИОННАЯ
ГИДРОФОБНЫЕ
ВЗАИМОДЕЙСТВИЯ
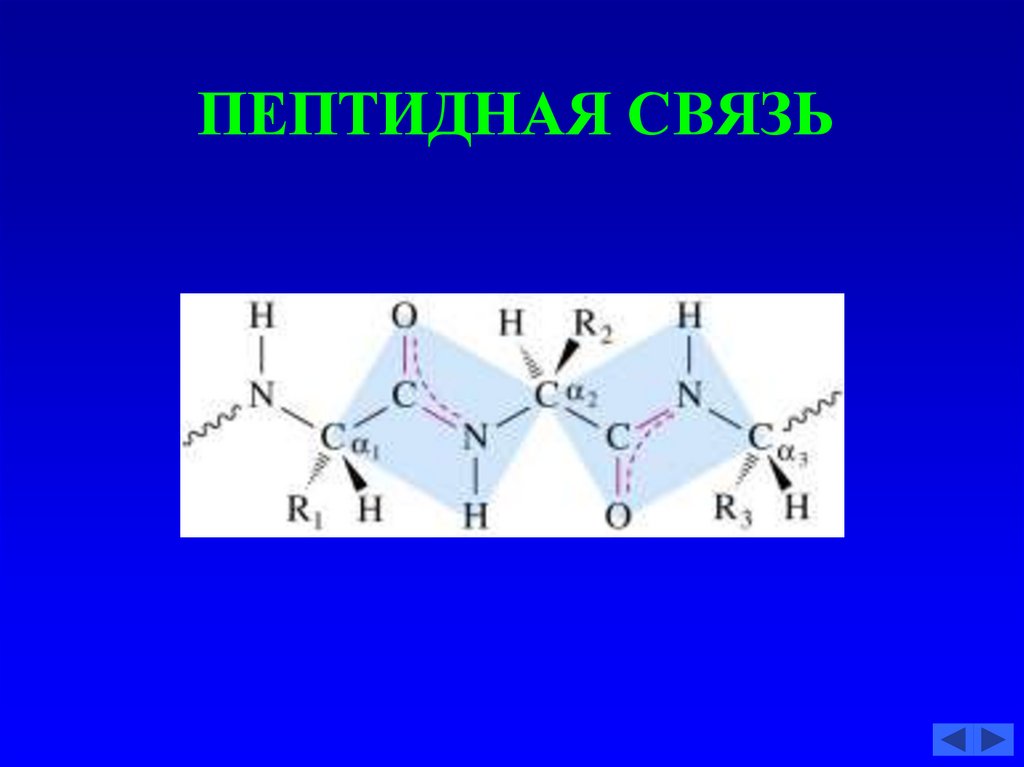
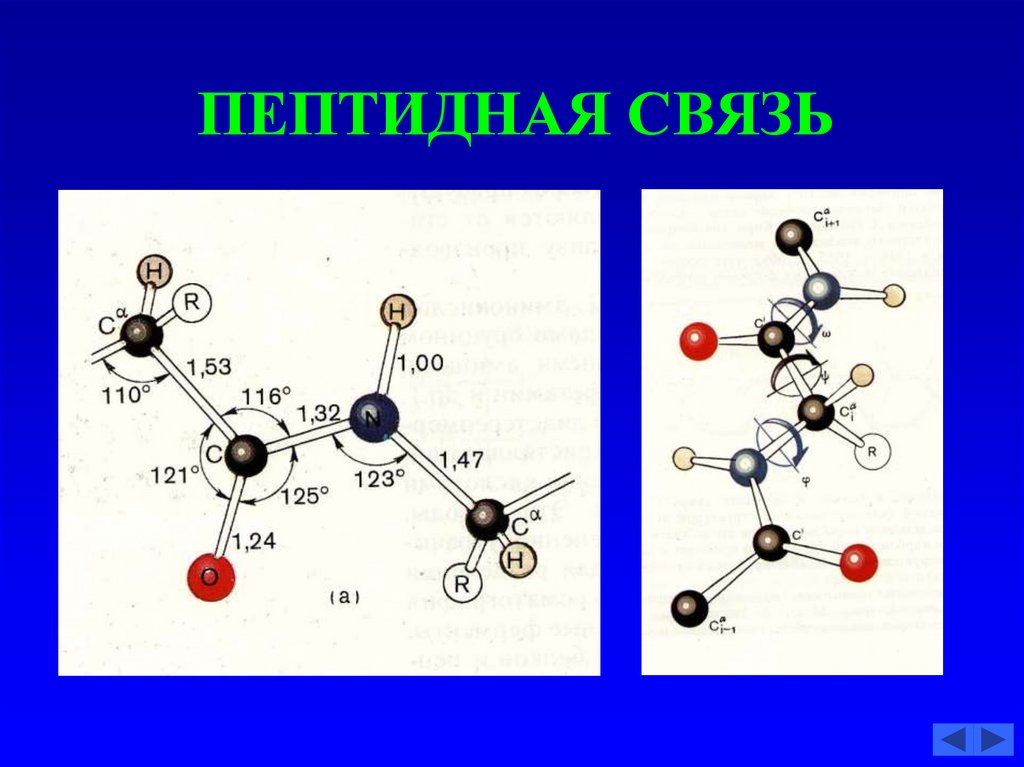
53. ПЕПТИДНАЯ СВЯЗЬ
54. ПЕПТИДНАЯ СВЯЗЬ
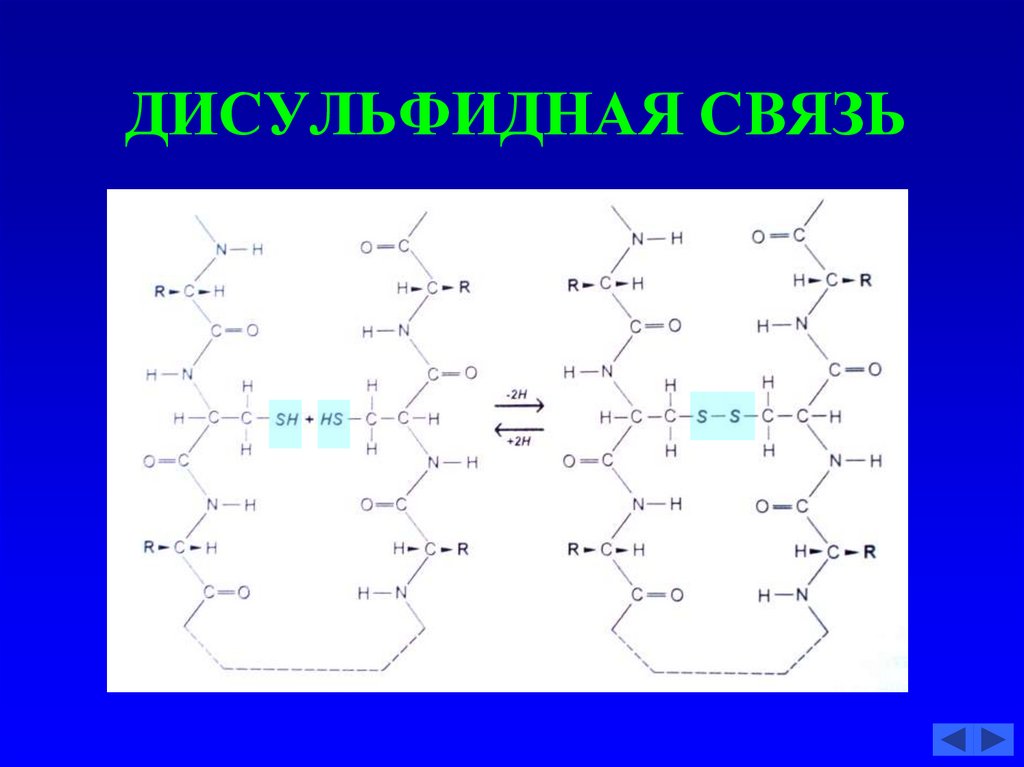
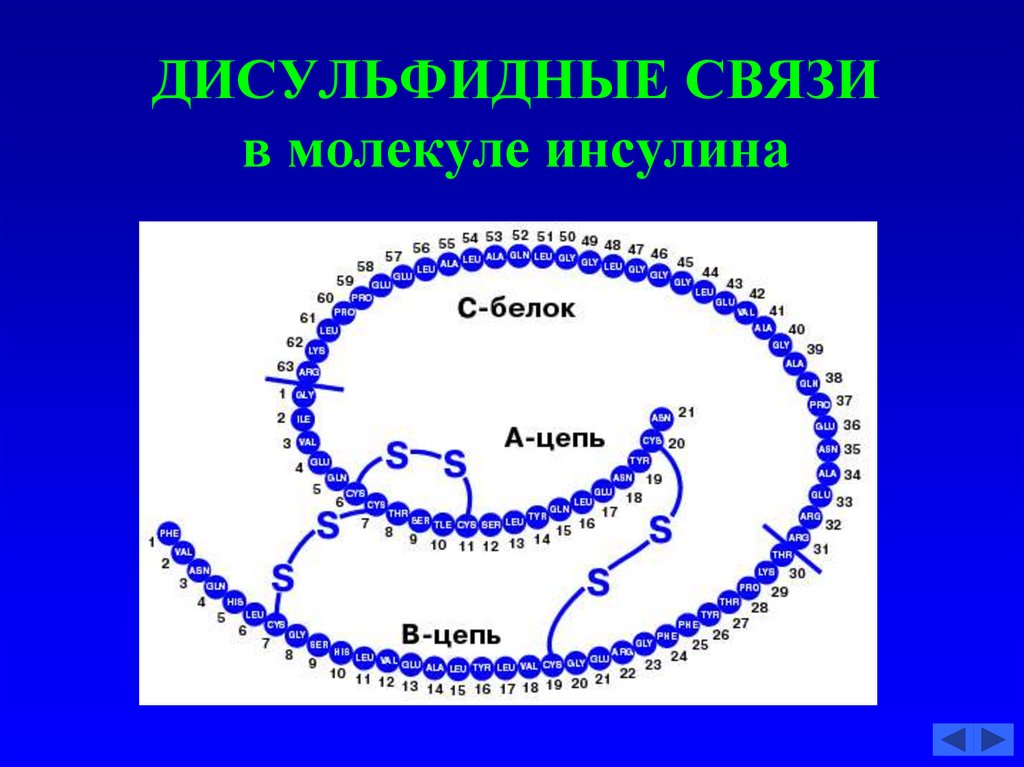
55. ДИСУЛЬФИДНАЯ СВЯЗЬ
56. ДИСУЛЬФИДНЫЕ СВЯЗИ в молекуле инсулина
57. Селеновый статус Хабаровского края
д.м.н., профессор Ковальский Ю.Г.58.
Martin Heinrich Klaproth(1743 –1817)
59. Биологическая роль селена
• Входит в состав простетической группыфермента глутатионпероксидазы
• Участвует в антиоксидантной защите
мембран клеток от повреждения
активными формами кислорода
• Инактивация ПОЛ
60. Биологическая роль селена
• участвует в детоксикацииперекиси водорода и
гидроперекисей ненасыщенных
жирных кислот , препятствует
образованию чрезвычайно
реакционно-способного
гидроксильного радикалаактивного инициатора
61. Биологическая роль селена
Кардиопротективный эффект:уменьшает количество
гидропероксидов фосфолипидов и
холестерина в составе ЛПНП;
защита эндотелия от воздействия
свободных радикалов путем
предотвращения образования
пероксинитрита;
62. Биологическая роль селена
• дефицит селена приводит к изменениюсоотношения тромбоксан/простациклин,
следствием чего является вазоконстрикция
и нестабильность атеросклеротической
бляшки.
63. Биологическая роль селена
• дефицит селена приводит к изменениюсоотношения тромбоксан/простациклин,
следствием чего является вазоконстрикция
и нестабильность атеросклеротической
бляшки.
64. Биологическая роль селена
Антиканцерогенный эффект.Иммуномодулирующий эффект.
Участие в синтезе тиреоидных гормонов
( селен является компонентом дейодиназ,
участвующих в конверсии тироксина (Т4) в
(ТЗ), осуществляя дейодирование наружного
кольца Т4).
65.
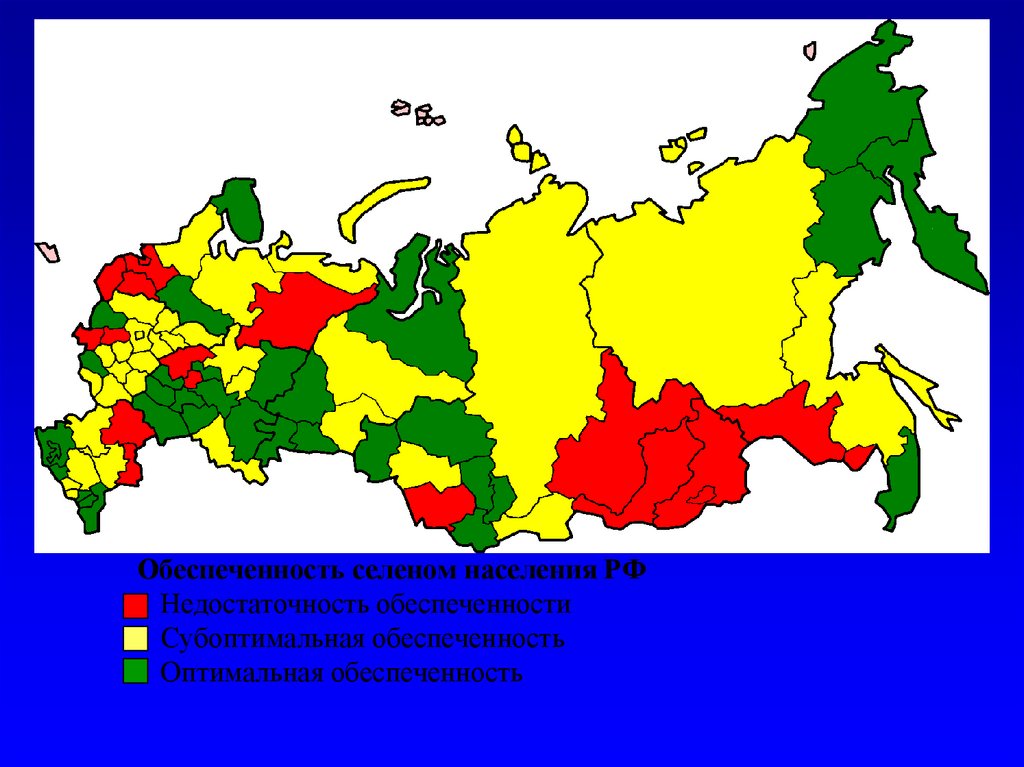
Обеспеченность селеном населения РФ• Недостаточность обеспеченности
• Субоптимальная обеспеченность
• Оптимальная обеспеченность
66.
Цель исследования:* комплексная оценка селенового статуса
Хабаровского края
Объект исследования:
* доноры крови (возраст 20-50 лет),
продукты питания, рыба
Предмет исследования:
* содержание селена в сыворотке крови,
биологических объектах Хабаровского края
Время проведения исследований
2005 – 2014 годы
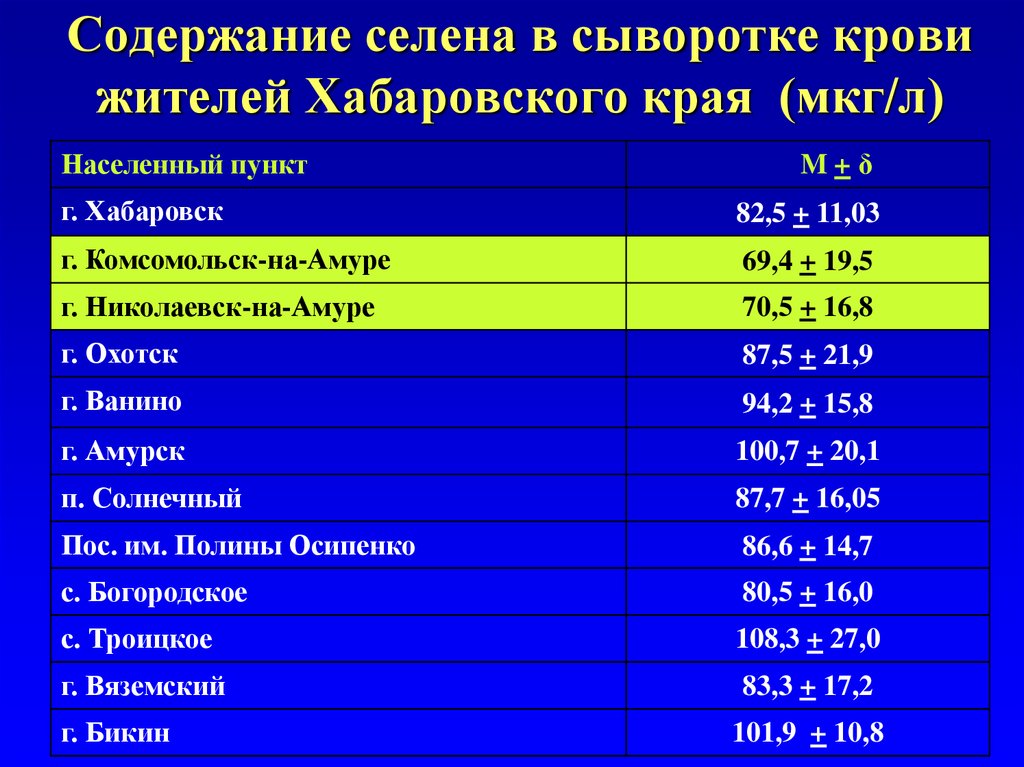
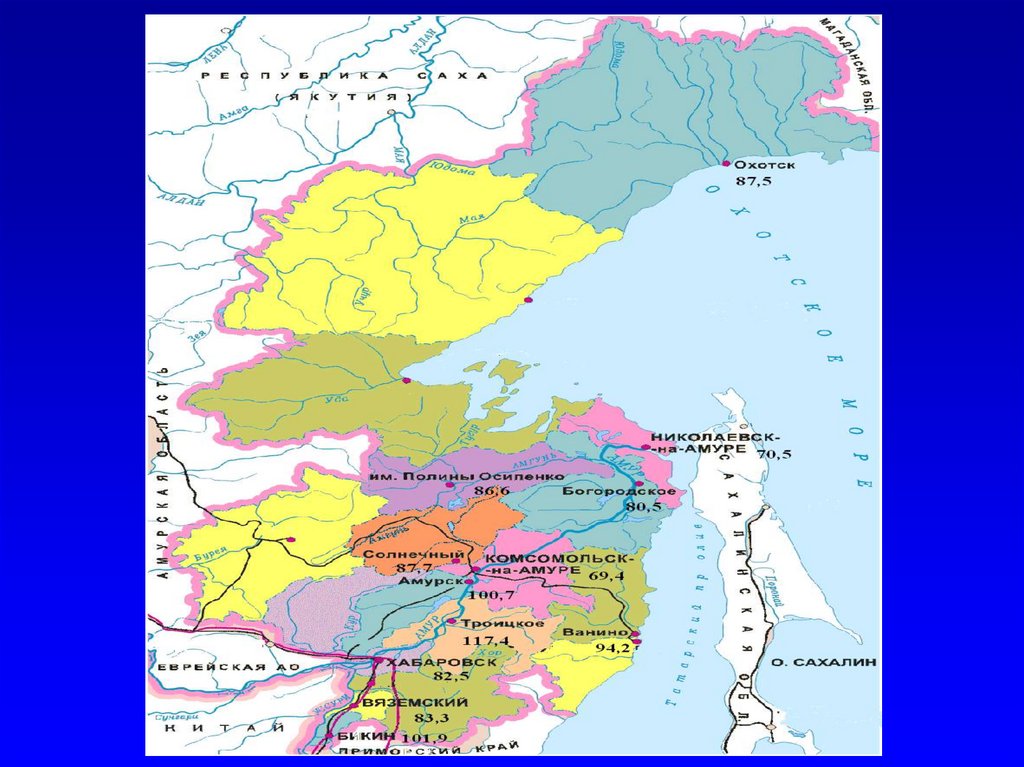
67. Содержание селена в сыворотке крови жителей Хабаровского края (мкг/л)
Населенный пунктM+δ
г. Хабаровск
82,5 + 11,03
г. Комсомольск-на-Амуре
69,4 + 19,5
г. Николаевск-на-Амуре
70,5 + 16,8
г. Охотск
87,5 + 21,9
г. Ванино
94,2 + 15,8
г. Амурск
100,7 + 20,1
п. Солнечный
87,7 + 16,05
Пос. им. Полины Осипенко
86,6 + 14,7
с. Богородское
80,5 + 16,0
с. Троицкое
108,3 + 27,0
г. Вяземский
83,3 + 17,2
г. Бикин
101,9 + 10,8
68.
69. Обеспеченность селеном жителей Хабаровского края
У практически здоровых жителейХабаровского края установлен дефицит
селена с уровнем микроэлемента в
сыворотке крови в пределах 60-80% от
величины физиологического оптимума (т.е.
в пределах 70-90 мкг/л).
70. Обеспеченность селеном жителей Хабаровского края
• Минимальные средние значениясодержания селена выявлены у жителей
г.Комсомольска-на-Амуре (69,4 + 19,5
мкг/л),
• Максимальные (108,3 + 27,0 мкг/л) у
жителей с. Троицкое.
71. Обеспеченность селеном жителей Хабаровского края
• Индивидуальные значения уровня Seв сыворотке крови достигают
критических значений - 50 мкг/л и
ниже в городах
• Вяземский,
• Комсомольск-на-Амуре
• Николаевск-на-Амуре
72. Обеспеченность селеном жителей Хабаровского края
• Доля лиц с недостаточнымпотреблением Se по всем
обследованным регионам составила
83%, что свидетельствует о
необходимости коррекции Se статуса в
Хабаровском крае.
73.
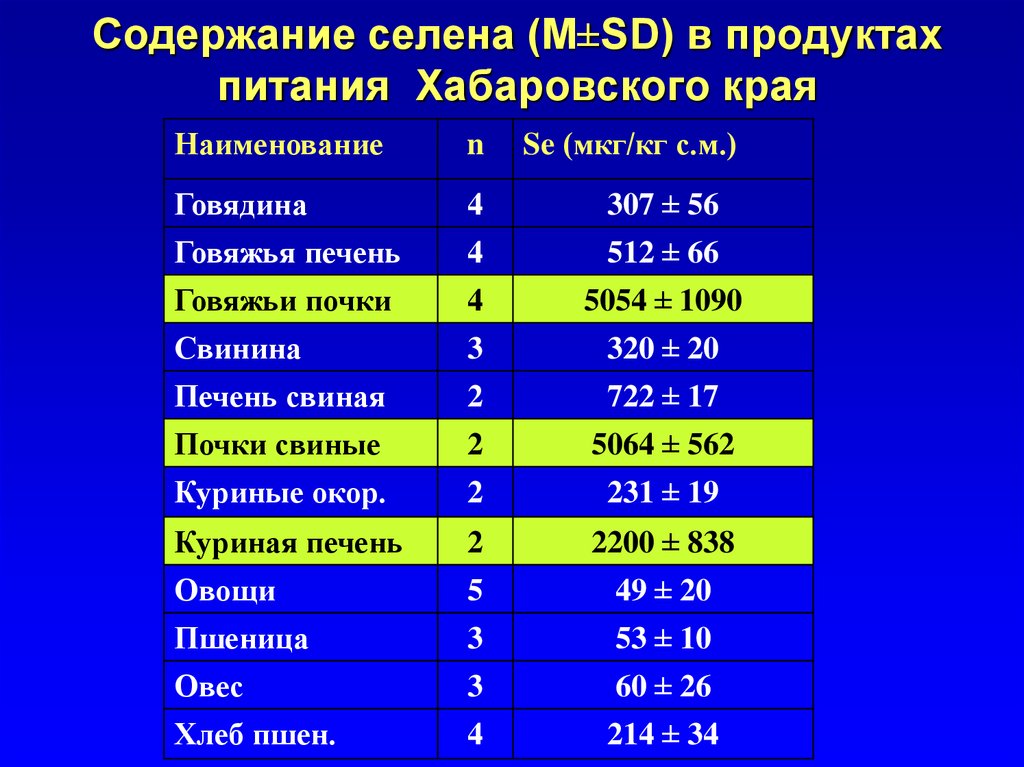
Содержание селена (M±SD) в продуктахпитания Хабаровского края
Наименование
n
Se (мкг/кг с.м.)
Говядина
4
307 ± 56
Говяжья печень
4
512 ± 66
Говяжьи почки
4
5054 ± 1090
Свинина
3
320 ± 20
Печень свиная
2
722 ± 17
Почки свиные
2
5064 ± 562
Куриные окор.
2
231 ± 19
Куриная печень
2
2200 ± 838
Овощи
5
49 ± 20
Пшеница
3
53 ± 10
Овес
3
60 ± 26
Хлеб пшен.
4
214 ± 34
74. Вклад различных продуктов питания в потребление Se жителями Хабаровска
молочныепродукты
яйца
6,9
8,7
овощи
мясо
0,15
29,7
33,46
зерновые
21,07
рыба
75. Содержание селена в пресноводной рыбе Дальнего Востока
• Уровни накопления селена в пресноводнойрыбе в среднем 283 мкг/кг мышечной ткани.
• Существенные видовые различия в
способности рыбы аккумулировать селен
• Один и тот же вид рыбы способен
аккумулировать разные количества селена в
зависимости от места обитания
• Преобладает количество видов рыбы с низким
содержанием селена
76. ВЫВОДЫ:
• впервые проведенная комплексная оценкаSe статуса населения Хабаровского края
позволила установить дефицит селена
• Угрожающе низкая обеспеченность селеном
выявлена в таких городах, как
Комсомольск-на-Амуре и Николаевск-наАмуре
• полученные нами сведения могут быть
использованы для составления программы
оптимизации Se статуса населения
Хабаровского края.
77.
ВЫВОДЫ:• Наиболее безопасным путем коррекции
является обогащение кормов
сельскохозяйственной птицы и животных в
пищевой цепи, что должно стать одной из
главных составляющих региональной
программы по снижению прогрессирования
депопуляционных процессов в регионе за
счет повышения выживаемости и
качества жизни его жителей.
78. ВЫВОДЫ:
• С учетом прогнозируемого падениясодержания микроэлемента в
продуктах растениеводства
становится необходимым
осуществление мониторинга уровня
селена в объектах окружающей среды
и прогнозирование селенового статуса
территорий.































































 Биология
Биология Химия
Химия








