Похожие презентации:
Энергетическая диаграмма орбиталей многоэлектронного атома
1.
Энергетическая диаграммаорбиталей
многоэлектронного атома
Е
7p
7s
6p
6d
5d
6s
5p
5f
4f
4d
5s
4p
3d
4s
3p
3s
2s
2p
1s
Лекция 3. Многоэлектронные атомы.
1
2.
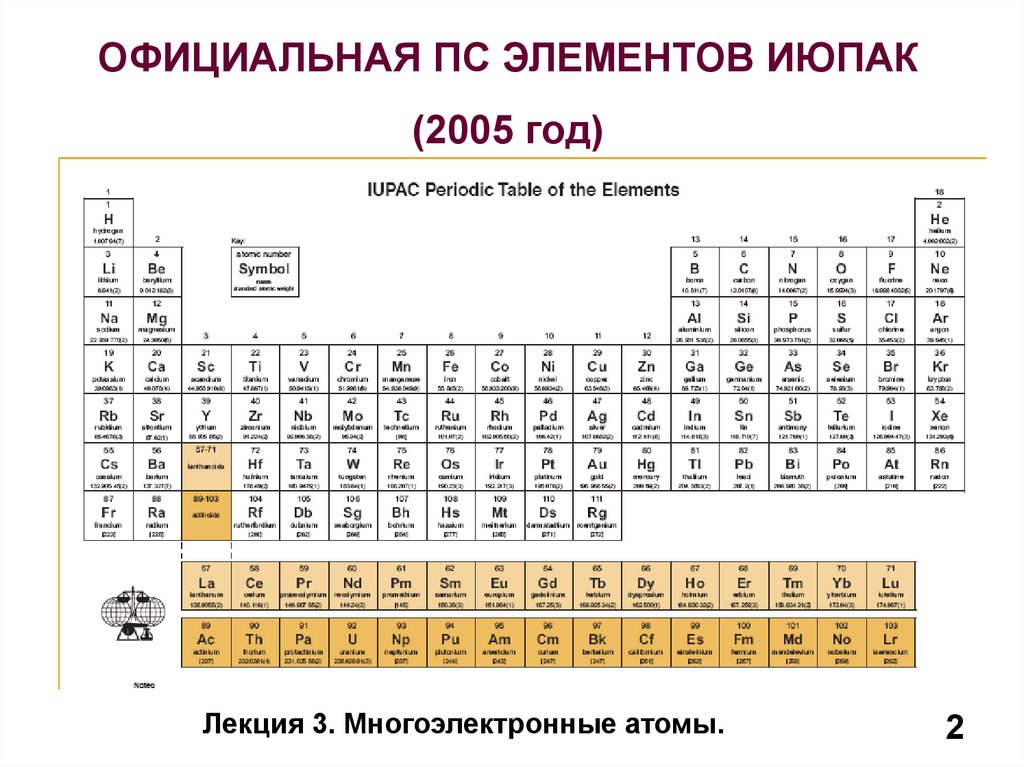
ОФИЦИАЛЬНАЯ ПС ЭЛЕМЕНТОВ ИЮПАК(2005 год)
Лекция 3. Многоэлектронные атомы.
2
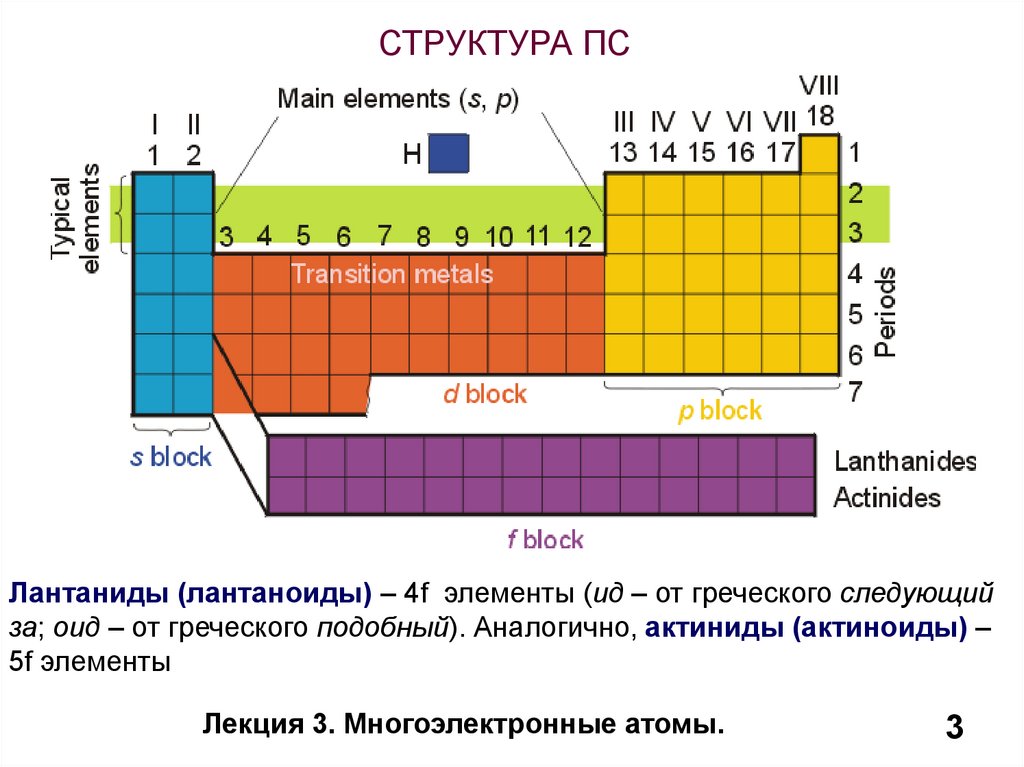
3.
СТРУКТУРА ПСЛантаниды (лантаноиды) – 4f элементы (ид – от греческого следующий
за; оид – от греческого подобный). Аналогично, актиниды (актиноиды) –
5f элементы
Лекция 3. Многоэлектронные атомы.
3
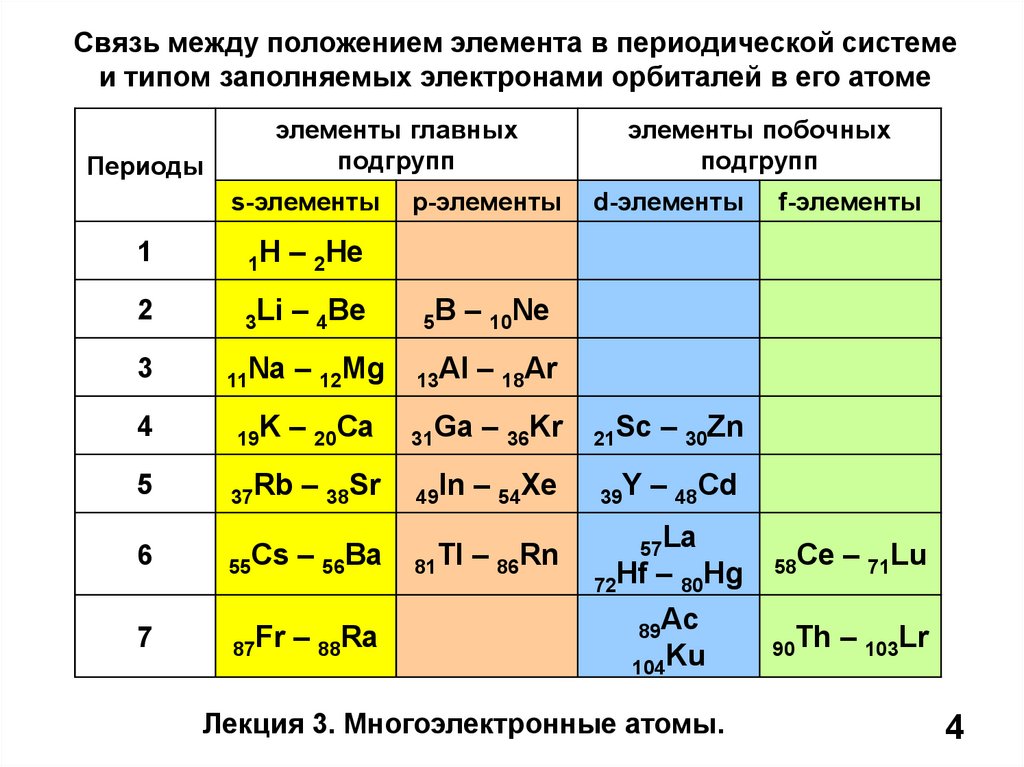
4.
Связь между положением элемента в периодической системеи типом заполняемых электронами орбиталей в его атоме
Периоды
элементы главных
подгрупп
s-элементы
1
1H
– 2He
2
3Li
– 4Be
3
11Na
4
19K
5
37Rb
6
55Cs – 56Ba
7
87Fr – 88Ra
p-элементы
5B
d-элементы
f-элементы
– 10Ne
– 12Mg
13Al
– 18Ar
– 20Ca
31Ga
– 36Kr
– 38Sr
элементы побочных
подгрупп
49In
– 54Xe
81Tl – 86Rn
21Sc
39Y
– 30Zn
– 48Cd
57La
72Hf – 80Hg
89Ac
104Ku
Лекция 3. Многоэлектронные атомы.
58Ce
– 71Lu
90Th
– 103Lr
4
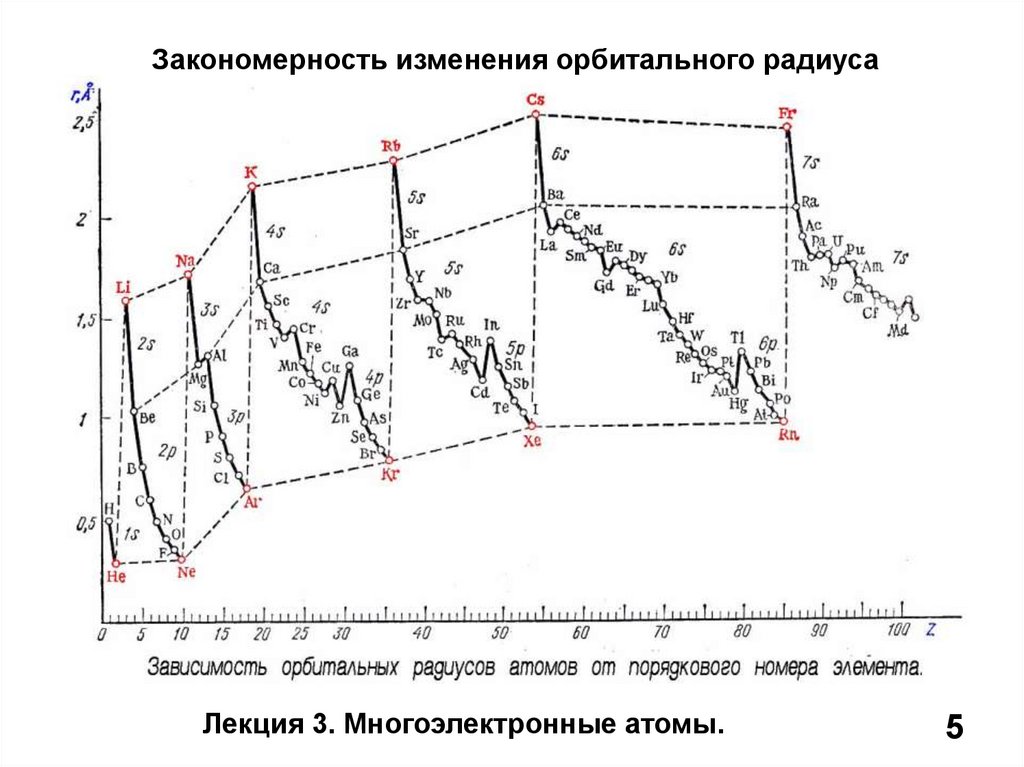
5.
Закономерность изменения орбитального радиусаЛекция 3. Многоэлектронные атомы.
5
6.
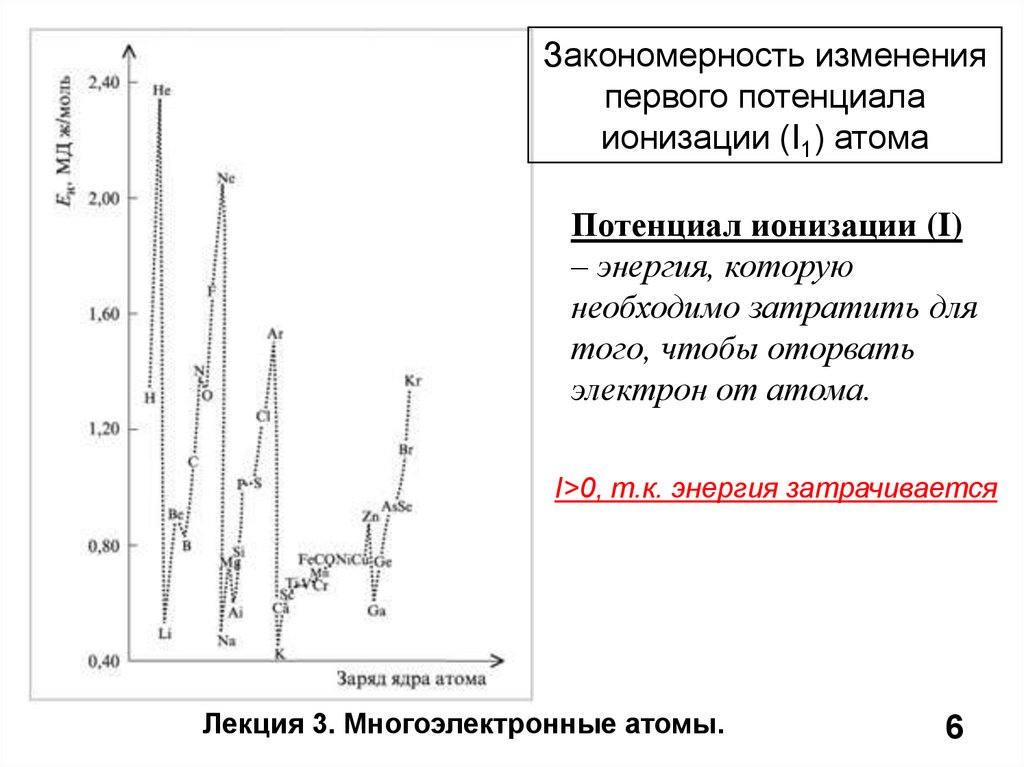
Закономерность измененияпервого потенциала
ионизации (I1) атома
Потенциал ионизации (I)
– энергия, которую
необходимо затратить для
того, чтобы оторвать
электрон от атома.
I>0, т.к. энергия затрачивается
Лекция 3. Многоэлектронные атомы.
6
7.
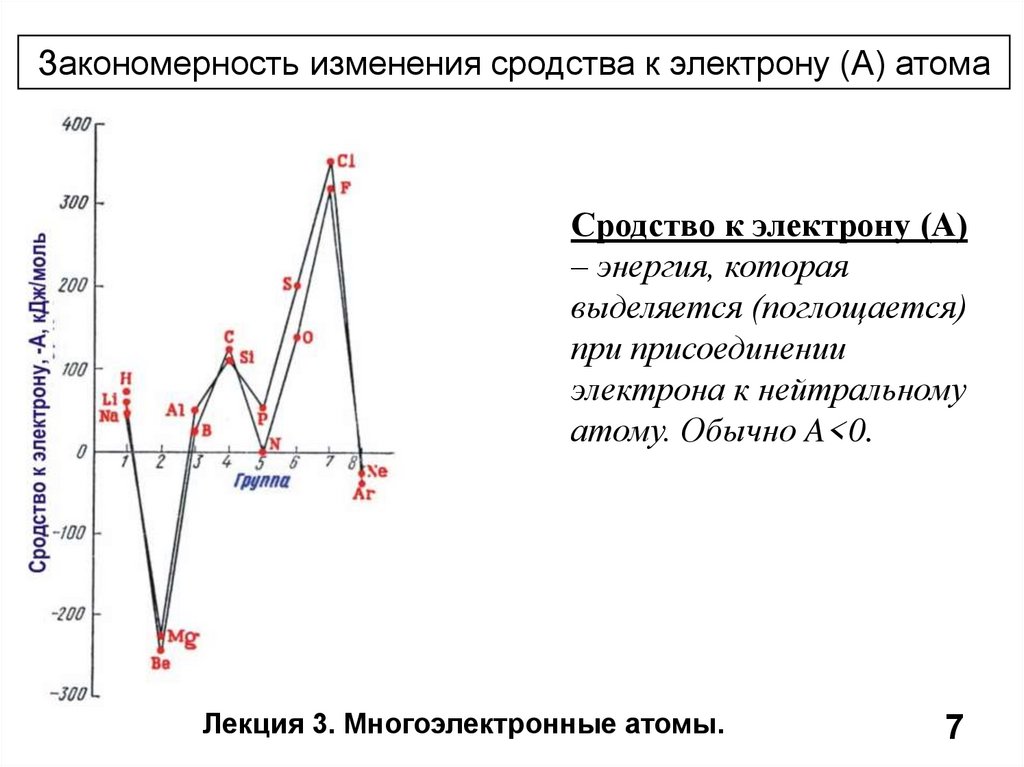
Закономерность изменения сродства к электрону (А) атомаСродство к электрону (А)
– энергия, которая
выделяется (поглощается)
при присоединении
электрона к нейтральному
атому. Обычно A<0.
Лекция 3. Многоэлектронные атомы.
7

 Химия
Химия








