Похожие презентации:
Электрохимические процессы
1. Электрохимические процессы
1. Процессы превращения энергиихимических реакций в электрическую –
гальванические элементы, химические
источники тока (ХИТ), батарейки,
аккумуляторы.
2. Процессы превращения электрической
энергии в энергию химических реакций –
электролиз.
3. Электрохимическая коррозия.
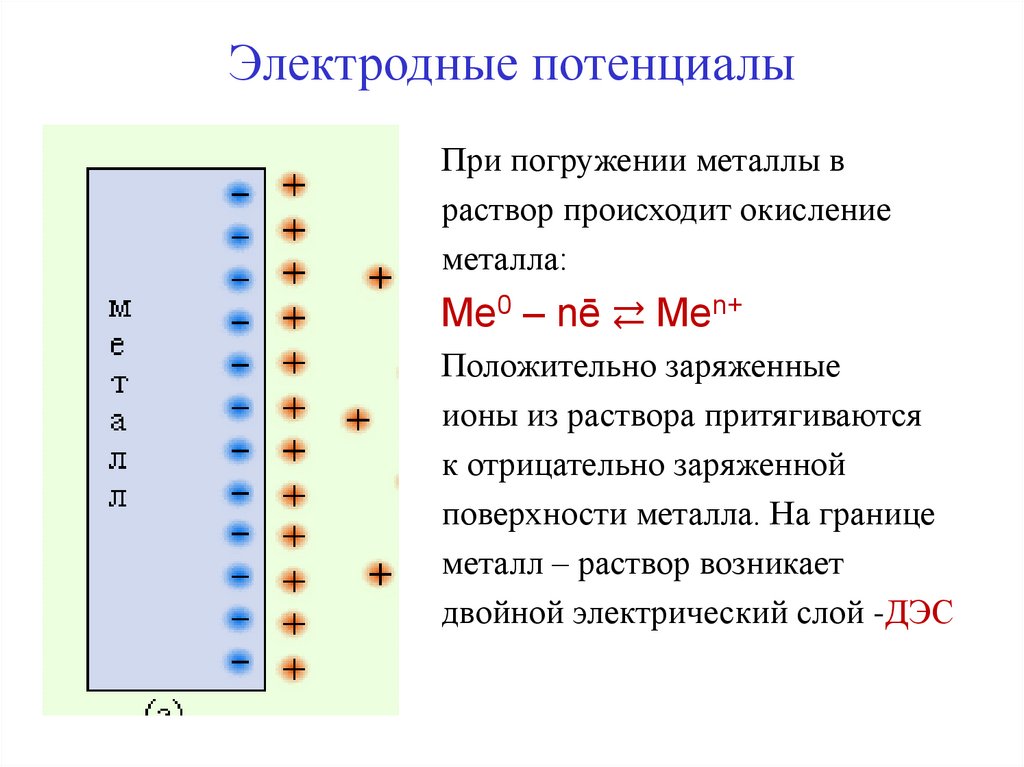
2. Электродные потенциалы
При погружении металлы враствор происходит окисление
металла:
Мe0 – nē ⇄ Men+
Положительно заряженные
ионы из раствора притягиваются
к отрицательно заряженной
поверхности металла. На границе
металл – раствор возникает
двойной электрический слой -ДЭС
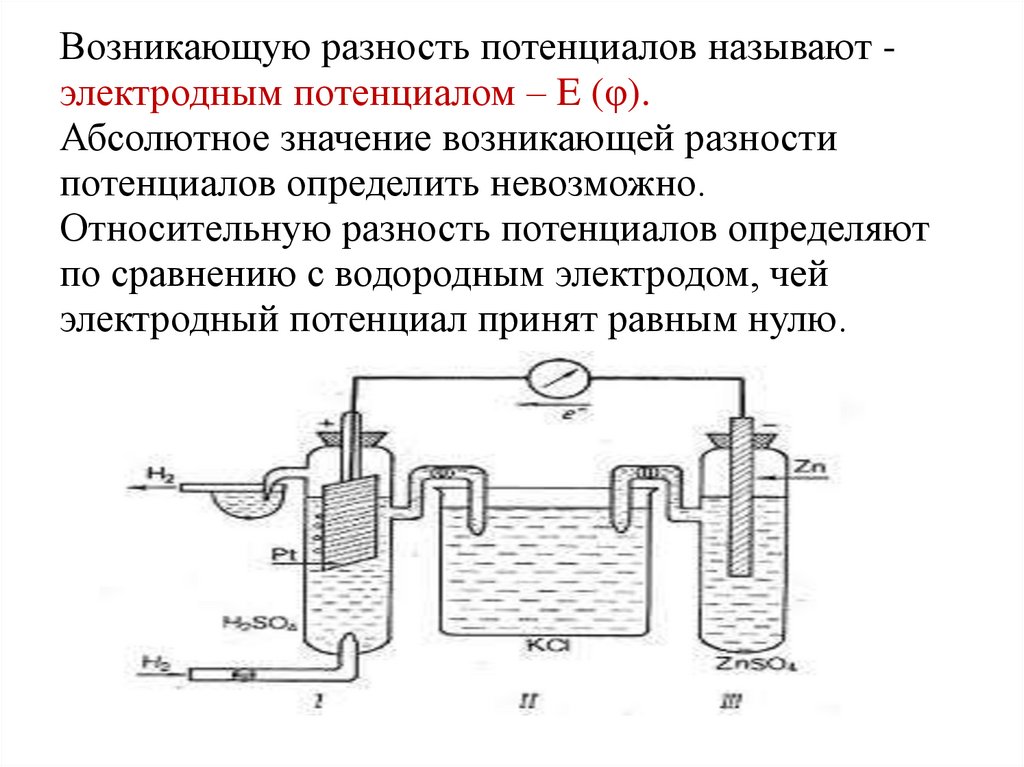
3.
Возникающую разность потенциалов называют электродным потенциалом – E (φ).Абсолютное значение возникающей разности
потенциалов определить невозможно.
Относительную разность потенциалов определяют
по сравнению с водородным электродом, чей
электродный потенциал принят равным нулю.
4. Электродный потенциал зависит от концентрации раствора электролита, уравнение Нернста:
RTE E
ln C M
nF
0
R 8,31 Дж / моль К
F 96500 Кл / моль
T 298K
СМ моль / л
0,059
E E
lg CM
n
0
5.
Если определение проводили пристандартных условиях (Т=298 К, р=101235Па,
СМ= 1 моль/л), то E = E0.
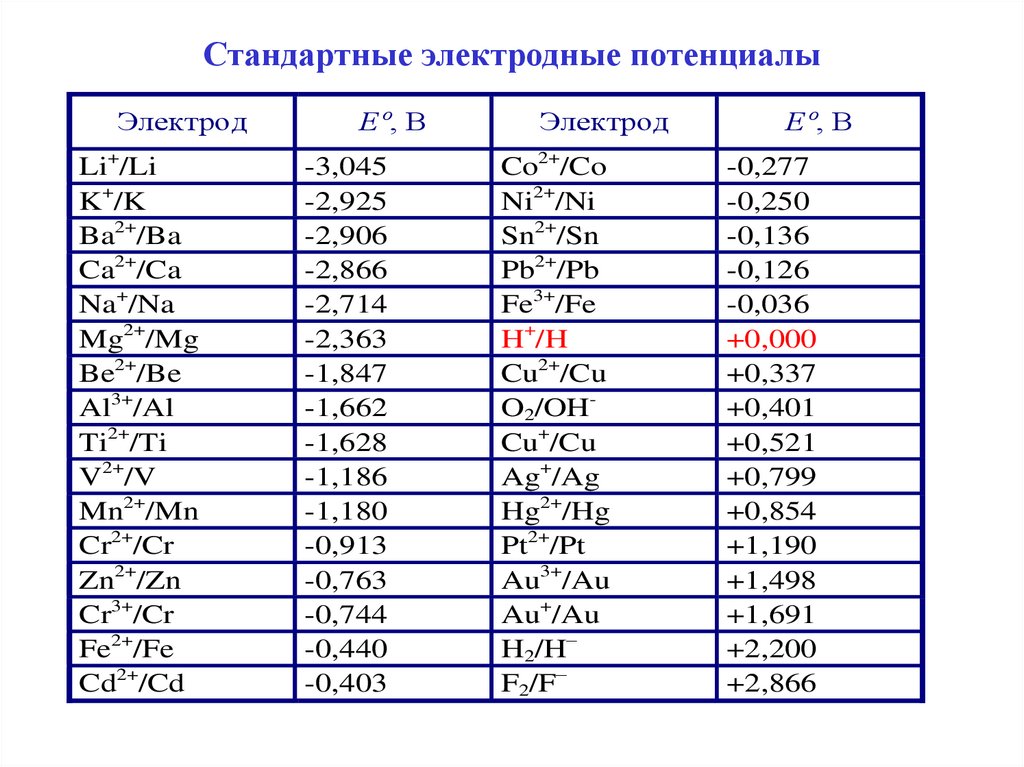
Значения стандартных электродных потенциалов
приведены в таблице, которая еще называется
ряд напряжения металлов.
Значения E0 для металлов расположенных до
водорода – отрицательны, для металлов
расположенных после водорода положительны.
6. Стандартные электродные потенциалы
ЭлектродLi+/Li
K+/K
Ba2+/Ba
Ca2+/Ca
Na+/Na
Mg2+/Mg
Be2+/Be
Al3+/Al
Ti2+/Ti
V2+/V
Mn2+/Mn
Cr2+/Cr
Zn2+/Zn
Cr3+/Cr
Fe2+/Fe
Cd2+/Cd
Еº, В
-3,045
-2,925
-2,906
-2,866
-2,714
-2,363
-1,847
-1,662
-1,628
-1,186
-1,180
-0,913
-0,763
-0,744
-0,440
-0,403
Электрод
Co2+/Co
Ni2+/Ni
Sn2+/Sn
Pb2+/Pb
Fe3+/Fe
H+/H
Cu2+/Cu
O2/OHCu+/Cu
Ag+/Ag
Hg2+/Hg
Pt2+/Pt
Au3+/Au
Au+/Au
H2/H–
F2/F–
Еº, В
-0,277
-0,250
-0,136
-0,126
-0,036
+0,000
+0,337
+0,401
+0,521
+0,799
+0,854
+1,190
+1,498
+1,691
+2,200
+2,866
7.
- металлы с меньшим значениемэлектродного потенциала (за исключением
металлов I-II А подгрупп)вытесняют металлы
с большим значением электродного
потенциала из растворов их солей:
Zn + CoSO4 = Co + ZnSO4
Co + ZnSO4 ≠
- металлы с отрицательным значением
электродного потенциала, вытесняют водород
из растворов кислот не окислителей (HCl, H3PO):
Zn + 2HCl = ZnCl2 + H2
Cu + HCl ≠
8. Гальванические элементы
ИсторияСогласно современной истории электрическая
батарея была изобретена в 1800 году Александром
Вольта. Ученый заметил, что когда два разнородных
металлических зонда помещаются в ткани лягушки,
появляется слабый электрический ток. Более того, ток
протекал и при помещении электродов не в
живую среду, а в некоторые химические растворы.
Собственно, с этого и начались работы над
электричеством.
9. Может быть первой была, так называемая, багдадская банка:
Впервые багдадскую батареюописал немецкий археолог
Вильгельм Кениг в 1938 году.
"Банка" найдена в Куджут-Рабу.
Багдадской банке около 2000
лет, она состоит из глиняного
сосуда с пробкой из битума,
которая протыкается железными
прутами. Внутри банки пруты
окружены медным цилиндром.
Если банку заполнить винным
уксусом, то "батарея" развивает
напряжение ок. 1.1 вольта
10. Вольтов столб
В 1800 году итальянскийучёный Александр Вольта
опустил в банку с кислотой
две пластинки — цинковую и
медную — и соединил их
проволокой.
После этого цинковая пластина
начала растворяться, а на
медной стали выделяться
пузырьки газа. Вольта
предположил и показал, что по
проволоке протекает
Электрический ток.
11.
• Причиной нестабильности и неэкономичностиисточника тока с опущенными в раствор серной
кислоты цинковым и медным электродами является
выделение водорода на медном электроде. Английский
ученый и изобретатель Джон Даниель опубликовал в
1836 г. сообщение о том, что им создан стабильный
медно-цинковый элемент. В то же самое время
талантливый физик и электротехник Борис Семенович
Якоби изобрел гальванический элемент новой
конструкции.
• Новый стабильно работающий электрохимический
источник тока получил впоследствии название элемента
Даниеля-Якоби. Это был сосуд, разделенный пористой
перегородкой. В одном отделении медный электрод
находился в растворе медного купороса, в другом
цинковый - в растворе сульфата цинка. Сульфат цинка
не взаимодействует с цинком, а сульфат меди - с медью.
12. Гальванический элемент Даниэля-Якоби
13.
Анод Zn0 - 2ē = Zn2+Катод Cu2+ + 2ē = Cu0
Анодом - называется электрод на котором
протекает реакция окисления.
Катодом называется электрод на котором
протекает реакция восстановления.
Из двух электродов анодом будет тот, у
которого меньше значение электродного
потенциала.
14.
Гальванический элемент характеризуетсязначением ЭДС (ЭДС - напряжение, которое
выдаёт источник тока при отсутствии
нагрузки в сети ):
ЭДС = Екатода - Еанода
ЭДС ЕCu 2 / Cu EZn 2 / Zn 0,34 ( 0,76) 1,1B
ЭДС > 0
15. Сокращенная схема гальванического элемента
ē(Анод) Zn0 / ZnSO4 // CuSO4 /Cu0 (Катод)
(Анод) Zn0 / ZnSO4 // CuSO4 / Cu0 (Катод)
1 моль/л
1 моль/л
ē
(Анод) Zn0/Zn2+//Cu2+/Cu0 (Катод)
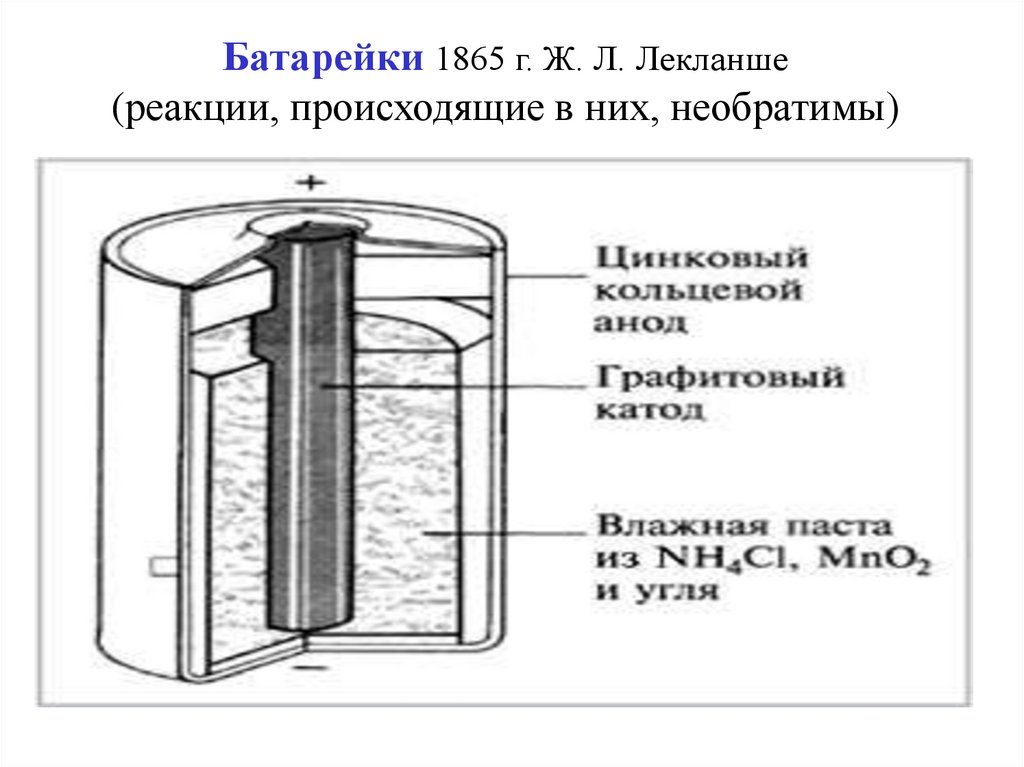
16. Батарейки 1865 г. Ж. Л. Лекланше (реакции, происходящие в них, необратимы)
17.
Сокращенная схема:(Анод) Zn0/ NH4Cl /MnO2 (Cграф.) (Катод)
Реакции на аноде и катоде:
Анод: Zn0 - 2ē = Zn2+
Катод: MnO2 + ē = MnOOH
Общее уравнение:
Zn +2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl2 + 2MnOOH
Электролит:
NH4Cl – раствор с загустителем (крахмал)
В щелочных батарейках используется 25-45%
раствор КОН.
18.
- Емкость элемента – это количествоэлектричества, которое источник тока
отдает при разрядке (при снижении
температуры уменьшается, особенно при
отрицательных).
- Энергия элемента – произведение его
емкости на напряжение.
- Сохраняемость – срок хранения элемента, в
течении которого его характеристики
остаются в заданных пределах.
19. Аккумуляторы
Аккумуляторы – приборы многократного действия,в основе его работы лежит обратимая химическая
реакция
Тип
ЭДС
(В)
свинцовокислотый (Lead
2,1
Acid)
никель-кадмиевые
1,2
щелочные (NiCd)
никель-металл1,2
гидридные (NiMH)
литий-ионные
4.2
(Li-ion)
литий-полимерные
3,7
(Li-pol)
никель-цинковые
1,6
(NiZn)
Область применения
автомобили, мотоциклы, электропогрузчики, штабелеры,
электротягачи, аварийное электроснабжение, источники
бесперебойного питания
замена стандартного гальванического элемента,
строительные электроинструменты, троллейбусы.
замена стандартного гальванического элемента,
электромобили
мобильные устройства, строительные электроинструменты,
электромобили
мобильные устройства, электромобили
замена стандартного гальванического элемента
20. Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году
Свинцово-кислотный аккумулятор — наиболеераспространенный на сегодняшний день тип аккумуляторов,
изобретен в 1859 году французским физиком Гастоном
Планте.
21.
22.
• Элемент свинцово-кислотного аккумуляторасостоит из положительных и отрицательных
электродов, сепараторов (разделительных
решеток) и электролита. Положительные
электроды представляют собой свинцовую
решётку, а активным веществом является
перекись свинца (PbO2). Отрицательные
электроды также представляют собой
свинцовую решётку, а активным веществом
является губчатый свинец (Pb).
23.
Электроды погружены в электролит, состоящийиз разбавленной серной кислоты (H2SO4).
Наибольшая проводимость этого раствора при
комнатной температуре (что означает
наименьшее внутреннее сопротивление и
наименьшие внутренние потери) достигается
при его плотности 1,26 г/см³. Однако на практике,
часто в районах с холодным климатом применяются и
более высокие концентрации серной кислоты, до 1,29
−1,31 г/см³. (Это делается потому, что при разряде
свинцово-кислотного аккумулятора плотность
электролита падает, и температура его замерзания
становится выше
24.
Сокращенная схема:(Анод) Pb/ H2SO4 / PbO2 (Катод)
Реакции на аноде и катоде:
Анод: Pb - 2ē = Pb2+
Катод: PbO2 + 4H+ +2ē = Pb2+ + 2H2O
Реакция в общем виде:
Pb + PbO2 + 2H2SO4 ⇄ PbSO4 + 2H2O
Прямая реакция – разрядка аккумулятора –
самопроизвольный процесс.
Обратная реакция – зарядка аккумулятора –
протекает под действием электрического
тока.
25.
На финальной стадии заряда аккумуляторовначинается вторичный процесс - электролиз
воды, входящей в состав электролита.
Создается впечатление, что аккумулятор
кипит, на самом деле пузырьки газа – это
водород и кислород, которые являются
продуктами электролиза воды.
Смесь водорода и кислорода – это «гремучий
газ», взрывоопасная смесь.
26.
Гелевые аккумуляторыВ новых версиях свинцовые пластины (решетки)
заменяют вспененным карбоном, покрытым
тонкой свинцовой пленкой, а жидкий электролит
может быть желирован силикагелем до
пастообразного состояния. Кроме того в состав
электродов добавляется кальций для
предотвращения выделения водорода . К плюсам
данных аккумуляторов можно отнести как более
высокий пусковой ток.
27.
• Теоретическая энергоемкость: около 133 Вт·ч/кг.• Удельная энергоемкость (Вт·ч/кг): 30-60 Вт·ч/кг .
• Удельная энергоплотность (Вт·ч/дм³): около 1250
Вт·ч/дм³.
• ЭДС заряженного аккумулятора = 2,11 В, рабочее
напряжение = 2,1 В (6 секций в итоге дают 12,7
В).(12,9 В)
• Напряжение полностью разряженного аккумулятора
= 1,75 — 1,8 В (из расчета на 1 секцию). Ниже
разряжать их нельзя.
• Рабочая температура: от минус 40 до плюс 40
• КПД: порядка 80-90%
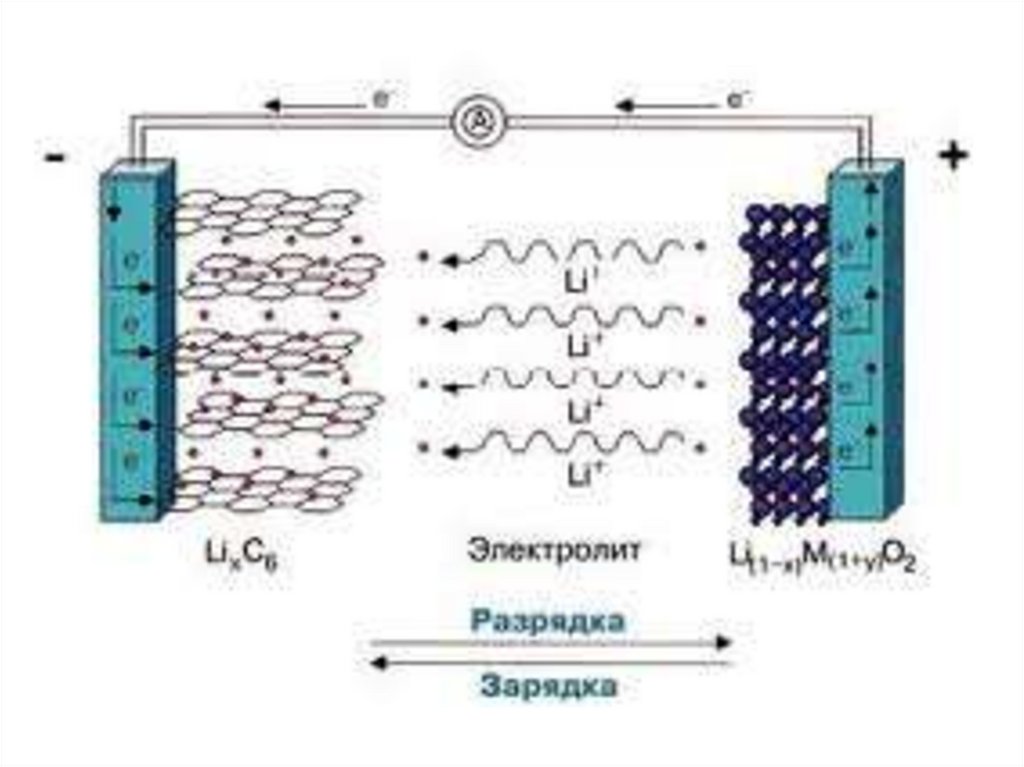
28. Литий – ионные аккумуляторы
Первый литиево-ионный аккумуляторразработала корпорация Sony в 1991 году
В качестве отрицательного электрода графит.
В качестве положительных пластин
применяют оксиды лития с кобальтом или
марганцем
на «+»: LiCoO2 - xe− → Li1-xCoO2 + xLi+
на «-» : С + xLi+ + xe− → CLix
29.
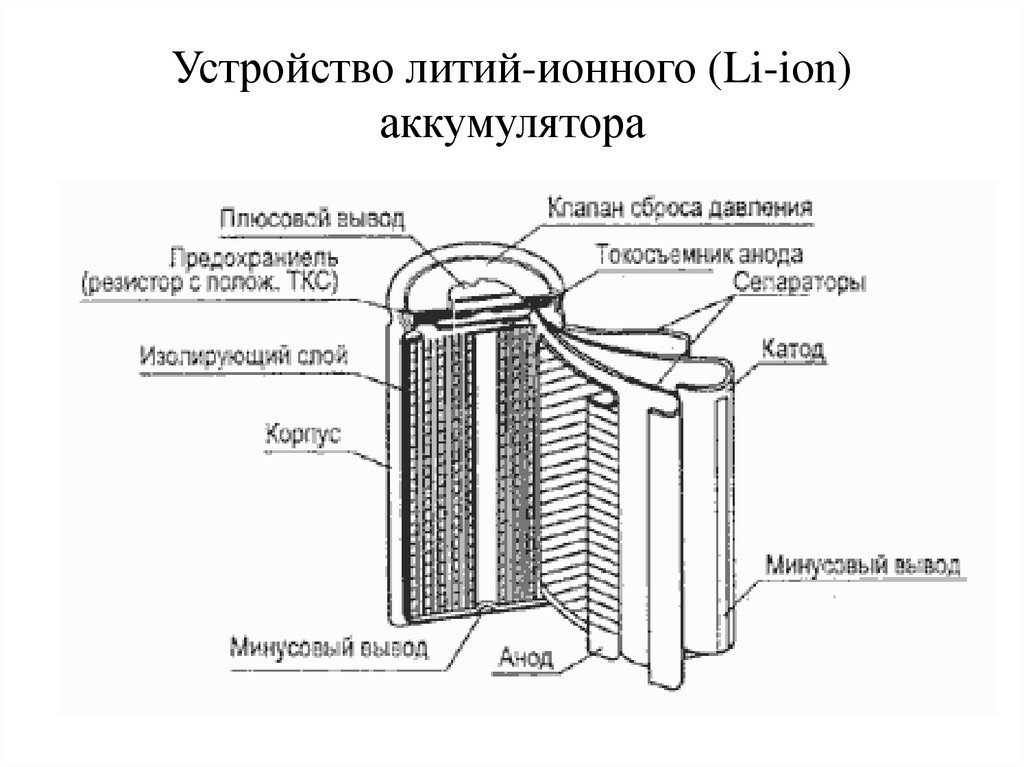
30. Устройство литий-ионного (Li-ion) аккумулятора
31.
Литий-полимерные аккумуляторы (Li-pol). Анодомслужит углеродистый материал, в который обратимо
внедряются ионы лития. Активными материалами
положительных электродов являются оксиды ванадия,
кобальта или марганца. Электролитом является или
раствор соли лития, заключенный в микропористую
полимерную матрицу, или полимер
(полиакрилонитрил, полиметилметакрилат,
поливинилхлорид либо другие), По сравнению с
литий-ионными аккумуляторами литий-полимерные
аккумуляторы имеют более высокие удельную
энергию и ресурс и лучшую безопасность.
Применяются для питания портативных электронных
устройств.
32. Вопросы для самоконтроля
Вычислите электродный потенциал меди, опущенной в 0,001 М раствор соли CuSO4 притемпературе 25ºС.
1) 0,426 В
2) 0,337 В
3) 0,396 В
4) 0,278 В
5) 0,248 В
2. Укажите электрод, который в гальваническом элементе в паре с электродом Ni/Ni2+ при
стандартных условиях будет катодом.
1) Mg/Mg2+ 2) Cd/Cd2+ 3) Co/Co2+ 4) Sn/Sn2+
5) Al/Al3+
3. Определите э.д.с. алюминий-свинцового гальванического элемента при стандартных
условиях ( CAl3 CPb2 1 моль/л).
1) –1,537 В
2) 1,798 В
4) нет правильного ответа
3) 1,663 В
5) 1,537 В
4. Составьте схему гальванического элемента, рассмотренного в вопросе № 3, и укажите анод
и катод.
1) (а) Pb│Pb(NO3)2║Al(NO3)3│Al (к)
2) (а) Pb│Pb2+║Al3+│Al (к)
3) (а) Al│Al(NO3)3║Pb(NO3)2│Pb (к)
4) (а) PbO2│Pb(NO3)2║AlCl3│Al (к)
5) (к) Pt, H2│H2SO4║AlCl3│Al (а)
5. Напишите ионное уравнение работы гальванического элемента, рассмотренного в
вопросах № 3 и № 4.
1) 2Al + 3Pb(NO3)2 → 3Pb + 2Al(NO3)3
2) 2Al3+ + 3Pb → 3Pb2+ + 2Al
3) 2Al + 3Pb2+ → 3Pb + 2Al3+
4) 4Al3+ + 3Pb → 3Pb4+ + 4Al
5) 3PbO + 6H+ + 2Al → 3Pb + 3H2O + 2Al3+


























 Химия
Химия








