Похожие презентации:
Кислород
1. Здравствуйте ребята. Сегодня урок химии буду проводить я, Прокина Татьяна Николаевна, учитель химии и биологии МБОУ
«БольшеберезниковскаяООШ». Мы сегодня будем изучать химический
элемент, который является самым
распространенным на Земле. Нет ни одной отрасли
химической промышленности, где не используется
этот элемент. А во время Великой Отечественной
войны для создания дешевых взрывчатых веществ
требовалось это вещество. Установка созданная
академиком П.Л. Капицей, за час вырабатывала
2000 кг этого вещества в жидком состоянии. Химией
и технологией порохов и взрывчатых веществ
занимались академики С.С. Семенов и Ю.Б.
Харитон. О каком элементе идет речь?
Это Кислород
2. О каком элементе идёт речь?
Задачи: закрепить и углубить теоретическиезнания учащихся о химических свойствах
кислорода. Познакомить учащихся со
свойствами кислорода и способами его
получения.
План урока:
1. История открытия кислорода;
2. Получение;
3. Свойства;
4. Применение.
Девиз урока: «Мало знать, надо и применять. Мало
хотеть, надо и делать» (Гёте)
3. Тема урока: «Кислород»
Задачи: закрепить и углубить теоретическиезнания учащихся о химических свойствах
кислорода. Познакомить учащихся со
свойствами кислорода и способами его
получения.
План урока:
1. История открытия кислорода;
2. Получение;
3. Свойства;
4. Применение.
Девиз урока: «Мало знать, надо и применять. Мало
хотеть, надо и делать» (Гёте)
4. Записываем тему и говорим о девизе урока
1. Элемент кислород находится в VI группеглавной подгруппы.
2. Строение атома +8
2ē 6ē
3. Самый электроотрицательный элемент
после F2. Поэтому степень окисления
О ², О ¹, О ², SO2, Н2О2, OF2
4. Входит в состав оксидов (Fe2O3), кислот
(H2SO4), солей (Na2SO4), оснований (NaOH) в
органических веществах в том числе живых
организмах. Входит в состав воздуха – 21%.
3O2
2O3
5. Получение кислорода
Имеется много способов получения кислорода, но влаборатории его получают так:
t
2KMnO4
H2MnO4 + MnO2 + O2
2H2O2
2H2O + O2
Здесь в двух колбах получен кислород, опускаем в колбы
горящую серу и горящий фосфор. А теперь, ребята,
посмотрите почему в колбе так ярко горит сера и фосфор.
В чем причина? Как этот процесс называется?
Этот процесс называется горение – это окисление, идущее с
выделением тепла и света. Записываем в тетрадях
уравнения реакций:
S + O2 = SO2 SO2 + H20 = H2SO4
P + O2 = P2O5 P2O5 + H20 = H3PO4
6. Ребята, что при этом образуется?
Оксиды.S + O2 = SO2 SO2 + H20 = H2SO4
4P + 5O2 = 2P2O5 P2O5 + 3H20 = 2H3PO4.
А для того чтобы определить, что здесь образуются кислоты, нужно добавить
метилоранж. И из оранжевого цвета растворы превращаются в малиновый. Это
доказывает, что в колбе находится кислота.
Теперь рассмотрим опыт. К доске выходят два ученика. Один будет нагревать селитру, а другой ученик уголь. Не
забываем, что необходимо соблюдать технику безопасности.
А история простая
Джозеф Пристли как-то раз,
Окись ртути нагревая
Обнаружил странный газ.
Газ без цвета, без названья,
Ярче в нем горит свеча.
Ане вреден для дыханья?
Не узнаешь у врача!
Новый газ из колбы вышел,
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит.
Название этому элементу дал А.Лавуазье. «Оксегениум» - рождающие кислоты. Это
было в конце XVIII века.
7. А теперь, давайте посмотрим, как же ребята приготовили опыт: Посмотрите как происходит горение угля t 2KNO3 2KNO2 + O2 C + O2 =
CO2. CO2 + H20 = H2CO3Таким образом вещества горят в кислороде,
даже такие как железо, медь, сложные
вещества.
8. Какими же свойствами обладает кислород? В кислороде все вещества горят или окисляются.
Записываем уравнения реакций:H2S + O2 =
CH4 + O2 =
NH3 + O2 =
SO2 + O2 =
P2O5 + O2 =
Fe + O2 =
Cu + O2 =
9. Записываем уравнения реакций в тетрадях и на доске.
1. Проверяем правильные ответы:2H2S + 3O2 = 2SO2 + 2H2O; 2H2S + O2 = 2S + 2 H20
CH4 + 2O2 => CO2 + 2H2O
4NH3 + 5O2 = 4NO + 6 H2O; 4NH3 + 3O2 = 2N2 + 6H2O
2SO2 + O2 = 2SO3
P2O3 + O2 = P2O5
3Fe + 2O2 = Fe3O4 (Fe ²O ² · Fe2 ³ O3 ²)
2Cu + O2 = 2CuO
2. Какие вещества взаимодействуют с кислородом, а также нет.
Почему?
CO, Na2O, P2O3, SO2, CO2, NO, CuO.
3. Исключите из ряда лишнее, где нет кислорода. Назовите их.
Na2CO3, KCl, H2SO4, H3PO4, CaCl2, FeCl3, K2CO3.
10. А теперь ребята немного поиграем. Нужно составить формулы солей, используя кислород, комбинируя ниже приведенные составные
1.А теперь ребята немного поиграем. Нужно
составить формулы солей, используя кислород,
комбинируя ниже приведенные составные части.
Назовите пять солей:
Na2, O4, S, O4
Ca, S, S, N
Ba, O2, S, O3
K3, Cl, P, O4
2. Составьте формулы семи кислот, используя
кислород, комбинируя составные части:
H2, O4, S, H3, O4, P
H, O3, N, H2, O3, C
H2, O3, Si, H2, O4, Cr
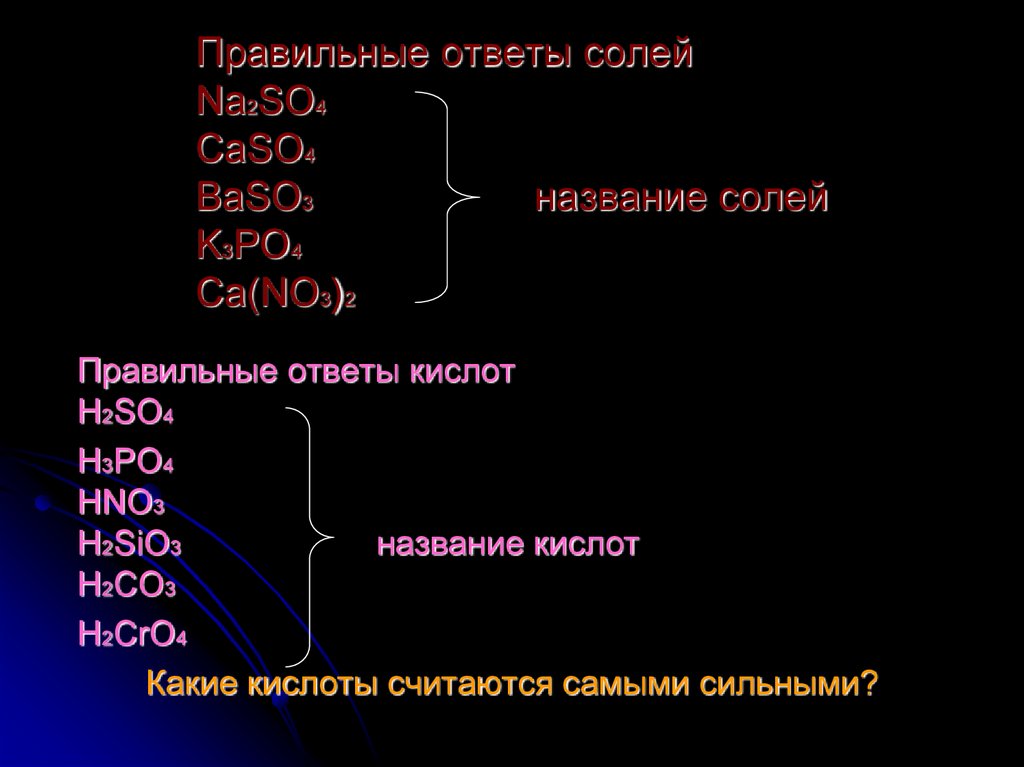
11. Правильные ответы солей Na2SO4 CaSO4 BaSO3 название солей K3PO4 Ca(NO3)2
Правильные ответы кислотH2SO4
H3PO4
HNO3
H2SiO3
название кислот
H2CO3
H2CrO4
Какие кислоты считаются самыми сильными?
12. 1. Осуществите уравнения реакций следующих превращений: P P2O5 H3PO4 Na3PO4 S SO2 SO3 H2SO4 H3PO4. 2. Сколько литров кислорода
вступает в реакцию с 5 л. водорода(н.у.)?
3. Сколько литров кислорода
разлагается при нагревании 180 г.
оксида ртути?
13. Кроссворд
1.2.
3.
4.
5.
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
14.
1.м о л ь
2.
3.
4.
5.
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
15.
1.м о л ь
Б о р о д и н
2.
3.
4.
5.
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
16.
1.м о л ь
Б о р о д и н
б р о м
2.
3.
4.
5.
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
17.
1.м
Б о
б р
в о
о
р
о
д
л ь
о д и н
м
о р о д
2.
3.
4.
5.
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
18.
1.Б
б
в
к
м
о
р
о
с
о
р
о
д
е
л
о
м
о
н
ь
д и н
2.
3.
4.
5.
р о д
о н
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
19.
1.Б
б
в
к
м
о
р
о
с
п
о
р
о
д
е
р
л
о
м
о
н
о
ь
д и н
2.
3.
4.
5.
р о д
о н
б и р к а
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
20.
1.Б
б
в
к
м
о
р
о
с
п
о
о
р
о
д
е
р
к
л
о
м
о
н
о
с
ь
д и н
2.
3.
4.
5.
р
о
б
и
о д
н
и р к а
д
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
21.
1.Б
б
в
к
м
о
р
о
с
п
о
о
р
о
д
е
р
к
в
л
о
м
о
н
о
с
о
ь
д и н
2.
3.
4.
5.
р
о
б
и
д
о д
н
и р к а
д
а
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
22.
1.Б
б
в
к
о
м
о
р
о
с
п
о
о
р
о
д
е
р
к
в
с н
л
о
м
о
н
о
с
о
о
ь
д и н
2.
3.
4.
5.
р
о
б
и
д
в
о д
н
и р к а
д
а
а н и я
6.
7.
8.
9.
Единица количества вещества
Русский композитор и химик
Темно-бурая жидкость
Химический элемент, самый
легкий газ
Инертный газ
Лабораторный сосуд
Соединение состоящих из двух
элементов, одним из которых
является кислород
Самое нужное вещество на
земле
Сложные вещества состоящие
из атомов металлов и одной
или нескольких гидроксогрупп
23. Применение кислорода
Кислород применяют в металлургии ихимической промышленности.
2. При резке и сварке металлов.
3. При дыхании.
4. На подводных и комических кораблях при
работе водолазов и пожарных.
ВЫВОД! А теперь ребята мы посмотрим как
происходит окисление дихромата аммония.
(Показываю опыт: смесь Mg (NH4)2 Cr2O7,
спирт, соли кальция и кобальта)
1.
24. Задание на дом
Осуществите уравнение реакцийследующих превращений:
Ca
CaO Ca(OH)2 CaCO3
CO2
Упражнение 4,6 после § Кислород
1.
Ребята, больше спасибо за хорошие
ответы!























 Химия
Химия








