Похожие презентации:
Коллигативные свойства растворов. Тема 7
1. ТЕМА №7: КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Рассматриваемые вопросы:1. Растворы неэлектролитов.
2. Осмос. Осмотическое давление. Закон Вант-Гоффа.
3. Законы Рауля.
4. Растворы электролитов. Электролитическая
диссоциация.
5. Отклонения от законов Вант-Гоффа и Рауля.
1
2. 1. Растворы неэлектролитов
Неэлектролиты – вещества, которые не диссоциируют наионы ни в растворах, ни в расплавах и не проводят
электрический ток.
К неэлектролитам относятся в основном органические
соединения, например, сахар, этанол, формальдегид и др.
Коллигативные свойства растворов – это свойства, которые
зависят лишь от числа частиц растворенного вещества и
приданных условиях не зависят от химической природы
растворенного вещества и растворителя.
2
3.
Коллигативные свойства растворов:• осмотическое давление (Росм),
• понижение давления насыщенного пара растворителя
над раствором ( Р/Р°),
• понижение температуры замерзания ( Тзам),
• повышение температуры кипения раствора ( Ткип).
3
4.
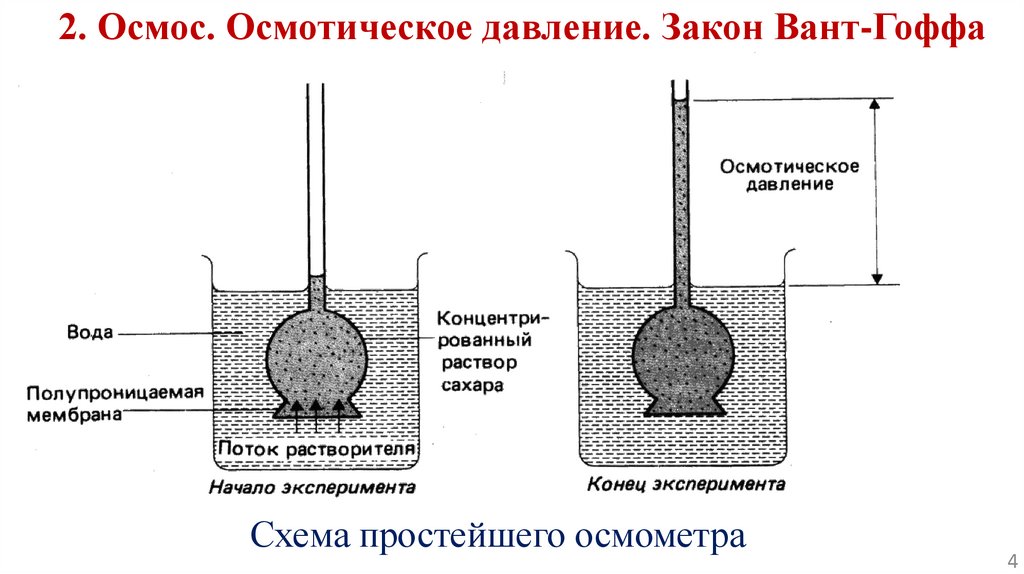
2. Осмос. Осмотическое давление. Закон Вант-ГоффаСхема простейшего осмометра
4
5.
ч Осмосом называется самопроизвольная диффузия молекулрастворителя в раствор через полупроницаемую мембрану,
разделяющую раствор и растворитель.
Осмотическое давление равно такому давлению, которое
нужно приложить к раствору для того, чтобы прекратить осмос.
Величина осмотического давления зависит от концентрации
раствора и от температуры, но не зависит ни от природы
растворенного вещества, ни от природы растворителя.
Для растворов неэлектролитов невысоких концентраций
зависимость осмотического давления от концентрации и
температуры раствора подчиняется закону Вант-Гоффа и
выражается уравнением:
5
6.
Закон Вант-ГоффаРосм = С∙R∙T
,
где Росм – осмотическое давление раствора, кПа или
атм;
С – молярная концентрация вещества, моль/дм3;
R – универсальная газовая постоянная, равная
8,314 Дж/(моль∙К) или 0,082 атм∙л/(моль∙К);
T – абсолютная температура раствора, К.
6
7. Молярная концентрация вещества С:
nв ваmв ва
С
Vр ра M в ва Vр ра
7
8.
Практическое значение осмоса:1. Процессы всасывания и выделения влаги в растительных и
животных организмах
2. Утоление жажды
3. Явление тургора (напряжения растительных тканей – упругость
мягких органов растений)
4. Процессы силосования кормов
Концентрированные растворы сахара (сироп) и соли (рассол) широко применяются для
консервирования продуктов, так как вызывают удаление воды из микроорганизмов (плазмолиз) и
их гибель.
Растворы с одинаковым осмотическим давлением называются изотоническими.
Молекулы нелетучего растворенного компонента (вещества) раствора препятствуют
улетучиванию из раствора молекул растворителя.
8
9.
Действие растворов соли различной концентрации на красные кровяныеклетки крови – эритроциты
9
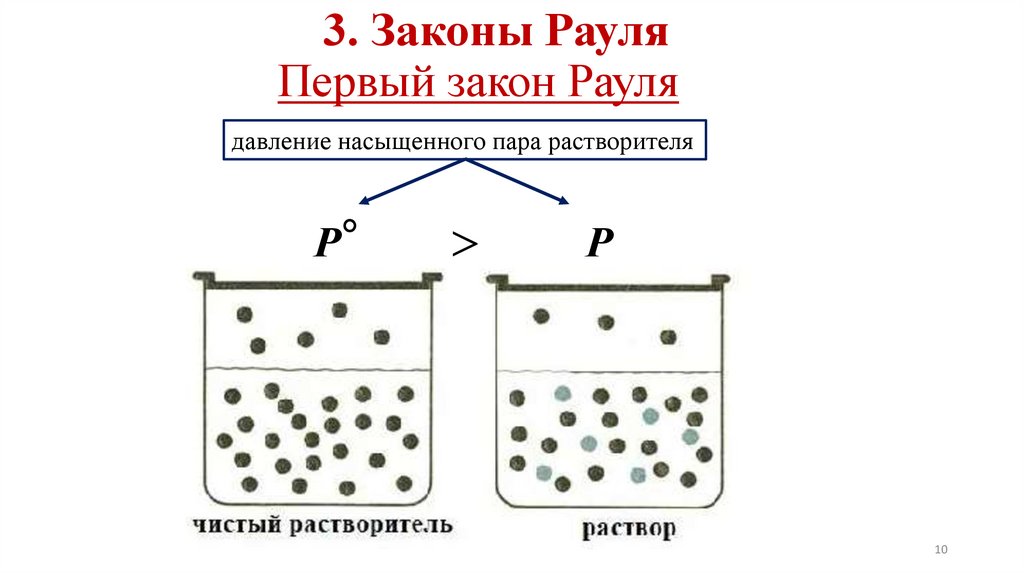
10. 3. Законы Рауля Первый закон Рауля
давление насыщенного пара растворителяР°
Р
10
11.
Первый закон Рауля: относительное понижение давлениянасыщенного
пара
растворителя
над
раствором
ΔP
пропорционально молярной доле растворенного нелетучего
вещества :
P P P
o
o
P
P
o
где ΔP– разность между давлениями насыщенного пара над
растворителем Р° и над раствором Р.
11
12.
Молярная доля растворенного вещества ( ):nв ва
χ
100 %
nв ва n р ля
12
13.
Второй закон Рауля (эбулиоскопический): повышениетемпературы кипения раствора неэлектролита ΔТкип
пропорционально моляльной концентрации растворенного
вещества Сm:
ΔТкип = ЭТ ∙Сm
Второй закон Рауля (криоскопический): понижение
температуры замерзания раствора неэлектролита ΔТзам
пропорционально моляльной концентрации растворенного
вещества Сm:
ΔТзам = КТ ∙Сm
13
14.
где ЭТ (КТ) – эбулиоскопическая (криоскопическая)постоянные, зависящие только от природы растворителя,
но не зависящие от природы растворенного вещества.
Физический смысл ЭТ (КТ): показывает, на сколько
градусов изменяется температура кипения (замерзания)
растворителя при Сm = 1 моль/кг.
Например, для воды ЭТ = 0,52; КТ = 1,86
14
15.
Моляльнаявещества Сm:
концентрация
растворенного
nв ва
mв ва
Сm
mр ля M в ва mр ля
Температуры кипения и замерзания растворов можно
рассчитать по формулам:
Ткип р-ра =Ткип р-ля + ΔТкип
Тзам р-ра = Тзам р-ля – ΔТзам
15
16.
4. Растворы электролитов. Электролитическаядиссоциация
Электролиты – вещества, диссоциирующие в растворах и
расплавах на ионы и проводящие электрический ток.
Электролитическая диссоциация – процесс распада молекулы
электролита на ионы под действием полярных молекул
растворителя.
В неполярных растворителях (органические вещества)
потенциальный электролит не диссоциирует.
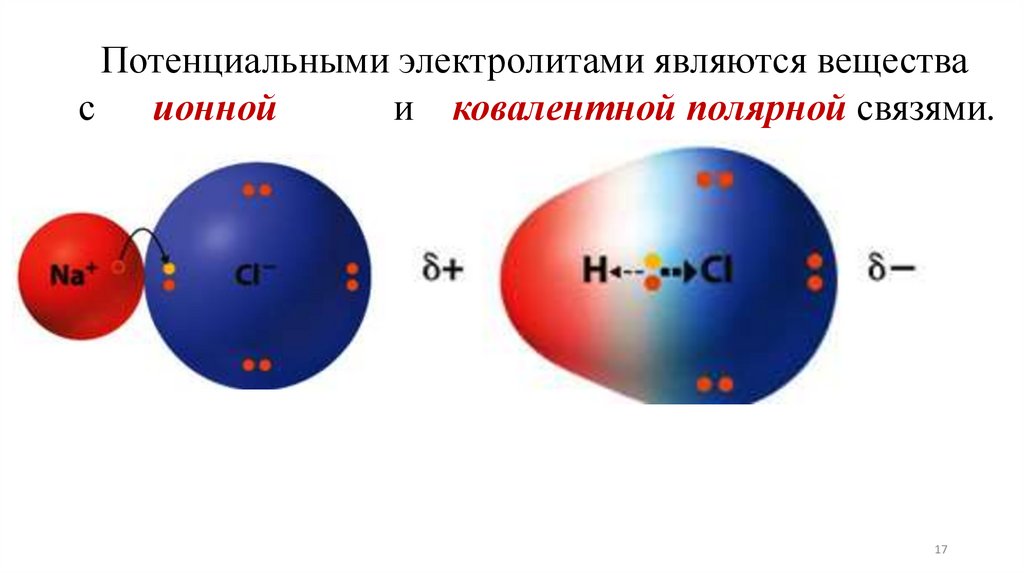
Потенциальными электролитами являются вещества с ионной и
ковалентной полярной связями.
16
17. Потенциальными электролитами являются вещества с ионной и ковалентной полярной связями.
1718.
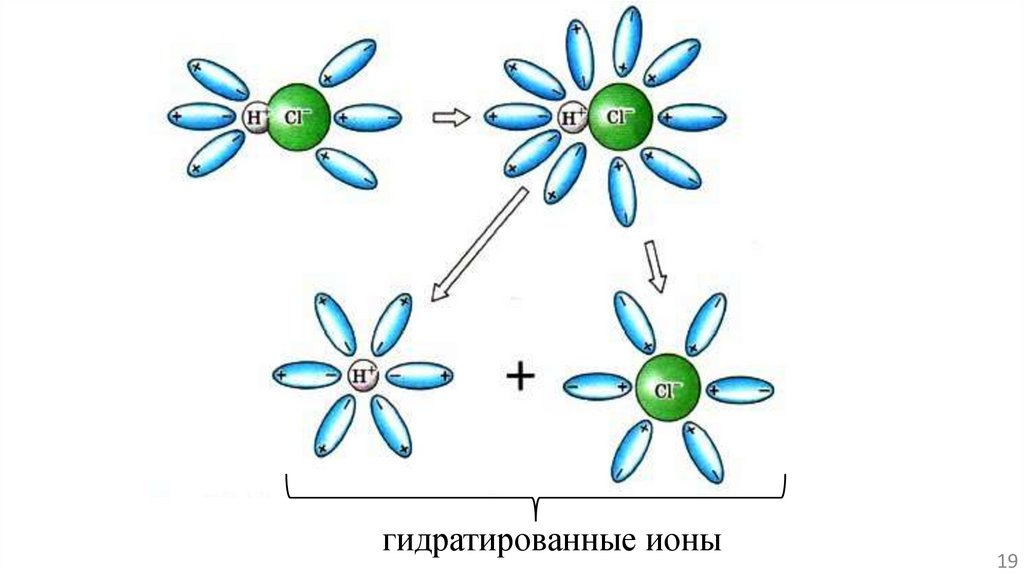
Электролитическая диссоциация в растворе происходит врезультате сложного физико-химического взаимодействия
молекул электролита с полярными молекулами растворителя.
Процесс растворения вещества К+А- в воде, являющегося
соединением с типичной ионной связью, рассмотрели на
прошлой лекции.
Электролитическая диссоциация полярных молекул
электролита в растворе происходит вследствие ослабления и
разрыва связи в молекуле растворяемого вещества,
вызванного действием полярных молекул растворителя:
18
19.
гидратированные ионы19
20. Количественными характеристиками электролитической диссоциации являются:
• степень диссоциации ( );• изотонический коэффициент (i);
• константа диссоциации (КД).
20
21.
Степень диссоциации – отношение количествамолекул, распавшихся на ионы (n), к общему
количеству растворенных молекул (Nобщ).
n
N общ
21
22. Исходя из значения степени диссоциации все электролиты условно можно разделить на три группы:
• слабые электролиты (α < 3 %): H2CO3, H2S, HCN,NH4OH, Cu(OH)2 и др.
• электролиты средней силы (3 % < α < 30 %): HNO2,
Н3РО4, HF, H2SO3, Mg(OH)2 и др.
• сильные электролиты (α 30 % ): HCl, H2SO4, HNO3,
NaOH, KOH, Ca(OH)2, NaCl, CuSO4 и др.
22
23.
Сильные электролиты в водных растворах (или полярныхрастворителях) диссоциируют практически полностью.
Уравнение процесса электролитической диссоциации
сильного электролита записывается с указанием его
практической необратимости: приводится лишь одна стрелка,
направленная от молекулярной формы электролита к его ионам.
H2SO4 → Н+ + HSO4−.
Диссоциация слабых электролитов протекает обратимо и
характеризуется установлением равновесия:
Н3РО4 ⇄ Н+ + Н2РО4−.
Диссоциация слабых электролитов проходит более эффективно
в разбавленных растворах, чем в концентрированных.
23
24. Изотонический коэффициент
i - показывает, во сколько раз увеличивается число частиц врастворе электролита в результате его диссоциации.
Он всегда больше единицы i > 1.
α и i связаны соотношением:
i 1
α
k 1
где k – количество ионов, на которое диссоциирует одна молекула
электролита.
Например, Al2(SO4)3 →2Al3+ + 3SO42−, следовательно, k = 5
24
25. Константа диссоциации
Для слабого электролита: KA K+
катион
–
+анион
A
[ K ][ A ]
Константа диссоциации выражается: Kд
[ KA]
+
–
где [K ], [A ] и [KA] – равновесные молярные концентрации
–
+
ионов K и A в растворе и недиссоциированного соединения
3
KА (в моль/дм ).
25
26.
Чем больше Kд, тем электролит лучше распадаетсяна ионы.
•ч
Константа диссоциации зависит от природы
электролита, растворителя, от температуры, но не зависит
от концентрации раствора.
26
27.
Закон разбавления ОствальдаПусть С – исходная молярная концентрация,
– степень электролитической диссоциации электролита.
+
Тогда при достижении равновесия концентрации ионов K и А
+
в растворе составят [K ] = [А ] = С, а
концентрация недиссоциировавших молекул KА: [KА] = (1– )С.
Тогда выражение для Kд запишется:
[ K ][ A ]
c
Kд
(1 )с
[ KA]
2
2
27
28.
cKд
1
2
Если 1, тогда:
Kд
Закон разбавления
Оствальда
Kд
2
≈ С
Чем меньше с, тем больше
.
c
28
29. 5. Отклонения от законов Вант-Гоффа и Рауля для растворов электролитов
Закон Вант-Гоффа для разбавленных растворов электролитов:Pосм = i∙СRT
Первый закон Рауля для разбавленных растворов электролитов:
P
i•
0
P
Второй закон Рауля для разбавленных растворов электролитов:
ΔТзам = i∙КТ Сm,
ΔТкип = i∙ЭТ Сm.
29
30.
3031.
3132.
Гидролиз – процесс взаимодействияионов соли с водой, приводящий к
образованию слабого электролита.
Гидролиз протекает в обменных
процессах живых организмов, при
приготовлении и переваривании
пищи, стирке, мытье посуды, и др.
32



























 Химия
Химия








