Похожие презентации:
Коллигативные свойства растворов
1. Растворы
Ч. 1 Введение.Коллигативные свойства.
2.
3.
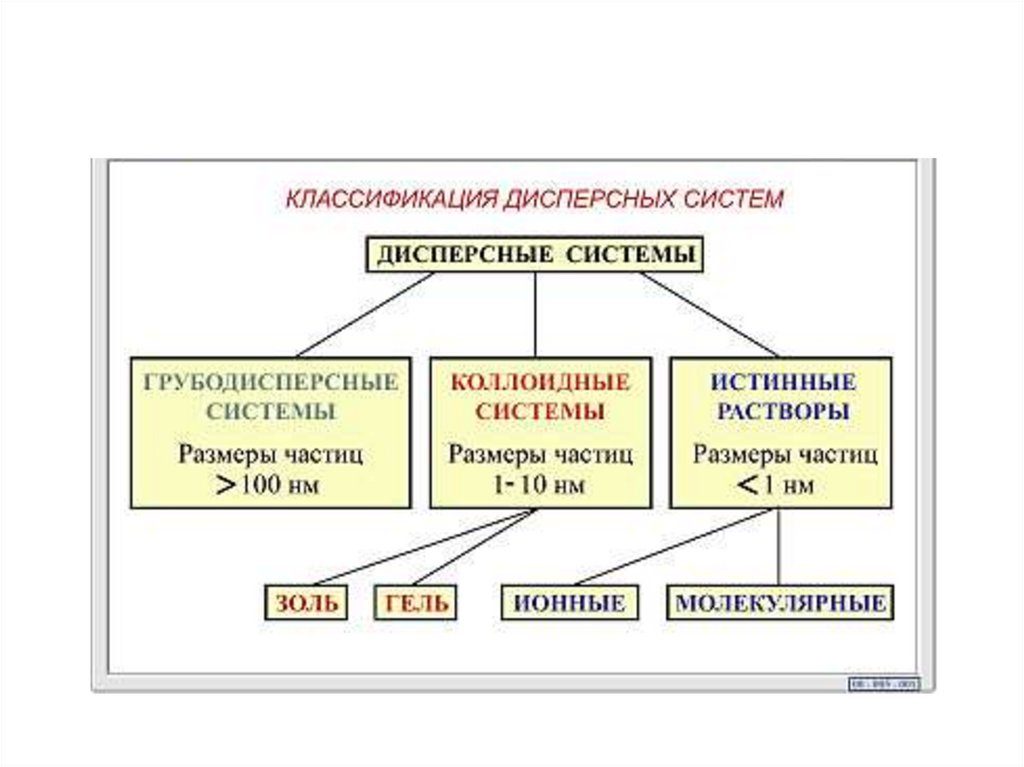
Дисперсные системы гетерогенные системы издвух или большего числа фаз с сильно развитой
поверхностью раздела между ними. Обычно одна из
фаз образует непрерывную дисперсионную среду в
объеме которой распределена дисперсная фаза в виде
мелких кристаллов, твердых аморфных частиц,
капель или пузырьков.
Моно-/полидисперсные системы:
одинаковый / неодинаковый размер частиц
дисперсной фазы.
Свободно/связнодисперсные
системы:
отсутствие/наличие взаимодействие частиц в
дисперсной фазе.
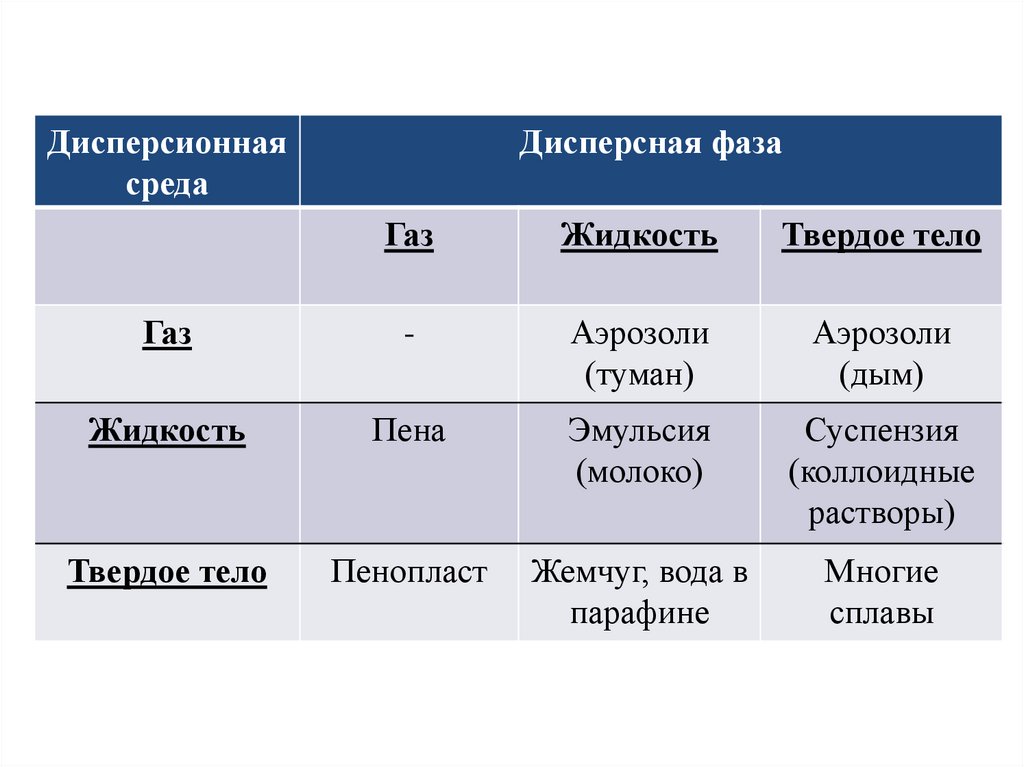
4.
Дисперсионнаясреда
Дисперсная фаза
Газ
Жидкость
Твердое тело
Газ
-
Аэрозоли
(туман)
Аэрозоли
(дым)
Жидкость
Пена
Эмульсия
(молоко)
Суспензия
(коллоидные
растворы)
Твердое тело
Пенопласт
Жемчуг, вода в
парафине
Многие
сплавы
5.
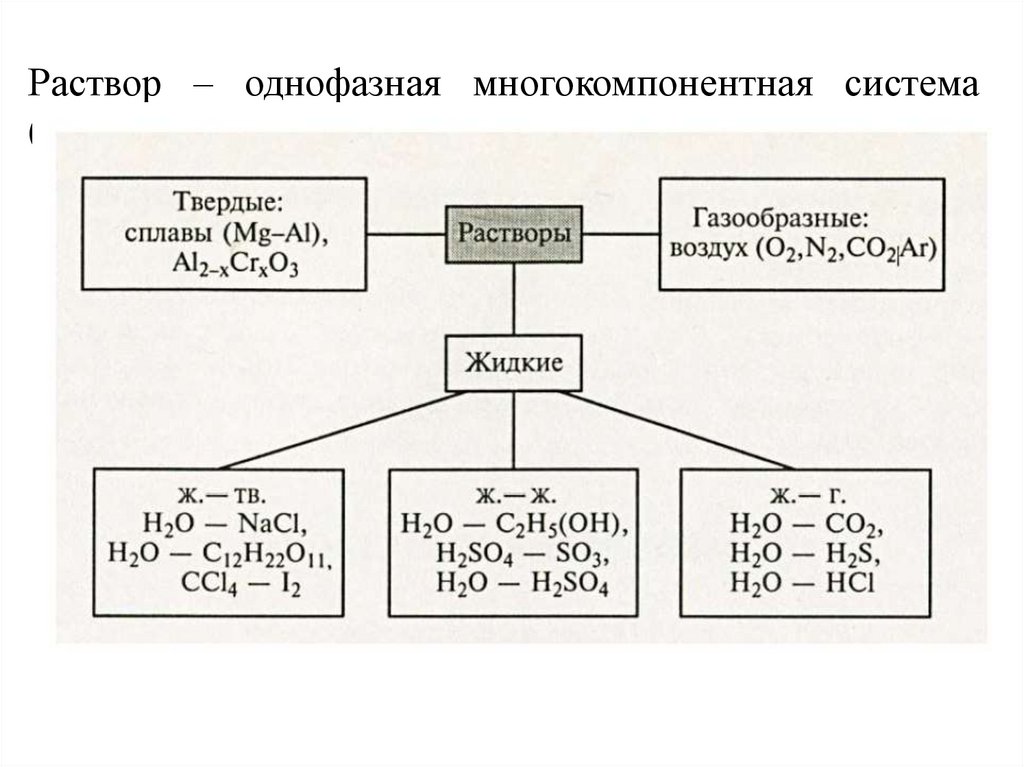
Раствор – однофазная многокомпонентная система(двух - ) переменного состава
6.
РастворимостьРастворимостью
(S)
называется
свойство
вещества
растворяться в том или ином растворителе. Мерой
растворимости является концентрация вещества в его
насыщенного раствора
Насыщенным называют раствор, находящийся в подвижном
гетерогенном равновесии с растворяемым веществом.
CaSO4
T = const
CaSO4
H2O
CaSO4(P)
CaSO4(T)
[Ca2+(P)+SO42-(P)]
Существуют так же ненасыщенные и пересыщенные растворы
7.
Пересыщенный раствор8.
Растворимость твердых веществ часто выражают в граммахрастворённого вещества, приходящегося на 100 г воды в
насыщенном растворе при определённой температуре. Эта
величина
называется
массовым
коэффициентом
растворимости (km).
Растворимость твердых веществ г/100г Н2О
9.
Растворимость газов выражают в миллилитрах газа,растворяющихся в 100 г воды до образования насыщенного
раствора при нормальном давлении газа. Эта величина
называется объёмным коэффициентом растворимости газа (kv).
Растворимость газов иногда выражают объемом газа,
растворяющегося в одном объеме воды при нормальном
давлении и определённой температуре. Эту величину называют
коэффициентом абсорбции газа.
Растворимость газов см3 /100г Н2О
10.
Способы выражения концентрации раствораМассовая доля
в
mB
m( р ра )
Моляльность, моль/кг
km
в
k m 100
Молярная концентрация, моль/л
Св
nB
V( p ра )
Нормальная, эквивалентная
концентрация, моль/л
Сэ
nэB
V( p ра )
Cm ( B )
nB
ms ( р рителя)
Титр, г/см3
T
mB
V( р ра )
Мольная доля
n1
N
n1 n2
11.
ПримерВ 1 л воды растворено 160 г NaOH. Выразить всеми способами
концентрацию раствора, плотность которого равна 1150 кг/м³.
1) Определяем массу полученного раствора:
m = m(H2O) + m(NaOH) = 1000 + 160 = 1160 г.
2) Находим объем раствора:
3) Вычисляем количества воды и гидроксида натрия в растворе:
4) Определяем массовую долю растворенного вещества:
12.
5) Находим молярную и эквивалентную концентрацию раствора:6) Вычисляем моляльность раствора:
7) Определяем титр:
8) Находим мольную долю гидроксида натрия:
9) Находим мольную долю воды:
13. Термодинамика процесса растворения
Растворение – процесс самопроизвольный,поэтому ∆Gрастворения < 0.
Gрастворения = ∆Н растворения –Т ∆Sрастворения
∆
14. Энергетическая характеристика растворения
1. Растворение твердого вещества с ионнойсвязью в воде.
∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации
> 0
< 0
Разрушение к.р. –
эндотермический процесс
Образование хим. связи
–экзотермический
процесс
15.
1. Если |∆Н ф. п. |> |∆Н гидр. |,то ∆Н растворения > 0, эндо-процесс,
раствор охлаждается (КNO3, NH4NO3)
2. Если |∆Н ф. п. |<|∆Н гидр. |,
то ∆Н растворения < 0, экзо-процесс,
раствор нагревается (NaOH, Н2SO4 )
При растворении тв./ж.
0 < ∆ Н растворения < 0
16.
Теплота (энтальпия) растворения одного моля веществазависит от массы (объема) взятого растворителя.
Теплота растворения вещества в определенном объёме
растворителя
называется
интегральной
теплотой
растворения, а в бесконечно большом объёме растворителя –
дифференциальной теплотой растворения (в данных
примерах она стоит под знаком ∞). Разность значений
интегральной теплоты растворения одного и того же
вещества в различном объёме растворителя называется
теплотой разбавления раствора.
17. Энтропийная характеристика растворения
∆Sрастворения = ∆S фаз. перехода + ∆S гидратации>> 0
< 0,
т.к. уменьшается
число частиц в
единице объёма
Т.о., |∆S ф. п. |> |∆S гидр. |, поэтому
∆Sрастворения тв. веществ > 0
18.
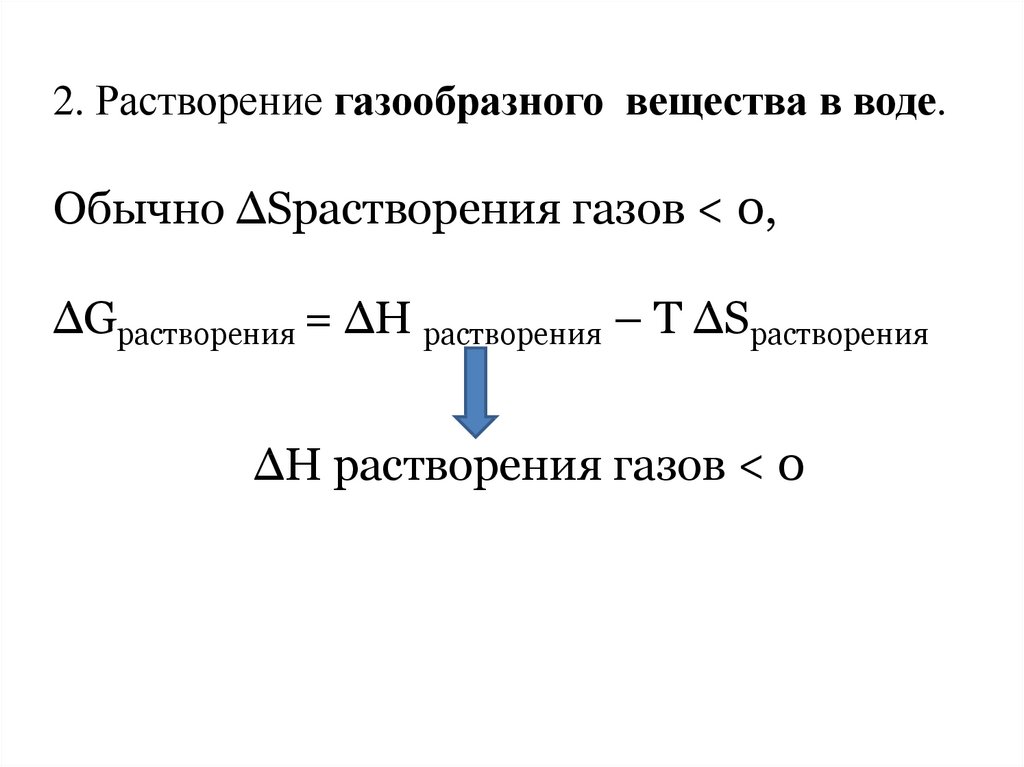
2. Растворение газообразного вещества в воде.Обычно ∆Sрастворения газов < 0,
∆Gрастворения = ∆Н растворения – Т ∆Sрастворения
∆Н растворения газов < 0
19.
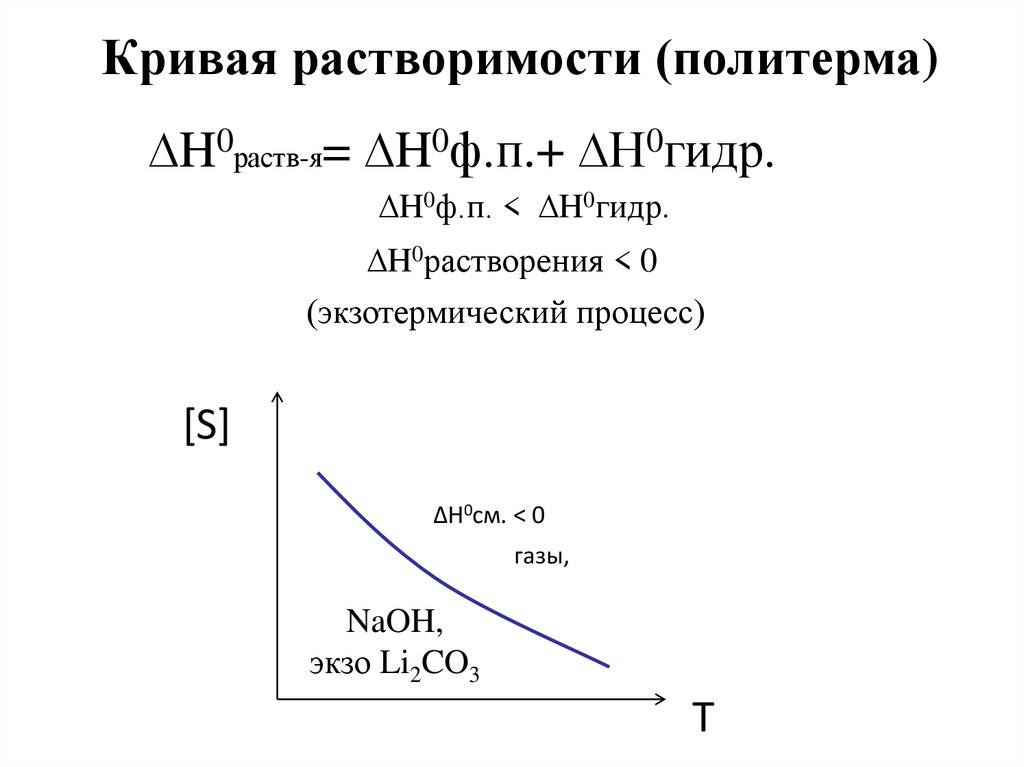
Кривая растворимости (политерма)∆H0раств-я= ∆H0ф.п.+ ∆H0гидр.
∆H0ф.п. < ∆H0гидр.
∆H0растворения < 0
(экзотермический процесс)
[S]
∆H0см. < 0
газы,
NaOH,
экзо Li2CO3
T
20.
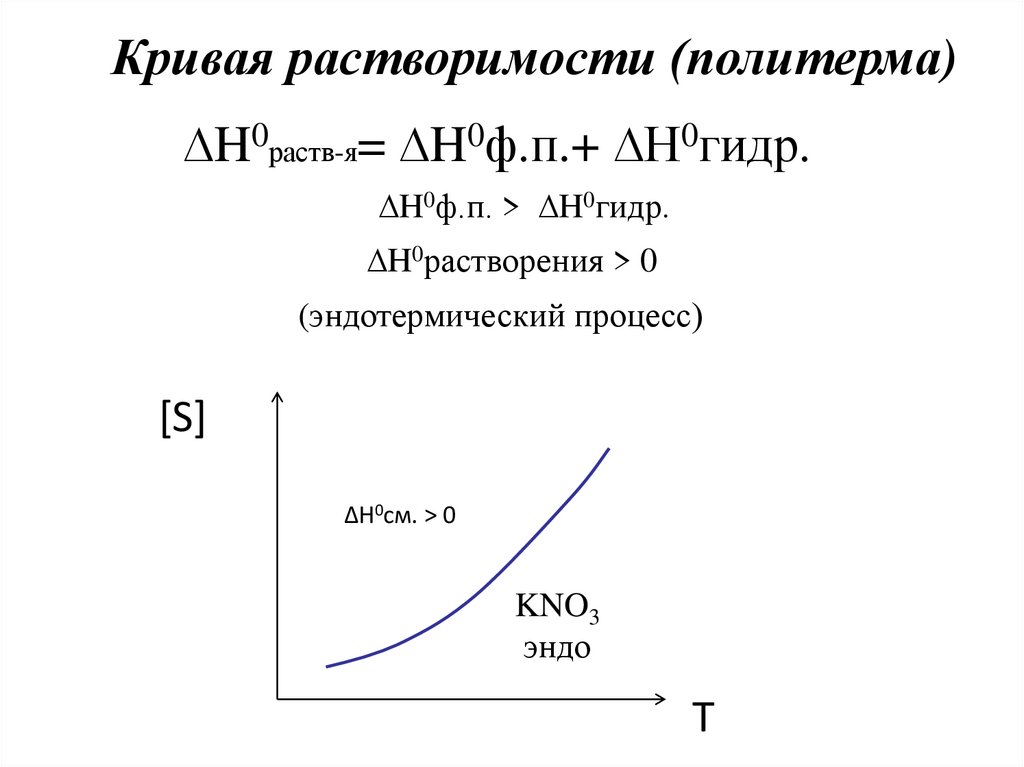
Кривая растворимости (политерма)∆H0раств-я= ∆H0ф.п.+ ∆H0гидр.
∆H0ф.п. > ∆H0гидр.
∆H0растворения > 0
(эндотермический процесс)
[S]
∆H0см. > 0
KNO3
эндо
T
21.
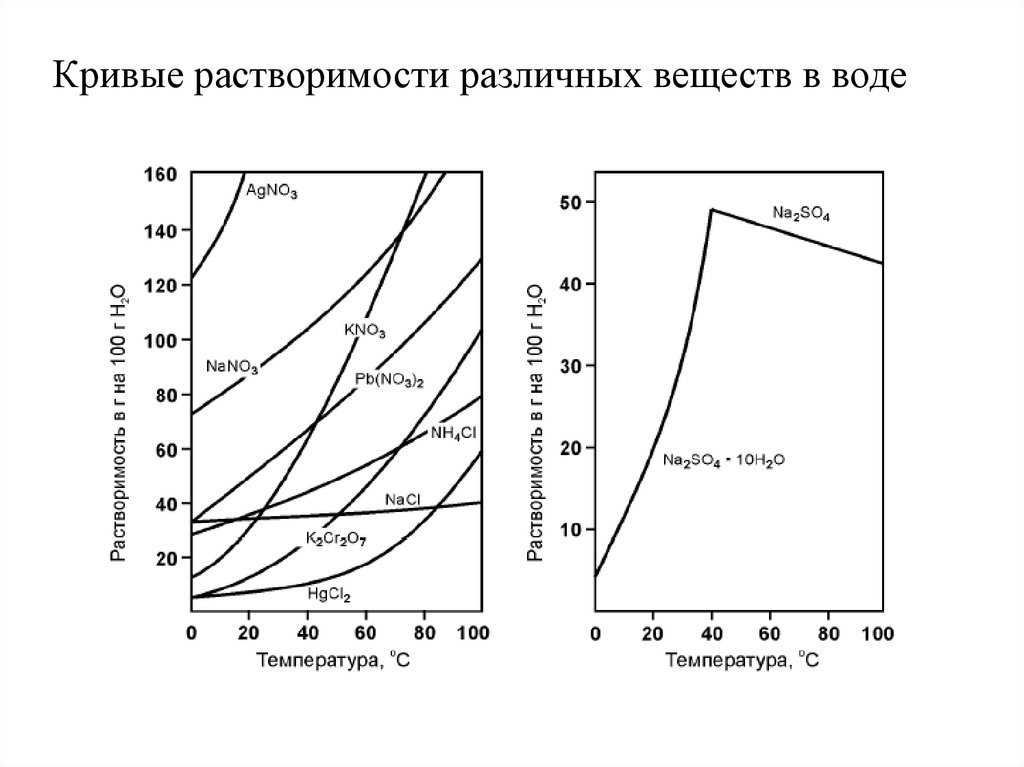
Кривые растворимости различных веществ в воде22. Растворимость газов
Газ + жидкость нас. р-р газаS k p
растворимость
газа (г/л)
Парциальное
давление газа -…
константа Генри (const
растворимости)
При постоянной температуре растворимость чистого идеального газа
пропорциональна его давлению, а растворимость компонентов газовой
смеси – пропорциональна их парциальным давлениям в смеси.
23.
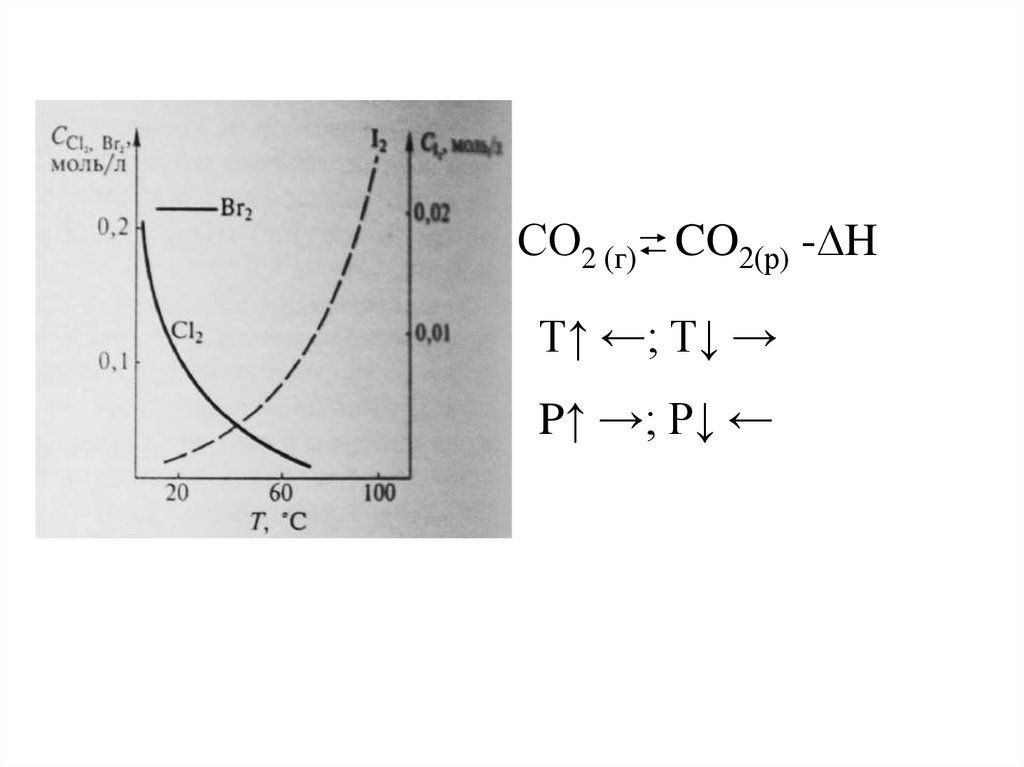
СO2 (г) CO2(р) -∆HТ↑ ←; T↓ →
P↑ →; P↓ ←
24. Коллигативные свойства растворов
1. Осмотическое давление2.Понижение
давления
насыщенного
пара
растворителя над раствором по сравнению с
давлением насыщенного пара растворителя над
чистым растворителем.
3. Повышение температуры кипения раствора по
сравнению с температурой кипения чистого
растворителя
4. Понижение температуры замерзания раствора по
сравнению с температурой замерзания чистого
растворителя.
25.
Диффузия - самопроизвольный процесс выравнивания концентрациичастиц по всему объему раствора или газа под влиянием теплового (или
броуновского) движения.
Осмос— процесс односторонней диффузии через полупроницаемую
мембрану молекул растворителя в сторону бо́льшей концентрации
растворённого вещества (меньшей концентрации растворителя).
26.
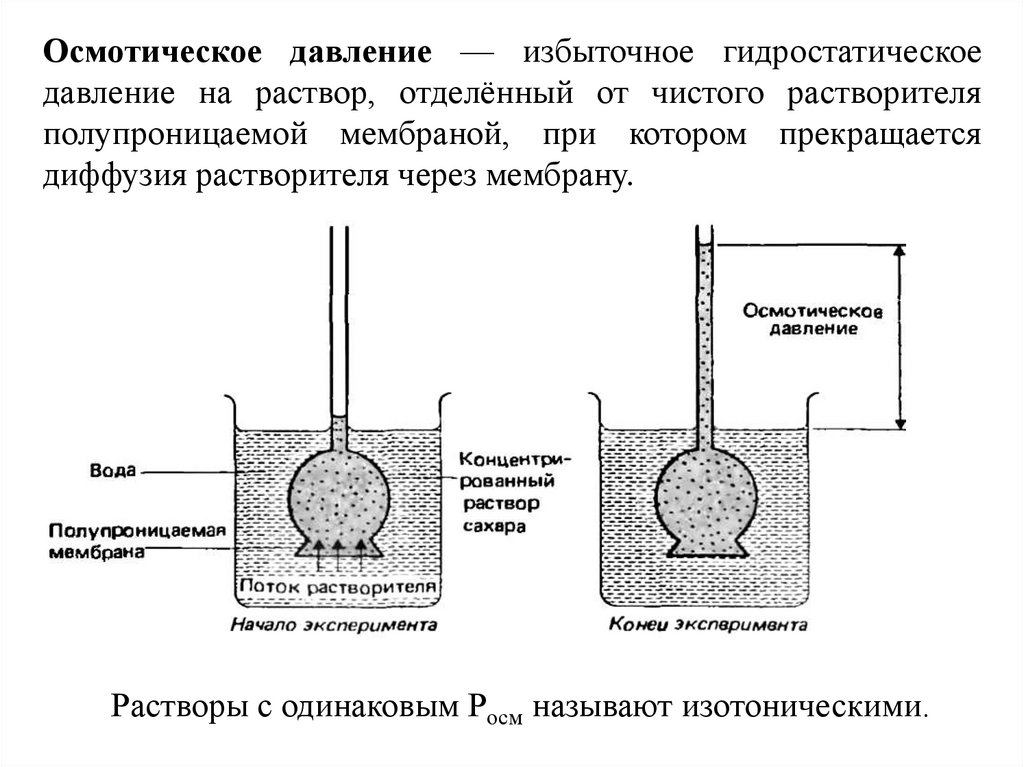
Осмотическое давление — избыточное гидростатическоедавление на раствор, отделённый от чистого растворителя
полупроницаемой мембраной, при котором прекращается
диффузия растворителя через мембрану.
Растворы с одинаковым Росм называют изотоническими.
27.
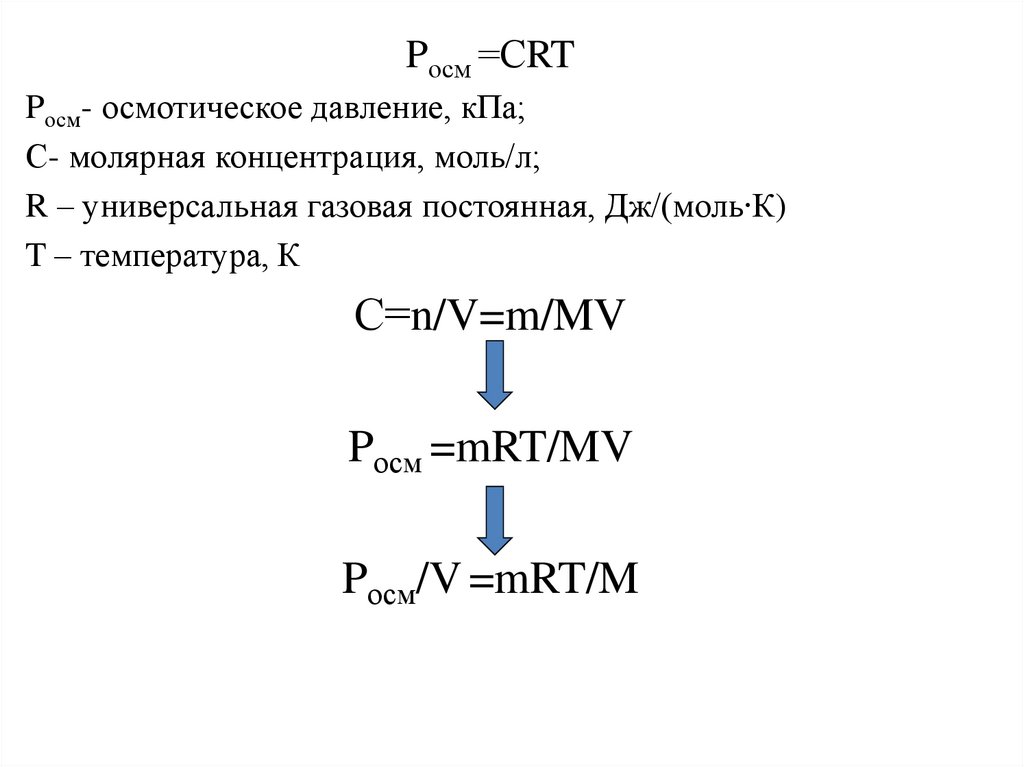
Pосм =СRTPосм- осмотическое давление, кПа;
С- молярная концентрация, моль/л;
R – универсальная газовая постоянная, Дж/(моль∙К)
T – температура, К
С=n/V=m/MV
Pосм =mRT/MV
Pосм/V =mRT/M
28. Практическое использование
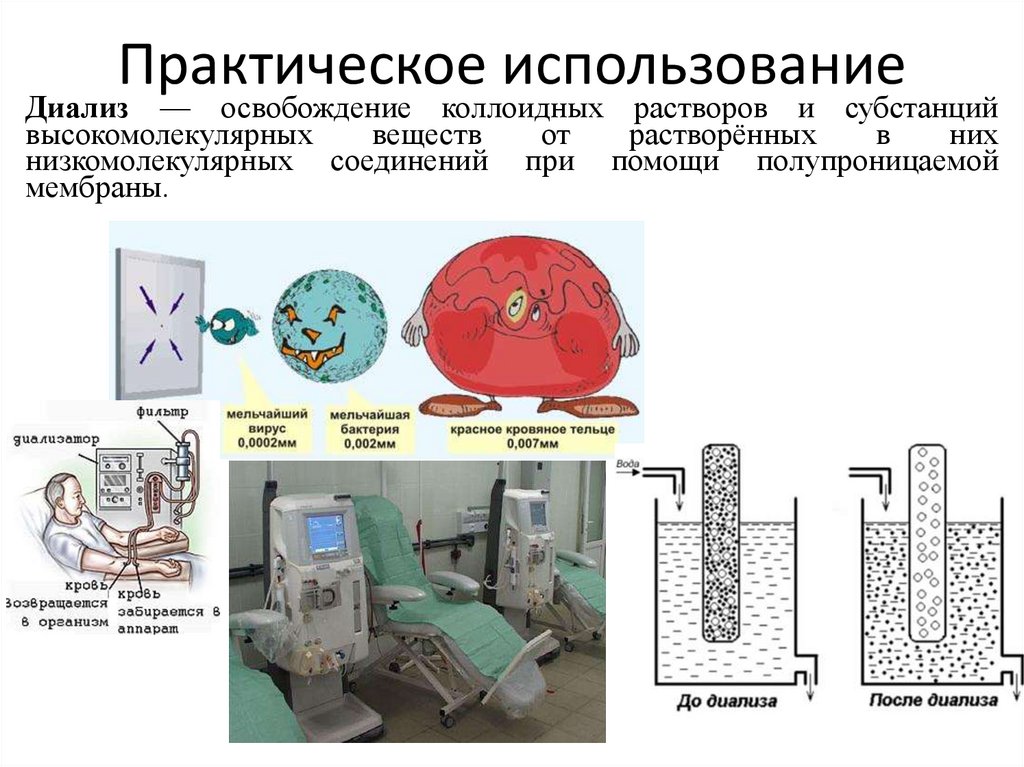
Диализ — освобождение коллоидных растворов и субстанцийвысокомолекулярных
веществ
от
растворённых
в
них
низкомолекулярных соединений при помощи полупроницаемой
мембраны.
29. Давление насыщенного пара растворителя
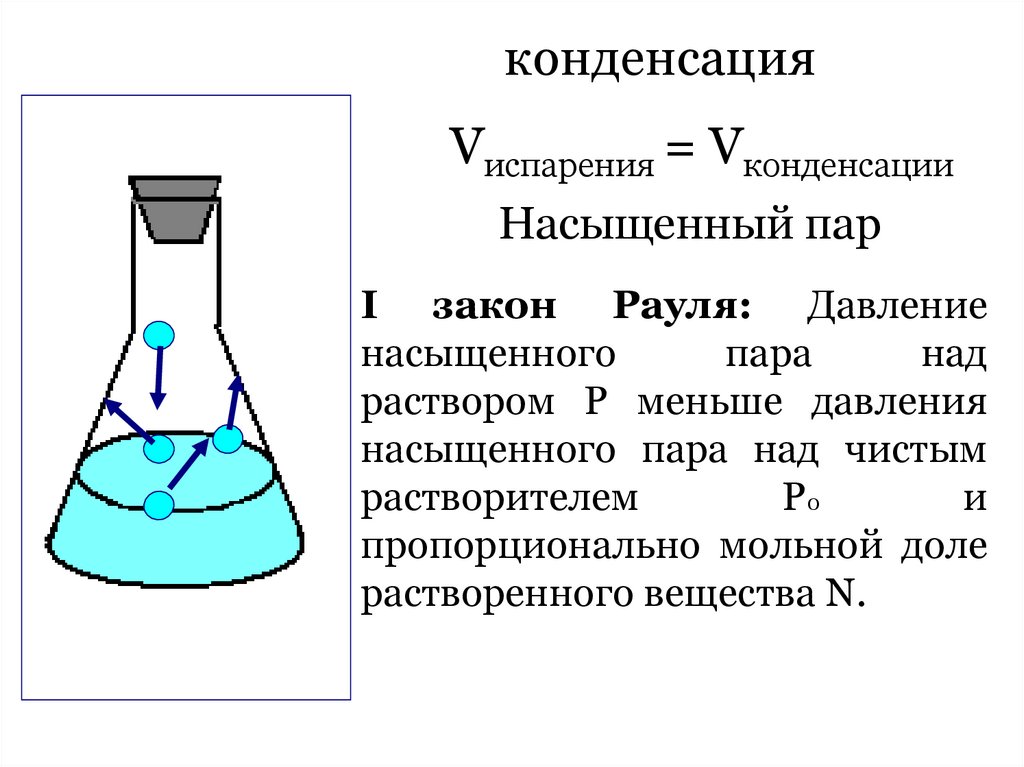
Испарение30.
конденсацияVиспарения = Vконденсации
Насыщенный пар
I закон Рауля: Давление
насыщенного
пара
над
раствором Р меньше давления
насыщенного пара над чистым
растворителем
Р0
и
пропорционально мольной доле
растворенного вещества N.
31.
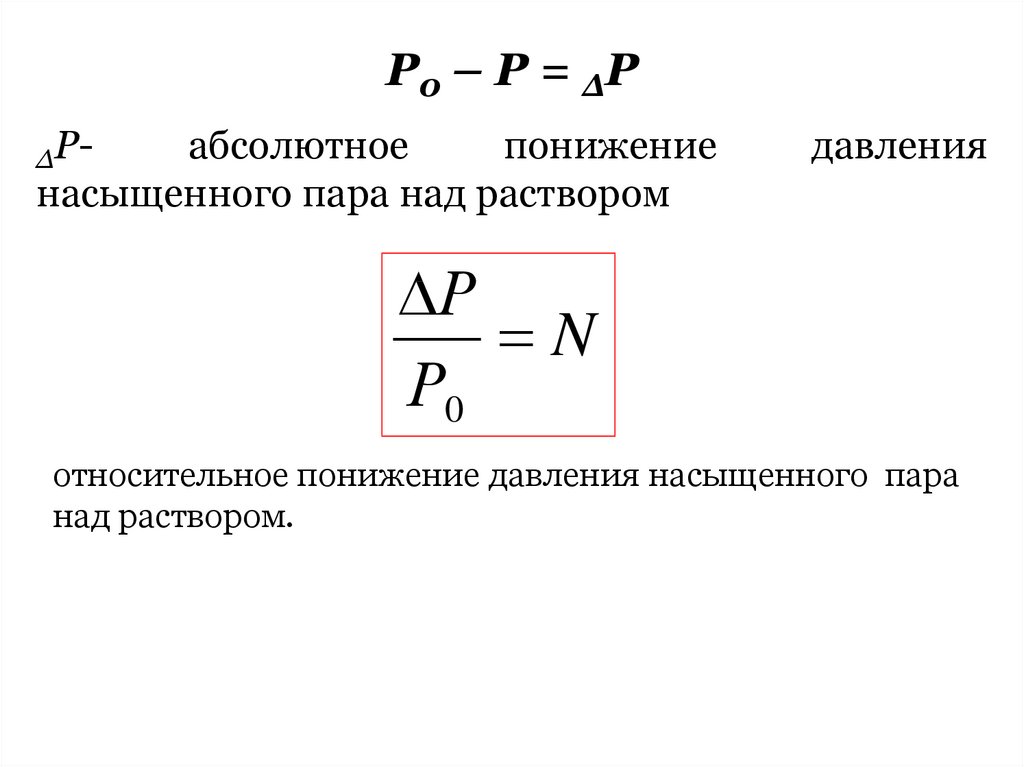
Р0 – Р = ΔРΔР-
абсолютное
понижение
насыщенного пара над раствором
Р0 Р
Р0
давления
Р
N
Р0
относительное понижение давления насыщенного пара
над раствором.
32.
Вычислить давление насыщенного пара над 4%-м воднымраствором глюкозы С6H12O6 при 40 °С.
Решение. Принимаем массу раствора 100 г, тогда масса воды в нём
составит 96 г, а глюкозы 4 г. Молярная масса воды равна 18 г/моль, а
глюкозы 180 г/моль. Давление насыщенного пара над чистой водой при 40
°С равно 7374 Па (справочная величина).
1) Определяем количество воды (n1) и глюкозы (n2) и мольную долю
глюкозы (N) в растворе:
n1
96
5,333 моль
18
n2
4
0,222 моль
180
N
0,022
0,004
5,355
2) Вычисляем величину понижения давления пара над раствором:
ΔР = 7374·0,004 = 29 Па
3) Вычисляем давление насыщенного пара над раствором:
Р = 7374 – 29 = 7345 Па
33.
В разбавленных растворах n1 >> n2, поэтому n1 + n2 ≈ n1.Таким образом, для разбавленных растворов получаем
упрощённые выражения для вычисления мольной доли и
молярной массы растворённого вещества:
P P0 N
n2
n2
N
n1 n2 n1
n2
P P0
n1
P n1
n2
P0
P n1 P0 n2
P0 m
M
P n1
P n1
m
P0
M
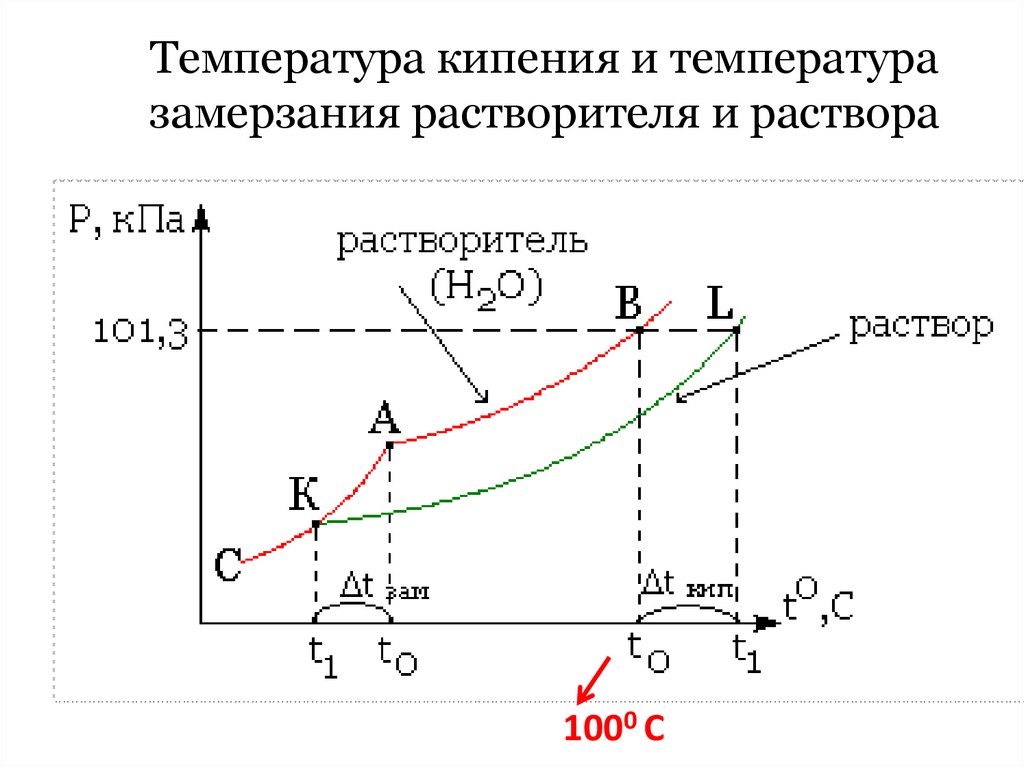
34. Температура кипения и температура замерзания растворителя и раствора
1000 С35.
II закон Рауля (1882) : «Повышение tкип. ипонижение tзам. растворов пропорционально
моляльности растворенного вещества.»
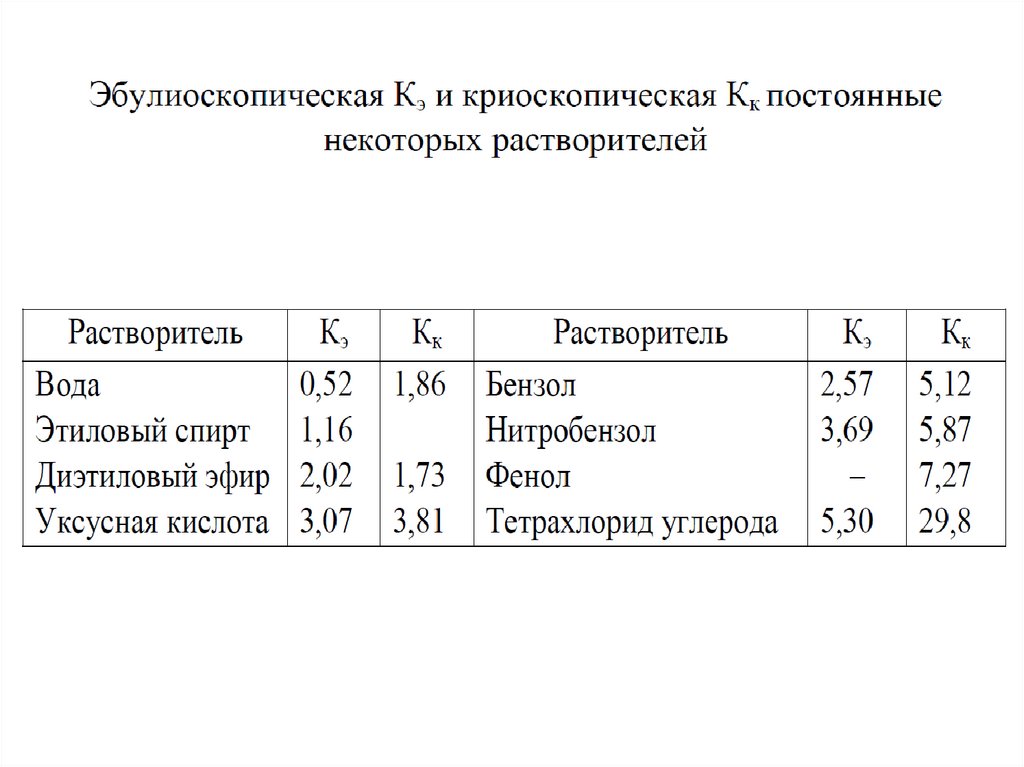
tкип. =Е Сm , tзам. = K Сm
Е- эбулиоскопическая постоянная,
К- криоскопическая постоянная,
Сm- моляльность раствора, моль/кг
Для Н2О: Е= 0,53 кг град / моль,
К=1,86 кг град / моль.
36.
37. Криометрия, эбулиометрия
t замn
m
К Сm K
К
m ( H 2O) кг
М m ( H 2O) кг
М
К m
t зам. m ( H 2O) кг
38.
В 200 мл воды растворено 6,58 г сахара. При какой температурекипит этот раствор?
Решение. 1) При решении имеем в виду, что масса 200 мл воды
равна 200 г, эбулиоскопическая константа воды 0,52, а
молярная масса сахара составляет 342 г/моль. Пересчитываем
массу сахара на 1000 г воды:
Рассчитываем моляльность:
С=32,88/342=0,096 моль/кг
Вычисляем повышение температуры кипения
∆t=0,52∙0,096=0,05град.
Вычисляем температуру кипения раствора
∆t=100+0,05=100,05 ̊С.
39.
Только для растворов неэлектролитовРосм = См R T
P P0 N
Ткип.=Е Сm
Тзам.=К Сm
40.
Вант-Гофф ввел изотоническийкоэффициент i
Росм = i·См R T
P i P0 N
Ткип.= i· Е Сm
Тзам.= i· К Сm
i – отношение общего числа частиц в
растворе к числу исходных молекул
41.
РастворыЧ. 2 Электролитическая диссоциация
Теории кислот и оснований
42.
Электролитическая диссоциация43.
Основные положения учения Арениуса:1. По отношению к электрическому току:
- проводящие электрический ток (электролиты);
- не проводящие электрический ток (неэлектролиты)
2.По степени электролитической диссоциации электролиты:
- сильные > 0,3 (для децимолярного раствора 0,1 моль/л)
- слабые < 0,03
- Электролиты средней силы 0,03 > < 0,3 (HNO2, H2SO3,
HF, H3PO4, HCOOH, H2C2O4, HClO2)
N дис
д
N общ
3. Константа электролидической диссоциации – это константа
равновесия диссоциации.
[
A
][
B
]
+
АВ(р) А (р) + В (р)
K дис.
[ AB]
44.
Факторы, влияющие на :1. природа вещества
а) растворителя (дипольный момент , диэлектрическая
проницаемость);
б) характер хим. связи в молекуле растворенного вещества.
2. концентрация вещества ( С , ↓)
3. температура ( Т, )
45.
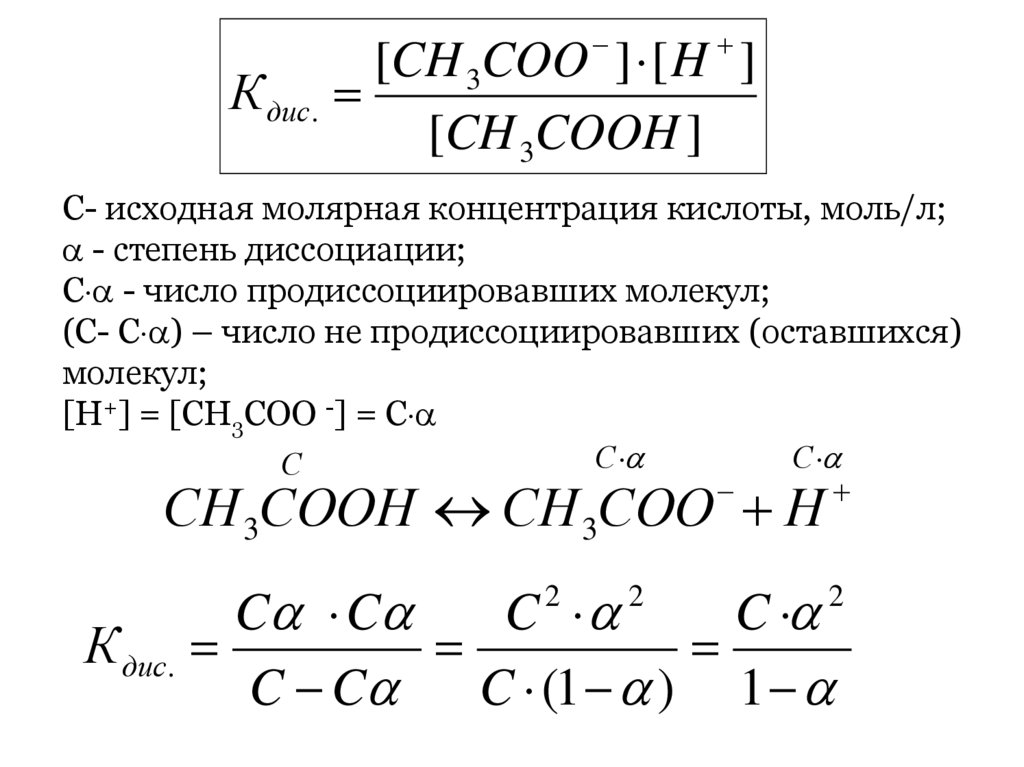
[CH 3COO ] [ H ]СН 3СООН
К дис. СН 3СОО Н
[CH 3COOH ]
С- исходная молярная концентрация кислоты, моль/л;
- степень диссоциации;
С - число продиссоциировавших молекул;
(С- С ) – число не продиссоциировавших (оставшихся)
молекул;
[H+] = [CH3COO -] = С
С
С
С
СН 3СООН СН 3СОО Н
C C
C
C
К дис.
C C C (1 ) 1
2
2
2
46.
22 0 и2(1- ) 1, тогда
для слабых C
электролитов
C
C
C
К дис.
2 (1 )
C КC CC
1
дис.
Кд
С
Закон разведения Оствальда (1888 г.)
Степень диссоциации азотистой кислоты равна 2,3 % в 1 М,
7,1 % в 0,1 М, 22,6% в 10-3 М и т.д. вплоть до 100 %.
47.
Пусть общее число молекул электролита N и каждаямолекула диссоциирует на n ионов. Тогда число молекул
электролита, распавшихся на ионы, равно α·N, число ионов
в растворе – n·α·N, число не распавшихся молекул N - N
или (1 – α)·N Общее число частиц (1 – α)·N + n·α·N
число всех частиц в растворе
i
число исходных частиц
N (n 1 )
n 1
N
i= (n-1) + 1
N n N (1 )
N
i 1
n 1
48.
Изотоническийкоэффициент
определяется
по
отклонению экспериментальных значений свойств
растворов электролитов от расчётных для растворов
неэлектролитов. Численное значение можно вычислить
по одному из следующих отношений:
Pосм.эксп Рэксп Т зам.эксп Т кип.эксп
i
Росм
Р
Tзам
Т кип
49.
Пример. Определите константу и степени диссоциации уксусной кислоты врастворе содержащем 0,571 г CH3COOH в 100 г воды, если этот раствор
замерзает при температуре –0,181 0С.
Решение. 1) Молярная масса уксусной кислоты равна 60 г/моль. Вычисляем
моляльность раствора:
2) По второму закону Рауля вычисляем понижение температуры
замерзания раствора:
3) Вычисляем изотонический коэффициент:
4) Исходя из того, что каждая молекула кислоты диссоциирует на два иона,
вычисляем степень электролитической диссоциации:
5)Ввиду того что раствор
разбавлен считаем
концентрация равна моляльности
что молярная
50.
Сильные электролиты диссоциируют на ионы необратимо и полно но степеньих электролитической диссоциации не достигает 1
молярная концентрация раствораНСl: 0,001 0,01 0,1
степень диссоциации (%)
99
97 92
1
79
Это противоречие объясняет теория П. Дебая и Хюккеля (1923 )
Степень электролитической диссоциации сильного электролита,
определяемая опытным путем называется кажущейся. Она обозначается
αкаж (или αэфф).
51.
Пример. При растворении 3,48 г нитрата кальция в 200 г воды полученраствор замерзающий при температуре –0,491 0С. Определить
кажущуюся степень электролитической диссоциации Ca(NO3)2.
Решение. 1) Молярная масса нитрата кальция равна 174 г/моль.
Определяем моляльность раствора:
2) Находим по второму закону Рауля теоретическое понижение температуры
замерзания раствора:
3) Вычисляем изотонический коэффициент:
4) Определяем кажущуюся степень диссоциации Ca(NO3)2:
52.
Образование гидратных оболочек ионных пар и ассоциатов врастворах сильных электролитов приводит как бы к
уменьшению концентрации ионов. Растворённый электролит
«проявляет себя» в химических реакциях так, как будто его
«действующая» концентрация меньше, чем она есть на самом
деле.
Г. Льюиса (1907) вместо концентрации вводит понятие активность.
Активность (a) – это кажущаяся (эффективная) концентрация сильного
электролита, соответственно которой он действует в химических
реакциях и с помощью которой свойства реального раствора электролита
можно рассчитывать по закономерностям, установленным для идеального
раствора.
а fa C
Аналитическая
концентрация
Коэффициент активности (справочная величина)
53.
Коэффициенты активности ионов зависят от ионной силы раствора (I), тоесть от интенсивности электростатического поля, которая определяется
расчётным путём как полусумма произведений из концентрации всех
ионов в растворе на квадрат их заряда:
1
2
I Cmi Z i
2
размерность совпадает с размерностью концентрации
Сm (NaCl) = 0,15 моль/ кг
1
2
2
I (0,15 1 0,15 1 ) 0,15 моль / кг
2 Na
Cl
54.
Для разбавленных растворов, в которых I ≤ 0,01:lg f a 0,5 Z Z I
Предельный з-н Дебая-Хюккеля
Для растворов электролитов одинаковозарядных
(MgSO4):
lg f a 0,5Z
2
I
55.
Пример:Определить fa 0,001 М р-ра К2SO4.
1
2
I (2 0,001 1 0,001 2 ) 0,003
2
K
SO4 2
lg f a 0,5 2 1 0,003 0,055
f a 10
0 , 055
0,88
56.
Пример. В 250 г воды растворено 0,375 г сульфата магния. Определитькоэффициенты активности ионов и активность раствора.
Решение. 1) Молярная масса MgSO4 равна 120 г/моль. Если
в 250 г воды содержится 0,375 г сульфата магния, то в 1 кг воды – 1,5 г.
Вычисляем моляльность раствора:
2) Поскольку раствор очень разбавленный, то его плотность можно принять
равной плотности воды, а молярную концентрацию равную моляльной
C = Сm = 0,0125 моль/л.
1 2
I (2 0,0125 2 2 0,01 25) 0,05 моль / л
2
Мg 2
SO4 2
3) Пользуясь справочными данными находим коэффициенты активности
ионов для найденной ионной силы раствора f (Mg2+)=0,595; f(SO42-) =0,545
4) Определим активности ионов и активность раствора.
57.
Произведение растворимостиПроизведение растворимости (ПР) - произведение равновесных
концентраций ионов сильных малорастворимых электролитов в их
насыщенном растворе в степенях, равных стехиометрическим
коэффициентам.
ПР = [Ba+][SO42-]
Ag2S(T) 2Ag+(p)+S2-(p)
[Ag+]=4х2; [S2-]=х ПР=4х3
3
ПРAg 2 S
4
58.
Условие выпадения осадка59.
Предсказать возможные направления превращений60.
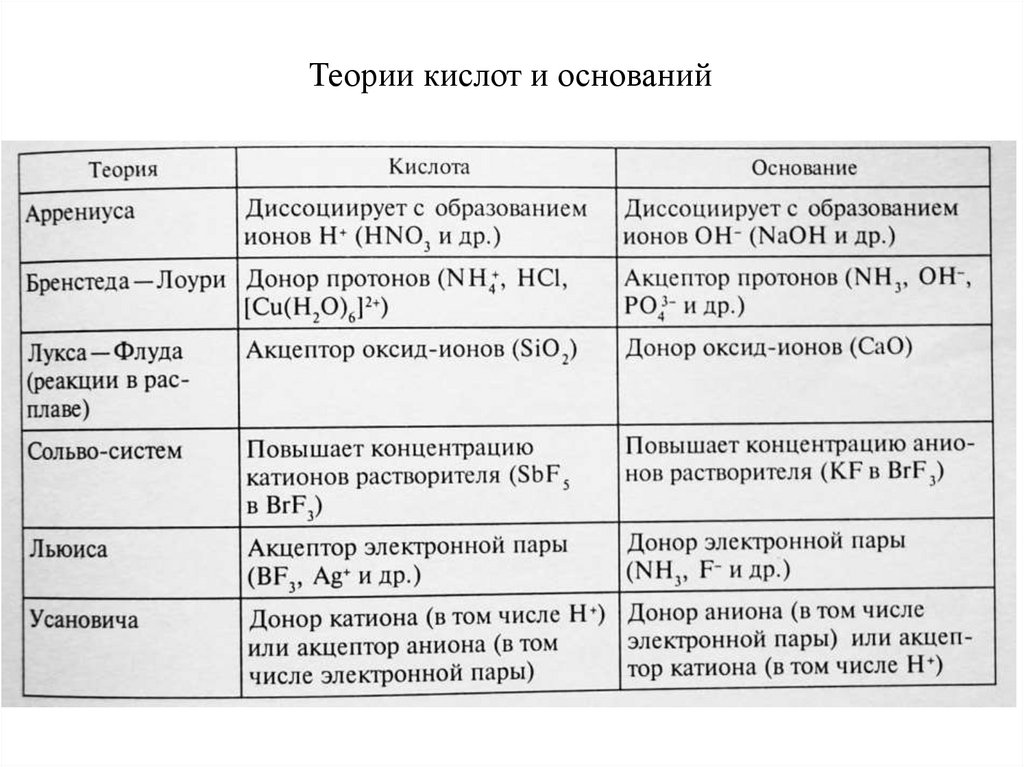
Теории кислот и оснований61. Протонная теория кислот и оснований. Теория Бренстеда – Лоури (1923 г.)
Основные положения :Кислота - всякая частица (молекула, ион)
отдающая протон, т.е. донор протонов.
Основание – частица, присоединяющая
протон, т.е. акцептор протонов.
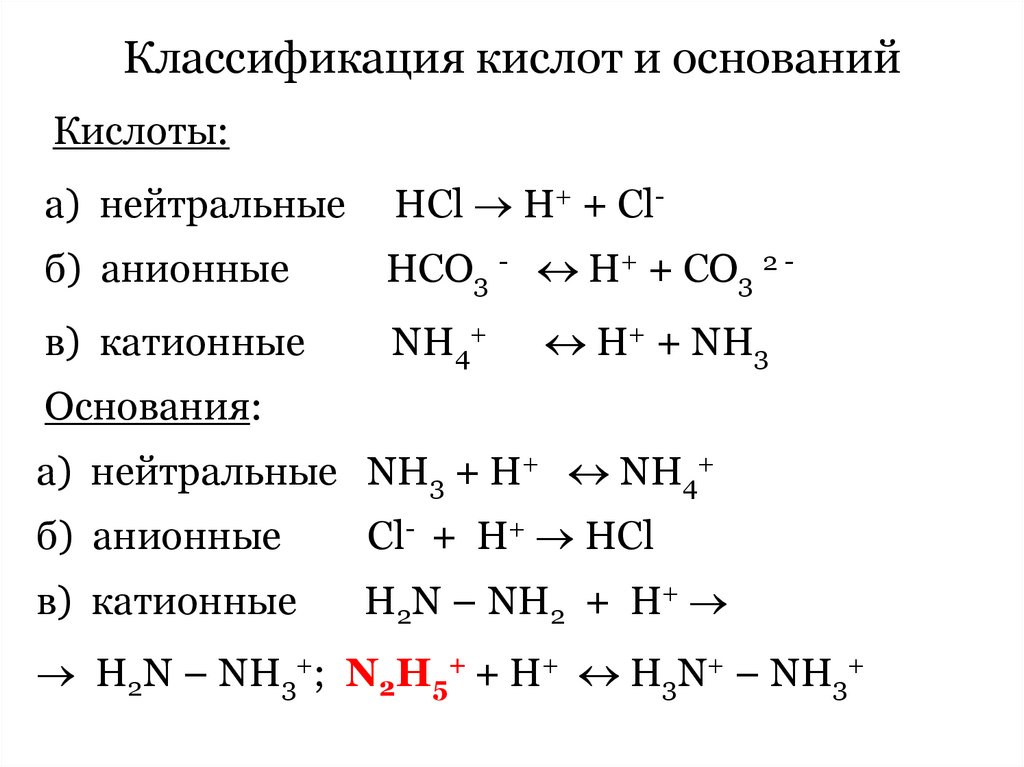
62. Классификация кислот и оснований
Кислоты:а) нейтральные
НCl H+ + Cl-
б) анионные
HCO3 - H+ + CO3 2 -
в) катионные
NH4+
H+ + NH3
Основания:
а) нейтральные NH3 + H+ NH4+
б) анионные
Сl- + H+ HCl
в) катионные
H2N – NH2 + H+
H2N – NH3+; N2H5+ + H+ H3N+ – NH3+
63.
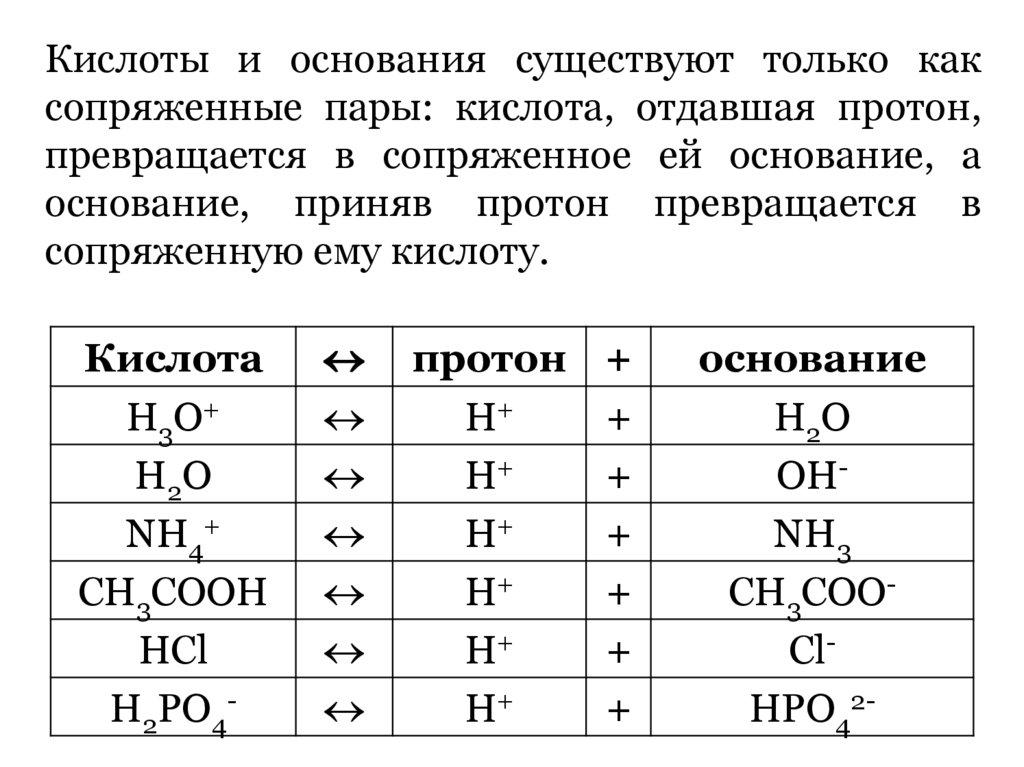
Кислоты и основания существуют только каксопряженные пары: кислота, отдавшая протон,
превращается в сопряженное ей основание, а
основание, приняв протон превращается в
сопряженную ему кислоту.
Кислота
Н3О+
Н2О
NH4+
CH3COOH
HCl
H2PO4-
протон
Н+
Н+
Н+
Н+
Н+
Н+
+
+
+
+
+
+
+
основание
Н2О
ОНNH3
CH3COOClHPO42-
64. Типы протолитических реакций
1. нейтрализацияCH 3COOH ОН СН 3СОО Н 2О
осн.2
к та1
Н 3О NH 3 Н 2О NH 4
к та1
осн.2
к та 2
осн.1
к та 2
осн.1
2. гидролиз
2
СО3 Н 2О НСО3 ОН
осн.1
к та 2
к та1
осн.2
3. электролитическая диссоциация
СН 3СООН Н 2О СН 3СОО Н 3О
к та1
осн.2
осн.1
к та 2
65.
4.Кислотно-основные свойства вещество
проявляет в конкретной химической реакции.
В зависимости от партнера могут быть
вещества амфолиты.
Характеристика воды как амфолита
НСl Н 2О Cl Н 3О
к та1
осн.2
осн.1
к та 2
NH 3 Н 2О NH 4 ОН
осн.1
к та 2
к та1
осн.2
5. Протон в водных растворах гидратирован,
существует в виде иона –гидроксония Н3О+
66.
Классификация растворителей1. апротонные (нет Н+) : СS2, CCl4 и др.
2. протолитические :
а) протогенные – отдают Н+ (Н2SO4,
CH3COOH)
б) протофильные
- присоединяют Н+
(NH3 жидкий)
в) амфипротонные (Н2О)
67.
NH3 Н2О С2Н5ОН HCN H2S CH3COOHHNO3 H2SO4 HF HClO4
Возрастает способность быть донором протона
В аммиаке все соединения – кислоты, а в хлорной кислоте основания
С2Н5ОН + NH3→NH4+ +С2Н5ОHNO3+HClO4→H2NO3++ClO4-
Слабые кислоты в аммиаке становятся сильными, а сильные так и
остаются сильными, сила кислот выравнивается.
Растворители в которых выравнивается сила кислот или
оснований называется нивелирующим.
68.
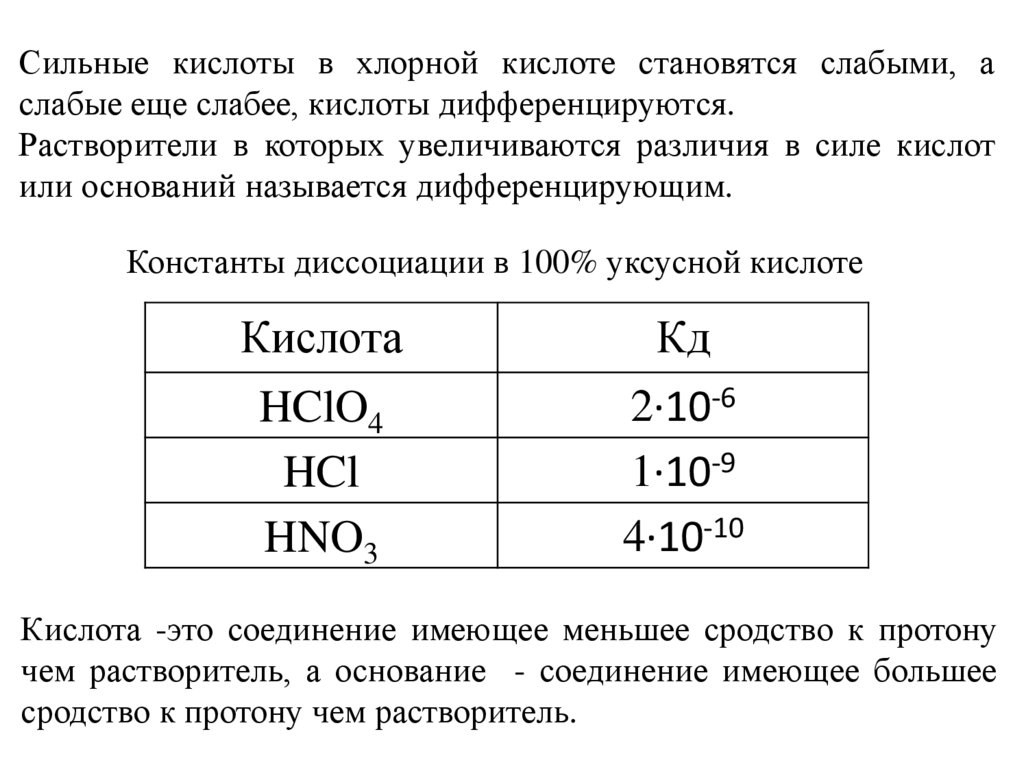
Сильные кислоты в хлорной кислоте становятся слабыми, аслабые еще слабее, кислоты дифференцируются.
Растворители в которых увеличиваются различия в силе кислот
или оснований называется дифференцирующим.
Константы диссоциации в 100% уксусной кислоте
Кислота
Кд
HClO4
HCl
HNO3
2∙10-6
1∙10-9
4∙10-10
Кислота -это соединение имеющее меньшее сродство к протону
чем растворитель, а основание - соединение имеющее большее
сродство к протону чем растворитель.
69.
70.
71.
72.
73.
74.
Формальная оценка силы кислот в водных растворах(правило Полинга)
1.HnЭОn. Это очень слабые кислоты, константы диссоциации
которых К < 10–7. HClO, HBrO, HIO, H3BO3, H3AsO3…
2.НnЭОn+1. Это слабые кислоты, константы диссоциации
которых находятся в интервале от 10–2 до 10–7. H2SO3, H2CO3,
H2SiO3, H3PO4
3.HnЭOn+2. Это сильные кислоты, константы диссоциации
которых находятся в интервале от 10–2 до 103 HNO3, HClO3,
H2SO4, H2SeO4, HPO3
4.HnЭOn+3. Это очень сильные кислоты,
диссоциации которых > 103. HClO4, HMnO4
константы
75.
Если у нескольких кислот формальный показательодинаков и одинаковая степень окисления
кислотообразующего элемента, то сила этих кислот
уменьшается с возрастанием радиуса атома
кислотообразующего элемента. Проявление этой
закономерности можно показать на примере
уменьшения констант диссоциации кислот в ряду
HClO(5·10–8) – HBrO(2·10–9) – HIO(2·10–10).
76.
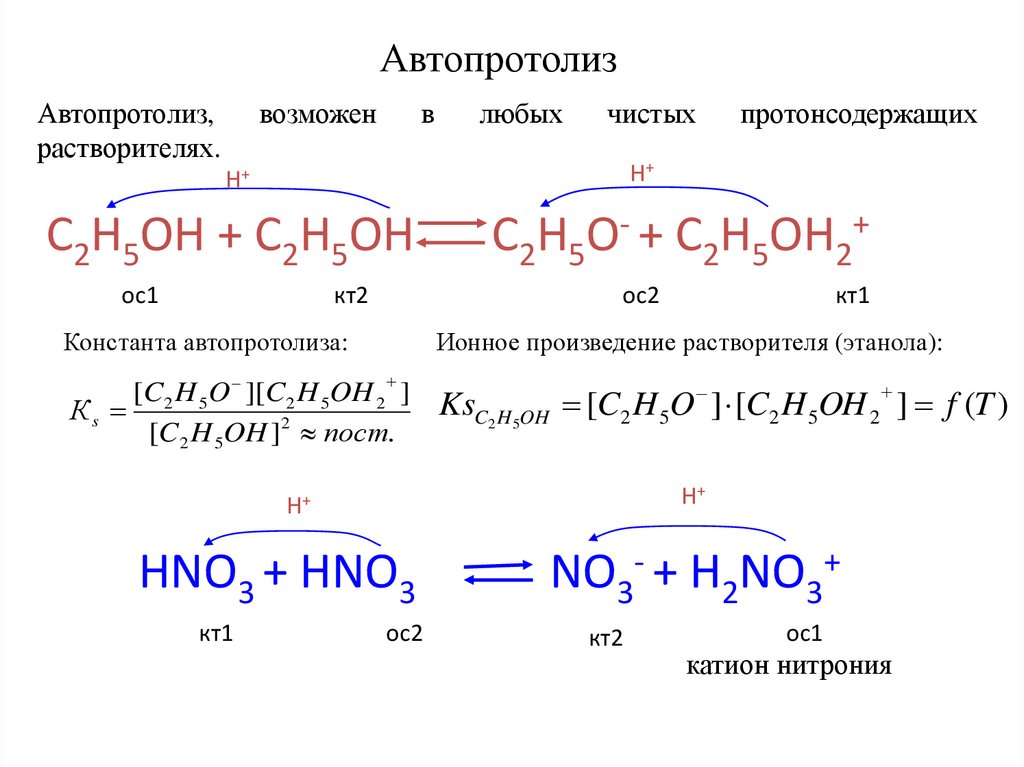
АвтопротолизАвтопротолиз,
растворителях.
возможен
в
любых
чистых
H+
H+
C2H5OH + C2H5OH
ос1
кт2
C2H5O- + C2H5OH2+
ос2
Константа автопротолиза:
кт1
Ионное произведение растворителя (этанола):
[C2 H 5O ][C2 H 5OH 2 ]
Кs
[C2 H 5OH ]2 пост.
KsC2 H 5OH [C2 H 5O ] [C2 H 5OH 2 ] f (T )
H+
H+
HNO3 + HNO3
кт1
протонсодержащих
ос2
NO3- + H2NO3+
кт2
ос1
катион нитрония
77.
Диссоциация воды. Ионноепроизведение воды.
Н+
H 2O H 2O ОН Н 3О
к та 1
осн.1
осн.2
к та 2
Н2О Н+ + ОН
[ H ] [OH ]
16
Кд
1,8 10
[ H 2O ]
const
0
(25 C )
78.
(Н2О) =1,8 10-9 , это значит, что из50 000 000 молекул распадается - 1
m
1000
[ H 2O ]
55,56 моль / л
M 18 г / моль
(t 25 C и Р 1 атм.)
0
К д [ H 2O] [ H ] [OH ] K H 2O const
Ионное произведение воды
K Н 2О [ H ] [OH ] 1,8 10
16
55,56 10
14
79.
К Н 2О 10 14При 250 С
При
37 С К Н 2О 10
При
800 С
0
13, 6
К H 2O f (t ),
если t , то К Н 2О
К Н 2О 10 12
В чистой воде [ H ] [OH ] K H 2O 10 14 10 7 моль / л
(нейтральная среда)
[ H ] [OH ], [ H ] 10 7 моль / л
(кислая среда)
7
[ H ] [OH ], [ H ] 10 моль / л
(щелочная среда)
80.
Водородный показатель (рН)1909 г. Серенсен
рН lg [ H ];
Н 10
рН lg aH
рН
рОН lg [OH ]; рОН lg аОН
[ H ] [OH ] 10
14
pH pOH 14
81.
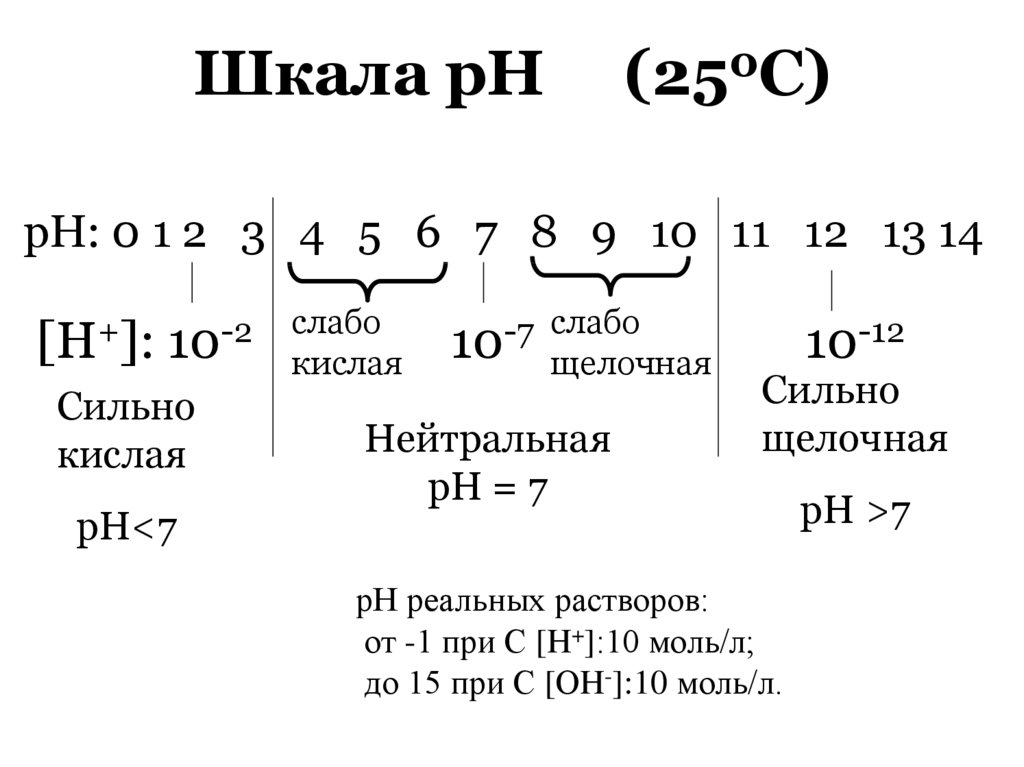
Шкала рН(250С)
рН: 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
[H+]:
10-2
Сильно
кислая
рН<7
слабо
кислая
слабо
-7
10 щелочная
Нейтральная
рН = 7
10-12
Сильно
щелочная
рН реальных растворов:
от -1 при С [H+]:10 моль/л;
до 15 при С [ОH-]:10 моль/л.
рН >7
82.
Расчет рН растворовI. Сильных кислот и оснований fa 1
а) НСl Н Сl , [ H ] Cн (к ты)
рН lg [ H ] lg Cн (к ты)
б ) NaOH Na OH , [OH ] Cн (щел.)
рОН lg [OH ] lg Cн (щел.)
рН 14 рОН
83.
II. Слабых кислот и основанийа) СН 3СООН СН 3СОО Н
[ H ] Cн (к ты) ;
рН lg Cн (к ты)
б ) NH 4OH NH 4 OH
[OH ] Cн (осн.)
рН 14 рОН 14 ( lg Cн. (осн.) )
84.
Если неизвестно:[CH 3COO ] [ H ]
К дис.
[CH 3COOH ]
2
[H ]
К дис.
;
[CH 3COOH ]
[СН3СОО-]=[Н+]
[ H ] K д Cк ты
1
1
рН рК д lg Cк ты ;
2
2
1
1
рОН рК осн. lg Cосн
2
2
рК lg K д
В справочнике
85.
H3PO4 + H2OH2PO4- + H3O+ Кк = 7,5∙10-3
H2PO4- + H2O
HPO42- + H3O+
Кк = 6,3∙10-8
HPO42- + H2O
PO43- + H3O+
Кк = 2,∙10-13
α1 >> α2 >> α3
86.
Буферные растворыБуферные растворы – это растворы состоящие из слабой кислоты и её соли
или слабого основания и его соли, поддерживающие в определенных
пределах значение водородного показателя постоянным при изменении
концентрации и состава раствора
слабая кислота
I.
сопряжен. основание
слабое основание
II .
сопряжен. кислота
87.
Значения рН важнейших биологическихжидкостей
жидкость
1. желудочный сок
рН
1,85 0,15
2. слюна
6,6 0,3
3. желчь
6,9 0,4
4. плазма крови (артериальная)
7,4 0,05
5. слезная жидкость
7,7 0,1
6. сок поджелудочной железы
8,8 0,2
88.
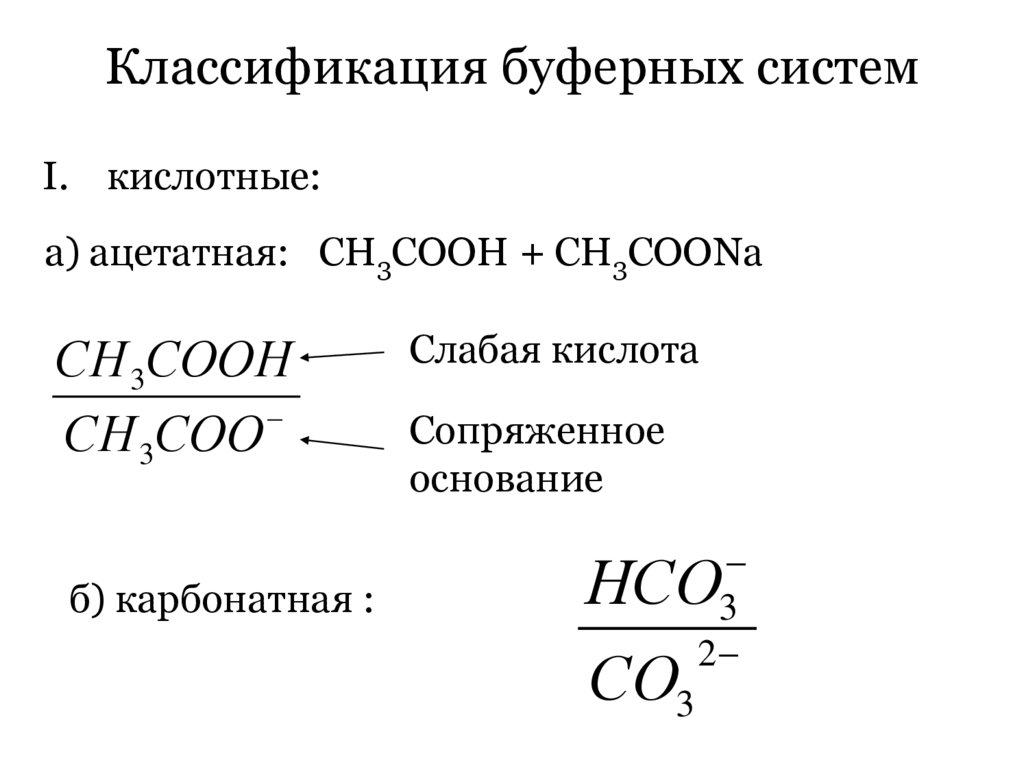
Классификация буферных системI. кислотные:
а) ацетатная: СН3СООН + СН3СООNa
СН 3СООН
СН 3СОО
б) карбонатная :
Слабая кислота
Сопряженное
основание
3
2
НСО
СО3
89.
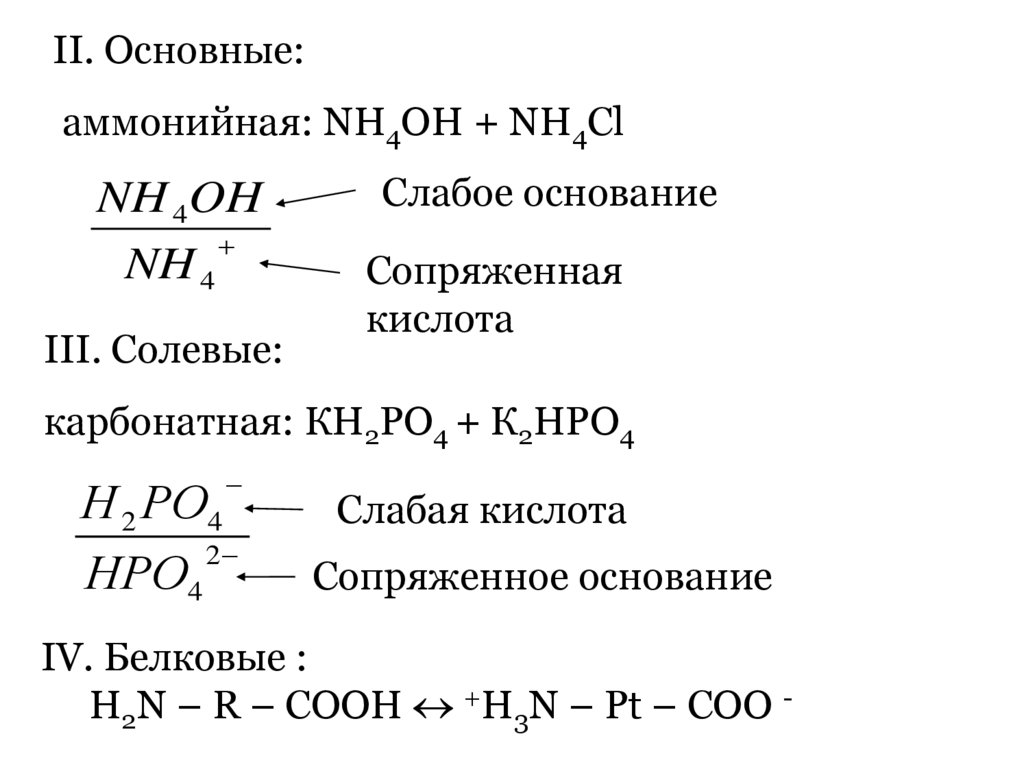
II. Основные:аммонийная: NH4OH + NH4Cl
NH 4OH
NH 4
III. Солевые:
Слабое основание
Сопряженная
кислота
карбонатная: КН2РО4 + К2НРО4
Н 2 РО4
2
НРО4
Слабая кислота
Сопряженное основание
IV. Белковые :
H2N – R – COOH +H3N – Pt – COO -
90.
91.
Расчет рН буферных системСН 3СООН
1. кислотный буфер:
СН 3СООNa
СН3 СООН СН3 СОО- + Н+
СН3 СООNa СН3 СОО- + Na+
( 0)
( 1)
[CH 3COO ] [ H ]
Кд
;
[CH 3COOH ]
[CH 3COO ] Cсоли , [CH 3COOH ] Cк ты
92.
Ссоли [ H ]Ск ты
Кд
; [H ] Кд
Ск ты
Ссоли
Cк ты
lg [ H ] lg К д lg
;
Ссоли
lg К д рК к ты
Cсоли
рН рК к ты lg
Ск ты
уравнение Гендерсона - Гассельбаха
93.
2. основной буфер:NH 4OH
NH 4Cl
Ссоли [ОH ]
Сосн
Кд
; [ОH ] К д
Сосн
Ссоли
Cосн
lg [ОH ] lg К д lg
;
Ссоли
lg К д рК осн
Cсоли
рОН рК осн lg
;
Сосн.
рН 14 рОН
94.
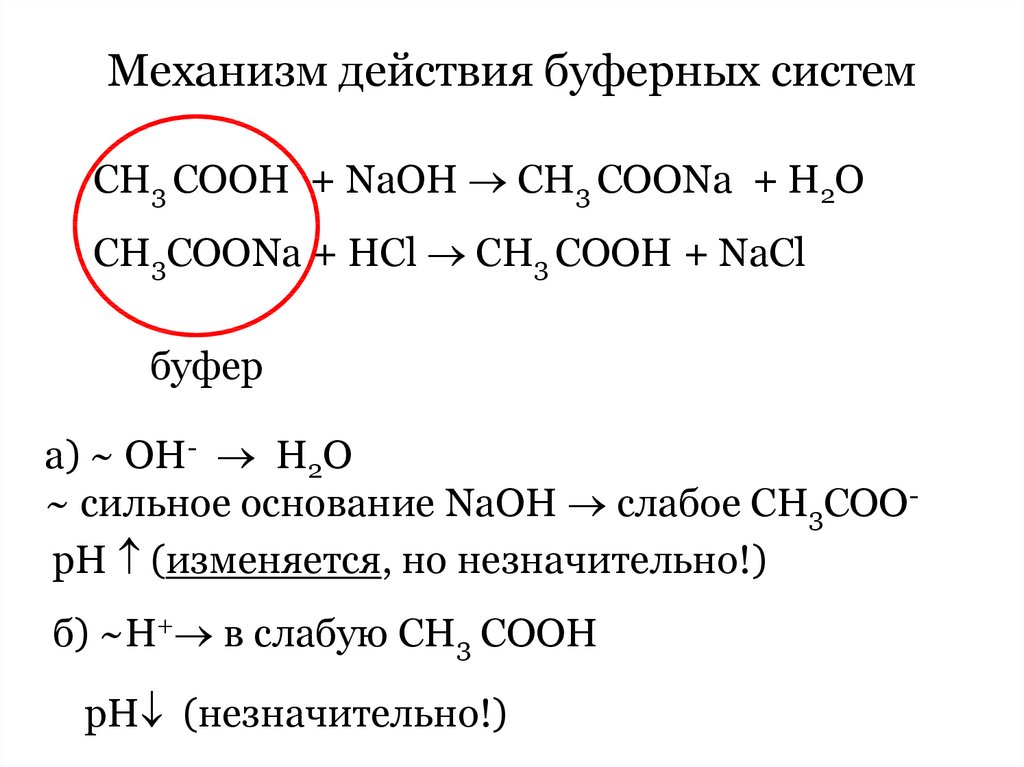
Механизм действия буферных системСН3 СООН + NaOH CH3 COONa + H2O
CH3COONa + HCl CH3 COOH + NaCl
буфер
а) ~ OH- Н2О
~ сильное основание NaOH слабое СН3СООрН (изменяется, но незначительно!)
б) ~Н+ в слабую СН3 СООН
рН (незначительно!)
95.
Вычислить pH ацетатного буфера при концентрациях CH3COOH иCH3COONa, равных 1 моль/л, и при разбавлении растворов 10 и в 100 раз;
по результатам вычислений сделать вывод.
Решение. 1) При концентрациях соли и кислоты 1М:
Ск ты
5 1
[H ] Кд
1,8 10 1,8 10 5
Ссоли
1
рН lg H 1,8 10 5 4,74
2) При разбавлении в 10 раз концентрации соли и кислоты 0,1М:
Ск ты
0,1
5
[H ] Кд
1,8 10
1,8 10 5
Ссоли
0,1
рН lg H 1,8 10 5 4,74
3) При разбавлении в 100 раз концентрации соли и кислоты 0,01М:
Ск ты
0,01
5
[H ] Кд
1,8 10
1,8 10 5
Ссоли
0,01
рН lg H 1,8 10 5 4,74
96.
В колбу поместили 2,25 мл 100% уксусной кислоты с плотностью 1,05 г/мл,4,92 г ацетата натрия и разбавили водой до 200 мл. Рассчитайте рН раствора.
Решение:
Ск ты
[H ] Кд
Ссоли
m(CH3COOH)=2,25 ∙ 1,05=2,36 г.
n (CH3COOH)=2,36/60=0,04 моль
С (CH3COOH)=0,04/0,2=0,2 моль/л
n (CH3COONa)=4,92/82=0,06 моль
С (CH3COONa)=0,06/0,2=0,3 моль/л
Ск ты
0,2
5
[H ] Кд
1,8 10
1,2 10 5
Ссоли
0,3
рН lg H 1,2 10 5 4,92
97.
К 100 мл 1 М ацетатного буферного раствора прибавили 100 млдецимолярной соляной кислоты. Вычислить водородный показатель
нового раствора.
Решение: количество вещества уксусной кислоты и ацетата натрия в
исходном растворе составит n=0,1∙1=0,1 моль, количество вещества
добавленной соляной кислоты составит n=0,1∙0,1=0,01 моль.
Согласно уравнению реакции:
CH3COONa+HCl=CH3COOH+NaCl
Количество вещества образовавшейся уксусной кислоты равно
количеству вещества добавленной соляной кислоты. В конечном
растворе n (CH3COOH)=0,1+0,01=0,11 моль, а количество ацетата натрия
0,1-0,01=0,09 моль
0,09
0,11
С
0,45 моль / л
Ск ты
0,55 моль / л
соли
0,2
0,2
Ск ты
0,55
5
[H ] Кд
1,8 10
2,2 10 5
Ссоли
0,45
рН lg H 2,2 10 5 4,66
98.
Предельное количество кислоты или щёлочи (в моль/л), придобавлении которого к буферному раствору его pH
изменяется на единицу, называется буферной ёмкостью
этого раствора.
Для ацетатного буферного раствора рН должен изменится с 4,74 например
до 3,74. Этому значению рН соответствует [H+]=1,8∙10-4 то есть в 10 раз
больше чем у исходного раствора (1,8∙10-5 ). Десятикратное увеличение
[H+] произойдет при условии увеличения в 10 раз отношения уксусной
кислоты и ацетата натрия
Неизвестное количество соляной кислоты (моль/л), которое можно
прибавить к 1 л исходного буферного раствора, обозначим Х. Тогда в
результате реакции HCl с CH3COONa концентрация уксусной кислоты в
растворе на эту величину повысится, а концентрация соли понизится:
Ск ты 1 x
10 x 0,82 моль / л
Ссоли 1 x
99.
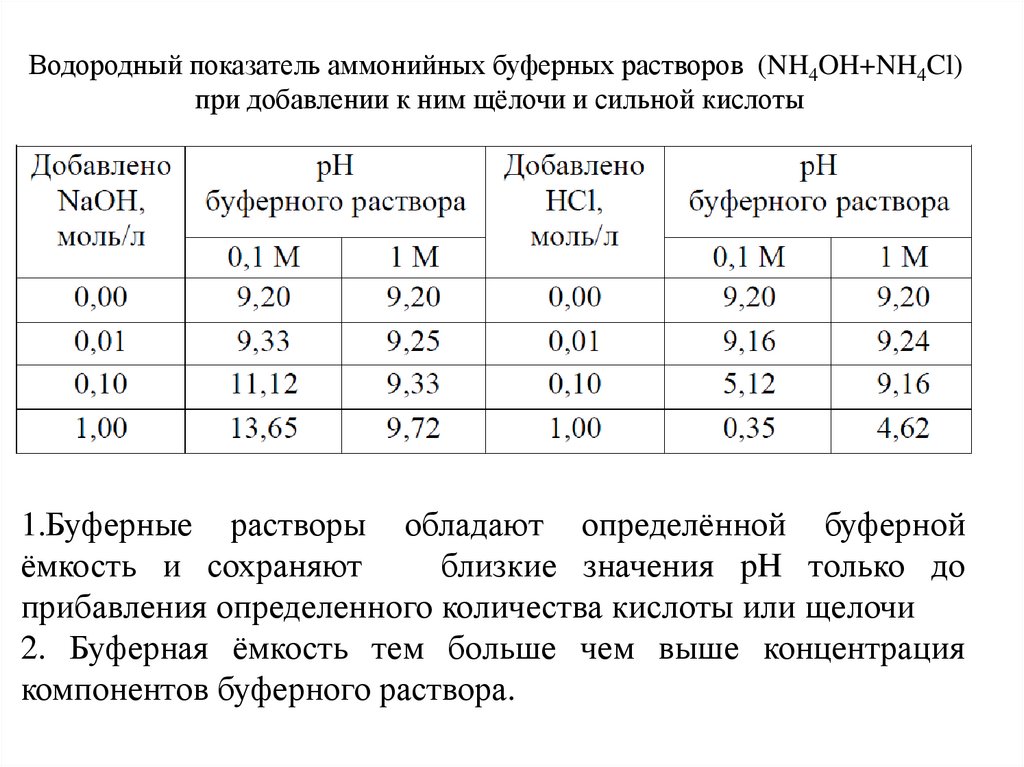
Водородный показатель аммонийных буферных растворов (NH4OH+NH4Cl)при добавлении к ним щёлочи и сильной кислоты
1.Буферные растворы обладают определённой буферной
ёмкость и сохраняют
близкие значения pH только до
прибавления определенного количества кислоты или щелочи
2. Буферная ёмкость тем больше чем выше концентрация
компонентов буферного раствора.





























































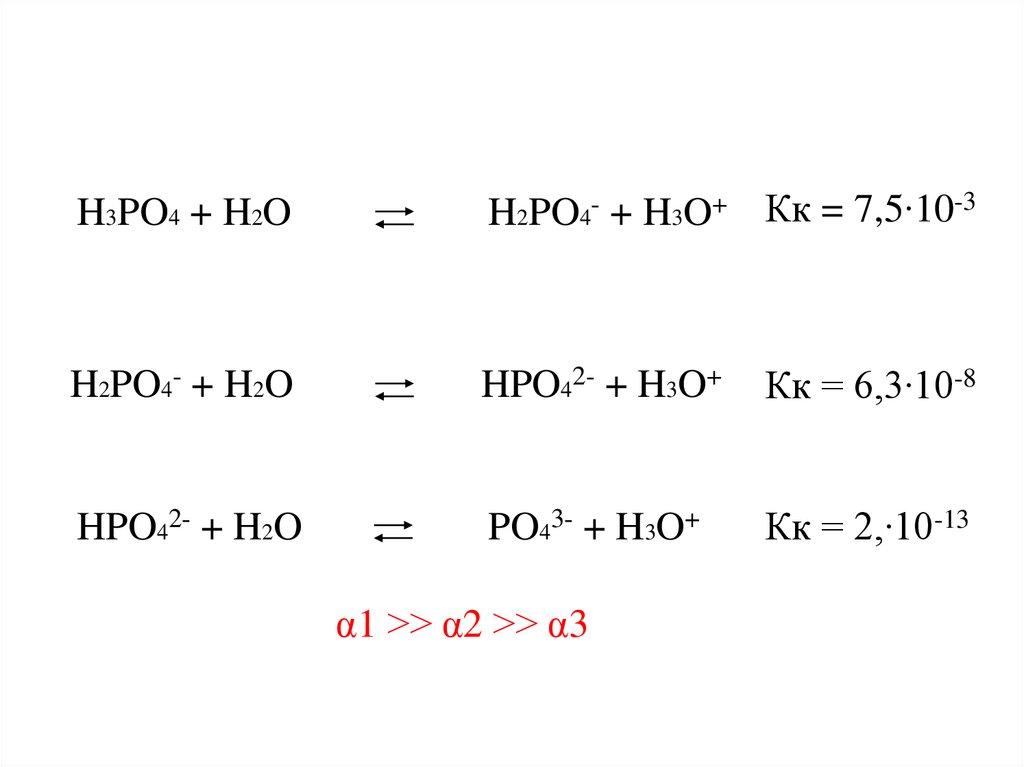











 Химия
Химия








