Похожие презентации:
Количество вещества
1. Количество вещества
Количество веществаУрок изучения нового материала
в 8 классе
2.
Расскажу сегодня, что ли,О зловредной роли моли.
Моль съедает шерсть и мех –
Просто паника у всех….
Ну а в химии – изволь!
Есть другое слово “моль”
Прост, как небо и трава,
Моль любого вещества.
Но трудна его дорога:
В моле так частичек много!
3. Моль
Моль – это такое количество вещества, в которомсодержится 6*10 23 молекул (или других структурных
частиц) этого вещества.
Например,
1 моль воды имеет массу, равную 18 грамм, так как
Мr(Н2О)= 18.
Тогда: 1 моль кислорода имеет массу - …,
5 моль алюминия - ….,
0,1 моль натрия - …..
.
4.
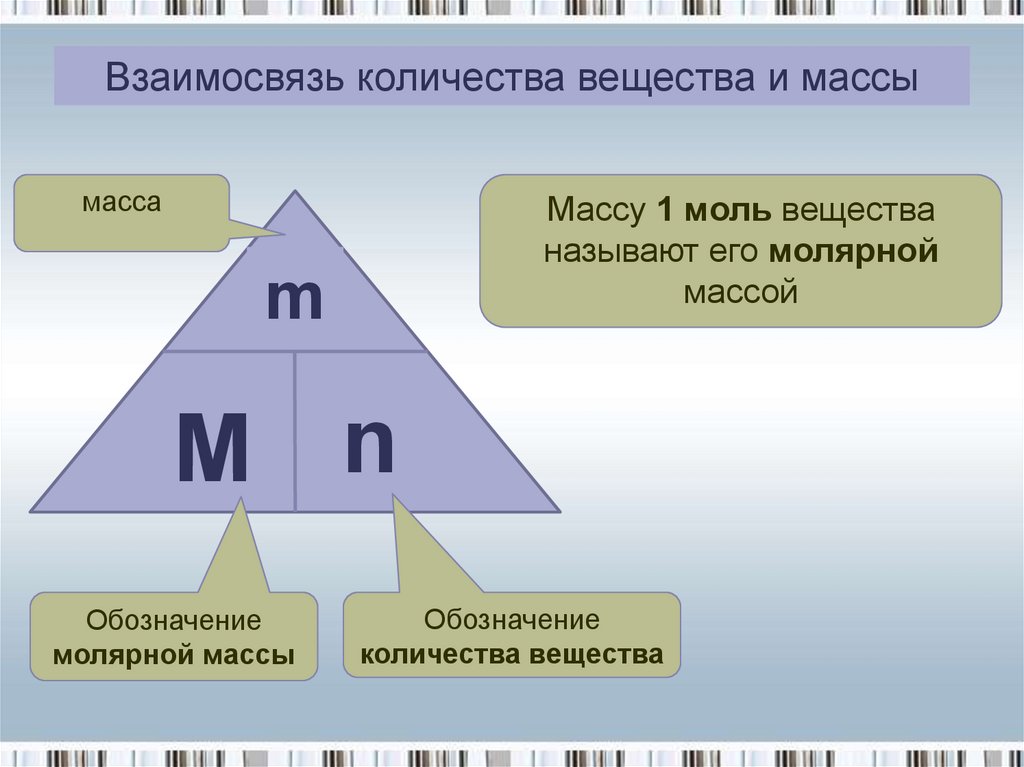
Взаимосвязь количества вещества и массымасса
Массу 1 моль вещества
называют его молярной
массой
m
M n
Обозначение
молярной массы
Обозначение
количества вещества
5. Единицы измерения
[ М] – г/моль,[ m] – г,
кг/кмоль,
мг/ммоль.
кг,
мг.
[ n] –моль,
кмоль,
ммоль.
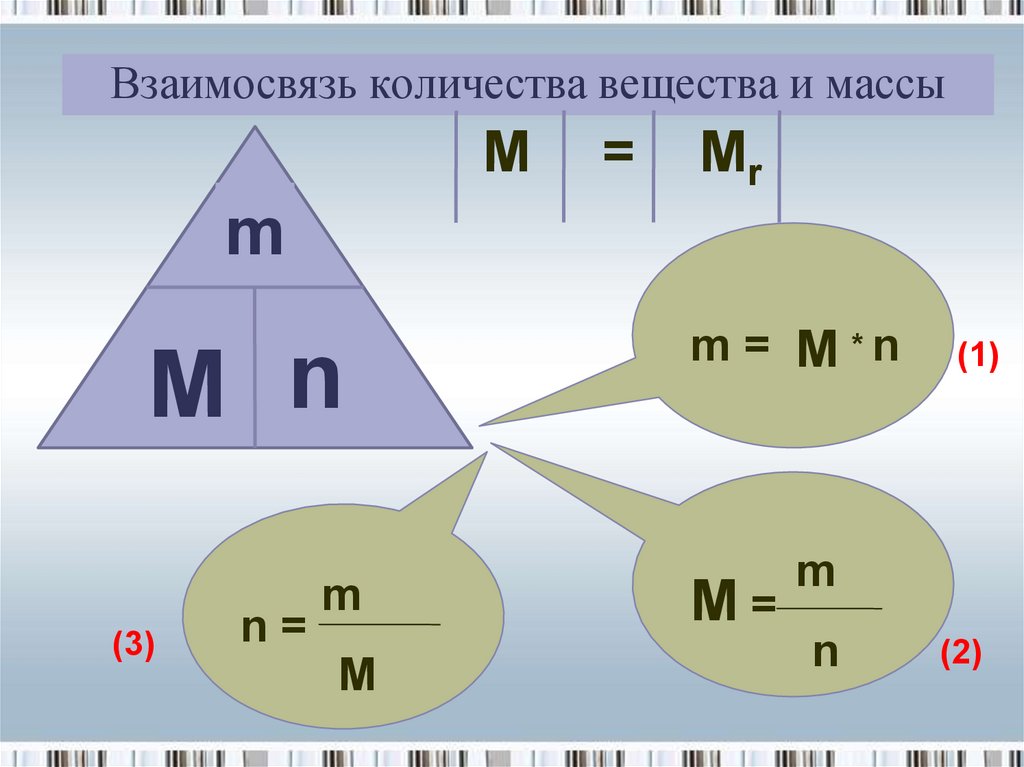
6. Взаимосвязь количества вещества и массы
M=
Mr
m
M n
(3)
n=
m
M
m = M *n
M=
(1)
m
n
(2)
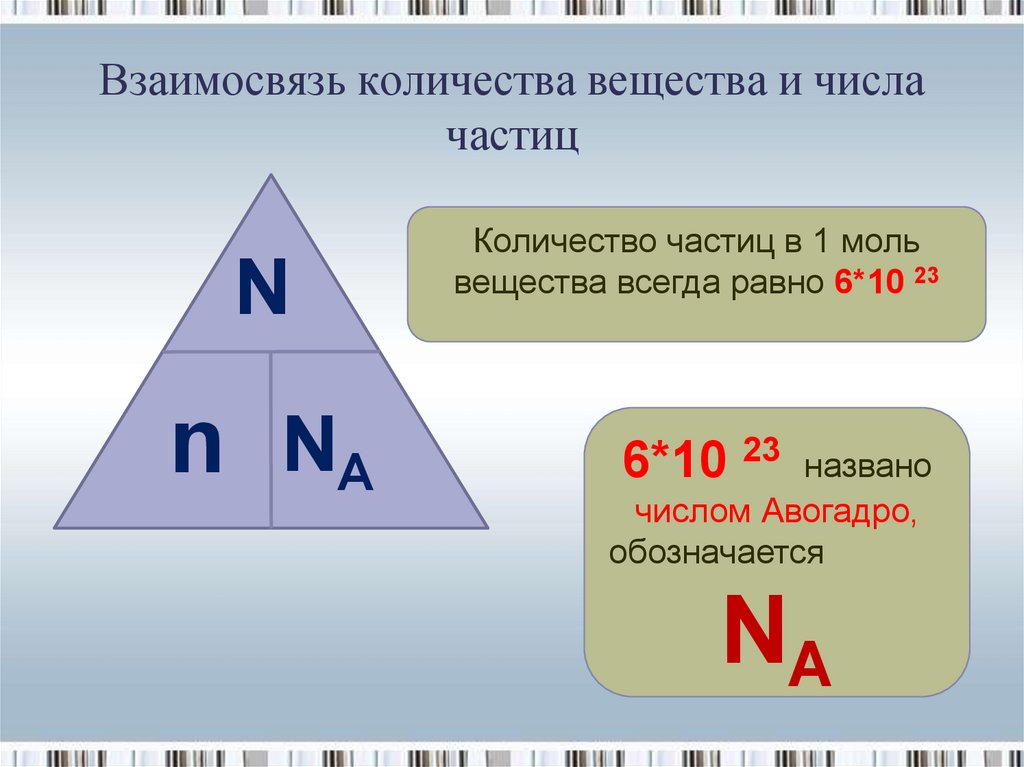
7. Взаимосвязь количества вещества и числа частиц
Nn NA
Количество частиц в 1 моль
вещества всегда равно 6*10 23
6*10 23
названо
числом Авогадро,
обозначается
NA
8.
Куча песка, засыпавшая большой завод, содержитпесчинок в 22400 раз меньше, чем число частиц в 1 моль
вещества (например, в чайной ложке воды, массой 18 г.
9.
Ниагарский водопад (США)10. Число Авогадро - NA
Некоторое представление о величинечисла Авогадро даёт следующий
пример.
Количество воды, которое
низвергается с ниагарского водопада
(США) – при длине 1279 м и высоте
40 м - составляет 6500 м3/с.
В капле воды содержится больше
молекул, чем капель, упавших с
Ниагарского водопада за 400 лет при
условии постоянного полноводья.
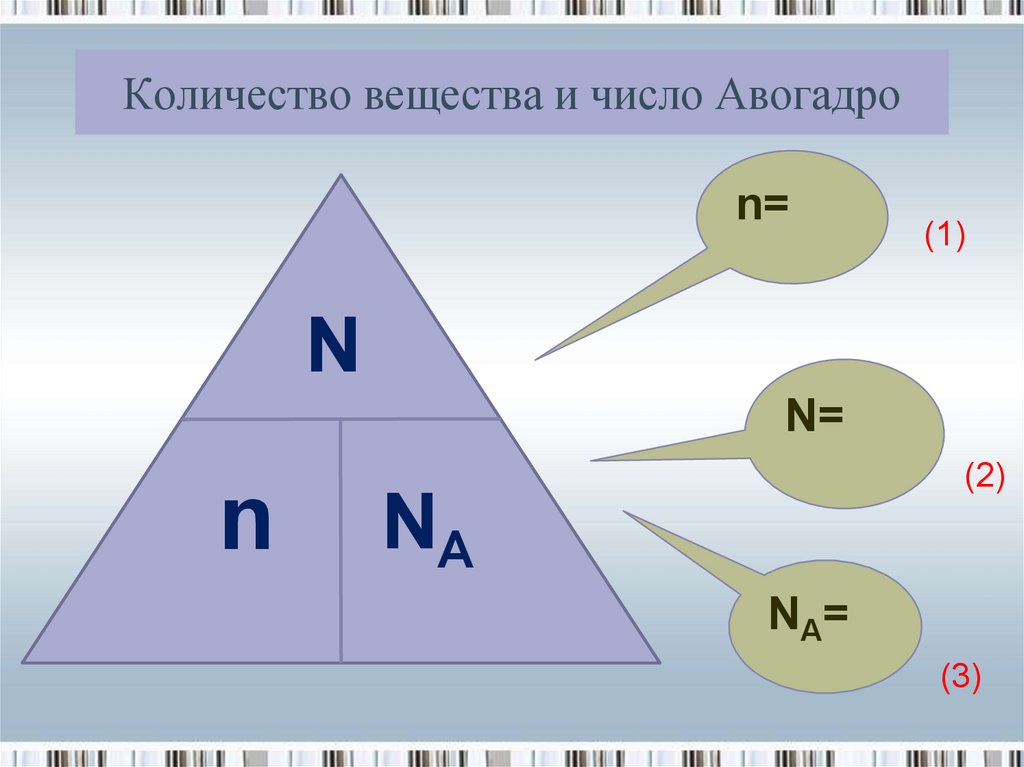
11. Количество вещества и число Авогадро
n=(1)
N
N=
n
(2)
NA
NA =
(3)
12. тема урока
Относительнаяатомная и
молекулярная массы
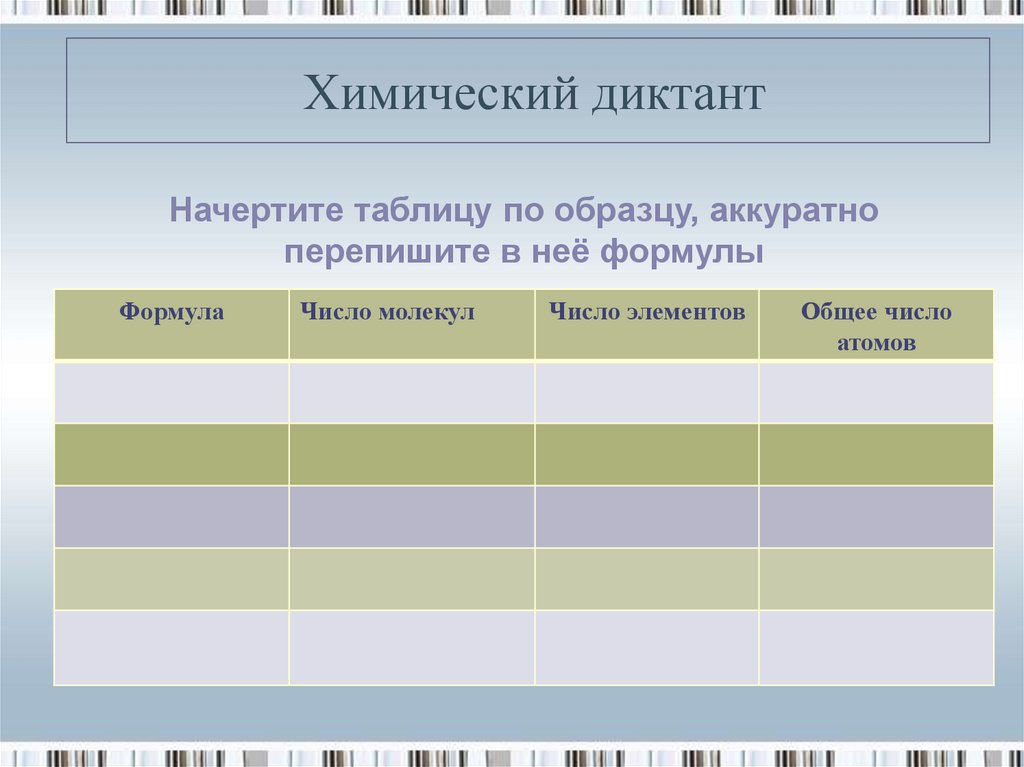
13. Химический диктант
Начертите таблицу по образцу, аккуратноперепишите в неё формулы
Формула
Число молекул
Число элементов
Общее число
атомов
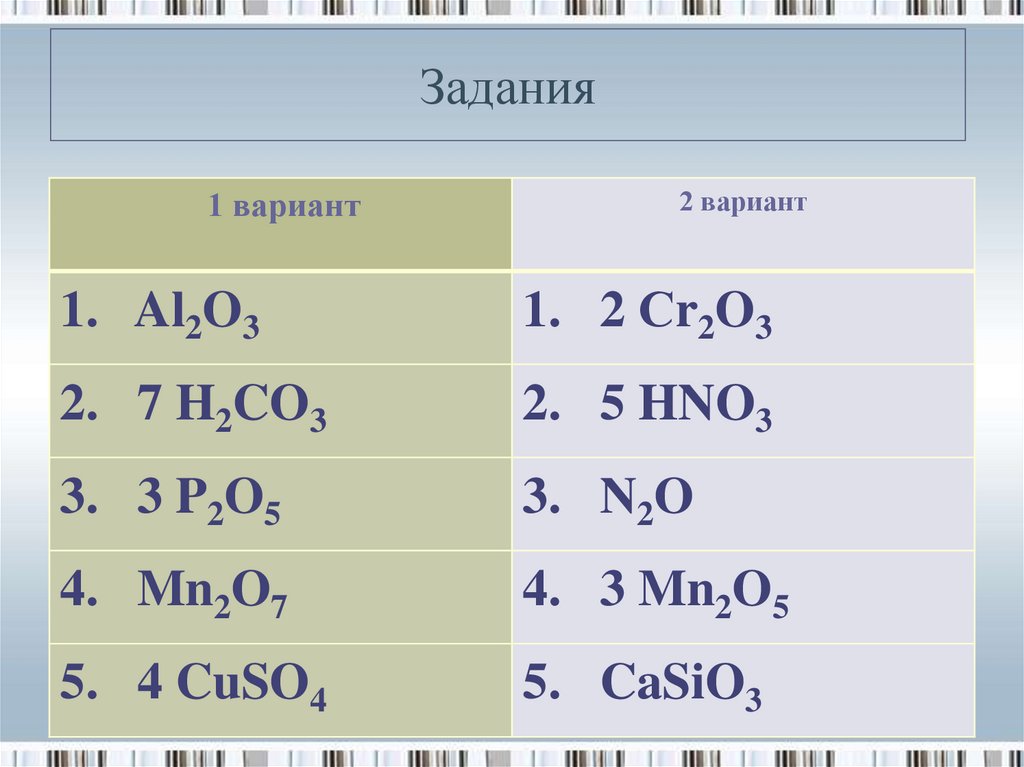
14. Задания
1 вариант2 вариант
1. Al2O3
1. 2 Сr2O3
2. 7 H2CO3
2. 5 HNO3
3. 3 P2O5
3. N2O
4. Mn2O7
4. 3 Mn2O5
5. 4 CuSO4
5. CaSiO3
15. Относительная атомная масса
Атомы элементов характеризуютсяопределённой (только им присущей)
массой.
Например, масса
атома Н равна 1,67 · 10−23 г, атома С −
1,995 · 10−23 г, атома О −
2,66 · 10−23 г.
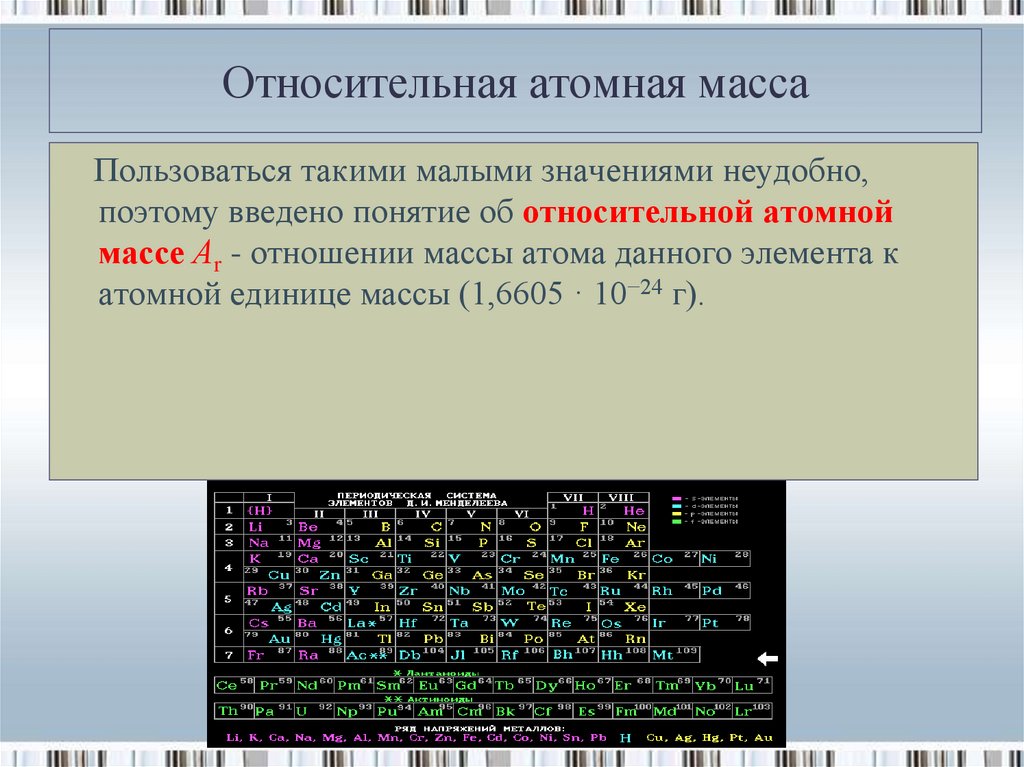
16. Относительная атомная масса
Пользоваться такими малыми значениями неудобно,поэтому введено понятие об относительной атомной
массе Аr - отношении массы атома данного элемента к
атомной единице массы (1,6605 · 10−24 г).
17. Относительная молекулярная масса - Мr
• Значения относительной молекулярной массырассчитываются из значений относительной
атомной массы с учётом числа атомов каждого
элемента в формульной единице сложного
вещества. Атомы и молекулы - частицы
чрезвычайно малые, поэтому порции веществ,
которые берутся для химических реакций,
характеризуются физическими величинами,
соответствующими большому числу частиц.
Мr = bAr (элемента 1)+ mAr(элемента 2)
18. Относительная молекулярная масса - Мr
Установлено, что• 12 г углерода (в виде графита или алмаза) содержат 6,02 ·
1023 атомов С (Аr = 12),
• 28 г азота N2 содержат то же число молекул N2 (Mr = 28),
• 18 г H2O - то же число молекул H2O (Mr = 18) и т.д.
19. Массовая доля элемента в сложном веществе
По известной химической формуле сложного веществаопределяют массовые доли элементов, входящих в это
вещество. Массовая доля элемента (wЭ) в общей массе
сложного вещества - это отношение массы, приходящейся
на этот элемент (то есть массы части), к массе всего
вещества (то есть к массе целого):
wЭ = mЭ/mвещ
20. Массовая доля элемента в сложном веществе
• Массовая доля элемента - это доля от единицы или доляот 100%. В сложном веществе wЭ всегда меньше единицы
(или меньше 100%).
• Например, для воды H2O
wH = 0,11 (11%) и wO = 0,89 (89%).
• Сумма массовых долей элементов, входящих в сложное
вещество, равна 1 (100%).
21. Домашнее задание
• § 16,• № 2,3
22. Список использованной литературы
• Аликберова Л. Занимательная химия., М, 1995 г ;• Габриелян О.С. Учебник Химия. 8 класс. М., Дрофа,
2008г;
• Школьный атлас «Химия», М., «Росмэн», 1998г















 Химия
Химия








