Похожие презентации:
Химический элемент
1.
2.
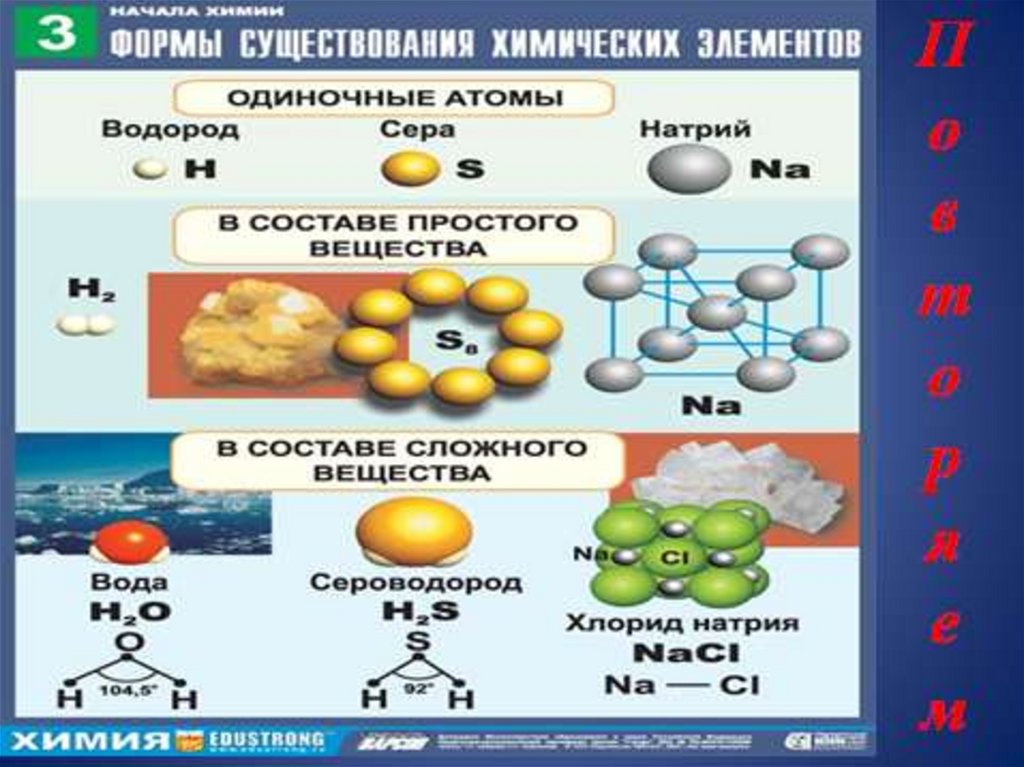
Свободные атомыПростые вещества
Сложные вещества
3.
4.
5.
6.
7.
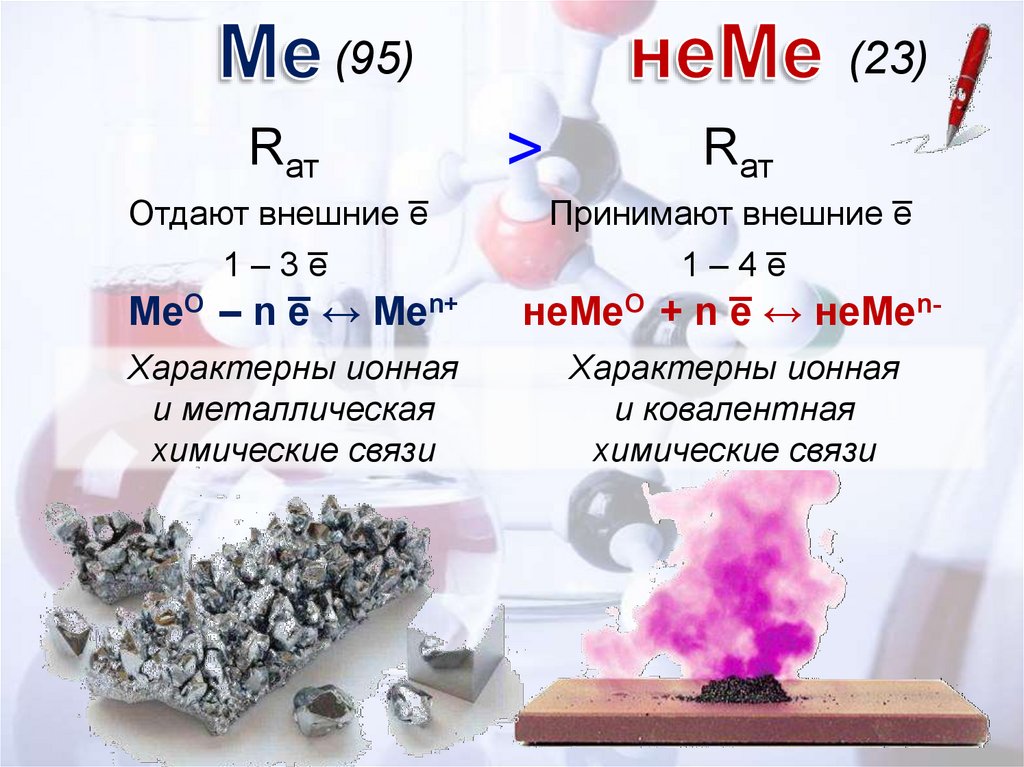
Известно 95 элементовБольшой атомный радиус
Отдают внешние электроны (1 – 3)
Характерны ионная и металлическая
химические связи
8.
Известно 23 элементаНебольшой атомный радиус
Принимают внешние электроны (1 – 4)
Характерны ионная и ковалентная
химические связи
9.
(95)Rат
Отдают внешние e̅
1 – 3 e̅
(23)
˃
Rат
Принимают внешние e̅
1 – 4 e̅
MeO – n e̅ ↔ Men+
неMeO + n e̅ ↔ неMen-
Характерны ионная
и металлическая
химические связи
Характерны ионная
и ковалентная
химические связи
10.
11.
Твердые(все Ме, кроме Hg)
Жидкая
(Hg – ртуть)
12.
Тугоплавкие(tпл > 1000°С)
W – вольфрам
Легкоплавкие
(tпл < 1000°С)
Hg – ртуть
13.
14.
15.
16.
Твердые(Cr – хром)
Мягкие
(Щелочные металлы)
17.
18.
Тяжелые(ρ > 5 г/см3)
Pb, Hg, Cd
Легкие
(ρ < 5 г/см3)
Al, Li, Mg
19.
20.
Худшая(Hg, Pb, W)
Лучшая
(Ag, Al, Au, Ag, Fe)
Электропроводность металлов объясняется наличием
в их структуре общих свободных электронов
21.
22.
Объясняется наличием свободных электронов, которыев результате своего движения обеспечивают быстрое
выравнивание температуры металла.
23.
Объясняется смещением слоев атомов без разрывахимических связей.
24.
Обеспечивается отражающей способностьюсвободных электронов.
25.
26.
27.
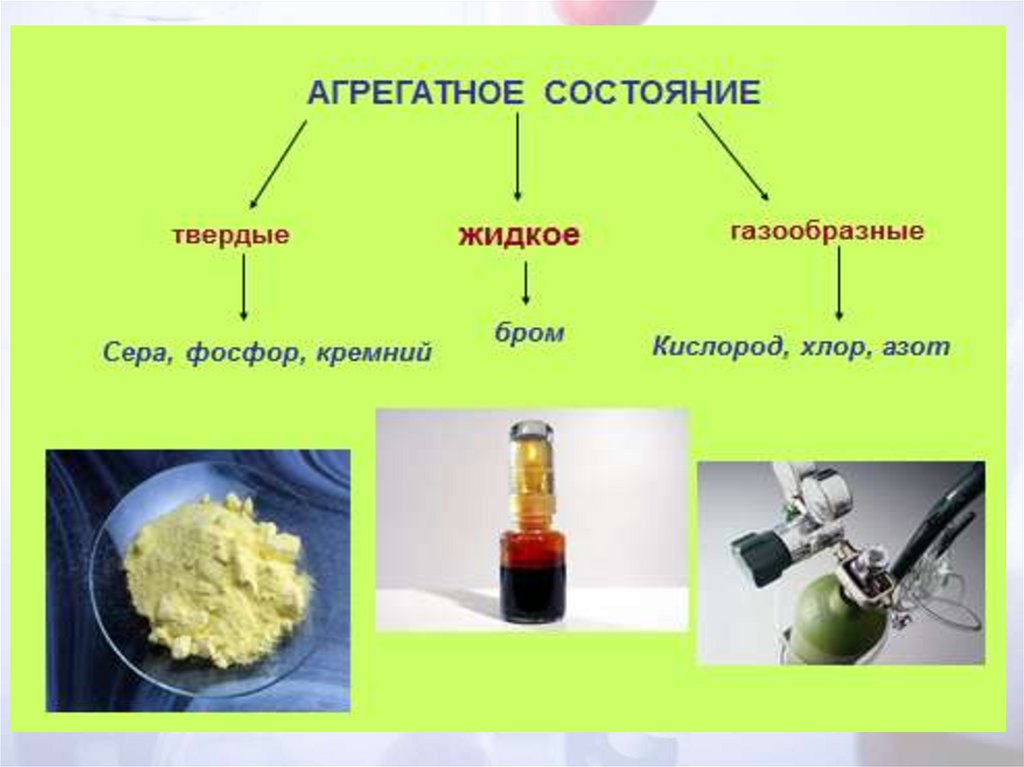
Твердые(C, P, S)
Жидкий
(Br2 – ртуть)
Газы
(O2, H2, N2, Cl2, F2, O3)
28.
29.
30.
31.
32.
Это способность атомов одного и того же х.э.образовывать несколько простых веществ
(аллотропных модификаций).
33.
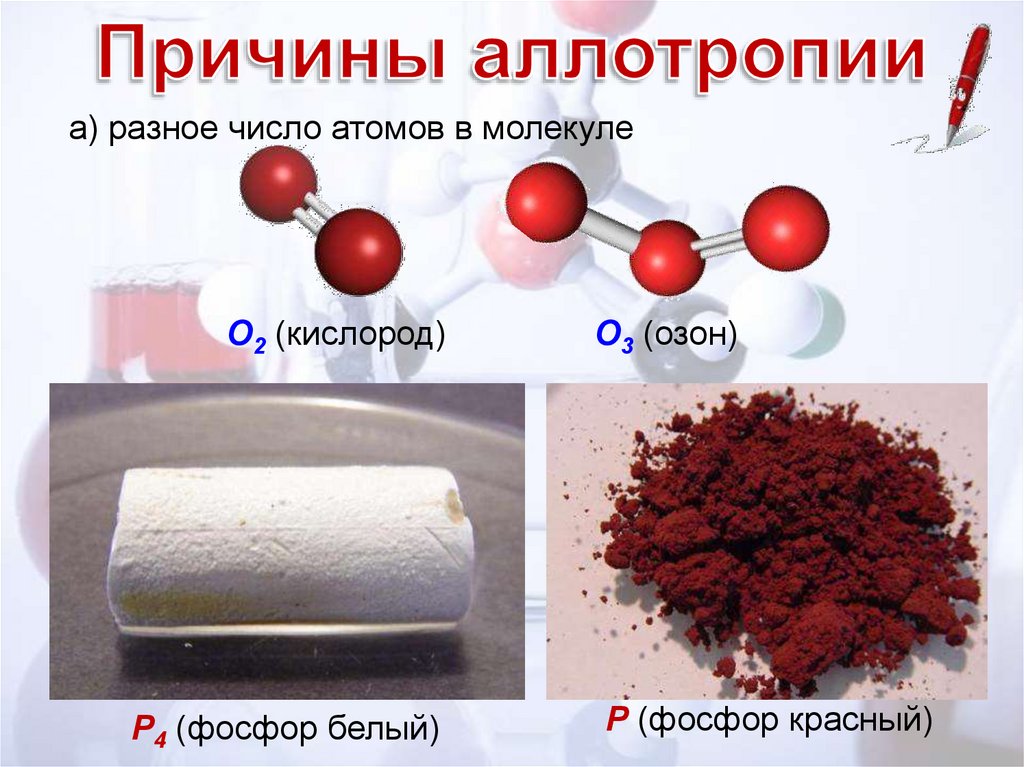
а) разное число атомов в молекулеО2 (кислород)
Р4 (фосфор белый)
О3 (озон)
Р (фосфор красный)
34.
б) образование разных кристаллических форм(С
Алмаз
- углерод)
Графит
Уголь
35.
Характерен только для графита (С),йода (I2), кремния (Si).
36.
37.
§14-15 (учебник: О.С. Габриелян)§ 27,28, 33 (учебник: О.С. Габриелян и др.)
Доклад - презентация
«Металлы» или «Неметаллы»
(рассказ на 2-3 мин, презентация 5-7 слайдов)
План
1. Полная характеристика
элемента.
2. Свойства вещества.
3. Применение.
4. Изделия из вещества
(картинки)






























 Химия
Химия








