Похожие презентации:
Фенолы. Физические свойства
1. Содержание презентации ФЕНОЛЫ
Определение2. Строение
3. Взаимное влияние атомов
4. Физические свойства
5. Химические свойства
6. Получение
7. Применение
8. Физиологическое воздействие
9. Экология
1.
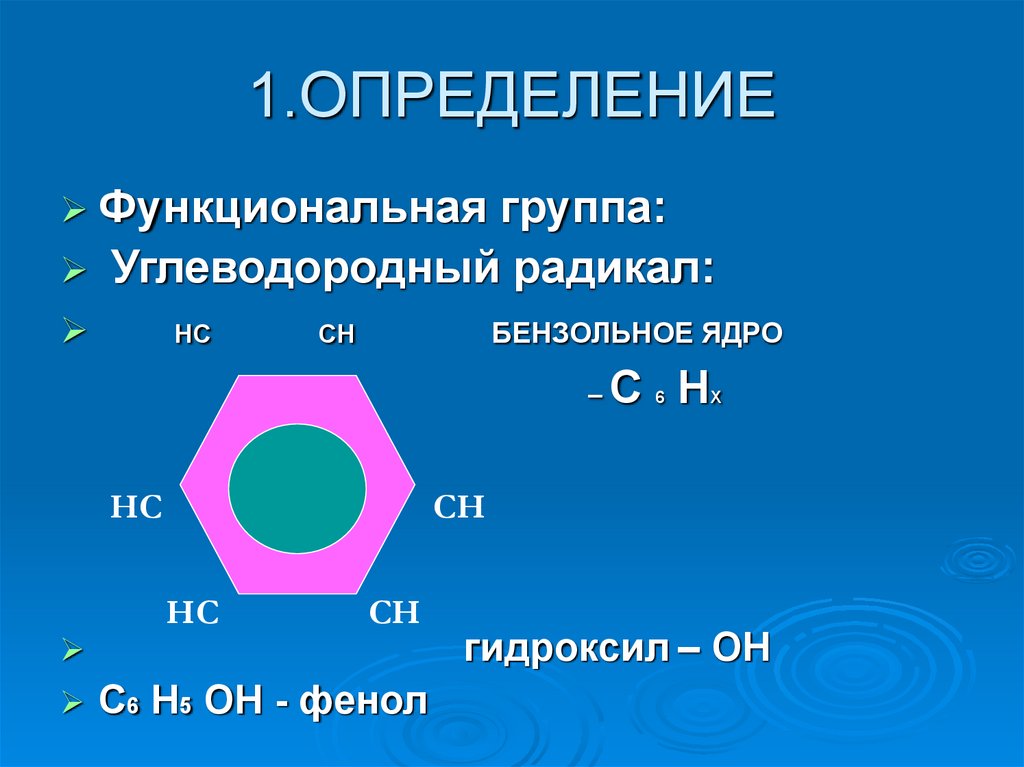
2. 1.ОПРЕДЕЛЕНИЕ
Функциональнаягруппа:
Углеводородный радикал:
НС
БЕНЗОЛЬНОЕ ЯДРО
СН
–
НС
6
Х
СН
НС
СН
С Н
С6 Н5 ОН - фенол
гидроксил – ОН
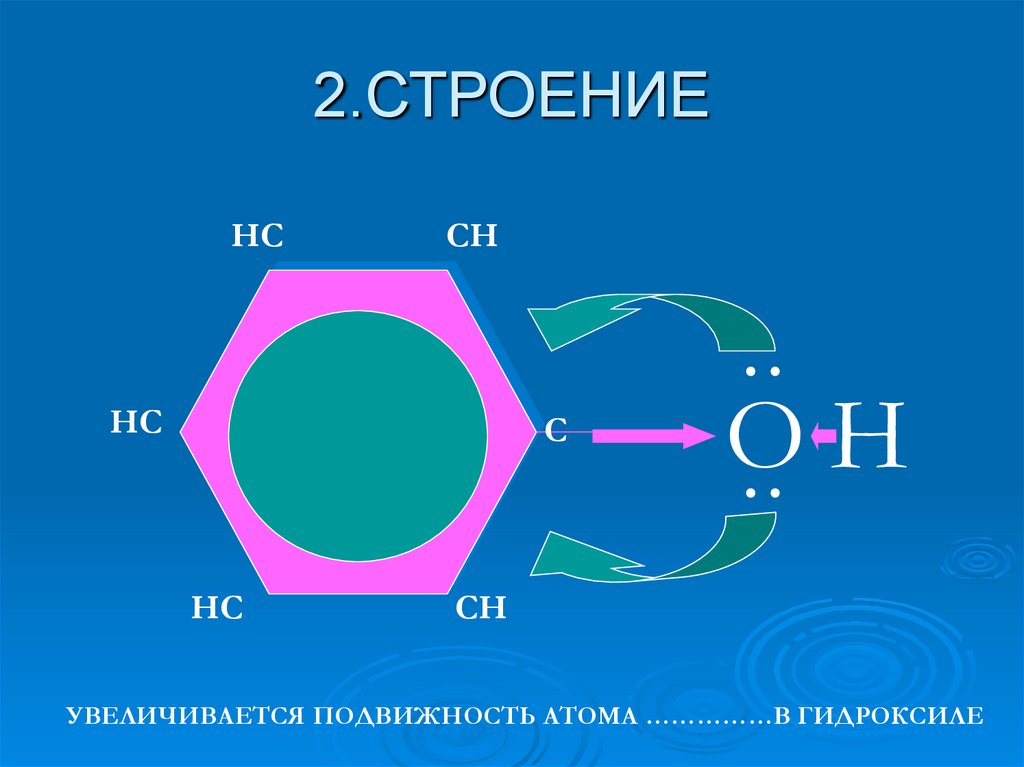
3. 2.СТРОЕНИЕ
HCCH
HC
C
HC
OH
CH
УВЕЛИЧИВАЕТСЯ ПОДВИЖНОСТЬ АТОМА ……………В ГИДРОКСИЛЕ
4. 3. Взаимное влияние атомов
..:O H
1
6
2
5
3
4
В ПОЛОЖЕНИЯХ
2, 4, 6
УВЕЛИЧИВАЕТСЯ
ЭЛЕКТРОННАЯ
ПЛОТНОСТЬ
5. ФИЗИЧЕСКИЕ СВОЙСТВА
тТвердое в-во
БЦ, ок-сь на воздухе
– розовый
Резкий, характерный
3. Запах4. Температура кипения- 182 С
5. Температура плавления- 42 С
М растворим в воде
6. Растворимость в водеЯдовит, сильный
7. Физиологическое
антисептик
воздействие1. Агрегатное состояние –
2. Цвет-
6. 5.ХИМИЧЕСКИЕ СВОЙСТВА
Реакции, идущие по функциональнойгруппе:
А. с активными металлами и щелочами:
2C6H5OH + Na = 2C 6H5 ONa + H2
1.
C6H5OH + NaOH = C 6H5 ONa + H2 O
C6H5OH + K = ? +?
C6H5OH + KOH = ? + ?
C 6H 5 OH + KOH = C6 H2 O K + H2 O C6 H 5 OH + K = C6 H5 O K + H2
7. 5.ХИМИЧЕСКИЕ СВОЙСТВА
2. Взаимодействие со спиртами:C6H5OH + НО СН3 = C6H5 – O - СН3 + Н2О
3 Взаимодействие с
галогенпроизводными
C6H5O H + J СН3 = C6H5 – O - СН3 + НJ
C6H5OH + Cl СН3 = C 6H5 – O – CH3 + H Cl
C 6H5 – O – C 2H5 + H 2O
C6H5OH + НО С2Н5 =
8. 5.ХИМИЧЕСКИЕ СВОЙСТВА
Реакции, идущие по бензольному ядруА. взаимодействие с галогенами:
1.
ОН
OH
Br 6
+ 3 Br 2 =
2 Br
3 HBr +
4
Br
2,4,6-трибромфенол
СДЕЛАЙ САМ: фенол с хлором
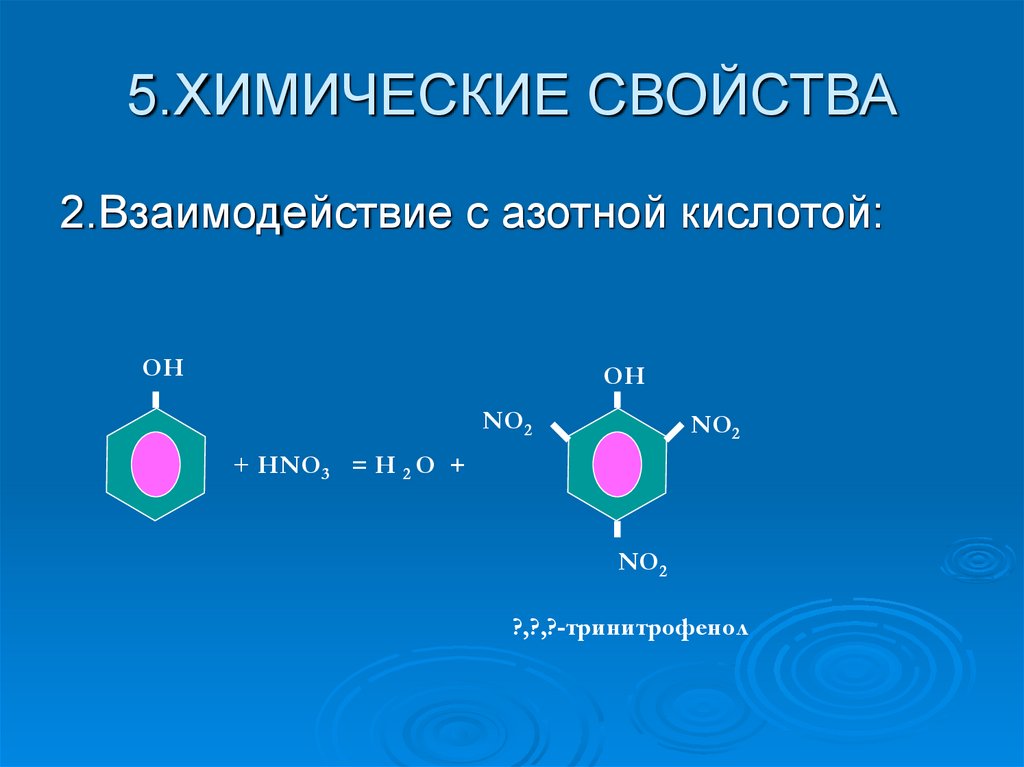
9. 5.ХИМИЧЕСКИЕ СВОЙСТВА
2.Взаимодействие с азотной кислотой:ОН
ОН
NO2
NO2
+ HNO3 = H 2 O +
NO2
?,?,?-тринитрофенол
10. 6. ПОЛУЧЕНИЕ
11. 6. ПОЛУЧЕНИЕ
C 6H 62. C 6 H 5 SO 3H
3. C 6H 5 ONa
4. C 6H 5 OH
Осуществи превращения
1.
12. 7. ПРИМЕНЕНИЕ
ОН13. 7. ПРИМЕНЕНИЕ
Ф. - важное сырьё в производстве ряда ценных продуктов. Так, хлорированиемэлементарным хлором в промышленности получают 2,4-дихлорфенол полупродукт в производстве гербицида 2,4-дихлорфеноксиуксусной кислоты,
конденсацией с альдегидами, главным образом с формальдегидом, - фенолоальдегидные смолы (см. также Фенопласты), с фталевым ангидридом фенолфталеин (индикатор и лекарственное средство), с ацетоном дифенилолпропан, используемый для производства поликарбонатов,
гидрированием - циклогексанол (полупродукт в синтезе капролактама,
полимеризацией которого получают поликапроамид), алкилированием олефинами
- n-aлкилфенолы RC6H4OH, применяемые в производстве поверхностно-активных
и душистых веществ. Ф. используют также для получения различных красителей,
лекарств, средств (салициловой кислоты, салола и др.), пикриновой кислоты
Ф. обладает бактерицидным действием; в медицине (более известен как
карболовая кислота) используется в виде разбавленных водных растворов для
дезинфекции помещений и предметов больничного обихода
14. 8.Физиологическое воздействие
СИЛЬНЫЙАНТИСЕПТИК
ЯДОВИТ
При попадании на кожу Ф. вызывает ожог. Предельно допустимая концентрация в
воздухе 0,005 мг/л.
15. 9. Экологические проблемы производства
Фенолы являются одними из наиболее распространенных загрязняющих веществ,поступающих в водную среду со сточными водами нефтеперерабатывающих,
лесохимических, коксохимических, анилинокрасочных и других предприятий.
16. 10. ВЫВОДЫ
1. ПРОЯВЛЯЕТСВОЙСТВА……
2. ПРОЯВЛЯЕТ
СВОЙСТВА……..
3.КИСЛОТНОСТЬ ОНгруппы……………
1. АРОМАТИЧЕСКОГО
УГЛЕВОДОРОДА
2. СЛАБОЙ КИСЛОТЫ
(имеет второе название
-карболовая кислота)
1. возрастает
17. Домашнее задание
ПараграфN














 Химия
Химия








