Похожие презентации:
Получение металлов
1.
Получениеметаллов
2.
Цели урока:• Рассмотреть и сравнить различные
способы получения металлов из
природного сырья.
• Рассмотреть сущность электролиза,
особенности электролиза растворов
электролитов.
• Закрепить умение составлять
окислительно-восстановительные
реакции.
3.
Проверочная работа4.
5.
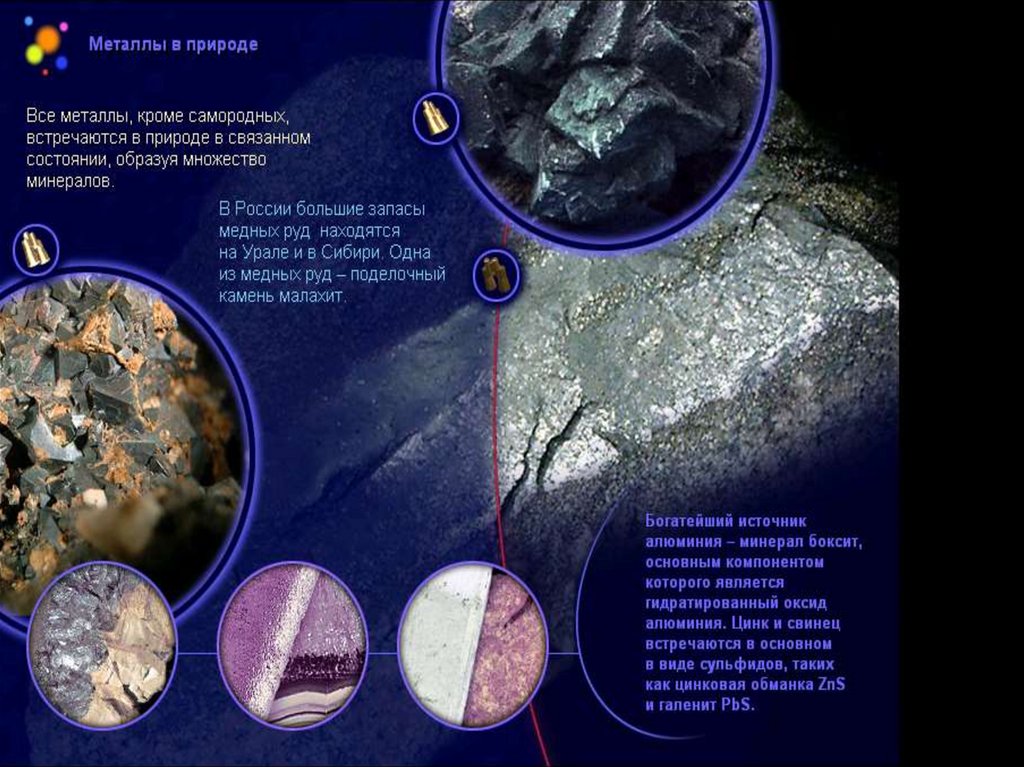
1. Пирометаллургия – восстановлениеметаллов из руд при высоких
температурах с помощью
восстановителей (углерода, оксида
углерода (II), водорода, металлов –
алюминия, магния).
6.
Пирометаллургия• Получение меди из
его оксида с
помощью
восстановителя
водорода
7.
Пирометаллургия• Получение меди из его оксида с
помощью восстановителя водорода
CuO + H2 → Cu + H2O
8.
Пирометаллургия• Получение свинца
из его оксида с
помощью
восстановителя
угля
9.
Пирометаллургия• Получение свинца из его оксида с
помощью восстановителя угля
PbO + C → Pb + CO
10.
Пирометаллургия• Получение хрома
алюмотермией
11.
Пирометаллургия• Получение хрома алюмотермией
Cr2O3 + 2AI → 2Cr + AI2O3
12.
2. ГидрометаллургияВосстановление более активными
металлами менее активных из
растворов их солей называется
гидрометаллургией.
13.
2. ГидрометаллургияЭто получение металлов, которое проходит
в два этапа:
1. Природное соединение «растворяют» в
подходящем реагенте с целью получения
раствора соли этого металла.
2. Из образовавшегося раствора данный
металл вытесняют более активным металлом
или восстанавливают электролизом.
14.
2. ГидрометаллургияНапример, для получения меди из
руды, содержащей оксид меди (II) CuO:
СuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
Таким же способом получают серебро,
цинк, молибден, золото, уран и т. д.
15.
3. ЭлектрометаллургияЭто способы получения металлов с
помощью электрического тока
(электролиза).
16.
• «Электролиз» – химические реакции,протекающие под действием
электрического тока на электродах,
помещенных в раствор, расплав или
твердый электролит.
• «Электролит» - вещество, проводящее
электрический ток.
• «Электрод» - проводник, имеющий
электронную проводимость и
находящиеся в контакте с ионным
проводником.
17.
• «Катод» - отрицательно заряженныйэлектрод, на котором происходит
процесс восстановления.
• «Анод» - положительно заряженный
электрод, на котором происходит
процесс восстановления.
• «Катионы» - положительно
заряженные ионы.
• «Анионы» - отрицательно
заряженные ионы.
18.
• При электролизе окислителем ивосстановителем является электрический
ток.
• Процессы окисления и восстановления
разделены в пространстве, они
совершаются не при контакте частиц друг с
другом, а при соприкосновении с
электродами электрической цепи.
19.
Электролиз водных растворовэлектролитов
• Катодные процессы в водных растворах
электролитов :катионы или молекулы
воды принимают электронов и
восстанавливаются.
• Li,K,Ca,
| Mn,Zn,Fe,Ni, | H2 |Cu,Hg,Ag,Pt
Na,Mg,Al
Sn,Pb
Au
Катионы металлов не | Катионы металлов и молекулы воды
восстанавливаются.
восстанавливаются
Восстанавливается вода
восстанавливаются
| Катионы
металлов
20.
1. Катионы металлов со стандартнымэлектродным потенциалом, большим, чем у
ВОДОРОДА, расположены в ряду
напряжений после него: Cu2+, Hg2+, Ag+,
Pt2+, ..., до Pt4+. При электролизе они почти
полностью восстанавливаются на катоде и
выделяются в виде металла.
2H2O + 2e– = H2 + 2OH–
21.
2. Катионы металлов с малой величинойстандартного
электродного
потенциала
(катионы металлов начала ряда напряжений
Li+, Na+, K+, Rb+, ..., до Al3+ включительно).
При электролизе на катоде они не
восстанавливаются,
вместо
них
восстанавливаются молекулы воды.
2H2O + 2e– = H2 + 2OH–
22.
3. Катионы металлов со стандартнымэлектродным потенциалом меньшим, чем у
ВОДОРОДА, но большим, чем у алюминия
(Mn2+, Zn2+, Cr3+, Fe2+, ..., до H). При
электролизе
эти
катионы,
характеризующиеся средними величинами
электроноакцепторной
способности,
на
катоде восстанавливаются одновременно с
молекулами воды.
Zn 2+ + 2e = Zn0
2H2O + 2e– = H2 + 2OH–
23.
Анодные процессы• На аноде происходит окисление анионов или
молекул воды ( частицы отдают электронов
- окисляются)
• Анионы по их способности окисляться
располагаются в следующем порядке:
Iˉ,Brˉ,S²ˉ,Clˉ,OHˉ, SO ²ˉ,NO ˉ,Fˉ
------------------------------------------------------→
Восстановительная активность уменьшается.
4
3
24.
25.
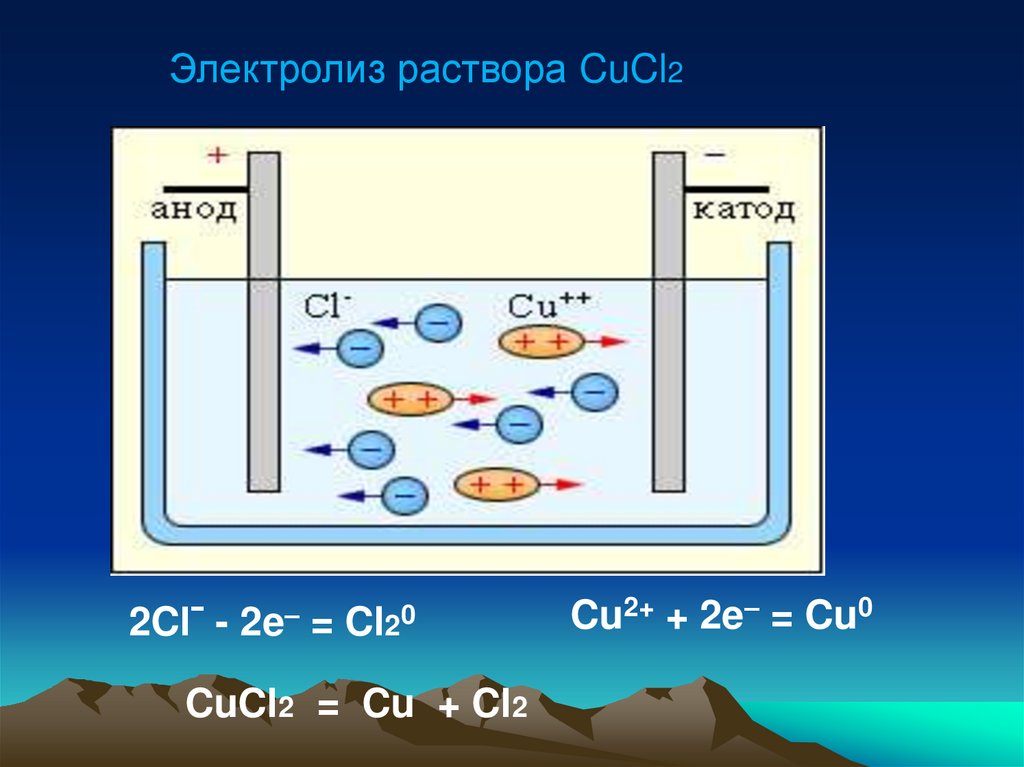
Электролиз растворахлорида меди (II)
26.
Электролиз раствора CuCl22Clˉ - 2e– = Cl20
CuCl2 = Cu + Cl2
Cu2+ + 2e– = Cu0
27.
Тестовая работа28.
Выводы:29.
Домашнее задание1. § 18, стр. 214-222
2. Повторить § 18, стр. 190-214
3. Упр. 23, 28 стр. 225
30.
Урок не понравился, неузнал(а) ничего нового
Урок прошел как обычно
Урок понравился, узнал(а)
много нового
31.
Желаю вам удачив изучении этой темы!





























 Химия
Химия








