Похожие презентации:
Решение задач на уравнение Менделеева-Клапейрона
1. Решение задач на уравнение Менделеева-Клапейрона
Антоничева В.А.учитель физики
Тютюнникова Е.А.
учитель химии
ГБОУ НАО «СШ №3»
2. Ян Баптист ван Гельмонт
12 января 1580, Брюссель— 30 декабря 1644,
Вилворде, Бельгия) —
химик, физиолог, врач и
теософ-мистик.
3. Дмитрий Иванович Менделеев
(27 января (8 февраля)1834, Тобольск —
20 января (2 февраля)
1907, СанктПетербург) — русский
учёный-энциклопедист,
общественный
деятель. Химик,
физикохимик, физик,
метролог, экономист,
технолог, геолог,
метеоролог, педагог,
воздухоплаватель,
приборостроитель.
4. Бенуа́ Поль Эми́ль Клапейро́н
(26 февраля 1799,Париж — 28
января 1864
Париж) —
французский
физик и инженер
5. Уравнение Менделеева-Клапейрона
.m
PV RT
M
.
6. Нормальные условия
Давлениер=760мм.рт.ст.=1атм=105Па
Температура
t=00С (Т=273,150К)
1 моль=22,4 л
1мм.рт.ст.=133 Па
7. Задача 1.
Рассчитайте массу и объемсернистого газа SO2
количеством вещества 0,8
моль.
8. Дано: n(SO2)=0,8 моль Найти: m-?,V-?
Решение: M(SO2)=32+2*16=64г/моль;m=n*M ; m=0.8 моль*64г/моль = 51,2г
V=n*Vm;
V= 0.8 моль*22,4л/моль=17,92л
9. Задача 2.
При температуре 170С и давлении 780мм.рт.ст. масса газа равна 1,56 г
занимает объем 624 мл. Найдите
молярную массу газа, предложите
для него молекулярную формулу.
10. Дано: t = 170C +273 = 2900K P=780 мм.рт.ст.* 133,3 = 1,03* 105Па m = 1,56г =1,56 * 10-3кг V = 624 мл = 624 * 10-6м3 Найти: М-?
mRTm
Решение:
PV
RT M
M
pV
1,56 *10 кг * 8,31* 290 К
M
5
6
3
1,03 *10 Па * 624 *10 м
57,7 *10 3 кг
58 г
моль
моль
-3
0
11. Задача 3.
Какой объем дихлорэтанаClCH2CH2Cl получится при
смешивании 5л хлора Cl2 и 5л
этилена CH2=CH2 при
нормальных условиях?
Плотность дихлорэтана равна
1,26 г/моль.
12. Дано: V(Cl2) =5л; V(CH2=CH2) =5л р = 105Па; Т=2730К Найти: V (ClCH2CH2Cl)-?
Решение:Cl2 + CH2=СН2 ClCH2CH2Cl
V
5л
n
n
0,22 моля
VM
22,4л
М(ClCH2CH2Cl) = 99 г/моль
V
m
M V 0,22моля 99 17,3 моля
n
1,26
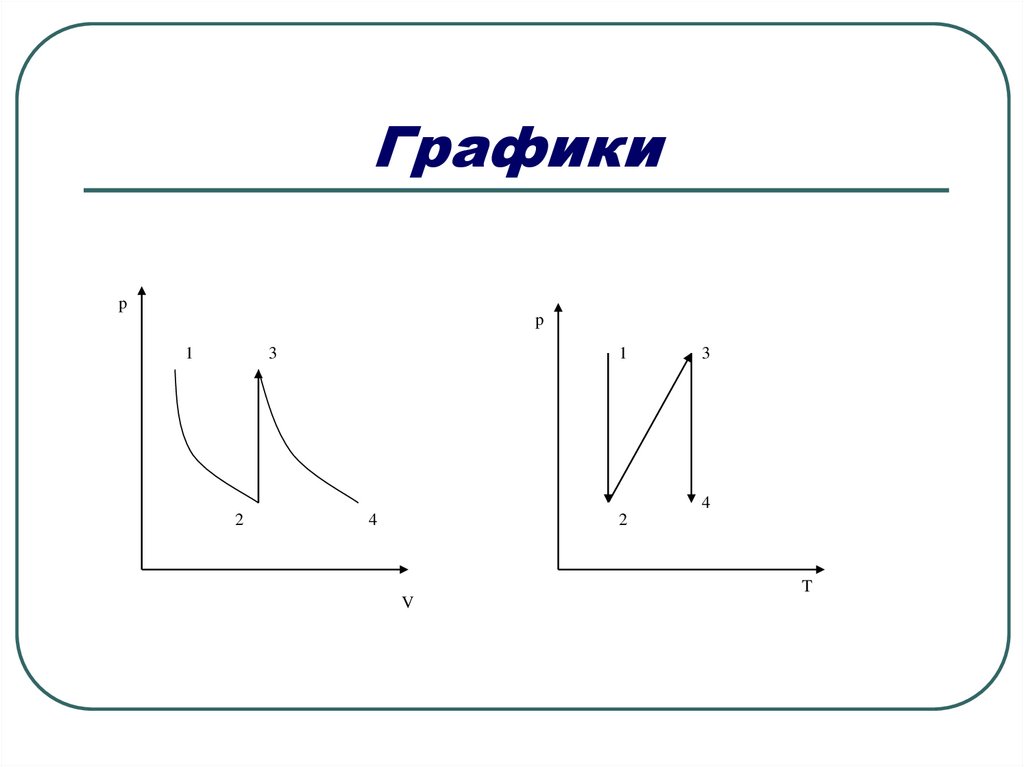
13. Задача 4.
На рисунке изображены процессы,происходящие с определенной массой
идеального газа. Изобразить эти
процессы в осях (p,V) и (p,T).
V
4
2
3
1
T
14.
P1V1 P2V2T1
T2
Процесс1-2: T=const, pV=const, при уменьшении p,
V увеличивается.
p
Процесс 2-3:V=const, const, при увеличении Т, р
T
увеличивается
Процесс 3-4: T=const, pV=const, при уменьшении p,
V увеличивается
15. Графики
pp
1
3
1
3
4
2
4
2
T
V















 Физика
Физика








