Похожие презентации:
Обобщение сведений о важнейших классах неорганических соединений
1. Обобщение сведений о важнейших классах неорганических соединений
Шумилова Алина Федоровна,учитель химии
МБОУ «Гимназия №13»
г. Нижнего Новгорода
2.
3. Оксиды
4. Цель
• систематизировать, углубить знания обоксидах, способах их получения и
свойствах.
5. Определение
• Оксиды - этосложные вещества, состоящие из атомов
водорода и кислотных остатков
сложные вещества, состоящие из двух
химических элементов, один из которых кислород
сложные вещества, состоящие из атомов
металлов и кислотных остатков
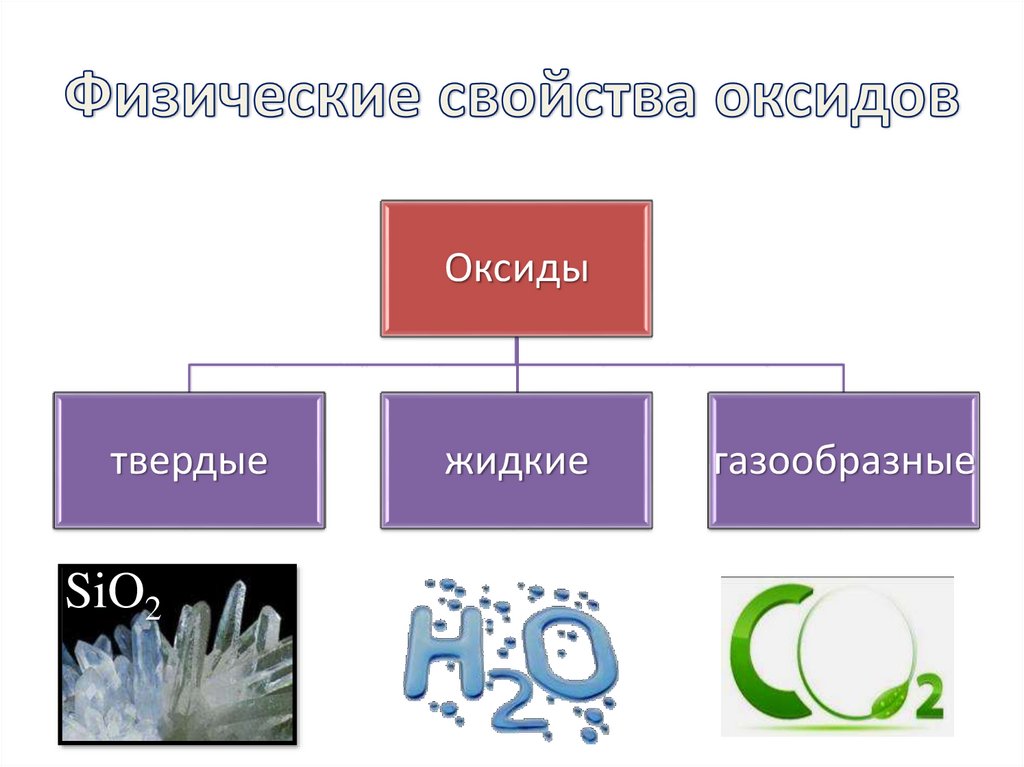
6. Физические свойства оксидов
Оксидытвердые
SiO2
жидкие
газообразные
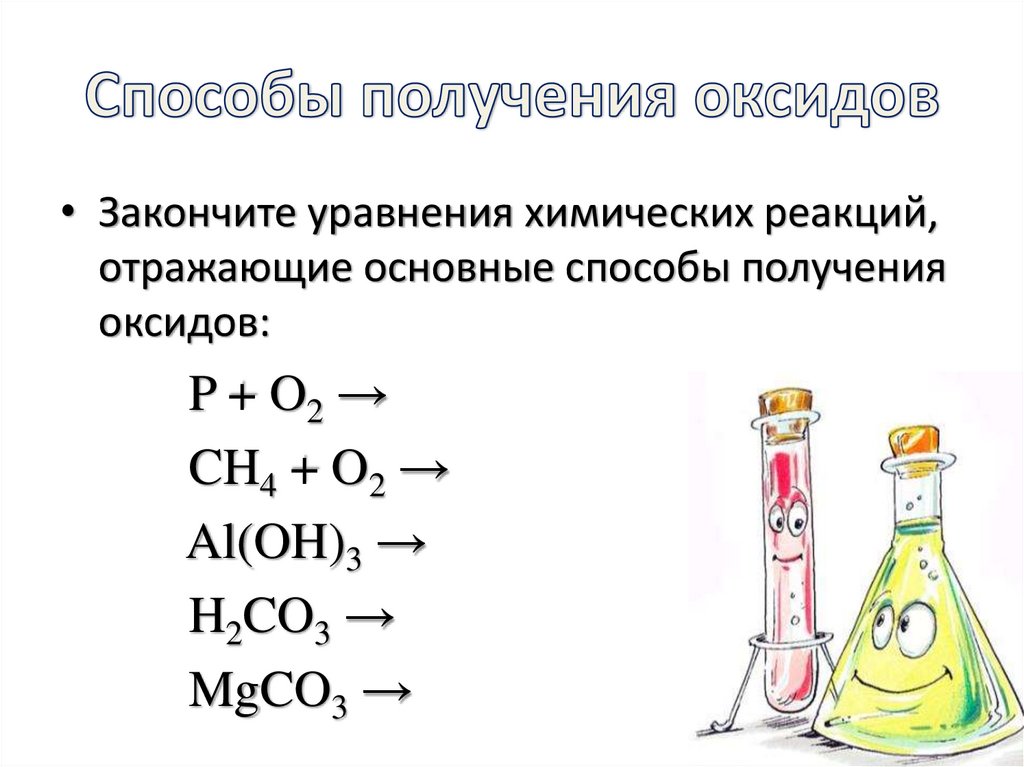
7. Способы получения оксидов
• Закончите уравнения химических реакций,отражающие основные способы получения
оксидов:
P + O2 →
CH4 + O2 →
Al(OH)3 →
H2CO3 →
MgCO3 →
8. Способы получения оксидов
• Сформулируйте общие способы полученияоксидов
1. Горение простых и сложных веществ
2. Разложение нерастворимых оснований
3. Разложение некоторых кислот
4. Разложение солей
9. Классификация оксидов
КислотныеОсновные
Солеобразующие
Несолеобразующие
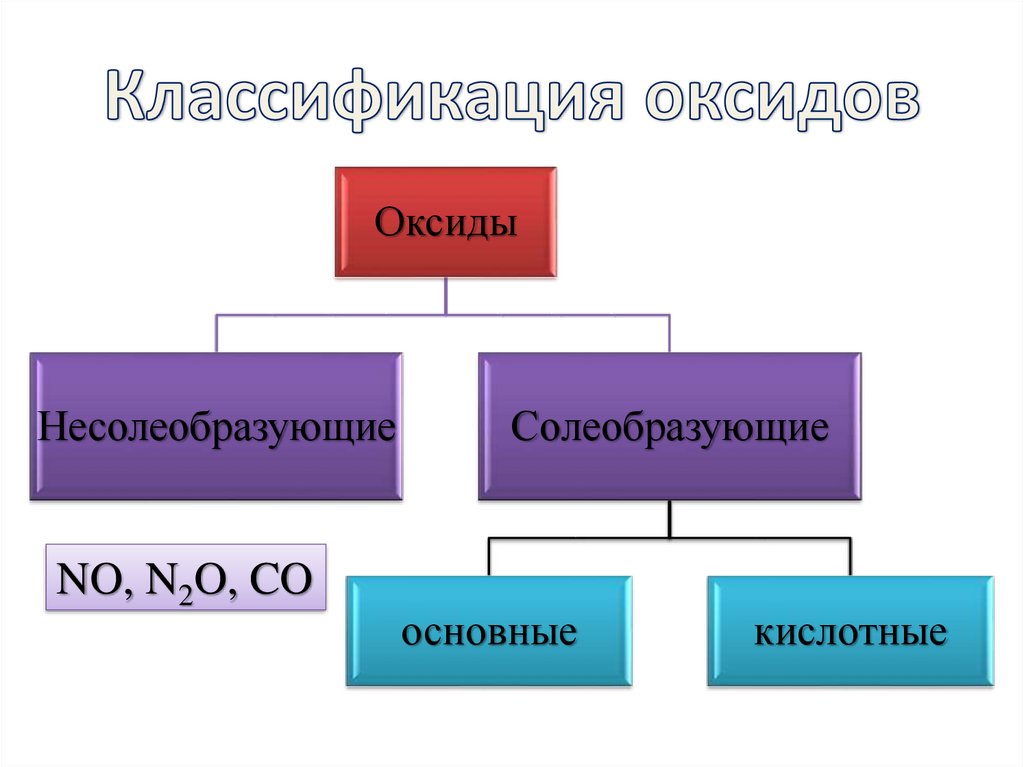
10. Классификация оксидов
ОксидыНесолеобразующие
NO, N2O, CO
Солеобразующие
основные
кислотные
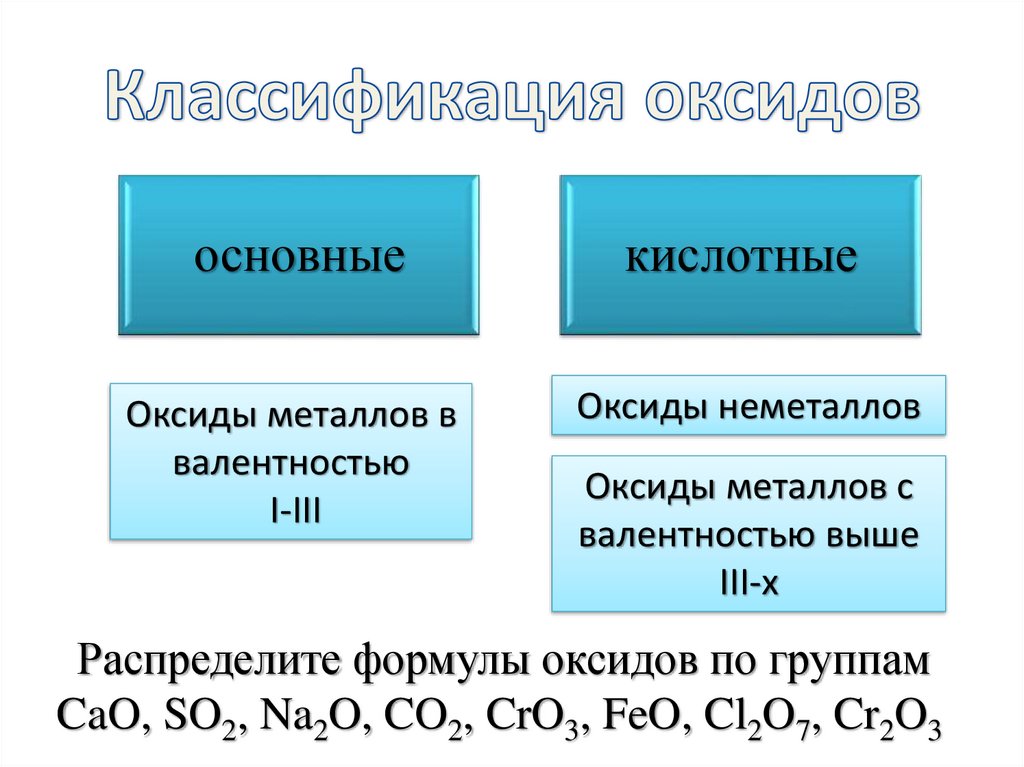
11. Классификация оксидов
основныекислотные
Оксиды металлов в
валентностью
I-III
Оксиды неметаллов
Оксиды металлов с
валентностью выше
III-х
Распределите формулы оксидов по группам
CaO, SO2, Na2O, CO2, CrO3, FeO, Cl2O7, Cr2O3
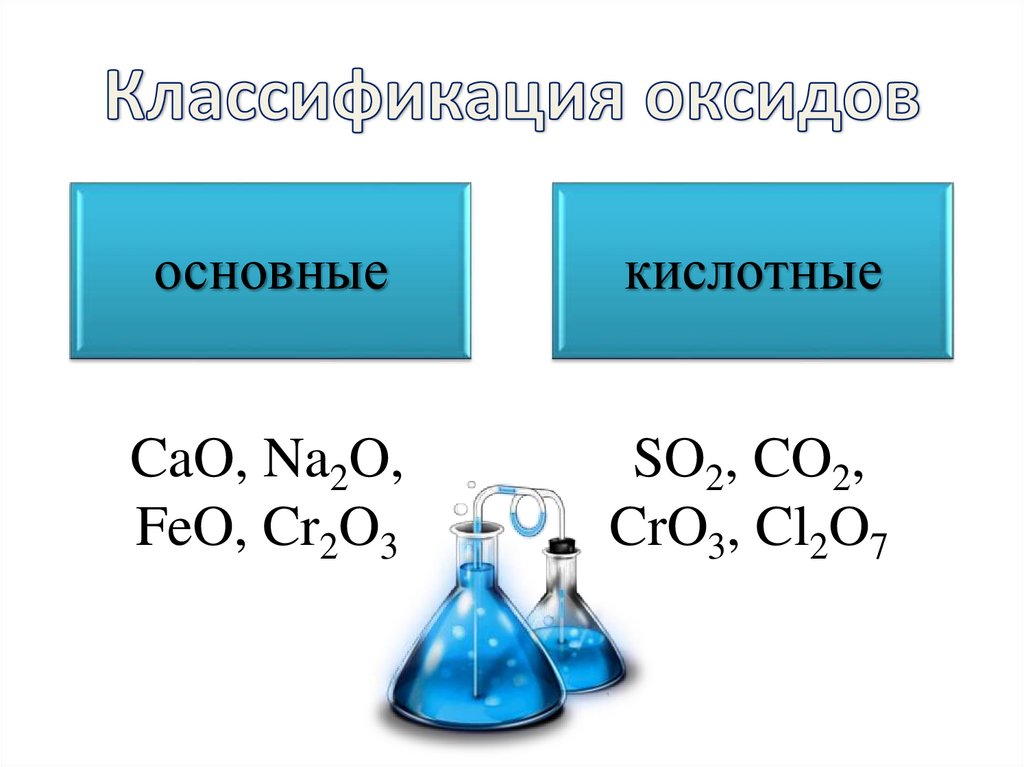
12. Классификация оксидов
основныекислотные
CaO, Na2O,
FeO, Cr2O3
SO2, CO2,
CrO3, Cl2O7
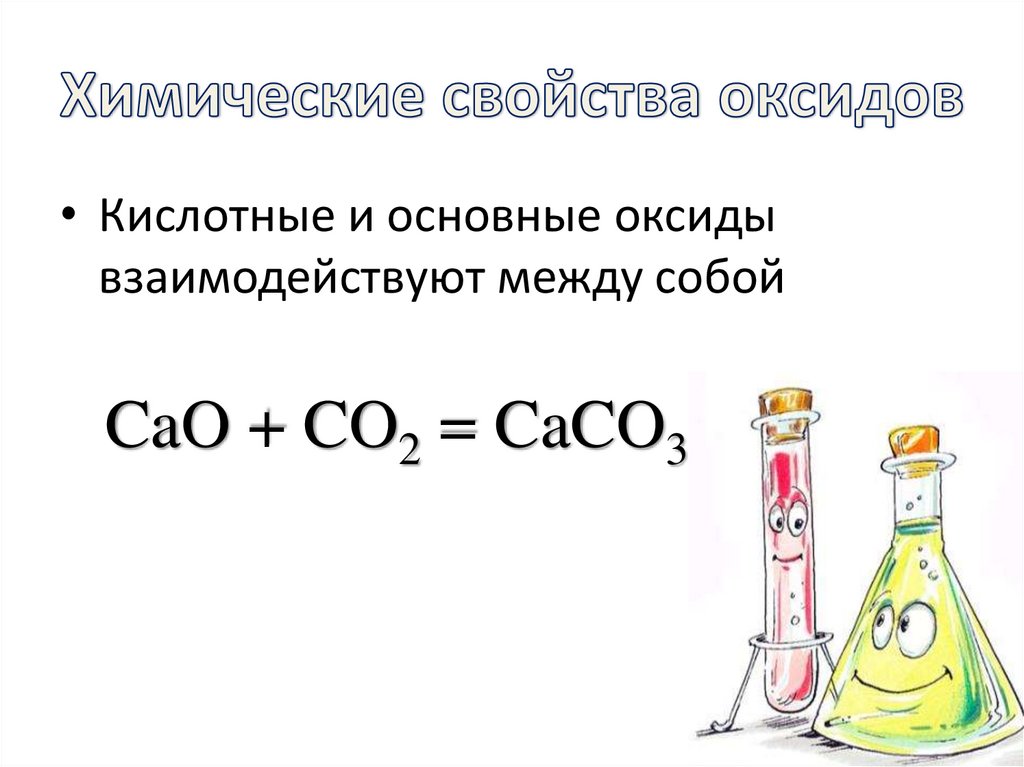
13. Химические свойства оксидов
• Составьте уравнения практическиосуществимых химических реакций.
Назовите образующиеся вещества.
• Na2O + H2O →
• CaO + H2O →
• FeO + H2O →
SiO2 + H2O →
P2O5+ H2O →
NO + H2O →
14. Химические свойства оксидов
• Кислотные и основные оксидывзаимодействуют между собой
CaO + CO2 = CaCO3
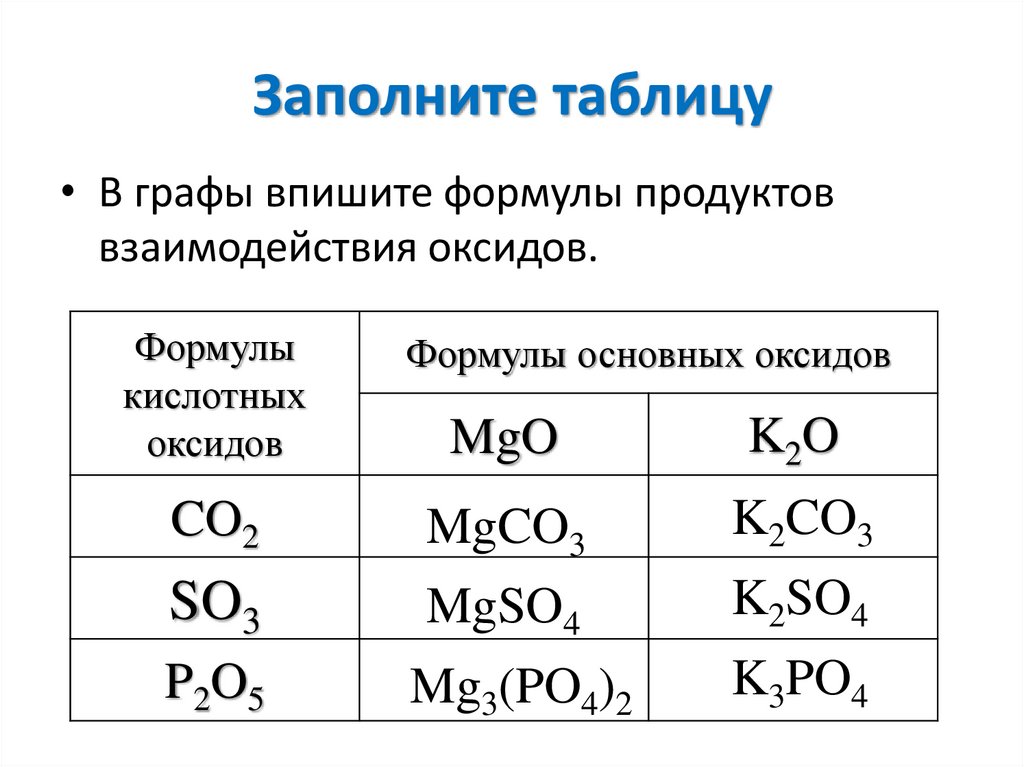
15. Заполните таблицу
• В графы впишите формулы продуктоввзаимодействия оксидов.
Формулы
кислотных
оксидов
Формулы основных оксидов
MgO
K2O
CO2
MgCO3
K2CO3
SO3
MgSO4
K2SO4
P2O5
Mg3(PO4)2
K3PO4
16. «Четвертый лишний»
CO2, K2O, SO3, SiO2
CaO, Cu2O, P2O5, Na2O
MgO, CrO3, Mn2O7, V2O5
NO, CO, CO2, N2O
N2O, N2O5, P2O5, P2O3
Укажите критерий, на основании которого вы
исключили формулу «лишнего» вещества в
каждой группе.
17. Домашнее задание
• §35; упр. 3, 6, 8• Что означает выражение:
«Дела как сажа бела»?
Каким оксидом образована
белая сажа? Вычислите
массовые доли каждого
элемента в белой саже.








 Химия
Химия








