Похожие презентации:
Биоорганическая химия
1. Биоорганическая химия
Изучает строение и свойства веществ,участвующих в процессах жизнедеятельности.
Как самостоятельная наука возникла во второй
половине XX века.
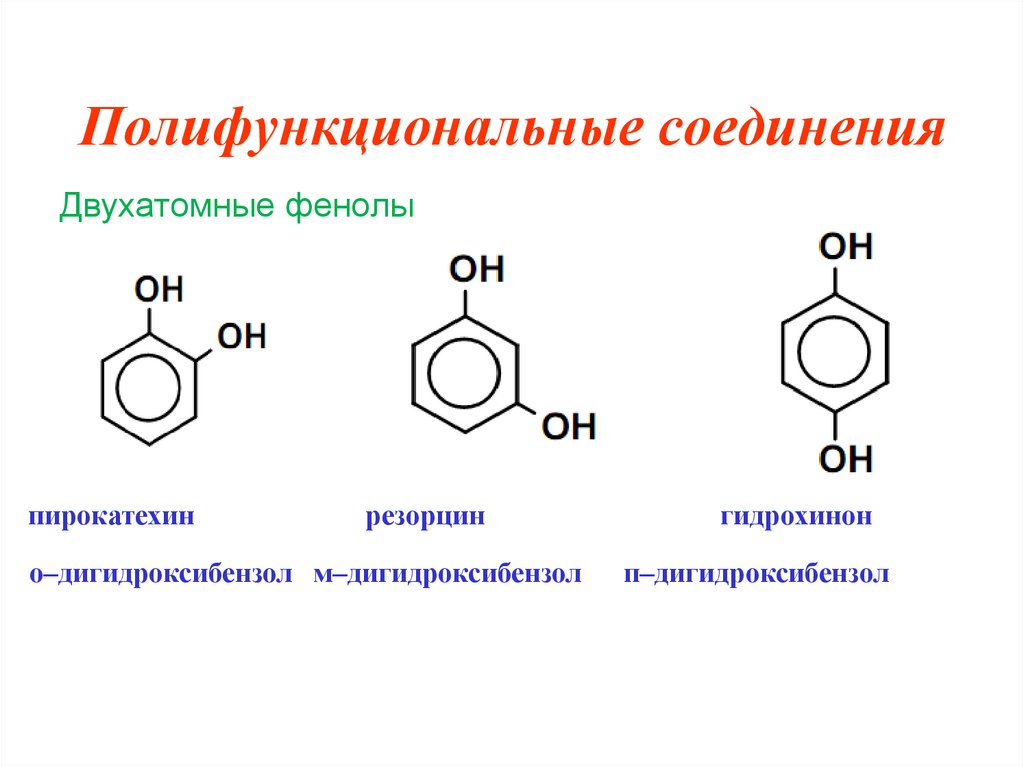
2. Полифункциональные соединения
Полифункциональные соединения – этосоединения, в молекулах которых содержатся две или
более одинаковых функциональных групп.
Чаще всего в природе встречаются соединения с
несколькими ОН-группами:
этиленгликоль
3. Полифункциональные соединения
Двухатомные фенолыпирокатехин
резорцин
о–дигидроксибензол м–дигидроксибензол
гидрохинон
п–дигидроксибензол
4. Соединения с несколькими аминогруппами встречаются гораздо реже
Простейший представитель:H2NCH2CH2NH2
этилендиамин
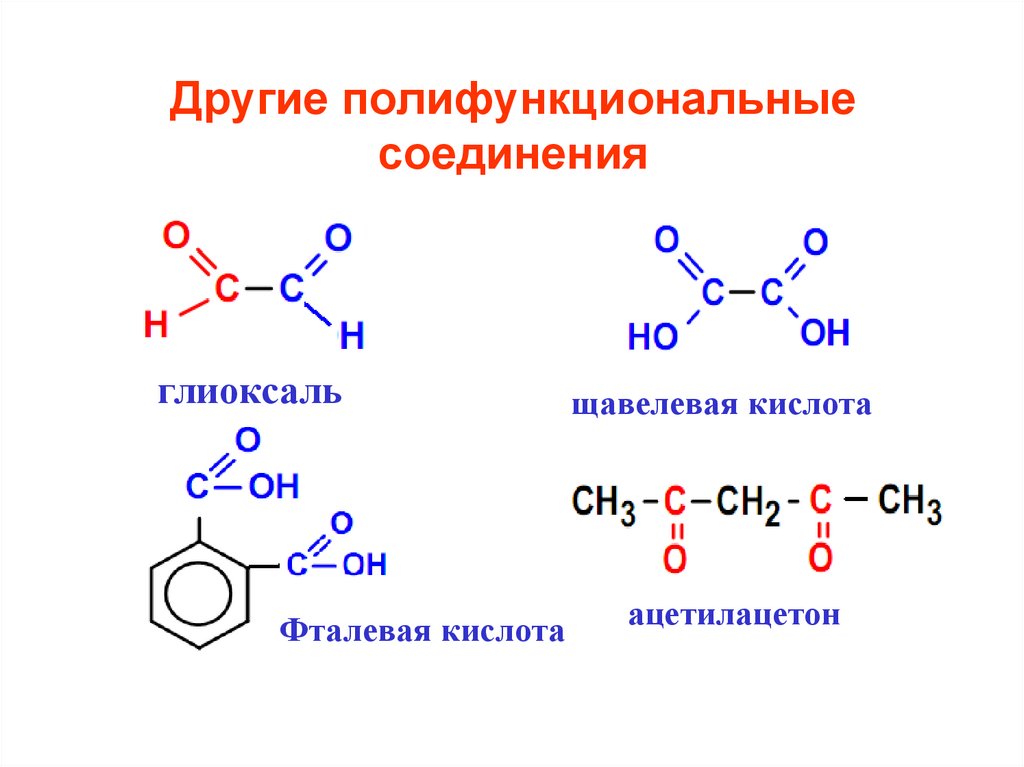
5. Другие полифункциональные соединения
глиоксальФталевая кислота
щавелевая кислота
ацетилацетон
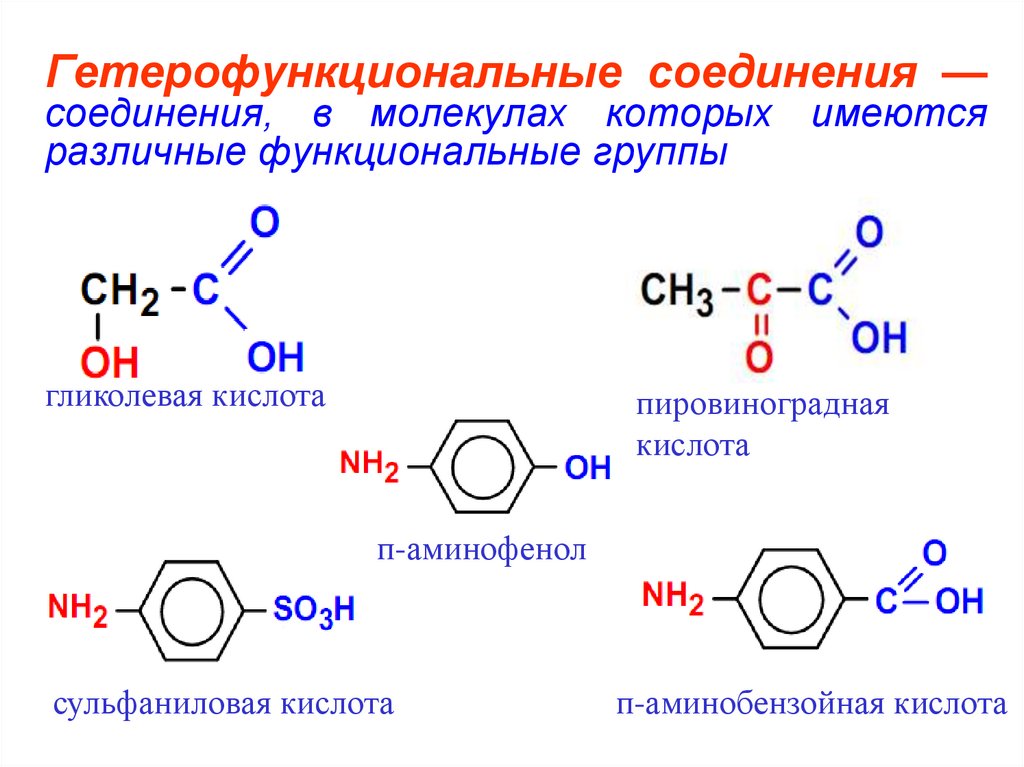
6. Гетерофункциональные соединения — соединения, в молекулах которых имеются различные функциональные группы
гликолевая кислотапировиноградная
кислота
п-аминофенол
сульфаниловая кислота
п-аминобензойная кислота
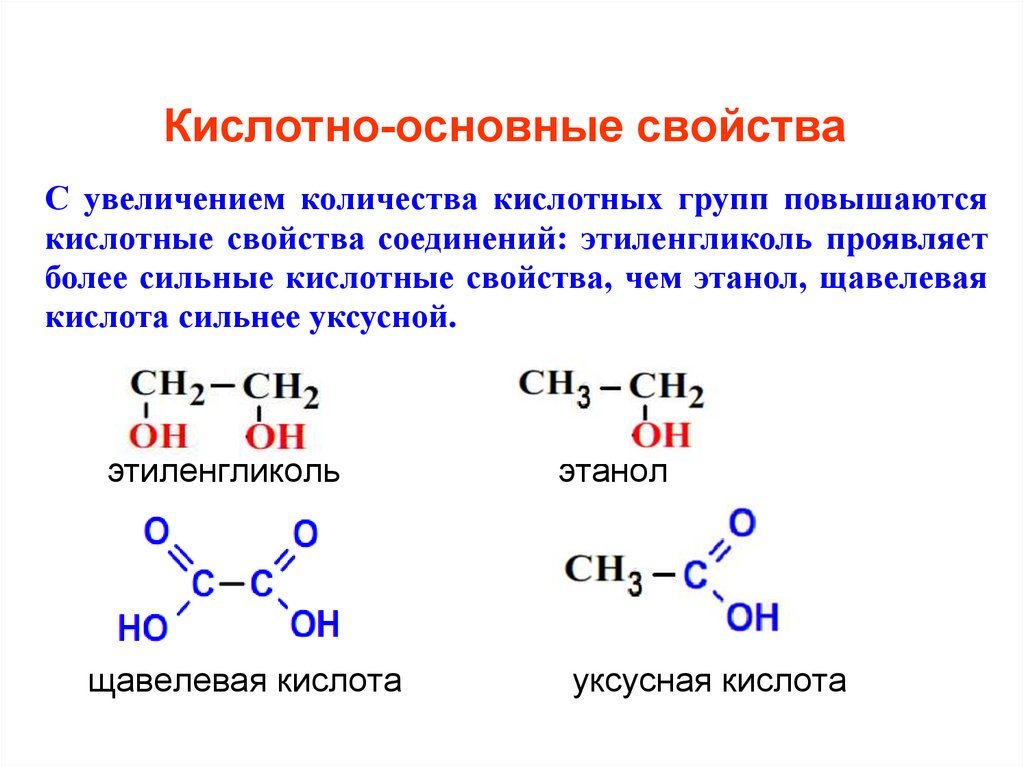
7. Кислотно-основные свойства
С увеличением количества кислотных групп повышаютсякислотные свойства соединений: этиленгликоль проявляет
более сильные кислотные свойства, чем этанол, щавелевая
кислота сильнее уксусной.
НОСН2СН2ОН СН3СН2ОН
НООС СООН
СН3 СООН
этиленгликоль
щавелевая кислота
этанол
уксусная кислота
8.
С накоплением аминогрупп в молекулеповышается основность соединений:
мочевина проявляет более сильные
основные свойства, чем ацетамид
мочевина
ацетамид
9.
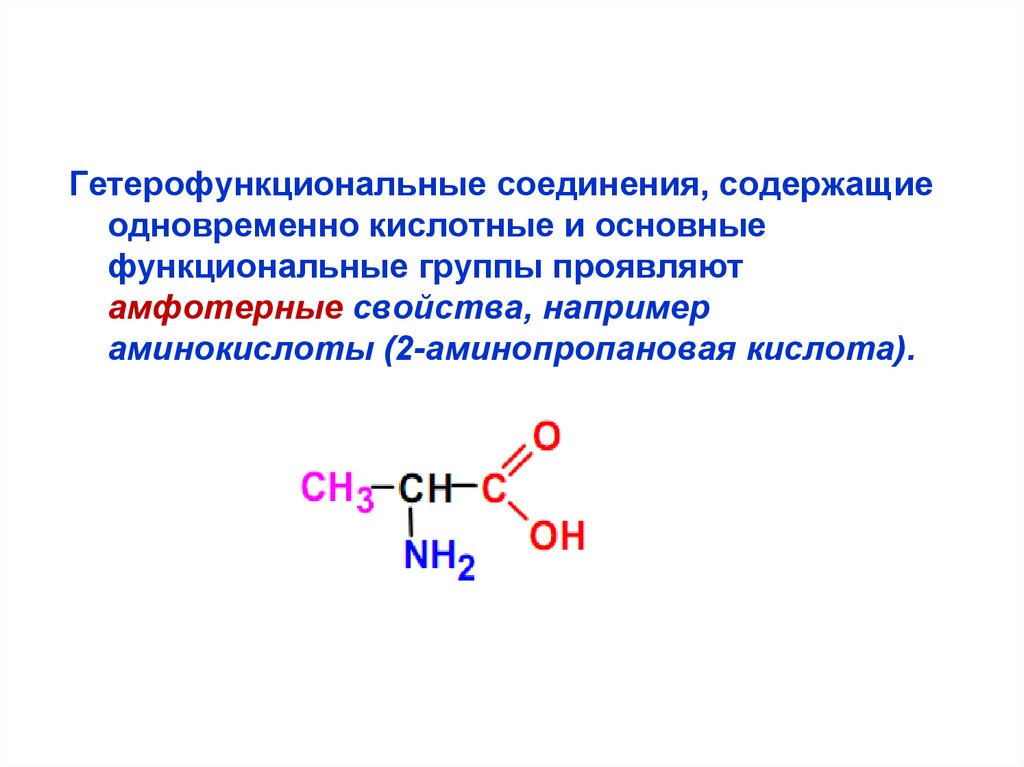
Гетерофункциональные соединения, содержащиеодновременно кислотные и основные
функциональные группы проявляют
амфотерные свойства, например
аминокислоты (2-аминопропановая кислота).
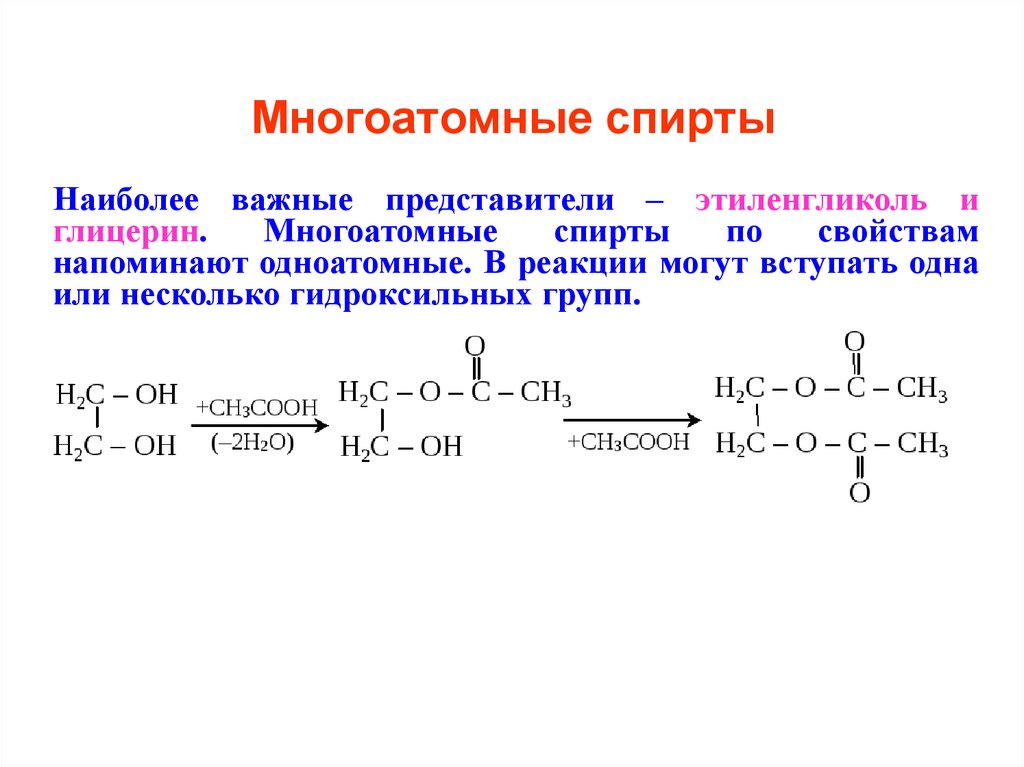
10. Многоатомные спирты
Наиболее важные представители – этиленгликоль иглицерин.
Многоатомные
спирты
по
свойствам
напоминают одноатомные. В реакции могут вступать одна
или несколько гидроксильных групп.
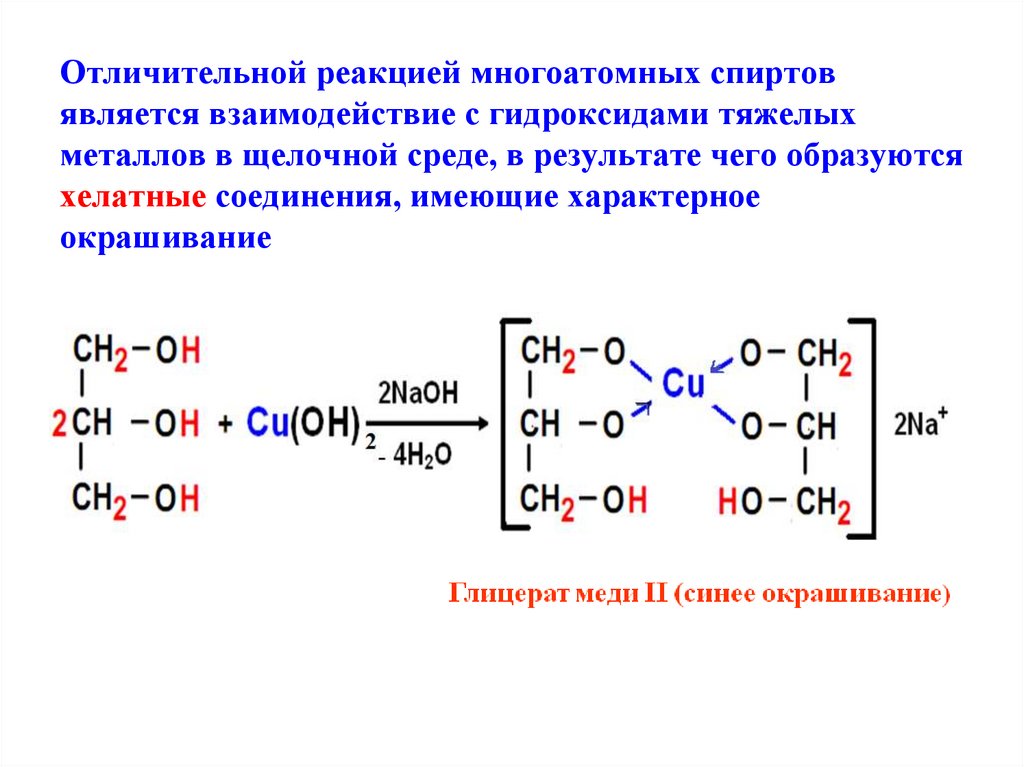
11. Отличительной реакцией многоатомных спиртов является взаимодействие с гидроксидами тяжелых металлов в щелочной среде, в
результате чего образуютсяхелатные соединения, имеющие характерное
окрашивание
12. Многоатомные спирты
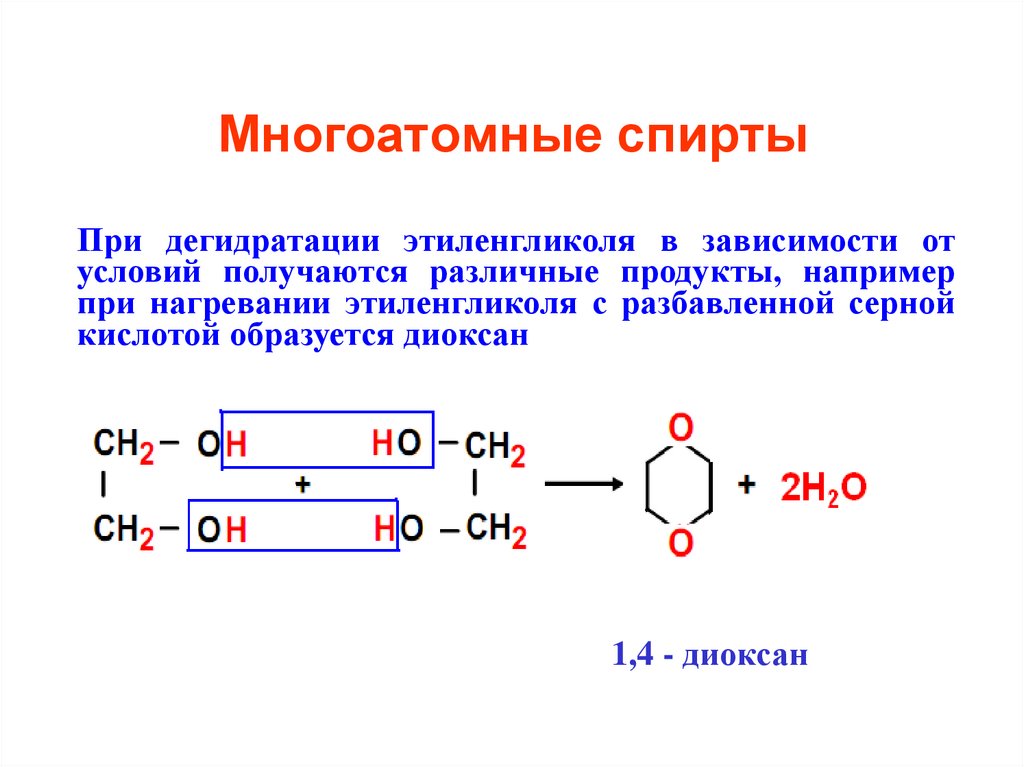
При дегидратации этиленгликоля в зависимости отусловий получаются различные продукты, например
при нагревании этиленгликоля с разбавленной серной
кислотой образуется диоксан
1,4 - диоксан
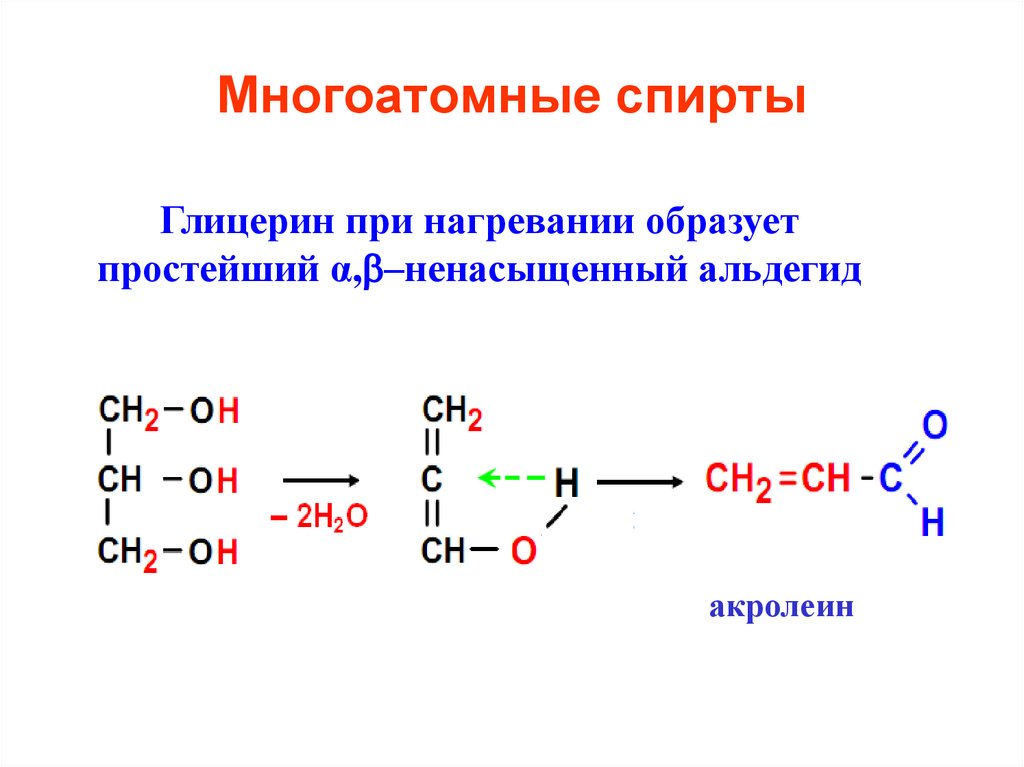
13. Многоатомные спирты
Глицерин при нагревании образуетпростейший α, –ненасыщенный альдегид
акролеин
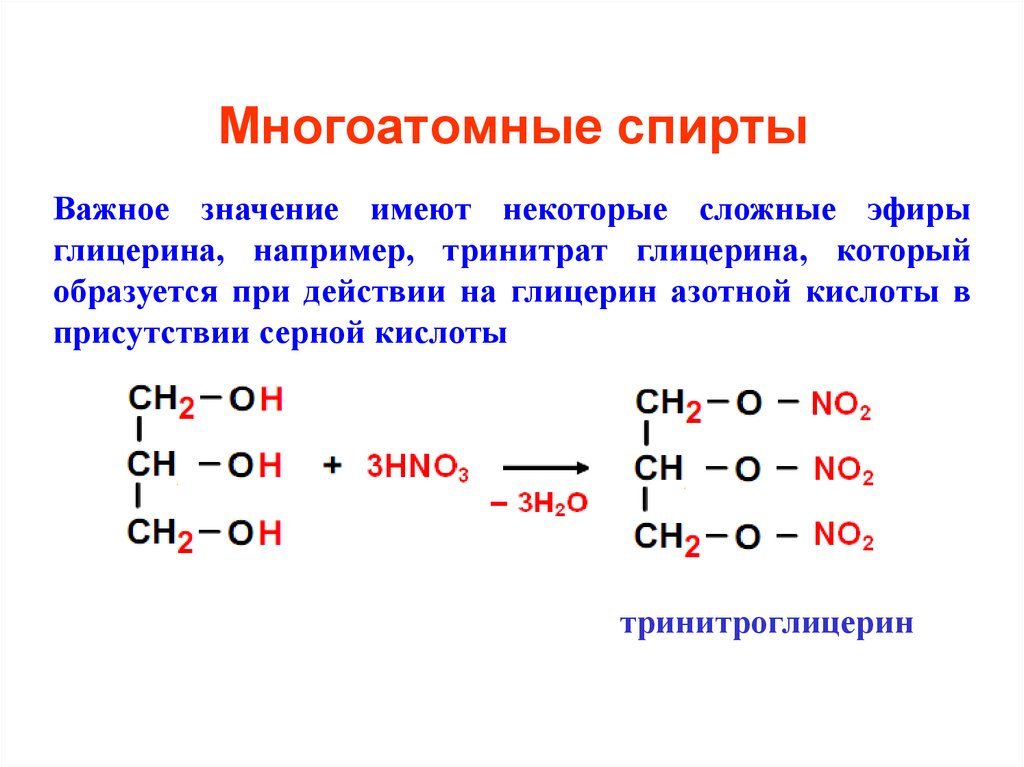
14. Многоатомные спирты
Важное значение имеют некоторые сложные эфирыглицерина, например, тринитрат глицерина, который
образуется при действии на глицерин азотной кислоты в
присутствии серной кислоты
тринитроглицерин
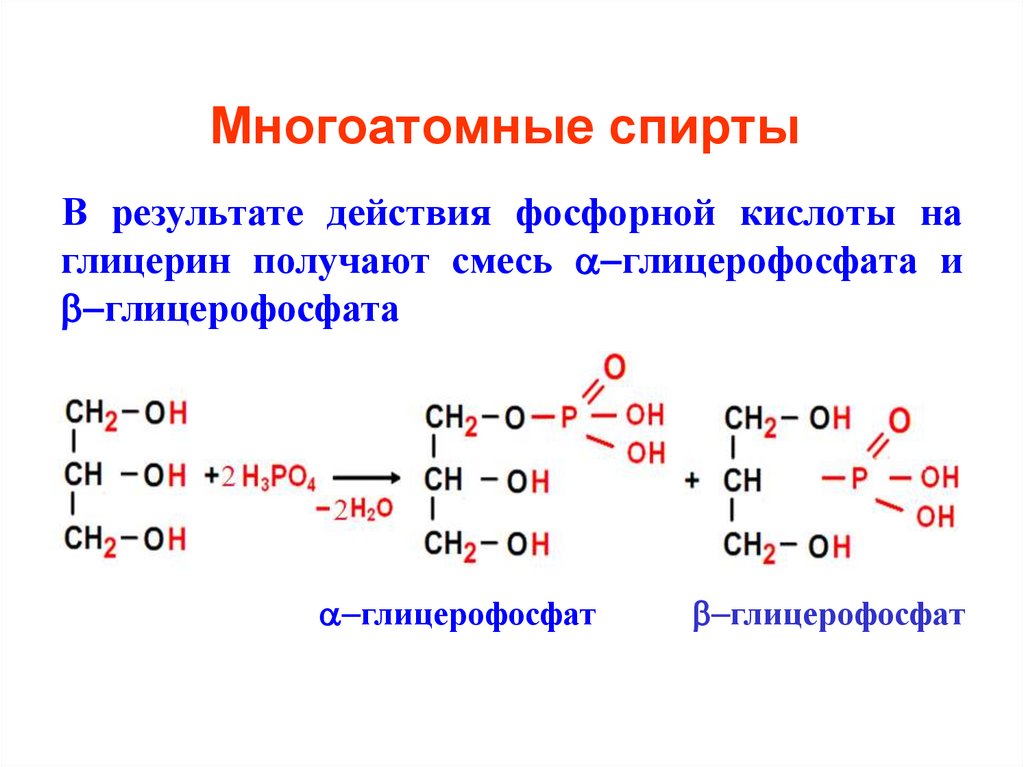
15. Многоатомные спирты
В результате действия фосфорной кислоты наглицерин получают смесь глицерофосфата и
глицерофосфата
глицерофосфат
глицерофосфат
16. Многоатомные спирты
Многоатомные спирты окисляются. Окислениепроходит легко различными окислителями.
Может проходить ступенчато:
17. Дикарбоновые кислоты
К ним относятся соединения с двумя кар–боксильными группами СООН
Эти кислоты могут вступать во все реакции, характерные для
монокарбоновых кислот. В реакции могут вступать как одна
карбоксильная группа, так и две. При этом образуются кислые соли
или эфиры или средние соли или эфиры.
Простейший представитель
Щавелевая кислота
ее соли называются
– оксалатами
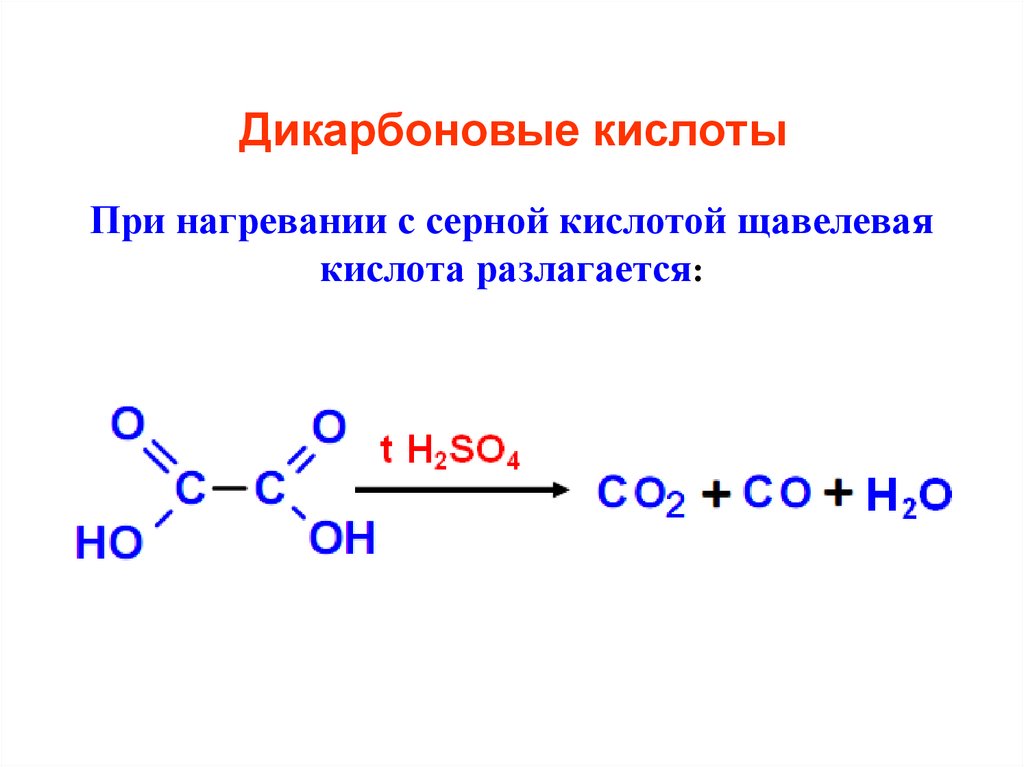
18. Дикарбоновые кислоты
При нагревании с серной кислотой щавелеваякислота разлагается:
19. Дикарбоновые кислоты
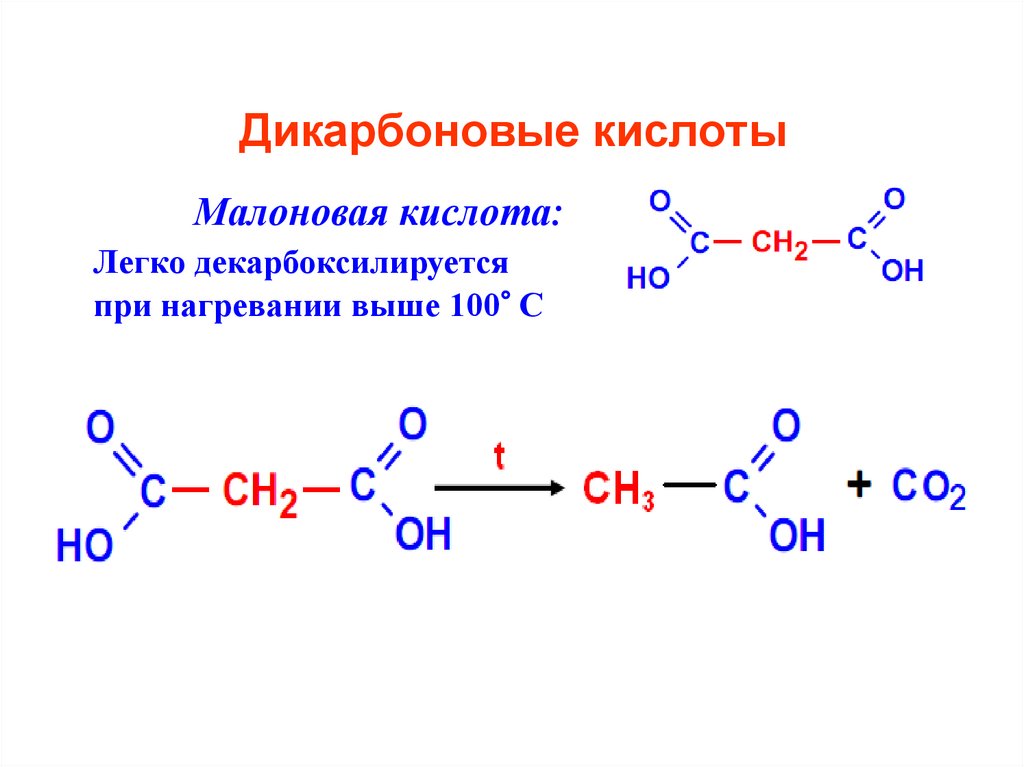
Малоновая кислота:Легко декарбоксилируется
при нагревании выше 100° С
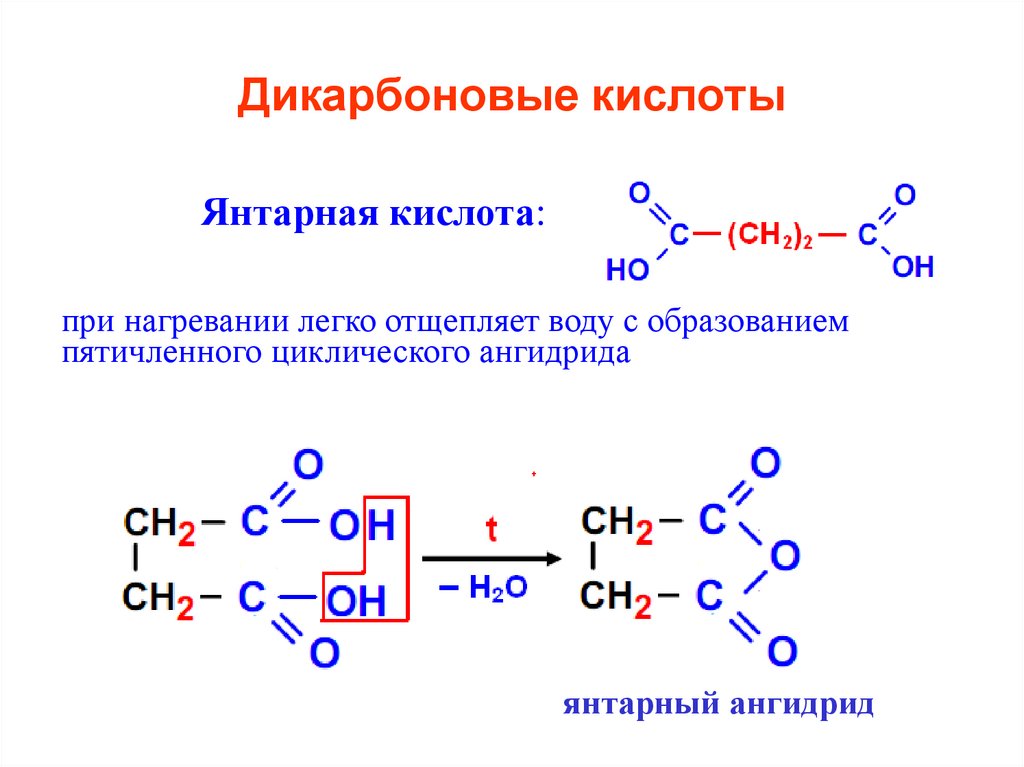
20. Дикарбоновые кислоты
Янтарная кислота:при нагревании легко отщепляет воду с образованием
пятичленного циклического ангидрида
янтарный ангидрид
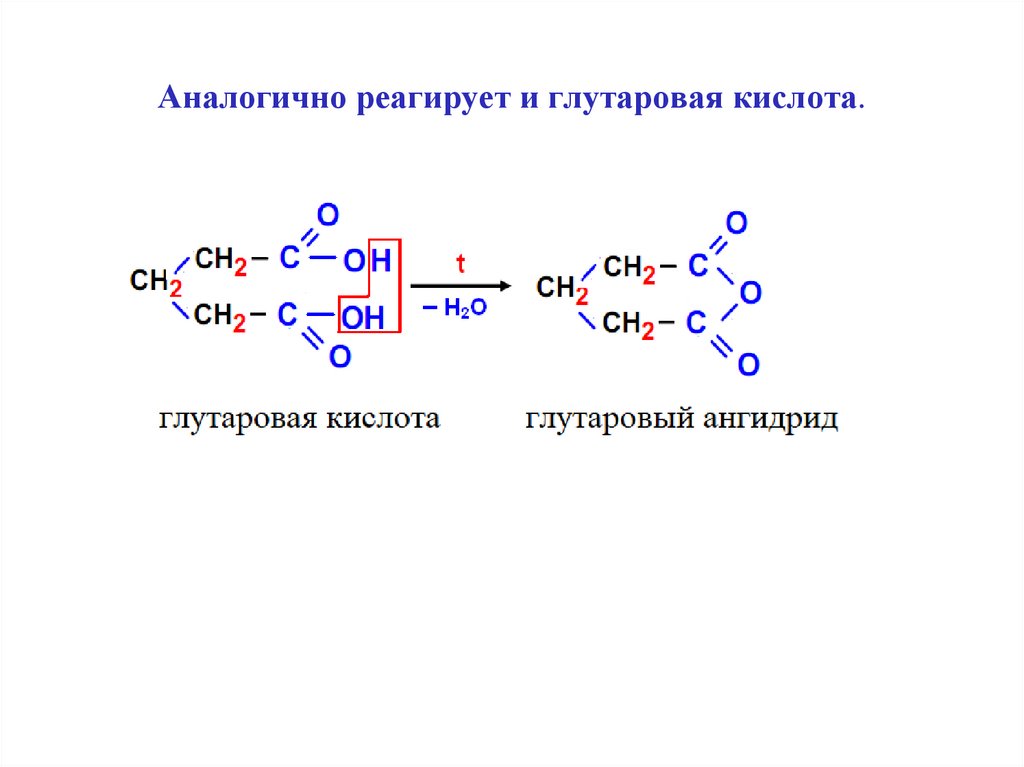
21. Аналогично реагирует и глутаровая кислота.
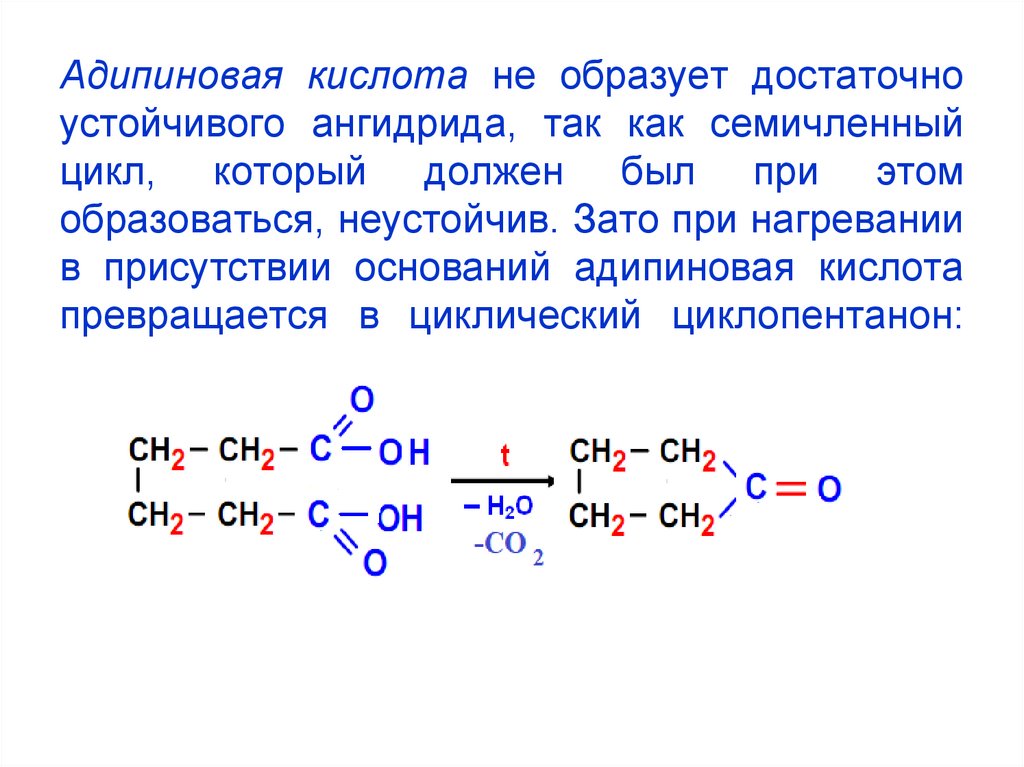
22. Адипиновая кислота не образует достаточно устойчивого ангидрида, так как семичленный цикл, который должен был при этом
образоваться, неустойчив. Зато при нагреваниив присутствии оснований адипиновая кислота
превращается в циклический циклопентанон:
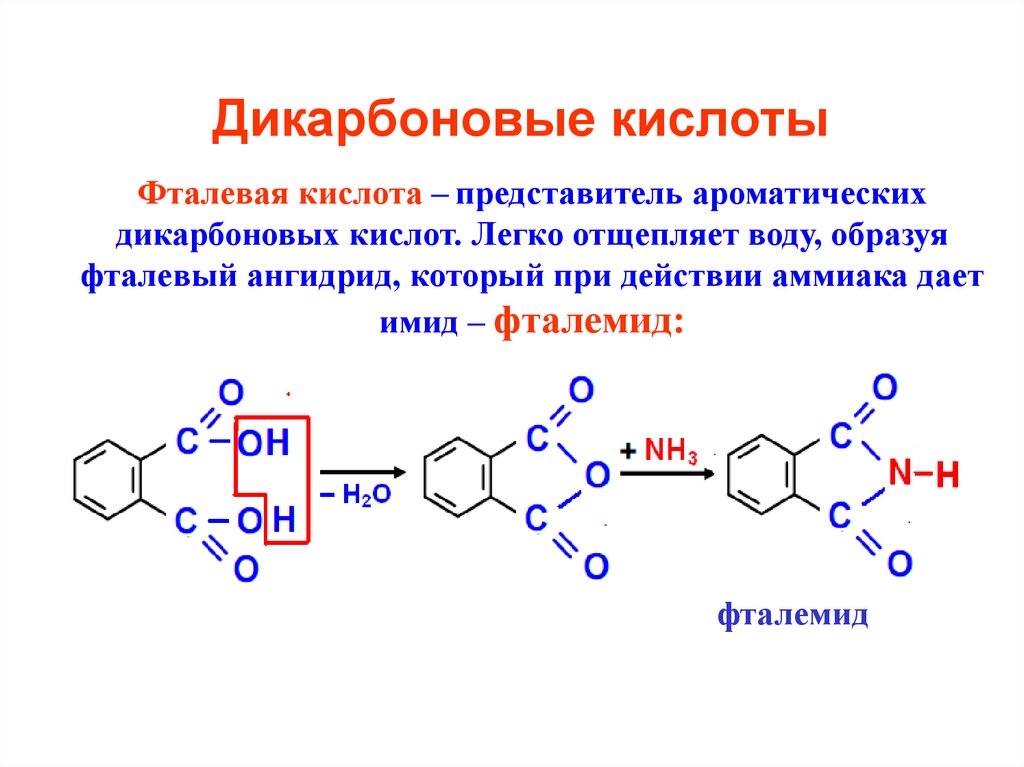
23. Дикарбоновые кислоты
Фталевая кислота – представитель ароматическихдикарбоновых кислот. Легко отщепляет воду, образуя
фталевый ангидрид, который при действии аммиака дает
имид – фталемид:
фталемид
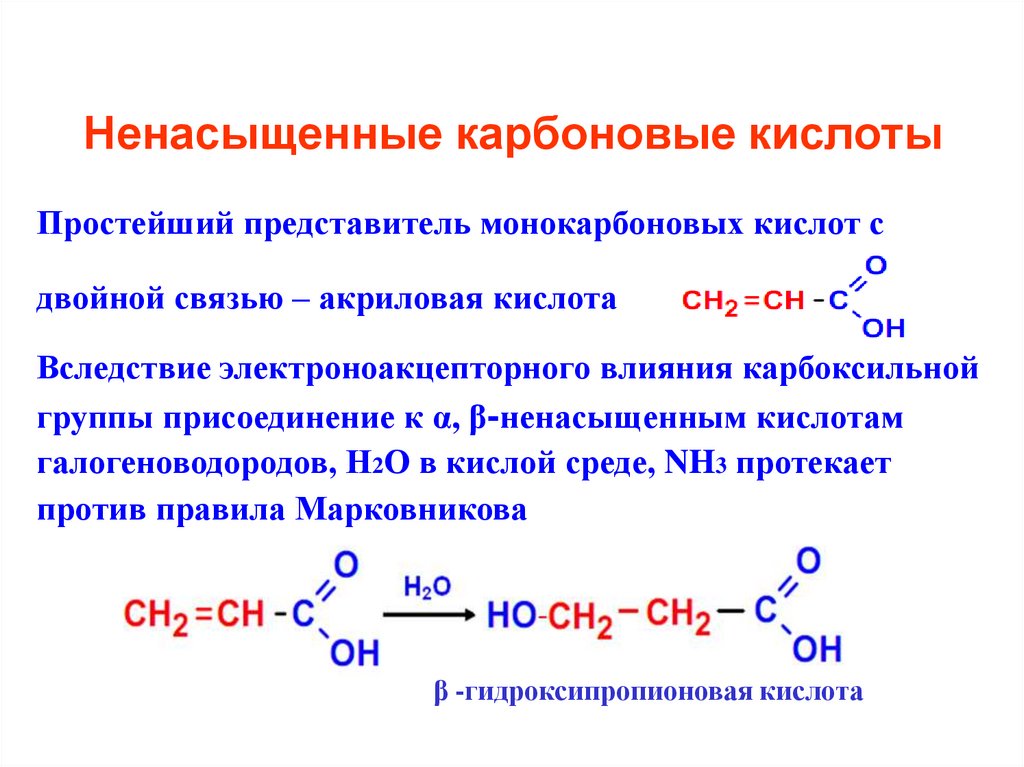
24. Ненасыщенные карбоновые кислоты
Простейший представитель монокарбоновых кислот сдвойной связью – акриловая кислота
Вследствие электроноакцепторного влияния карбоксильной
группы присоединение к α, β-ненасыщенным кислотам
галогеноводородов, Н2О в кислой среде, NH3 протекает
против правила Марковникова
β -гидроксипропионовая кислота
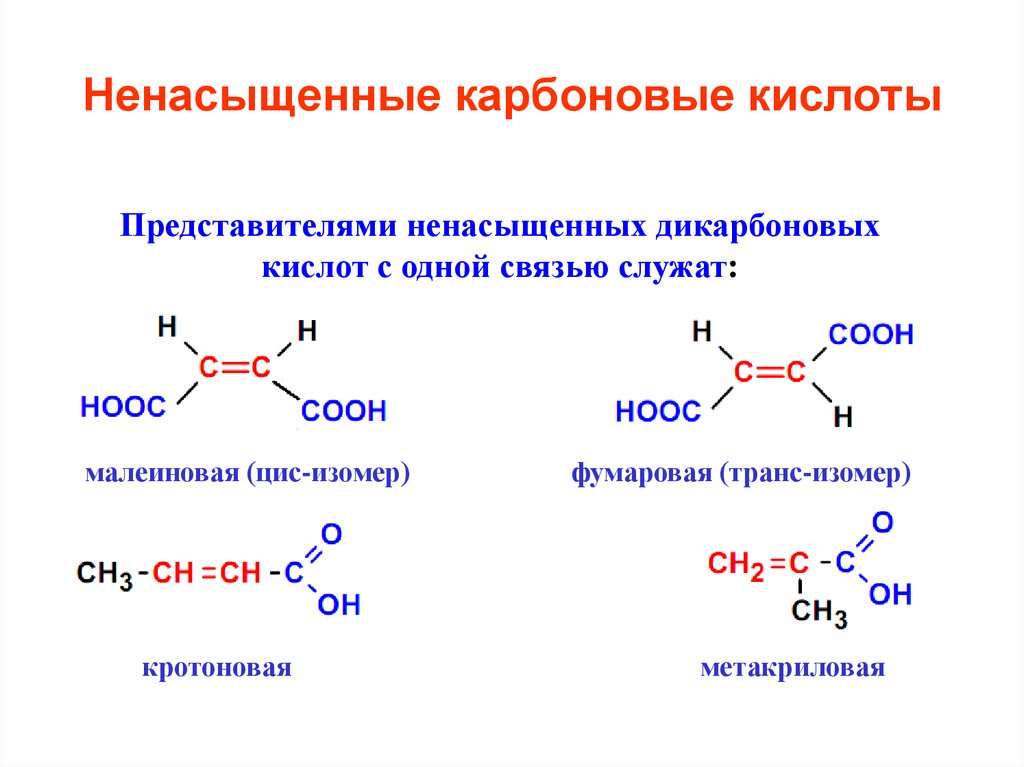
25. Ненасыщенные карбоновые кислоты
Представителями ненасыщенных дикарбоновыхкислот с одной связью служат:
малеиновая (цис-изомер)
кротоновая
фумаровая (транс-изомер)
метакриловая
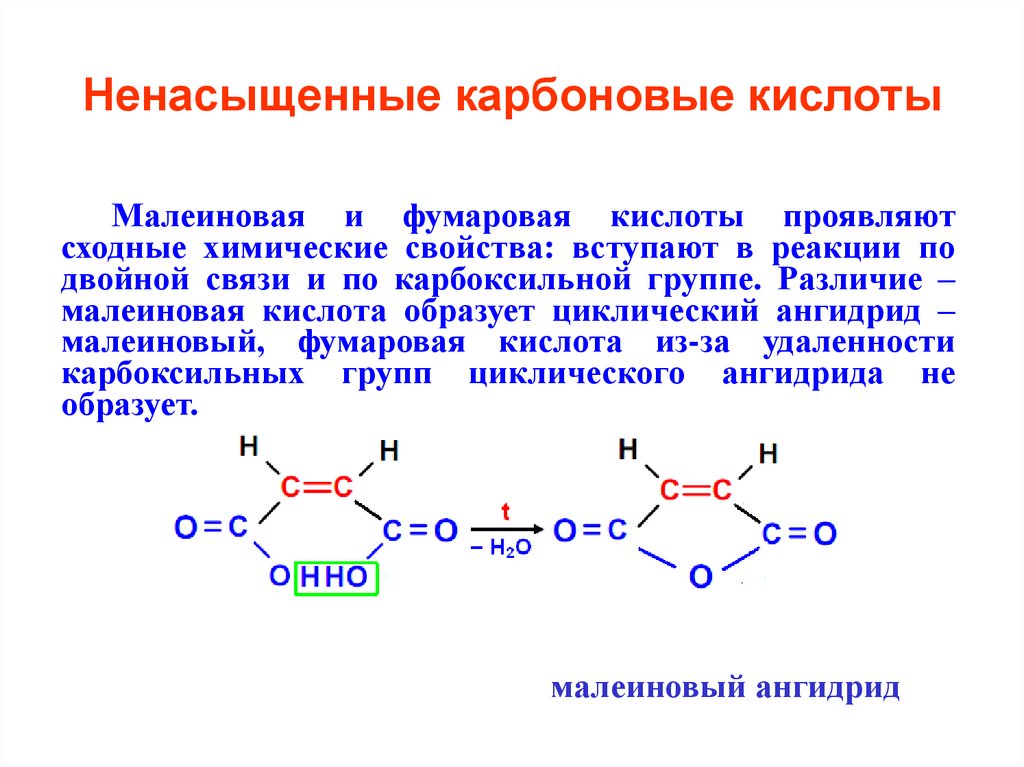
26. Ненасыщенные карбоновые кислоты
Малеиновая и фумаровая кислоты проявляютсходные химические свойства: вступают в реакции по
двойной связи и по карбоксильной группе. Различие –
малеиновая кислота образует циклический ангидрид –
малеиновый, фумаровая кислота из-за удаленности
карбоксильных групп циклического ангидрида не
образует.
малеиновый ангидрид
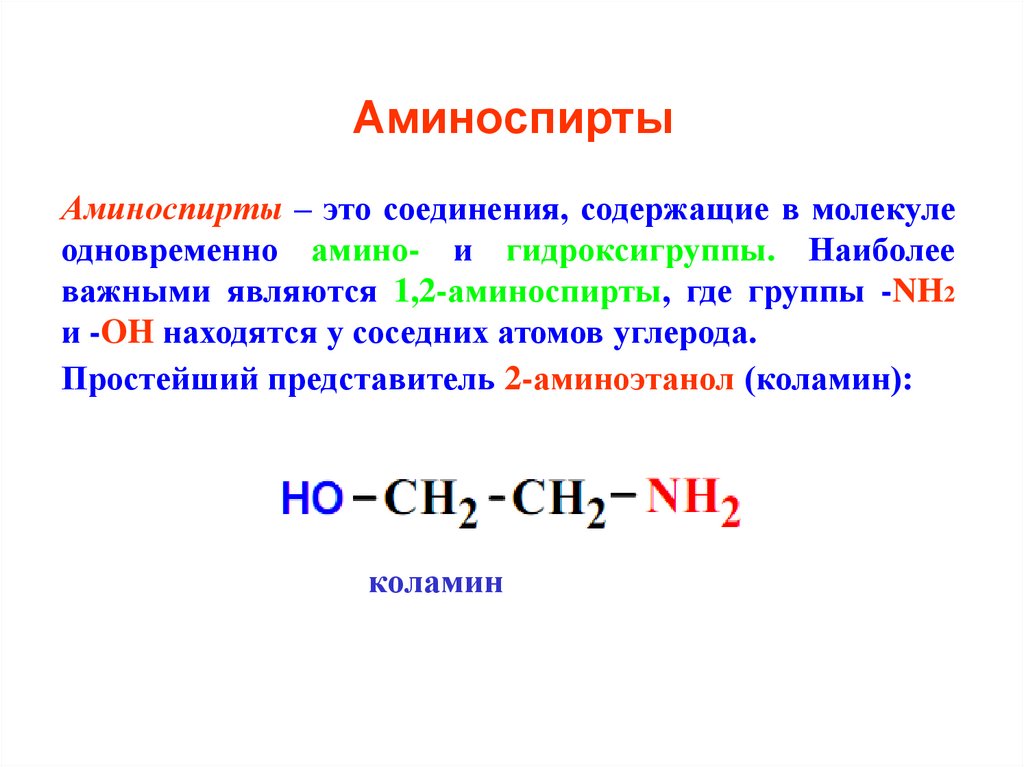
27. Аминоспирты
Аминоспирты – это соединения, содержащие в молекулеодновременно амино- и гидроксигруппы. Наиболее
важными являются 1,2-аминоспирты, где группы -NH2
и -OH находятся у соседних атомов углерода.
Простейший представитель 2-аминоэтанол (коламин):
коламин
28.
• При метилировании коламинаобразуется холин:
холин
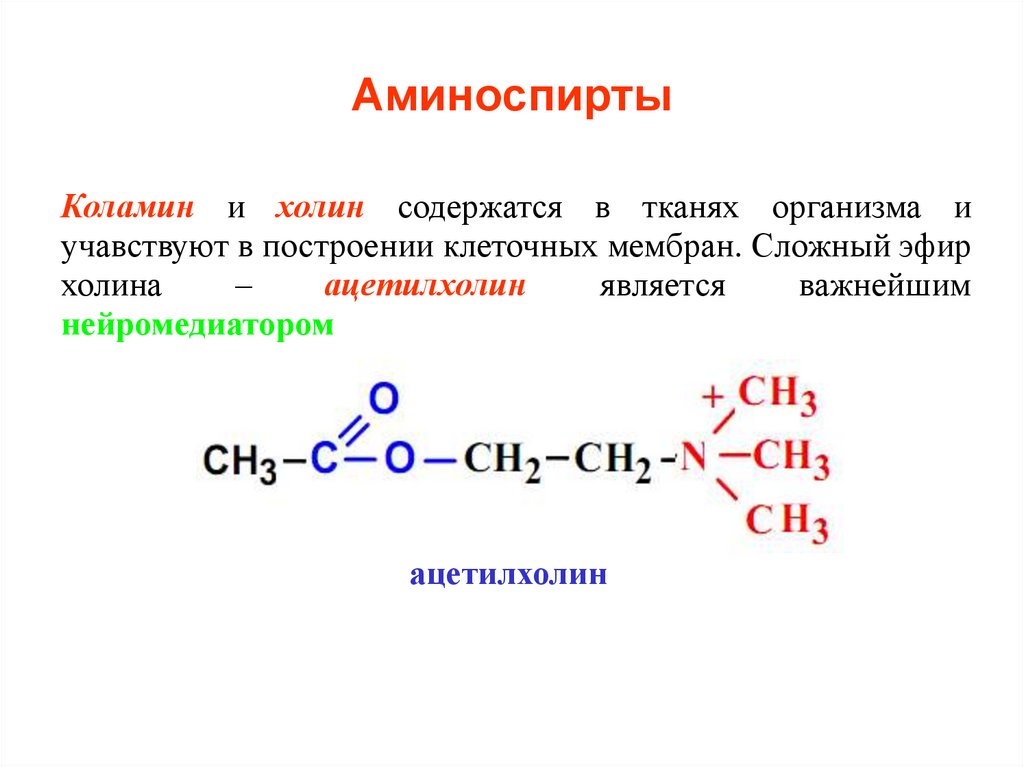
29. Аминоспирты
Коламин и холин содержатся в тканях организма иучавствуют в построении клеточных мембран. Сложный эфир
холина
–
ацетилхолин
является
важнейшим
нейромедиатором
ацетилхолин
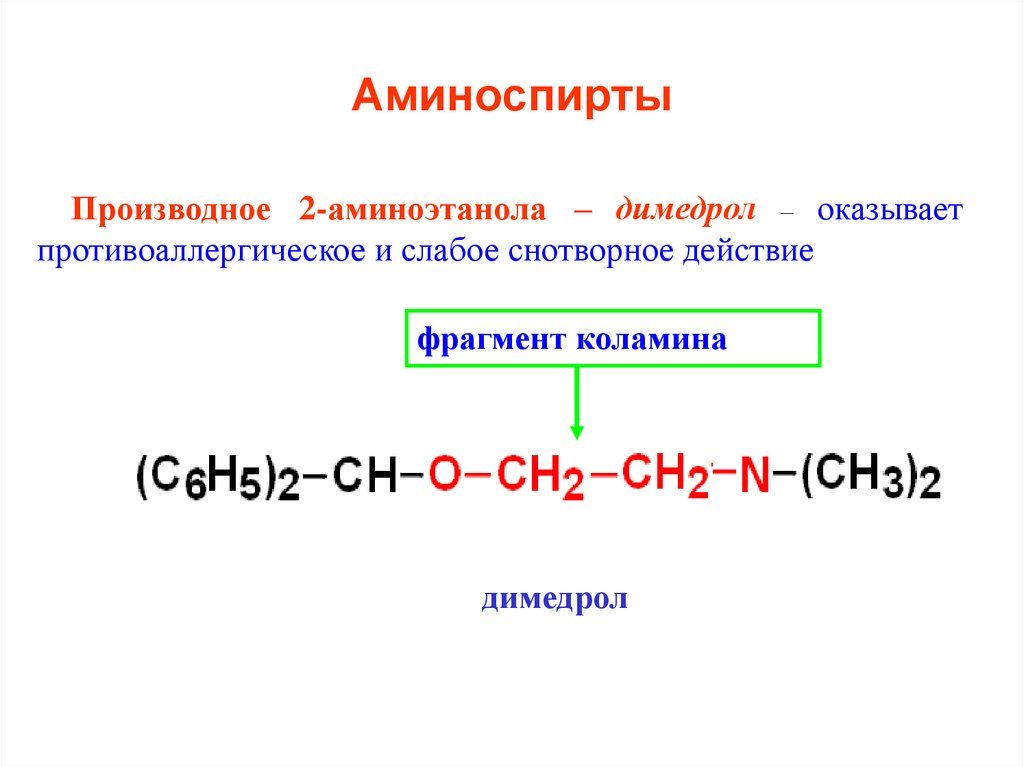
30. Аминоспирты
Производное 2-аминоэтанола – димедрол – оказываетпротивоаллергическое и слабое снотворное действие
фрагмент коламина
димедрол
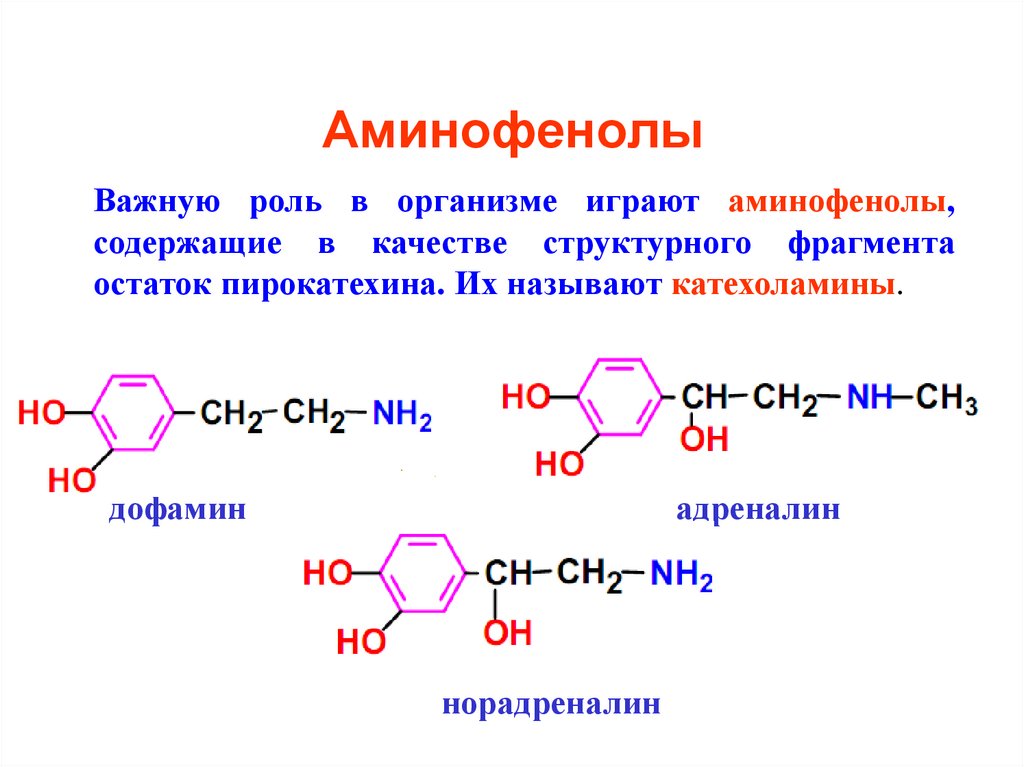
31. Аминофенолы
Важную роль в организме играют аминофенолы,содержащие в качестве структурного фрагмента
остаток пирокатехина. Их называют катехоламины.
дофамин
адреналин
норадреналин
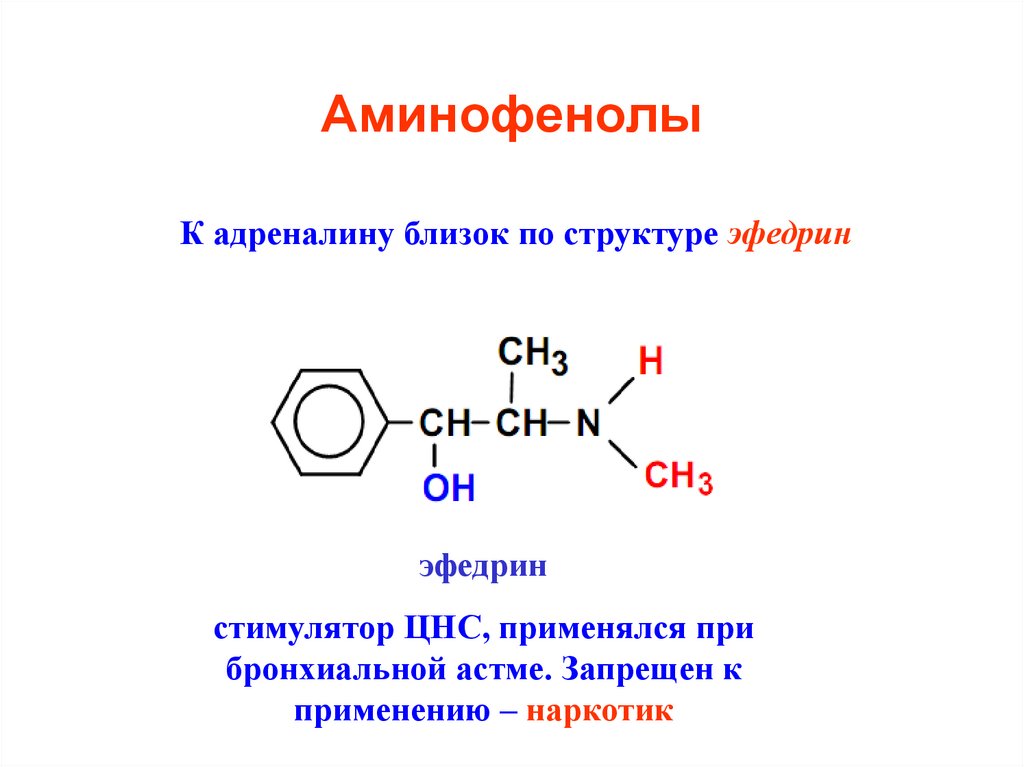
32. Аминофенолы
К адреналину близок по структуре эфедринэфедрин
стимулятор ЦНС, применялся при
бронхиальной астме. Запрещен к
применению – наркотик
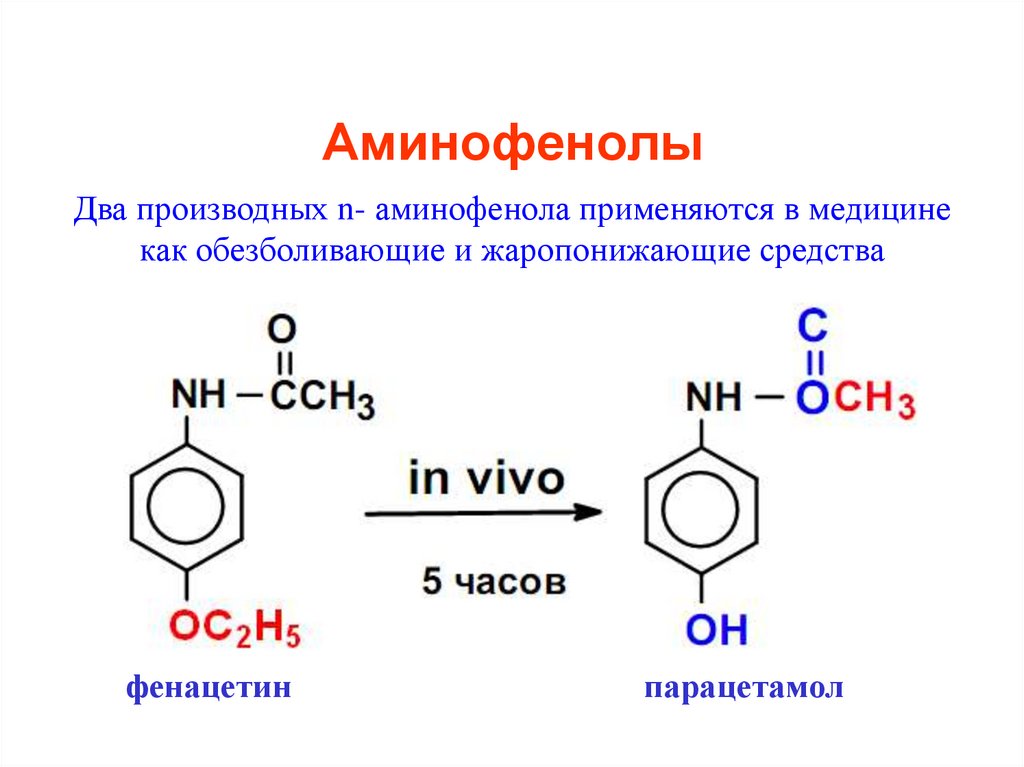
33. Аминофенолы
Два производных n- аминофенола применяются в медицинекак обезболивающие и жаропонижающие средства
фенацетин
парацетамол
34. Гидрокси– и аминокислоты
Гидроксикислоты – соединения, содержащие вмолекуле
одновременно
гидроксильную
и
карбоксильную группы.
Аминокислоты – соединения, содержащие в
молекуле одновременно амино- и карбоксильную
группы.
В зависимости от расположения OH- или NH2группы по отношению к карбоксильной группе
различают α-, β-, γ- и т. д. гидрокси- и
аминокислоты.
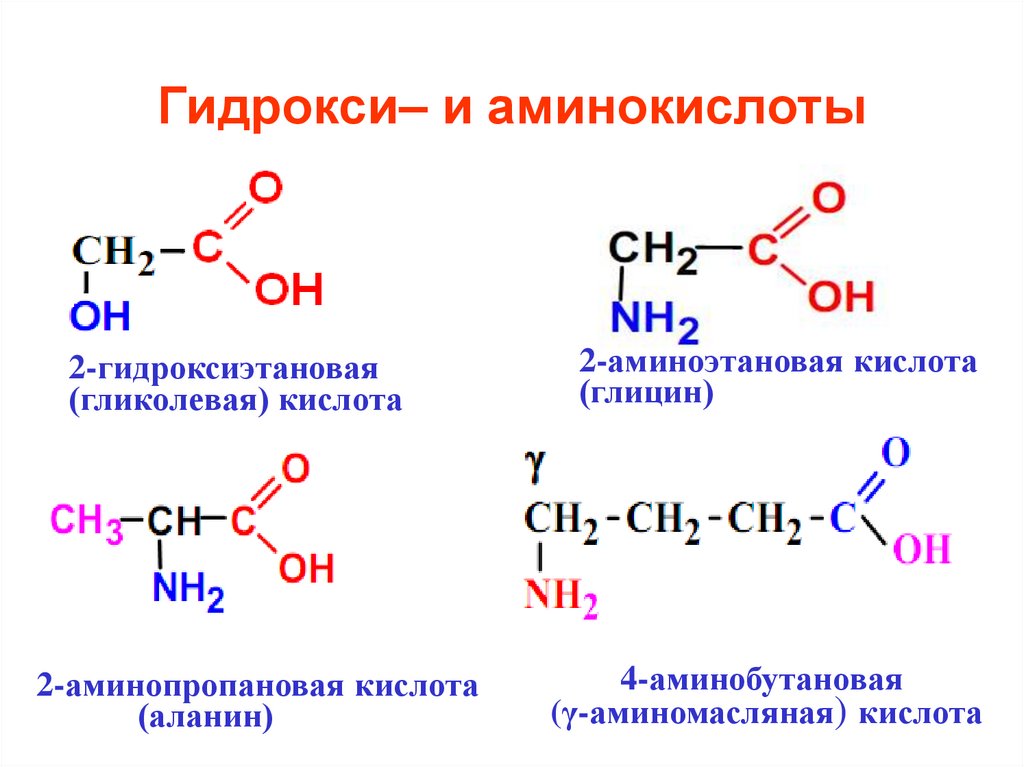
35. Гидрокси– и аминокислоты
2-гидроксиэтановая(гликолевая) кислота
2-аминопропановая кислота
(аланин)
2-аминоэтановая кислота
(глицин)
4-аминобутановая
(γ-аминомасляная) кислота
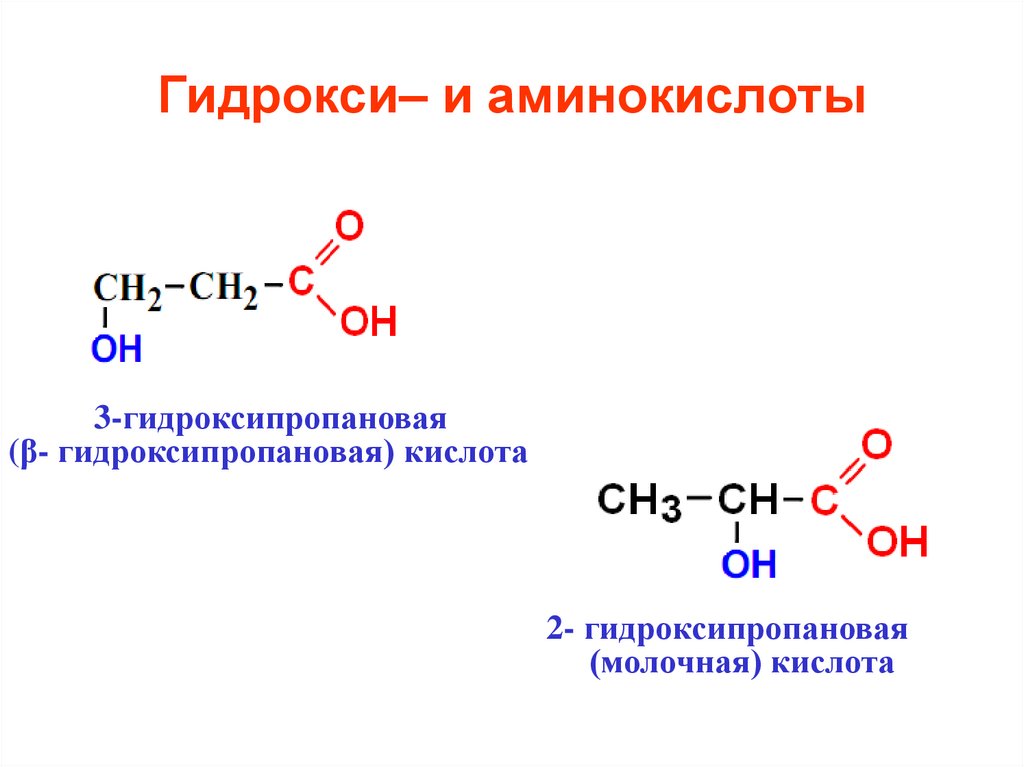
36. Гидрокси– и аминокислоты
3-гидроксипропановая(β- гидроксипропановая) кислота
2- гидроксипропановая
(молочная) кислота
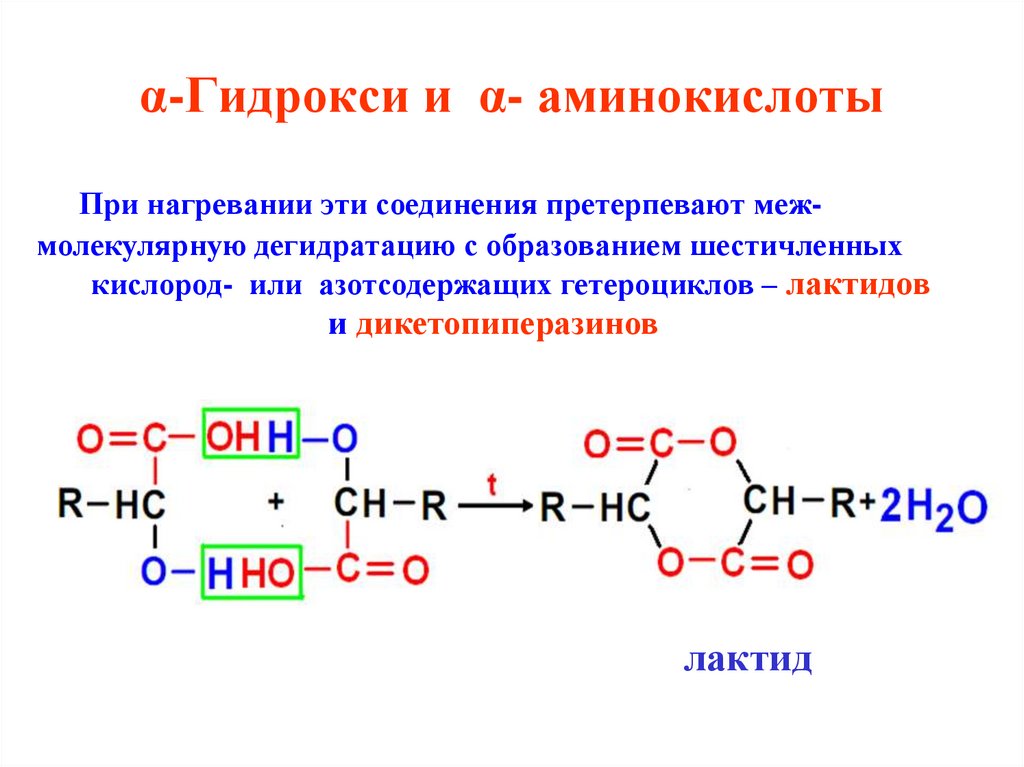
37. α-Гидрокси и α- аминокислоты
При нагревании эти соединения претерпевают межмолекулярную дегидратацию с образованием шестичленныхкислород- или азотсодержащих гетероциклов – лактидов
и дикетопиперазинов
лактид
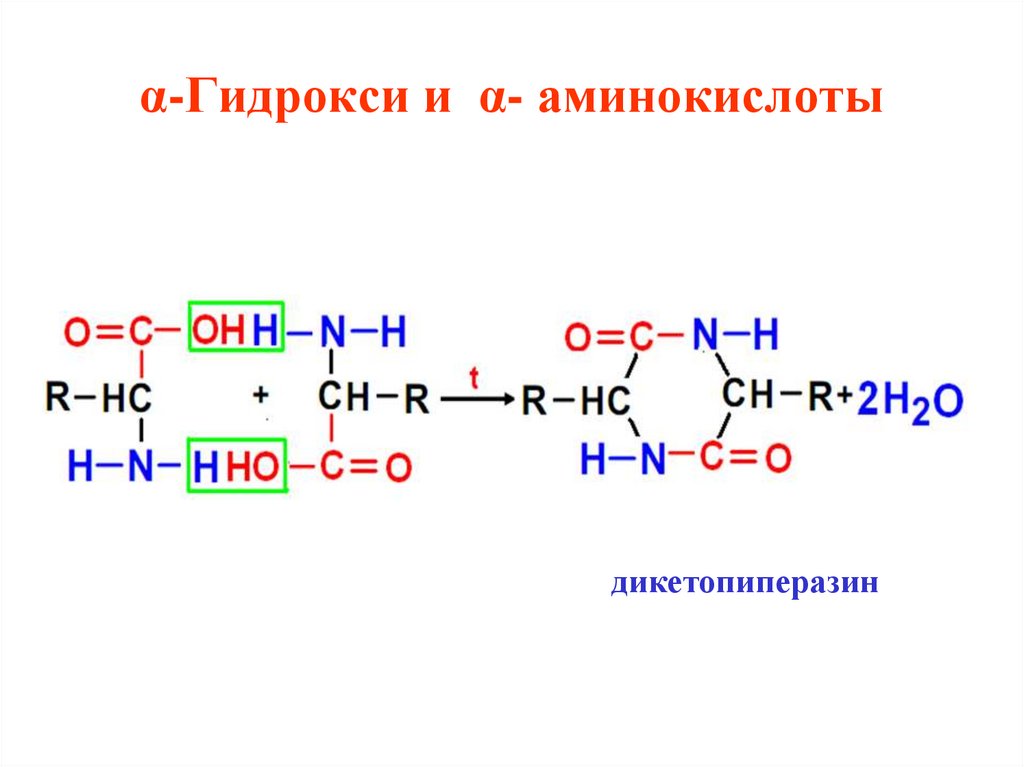
38. α-Гидрокси и α- аминокислоты
дикетопиперазин39. α-Гидрокси и α- аминокислоты
Особое свойство α- гидроксикислот – способность разла –гаться при нагревании в присутствии минеральных кислот с
образованием карбонильных соединений и муравьиной
кислоты:
40. α-Гидрокси и α- аминокислоты
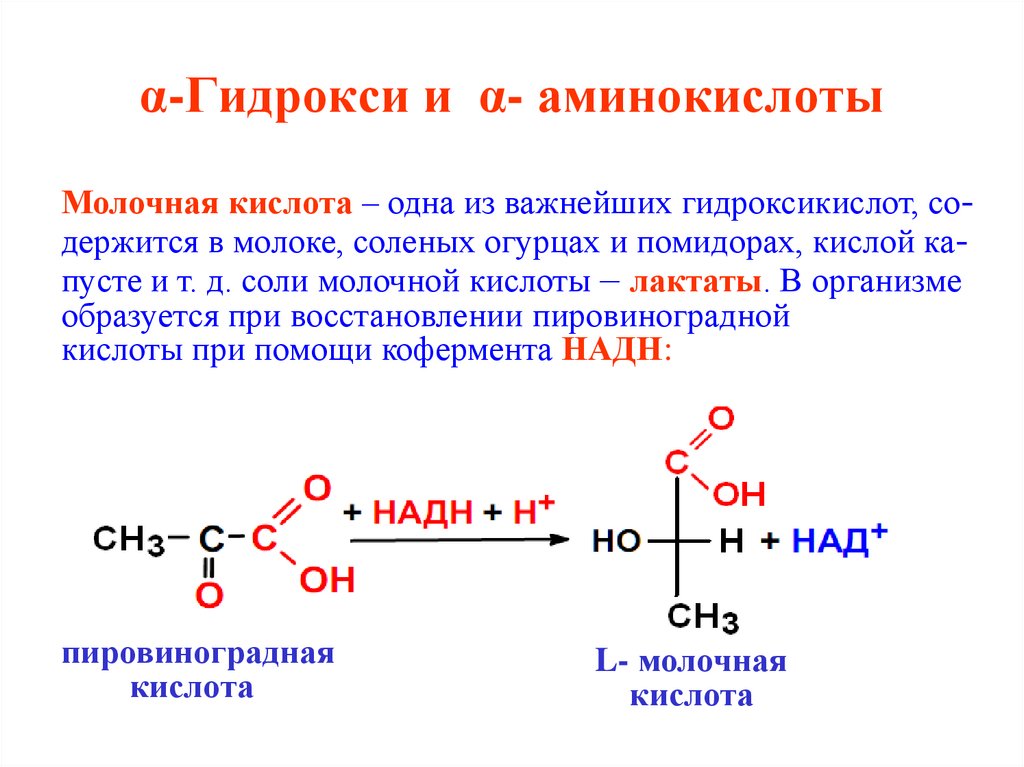
Молочная кислота – одна из важнейших гидроксикислот, содержится в молоке, соленых огурцах и помидорах, кислой капусте и т. д. соли молочной кислоты – лактаты. В организмеобразуется при восстановлении пировиноградной
кислоты при помощи кофермента НАДН:
пировиноградная
кислота
L- молочная
кислота
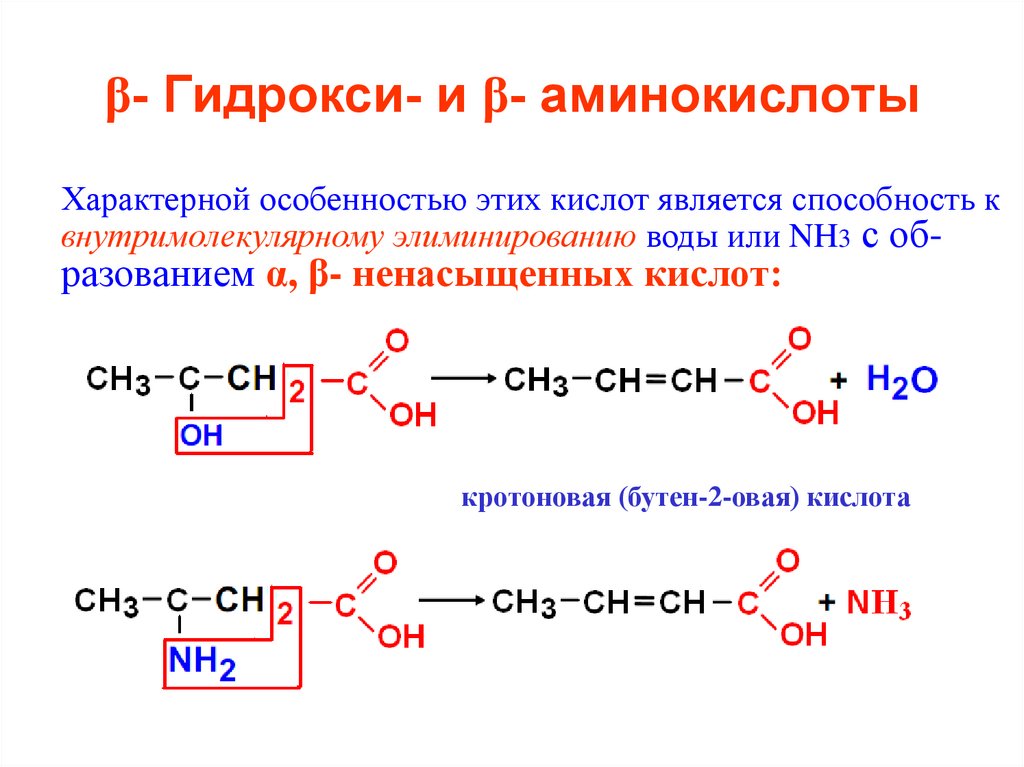
41. β- Гидрокси- и β- аминокислоты
Характерной особенностью этих кислот является способность квнутримолекулярному элиминированию воды или NH3 с об-
разованием α, β- ненасыщенных кислот:
кротоновая (бутен-2-овая) кислота
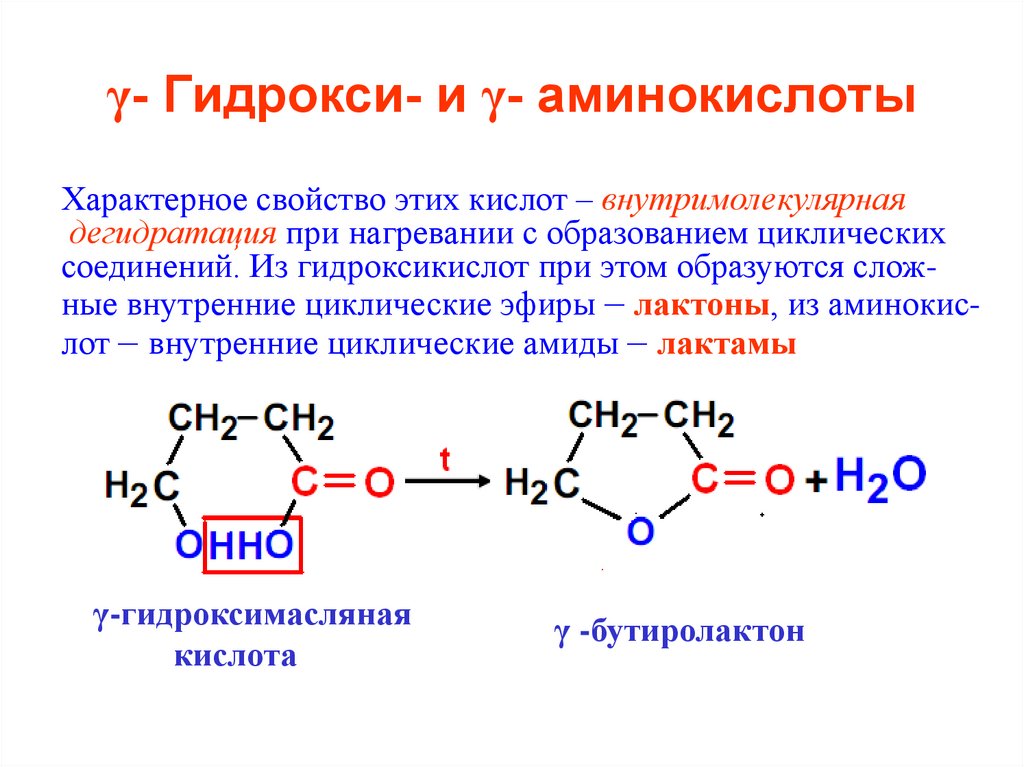
42. γ- Гидрокси- и γ- аминокислоты
Характерное свойство этих кислот – внутримолекулярнаядегидратация при нагревании с образованием циклических
соединений. Из гидроксикислот при этом образуются сложные внутренние циклические эфиры – лактоны, из аминокислот – внутренние циклические амиды – лактамы
γ-гидроксимасляная
кислота
γ -бутиролактон
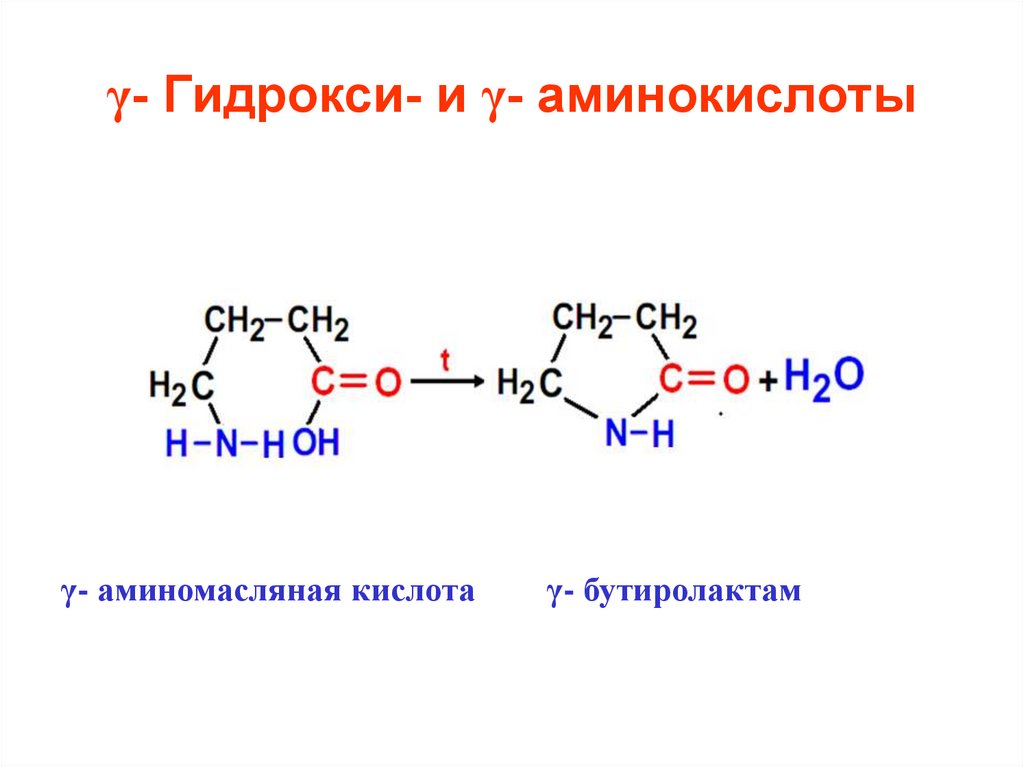
43. γ- Гидрокси- и γ- аминокислоты
γ- аминомасляная кислотаγ- бутиролактам
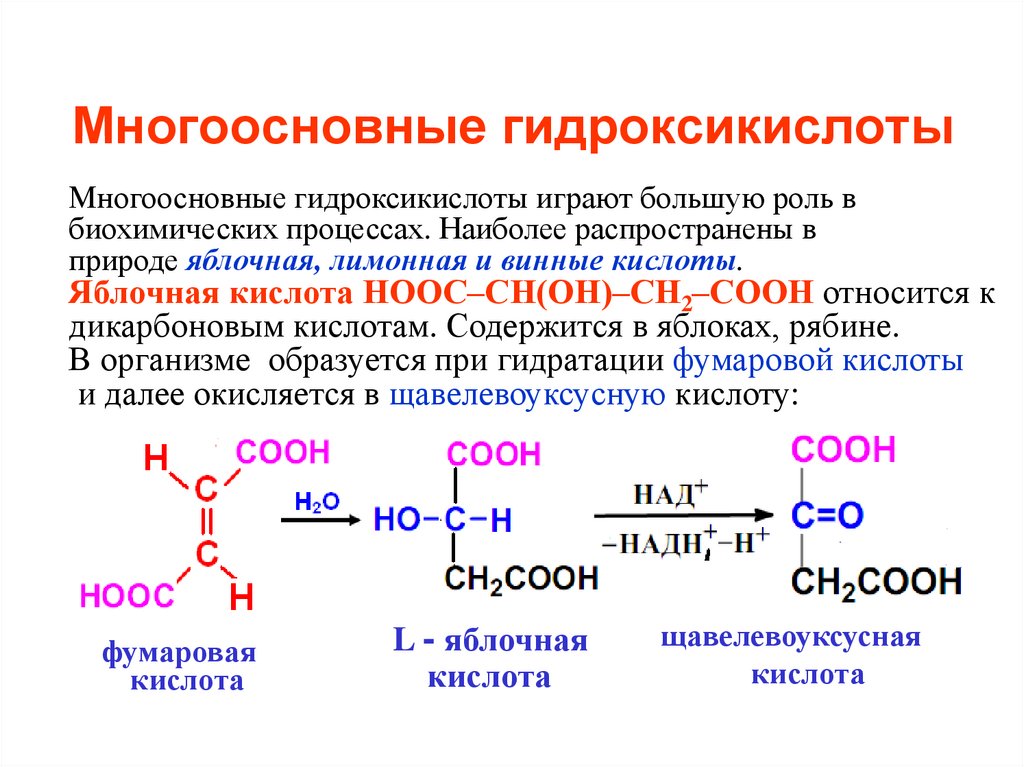
44. Многоосновные гидроксикислоты
Многоосновные гидроксикислоты играют большую роль вбиохимических процессах. Наиболее распространены в
природе яблочная, лимонная и винные кислоты.
Яблочная кислота НООС–СН(ОН)–СН2–СООН относится к
дикарбоновым кислотам. Содержится в яблоках, рябине.
В организме образуется при гидратации фумаровой кислоты
и далее окисляется в щавелевоуксусную кислоту:
фумаровая
кислота
L - яблочная
кислота
щавелевоуксусная
кислота
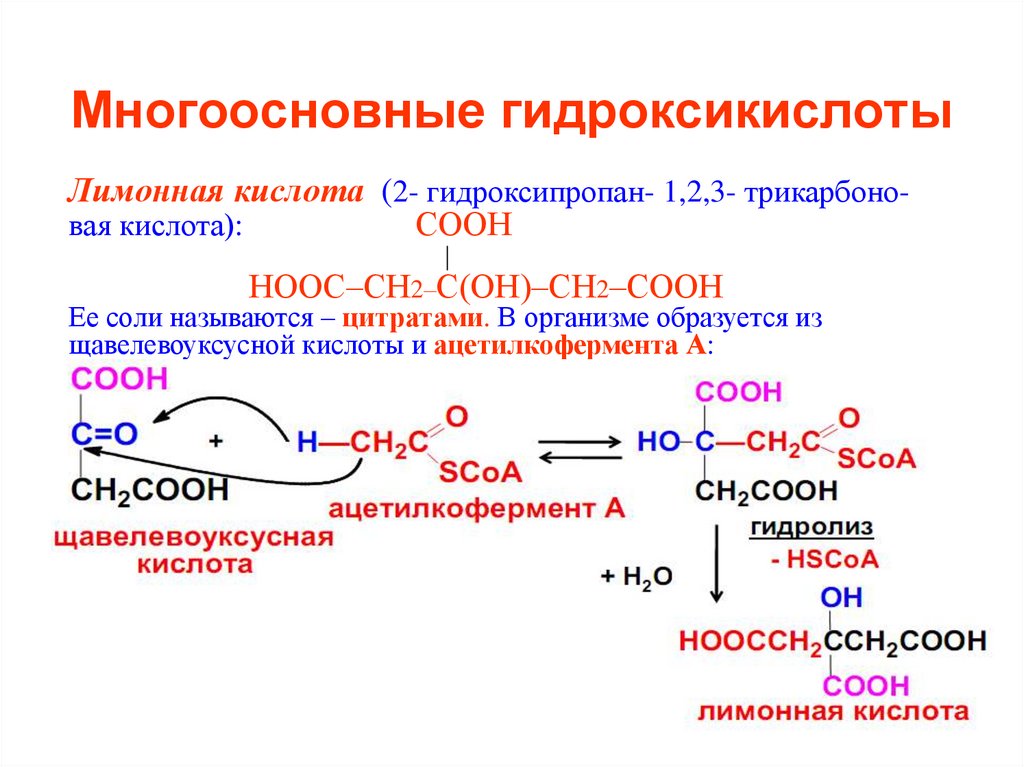
45. Многоосновные гидроксикислоты
Лимонная кислота (2- гидроксипропан- 1,2,3- трикарбоновая кислота):СООН
НООС–СН2–С(ОН)–СН2–СООН
Ее соли называются – цитратами. В организме образуется из
щавелевоуксусной кислоты и ацетилкофермента А:
46. Многоосновные гидроксикислоты
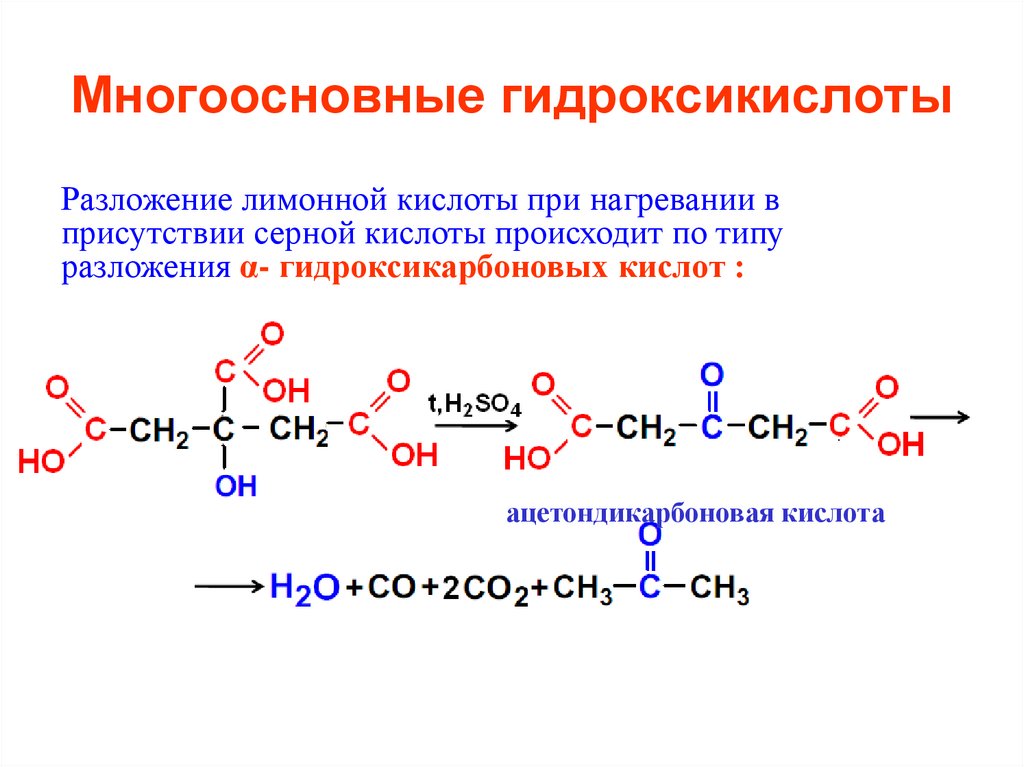
Разложение лимонной кислоты при нагревании вприсутствии серной кислоты происходит по типу
разложения α- гидроксикарбоновых кислот :
ацетондикарбоновая кислота
47. Многоосновные гидроксикислоты
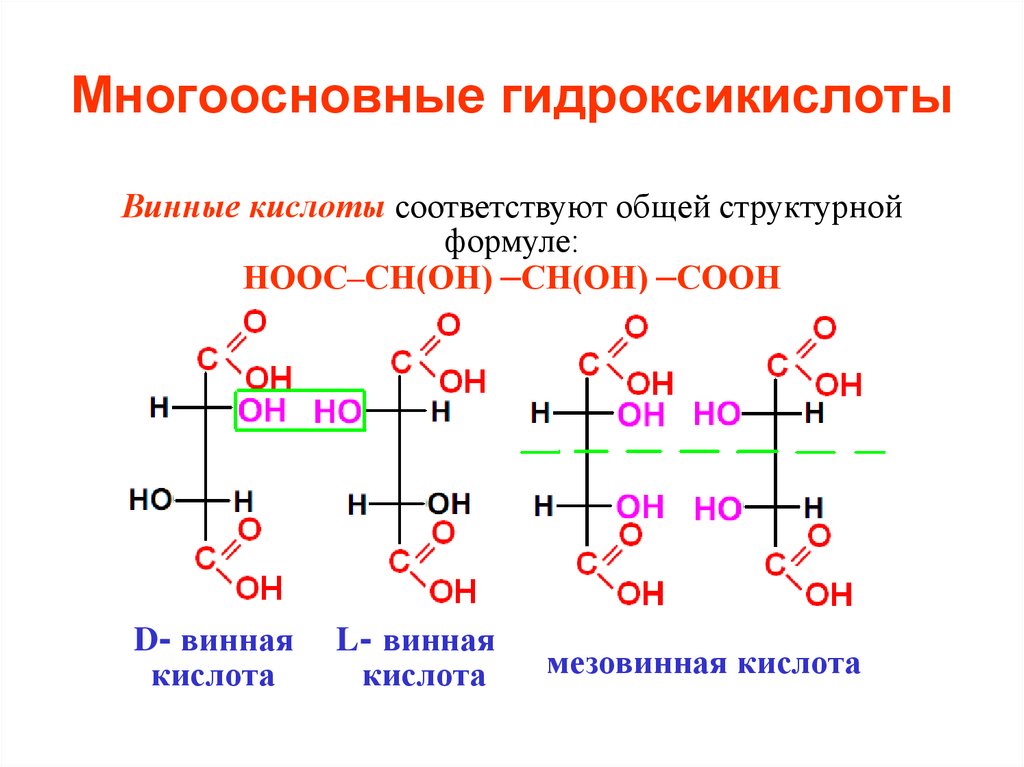
Винные кислоты соответствуют общей структурнойформуле:
НООС–СН(ОН) –СН(ОН) –СООН
D- винная
кислота
L- винная
кислота
мезовинная кислота
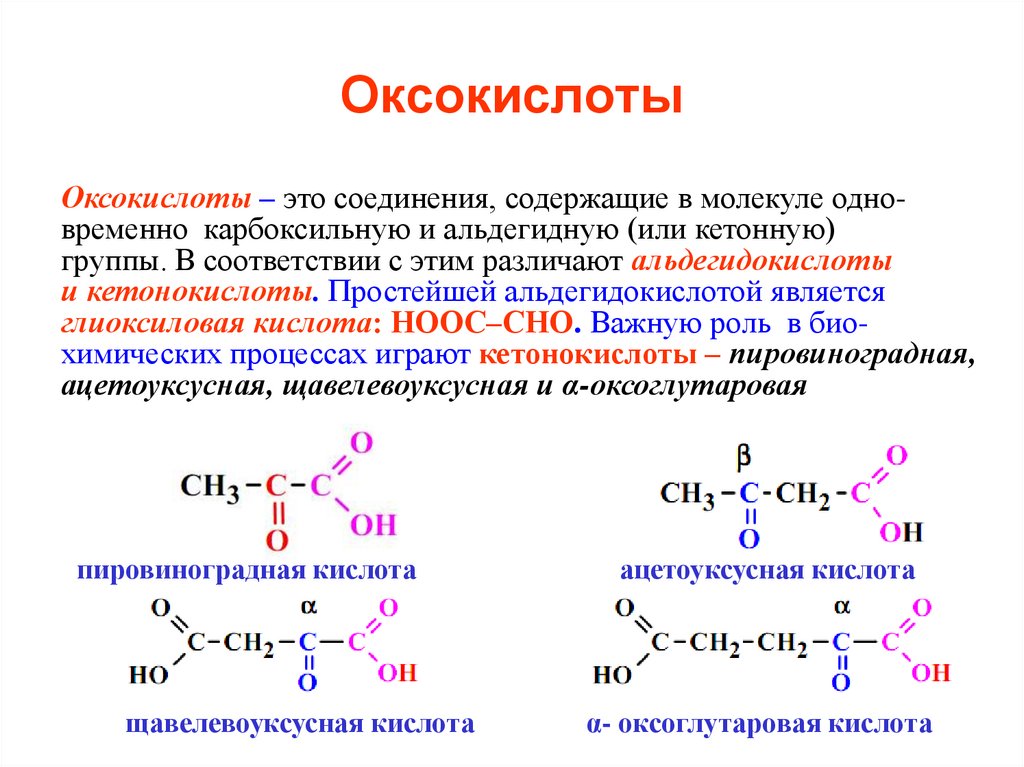
48. Оксокислоты
Оксокислоты – это соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную)группы. В соответствии с этим различают альдегидокислоты
и кетонокислоты. Простейшей альдегидокислотой является
глиоксиловая кислота: НООС–СНО. Важную роль в биохимических процессах играют кетонокислоты – пировиноградная,
ацетоуксусная, щавелевоуксусная и α-оксоглутаровая
пировиноградная кислота
щавелевоуксусная кислота
ацетоуксусная кислота
α- оксоглутаровая кислота
49. Оксокислоты
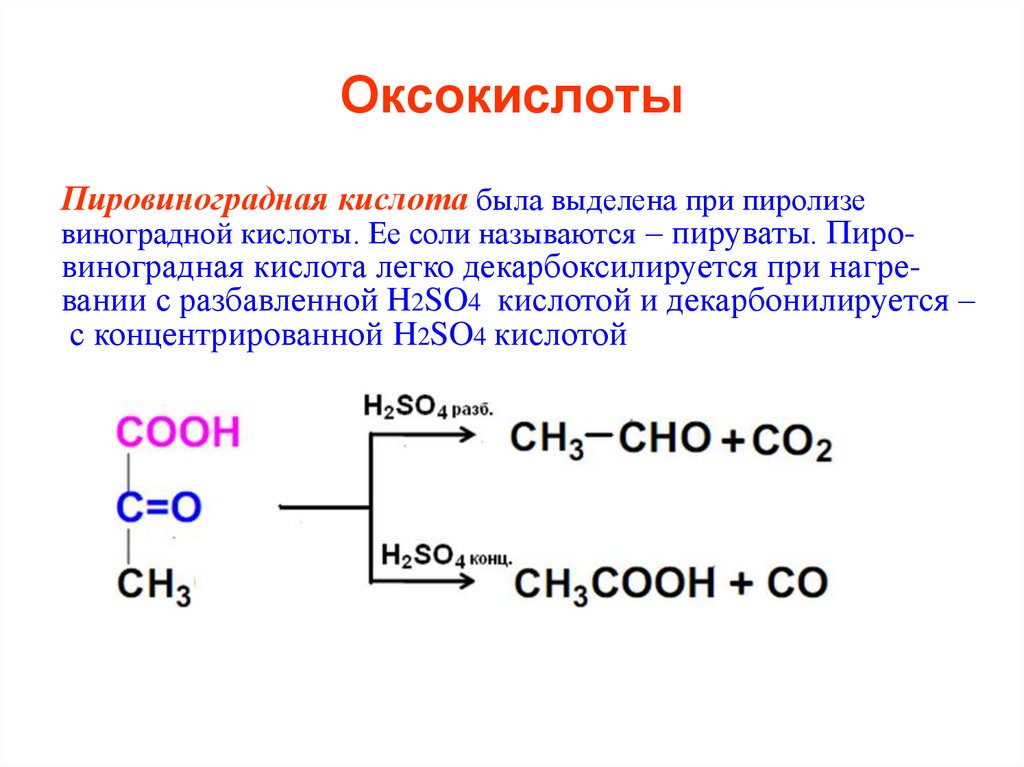
Пировиноградная кислота была выделена при пиролизевиноградной кислоты. Ее соли называются – пируваты. Пировиноградная кислота легко декарбоксилируется при нагревании с разбавленной H2SO4 кислотой и декарбонилируется –
с концентрированной H2SO4 кислотой
50. Оксокислоты
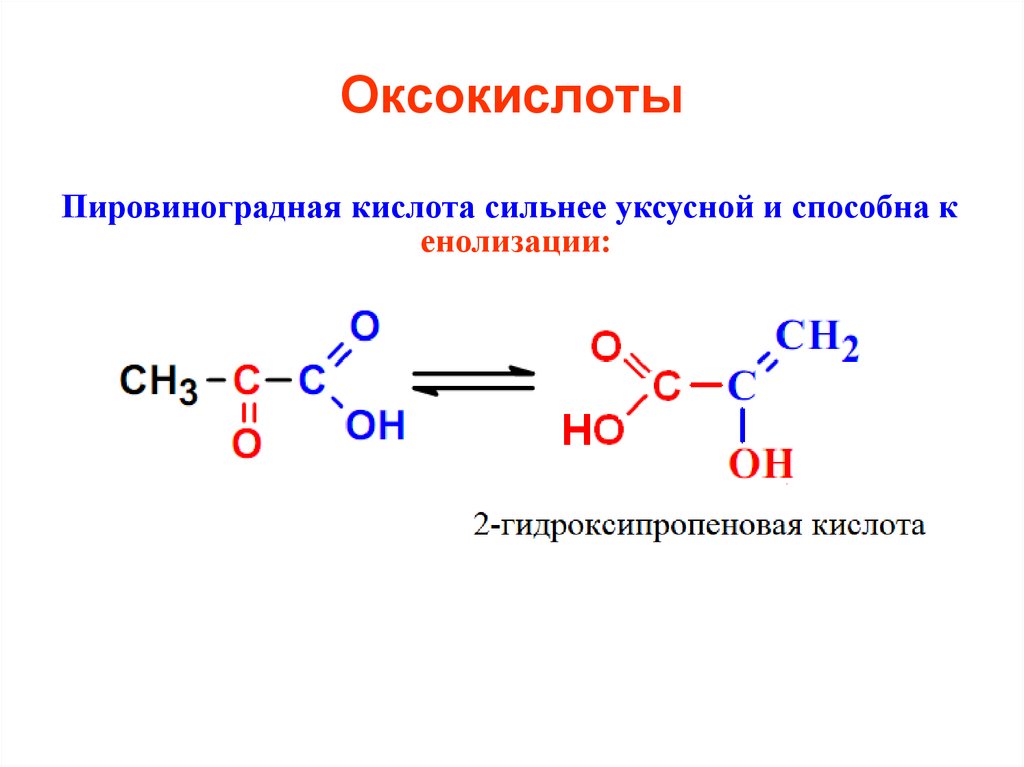
Пировиноградная кислота сильнее уксусной и способна кенолизации:
51. Оксокислоты
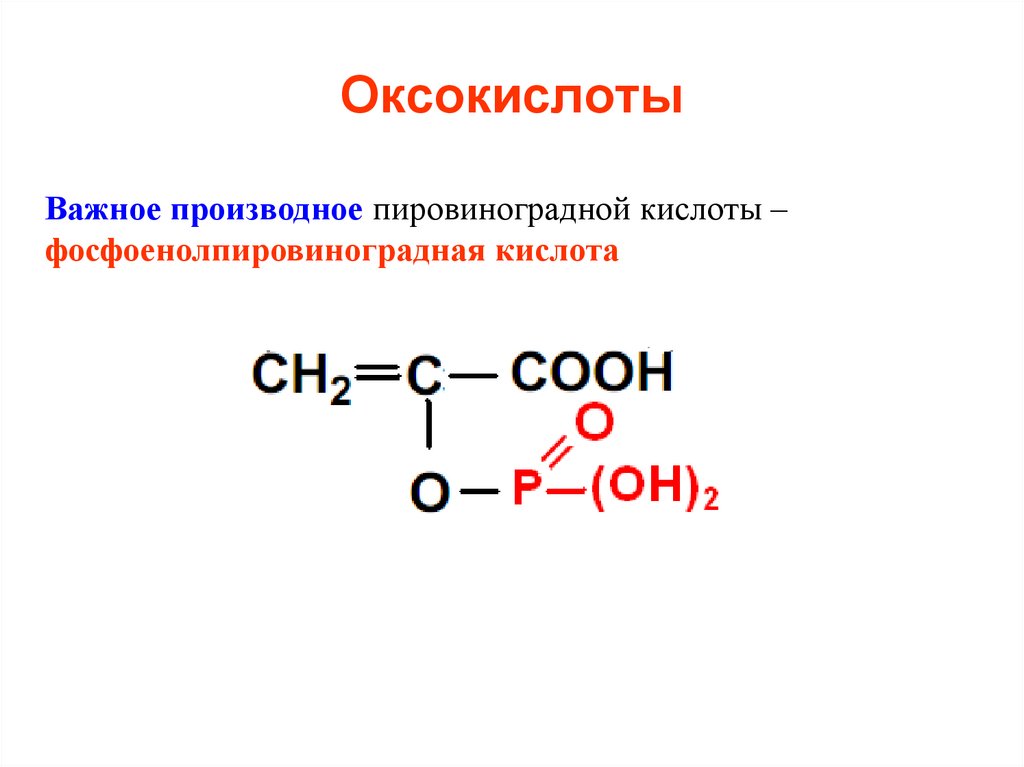
Важное производное пировиноградной кислоты –фосфоенолпировиноградная кислота
52. Оксокислоты
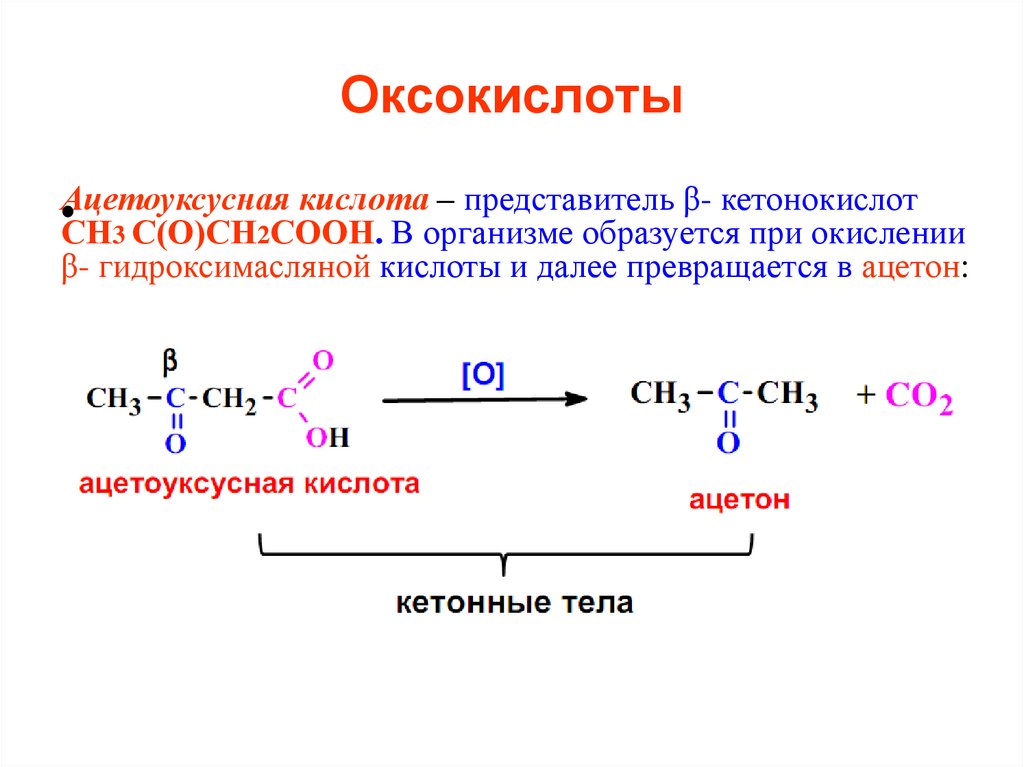
кислота – представитель β- кетонокислот•Ацетоуксусная
СН3 С(О)СН2СООН. В организме образуется при окислении
β- гидроксимасляной кислоты и далее превращается в ацетон:
53. Оксокислоты
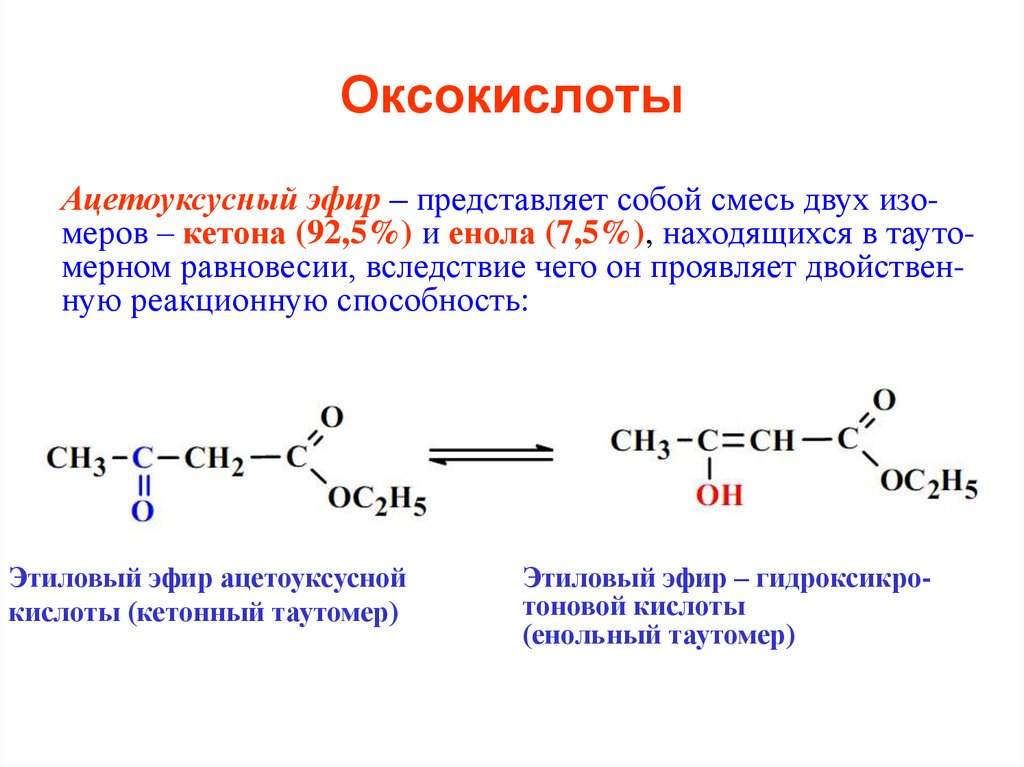
Ацетоуксусный эфир – представляет собой смесь двух изомеров – кетона (92,5%) и енола (7,5%), находящихся в таутомерном равновесии, вследствие чего он проявляет двойственную реакционную способность:Этиловый эфир ацетоуксусной
кислоты (кетонный таутомер)
Этиловый эфир – гидроксикротоновой кислоты
(енольный таутомер)
54. Оксокислоты
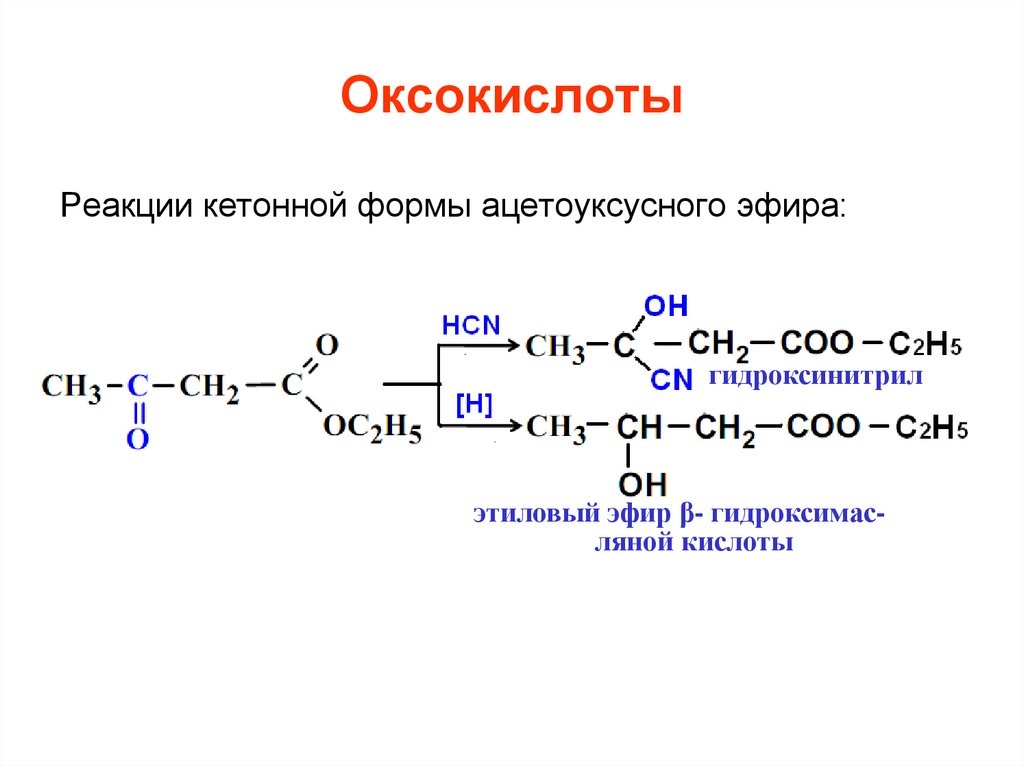
Реакции кетонной формы ацетоуксусного эфира:гидроксинитрил
этиловый эфир β- гидроксимасляной кислоты
55. Оксокислоты
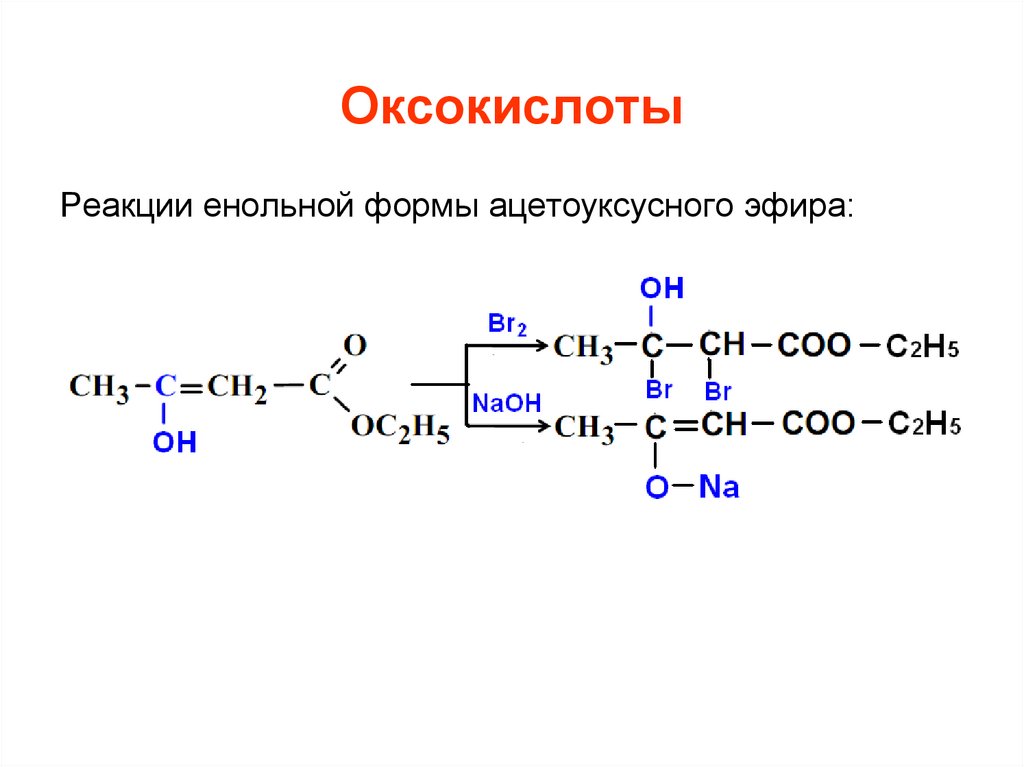
Реакции енольной формы ацетоуксусного эфира:56. Гетерофункциональные производные бензола
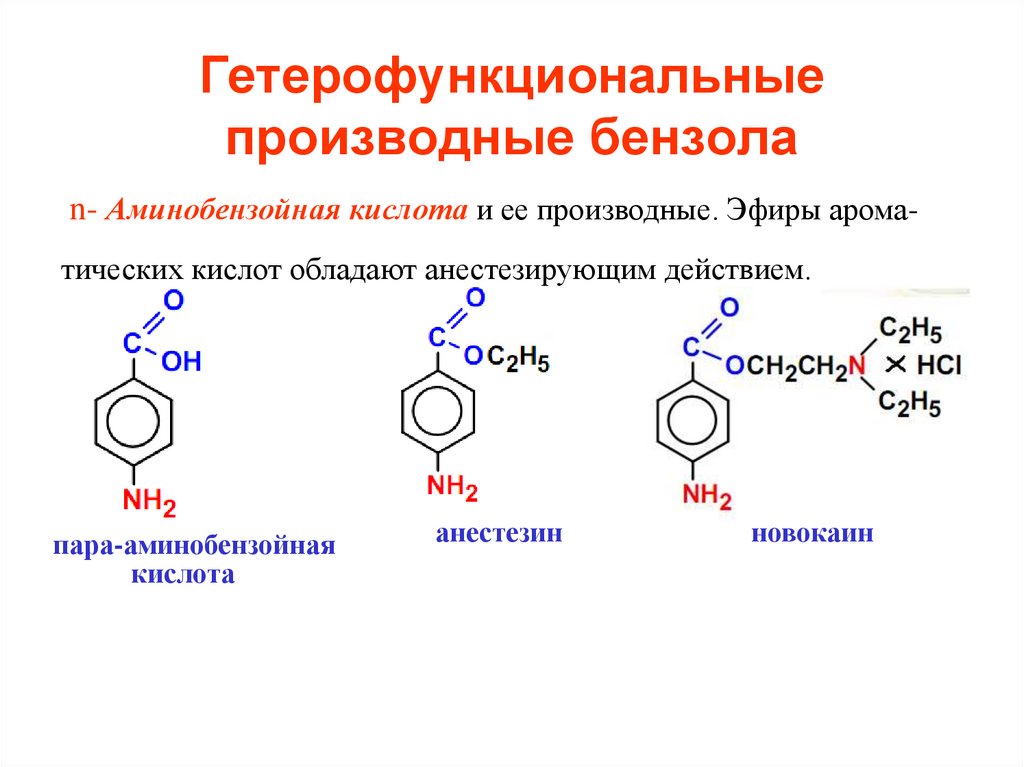
n- Аминобензойная кислота и ее производные. Эфиры ароматических кислот обладают анестезирующим действием.пара-аминобензойная
кислота
анестезин
новокаин
57. Сульфаниловая кислота и ее производные
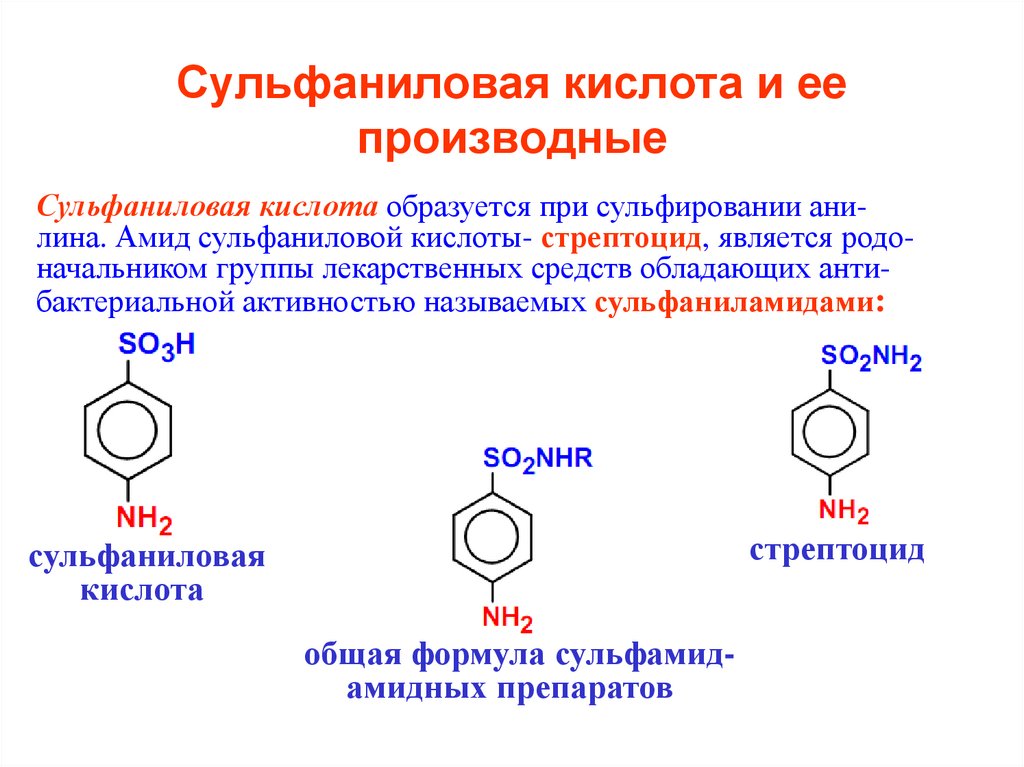
Сульфаниловая кислота образуется при сульфировании анилина. Амид сульфаниловой кислоты- стрептоцид, является родоначальником группы лекарственных средств обладающих антибактериальной активностью называемых сульфаниламидами:стрептоцид
сульфаниловая
кислота
общая формула сульфамидамидных препаратов
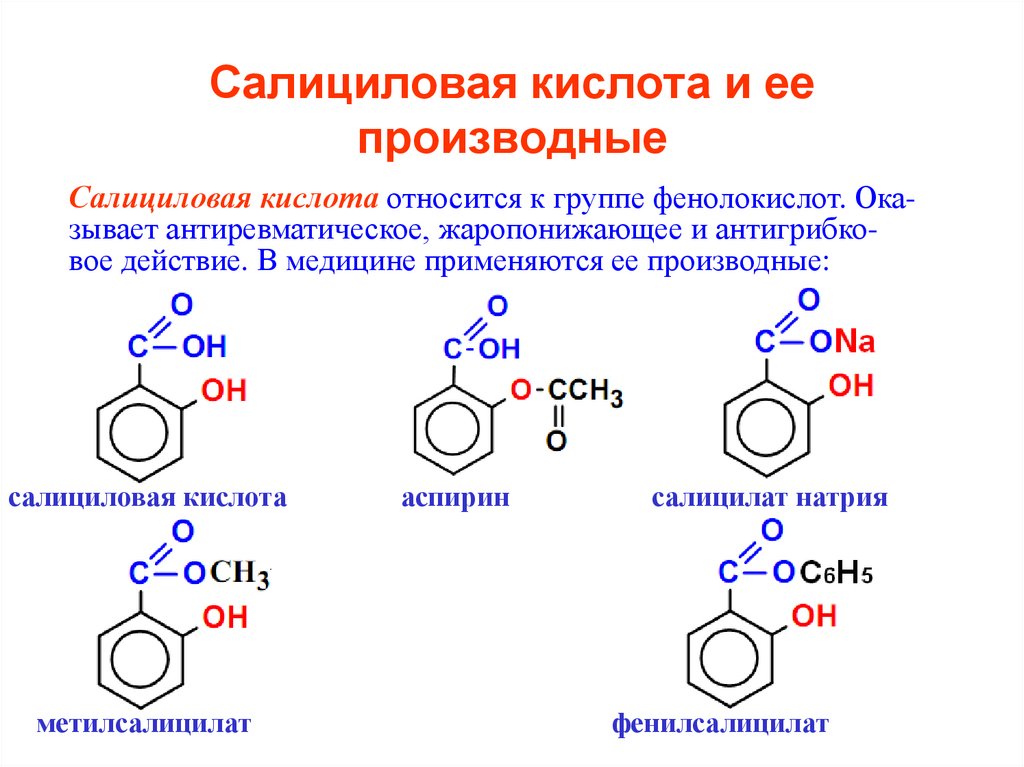
58. Салициловая кислота и ее производные
Салициловая кислота относится к группе фенолокислот. Оказывает антиревматическое, жаропонижающее и антигрибковое действие. В медицине применяются ее производные:салициловая кислота
метилсалицилат
аспирин
салицилат натрия
фенилсалицилат









 Химия
Химия








