Похожие презентации:
Карбоновые кислоты и их гетерофункциональные производные
1. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ : ГИДРОКСИ- И ОКСОКАРБОНОВЫЕ КИСЛОТЫ
2.
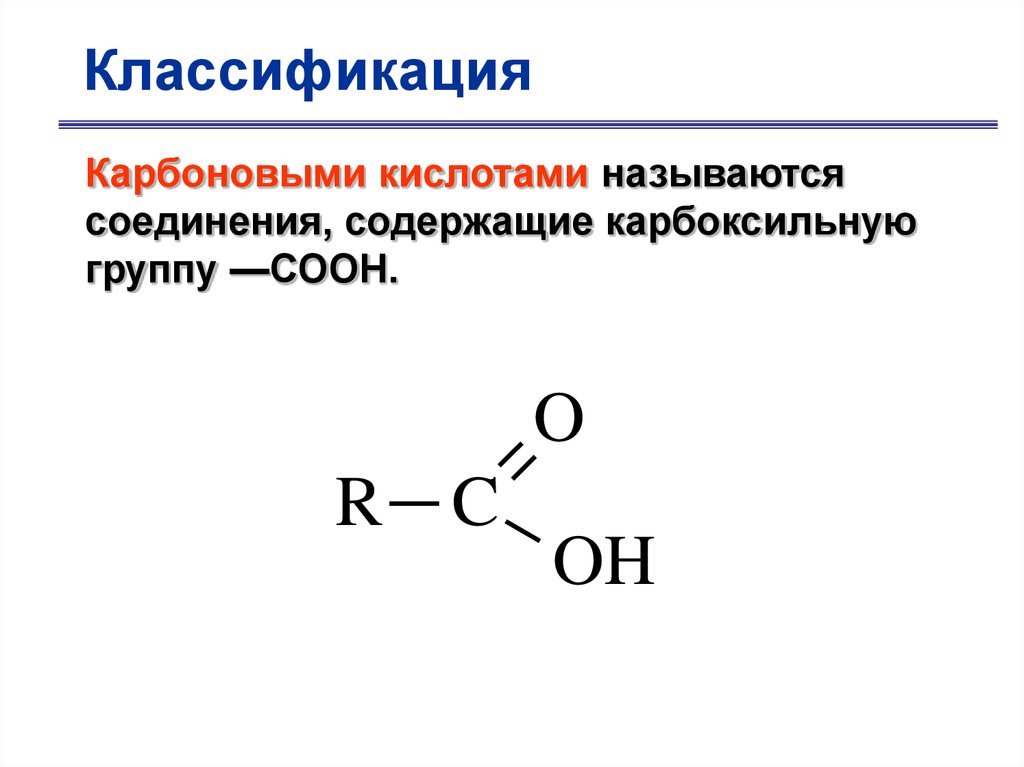
КлассификацияКарбоновыми кислотами называются
соединения, содержащие карбоксильную
группу —СООН.
O
R C
OH
3.
1. По числу карбоксильных групп :моно- , дикарбоновые кислоты и т.д.
2. В зависимости от строения радикала:
- алифатические предельные (ациклические, циклические )
- непредельные (содержат одну или несколько кратных связей)
- ароматические (карбо- и гетероароматические)
3. В связи с присутствием в радикале других функциональных
групп:
- гидроксикарбоновые (содержат одну или несколько
гидроксильных групп)
- оксокарбоновые (содержат карбонильную группуальдегидную или кетоновую)
- аминокислоты (содержат одну или несколько аминогрупп).
4. МОНОКАРБОНОВЫЕ КИСЛОТЫ
5.
ПОВТОРИТЬ!6. ХИМИЧЕСКИЕ СВОЙСТВА
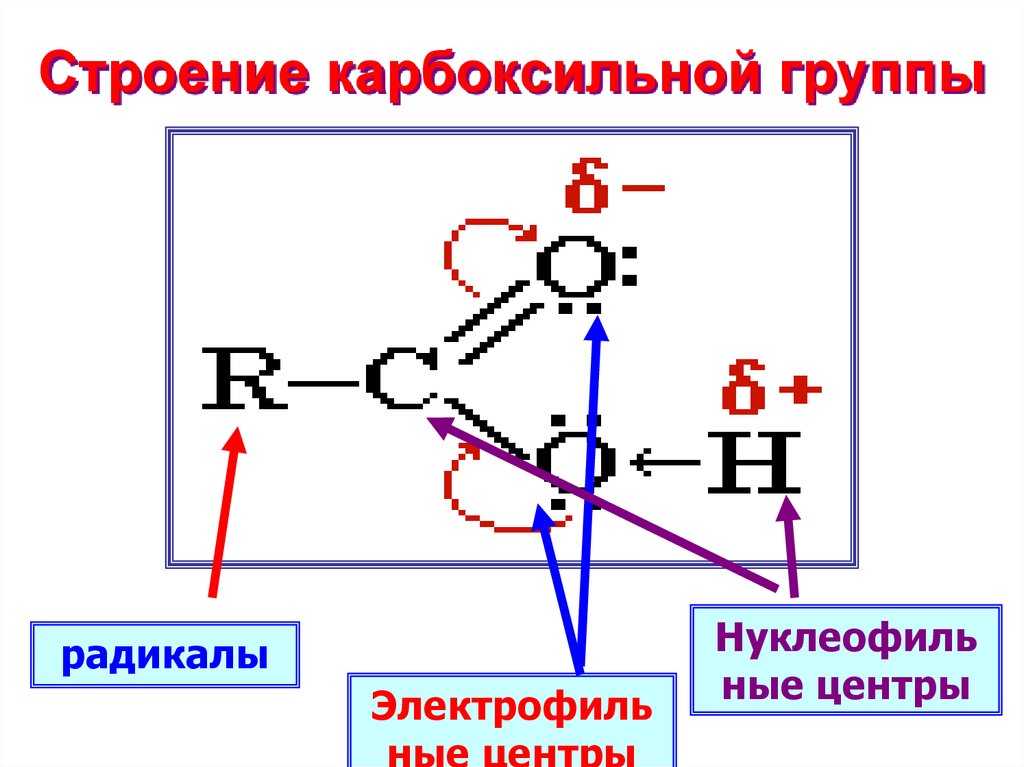
7. Строение карбоксильной группы
радикалыЭлектрофиль
ные центры
Нуклеофиль
ные центры
8.
9.
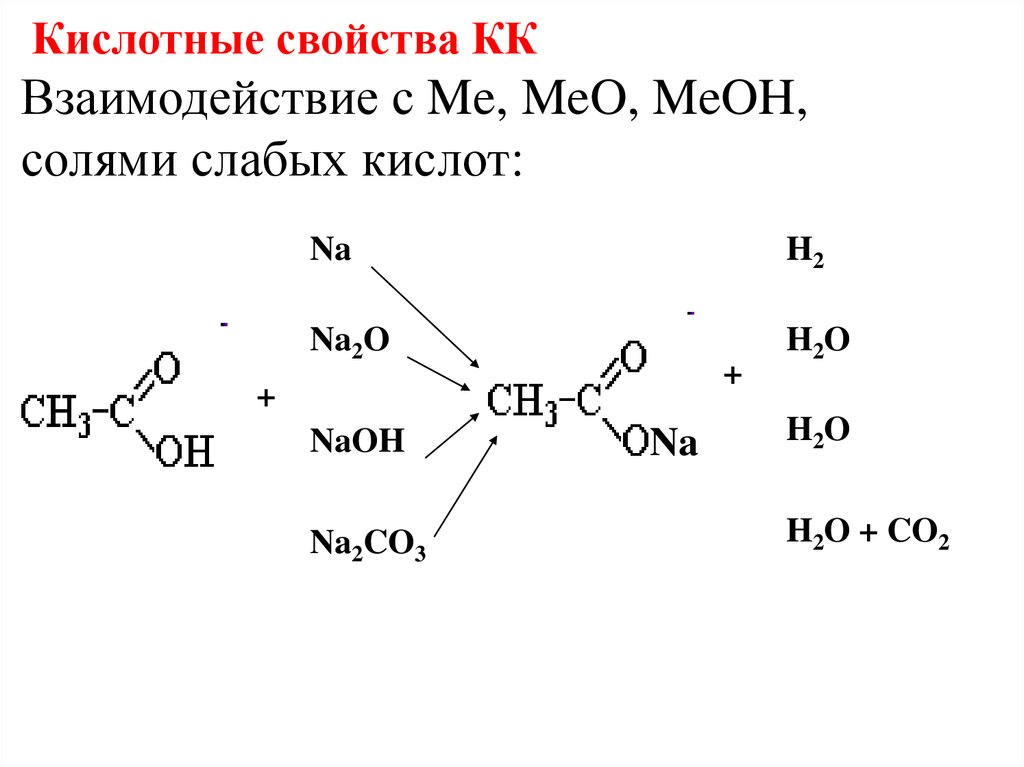
Кислотные свойства ККВзаимодействие с Me, MeO, MeOH,
солями слабых кислот:
Na
H2
Na2O
H2O
+
+
NaOH
Na2CO3
Na
H2O
H2O + CO2
10.
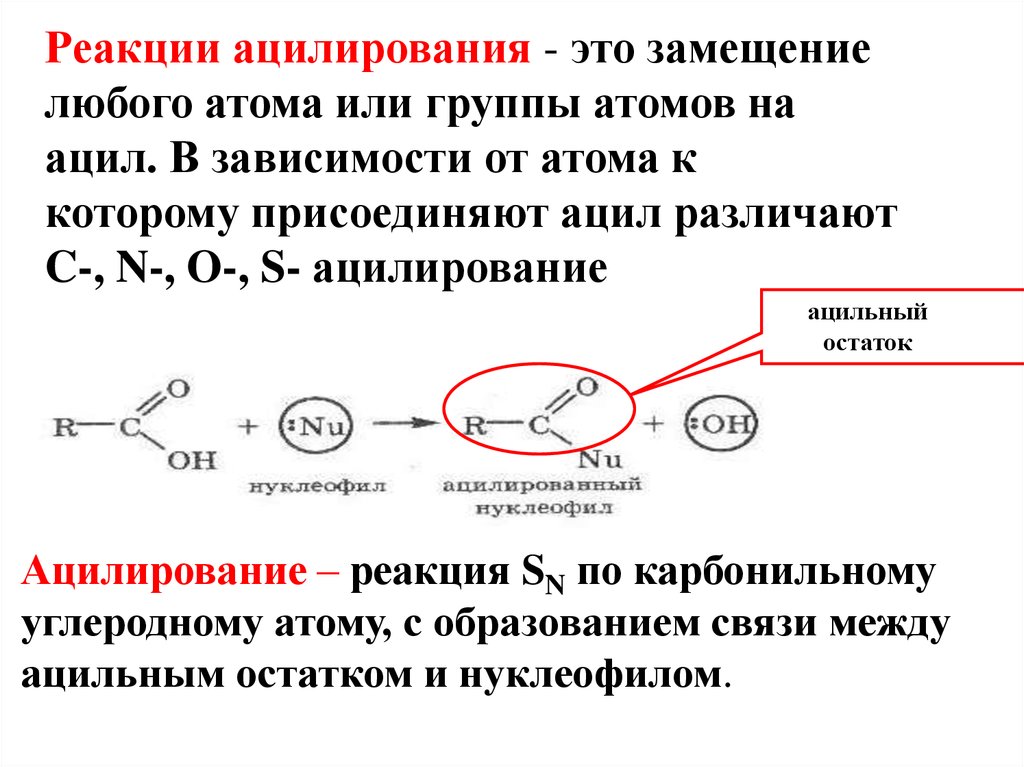
Реакции ацилирования - это замещениелюбого атома или группы атомов на
ацил. В зависимости от атома к
которому присоединяют ацил различают
C-, N-, O-, S- ацилирование
ацильный
остаток
Ацилирование – реакция SN по карбонильному
углеродному атому, с образованием связи между
ацильным остатком и нуклеофилом.
11.
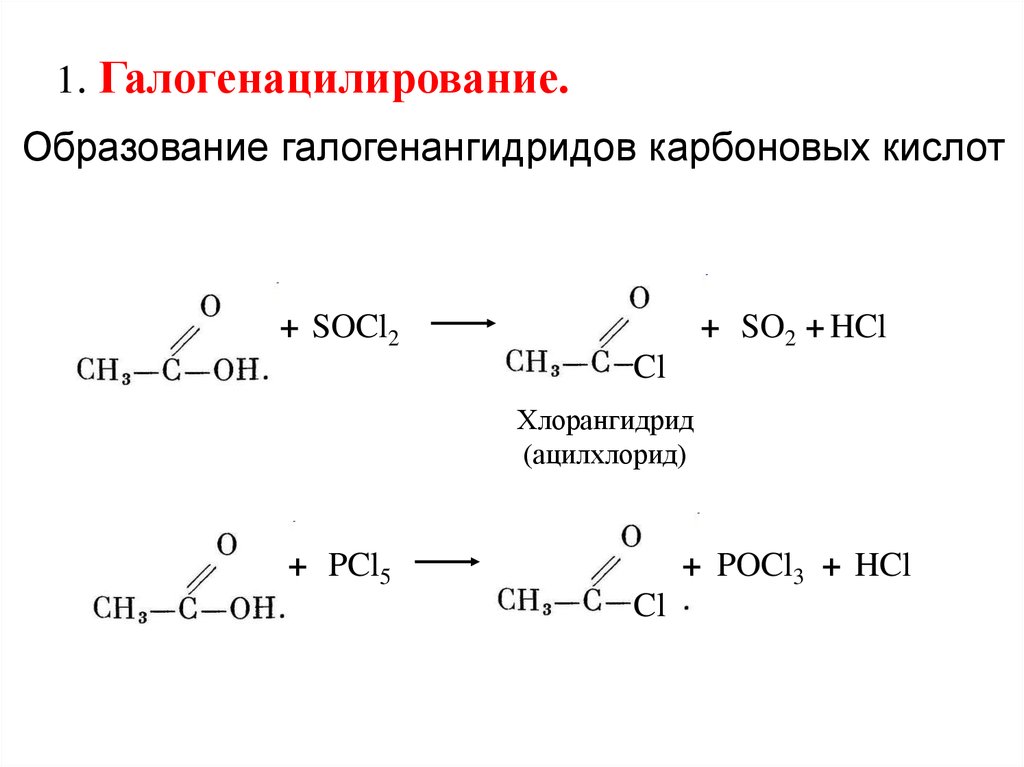
1. Галогенацилирование.Образование галогенангидридов карбоновых кислот
+ SOCl2
+ SO2 + HCl
Cl
Хлорангидрид
(ацилхлорид)
+ PCl5
+ POCl3 + HCl
Cl
12.
2. О-ацилирование карбоновых кислот.Образование ангидридов карбоновых кислот
+
+ HCl
Cl
Уксусный
ангидрид
2
+ P2О5
t
+ 2НPO3
13.
3. О-ацилирование спиртов.Реакция этерификации (образование сложных эфиров)
O
O
C6H5 C
+ C2H5OH
OH
бензойная кислота
C6H5 C
+ H2O
OC2H5
этилбензоат
14.
4. N-ацилирование аминов.Образование амидов карбоновых кислот
(этанамид, амид
уксусной кислоты)
Реакция образования амидов играет большую роль в
организме: за счет этой реакции происходит
обезвреживание токсичного аммиака.
15.
S-Ацилирование тиолов.В метаболизме карбоновых кислот большую роль
играет их способность при участии АТФ
ацилировать кофермент А*(Кофермент А -сложное
соединение, содержащее остаток 2-амино-этантиола
HSCH2CH2NHR, где R включает пантотеновую кислоту
и фосфатное производное аденозина. Кофермент А
кратко записывается НSКоА), который содержит
тиольную группу (—SH), с образованием сложных
тиоэфиров, называемых ацилкоферментами А (ацилКоА или RCOSKoA):
16.
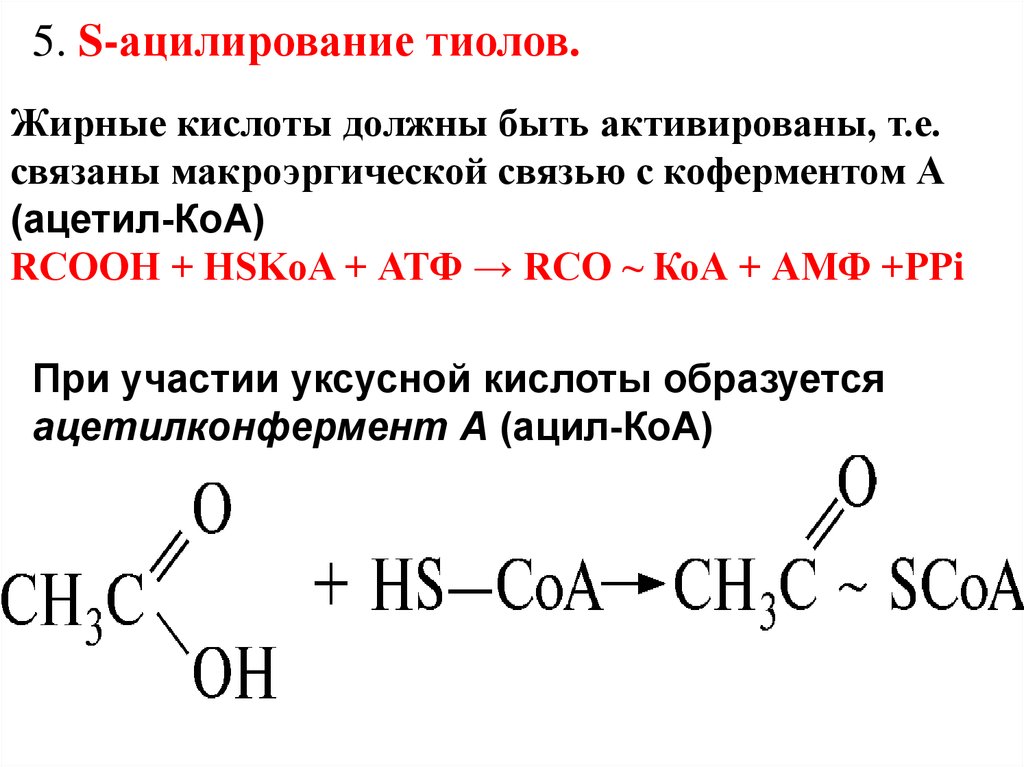
5. S-ацилирование тиолов.Жирные кислоты должны быть активированы, т.е.
связаны макроэргической связью с коферментом А
(ацетил-КоА)
RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ +РРi
При участии уксусной кислоты образуется
ацетилконфермент А (ацил-КоА)
17.
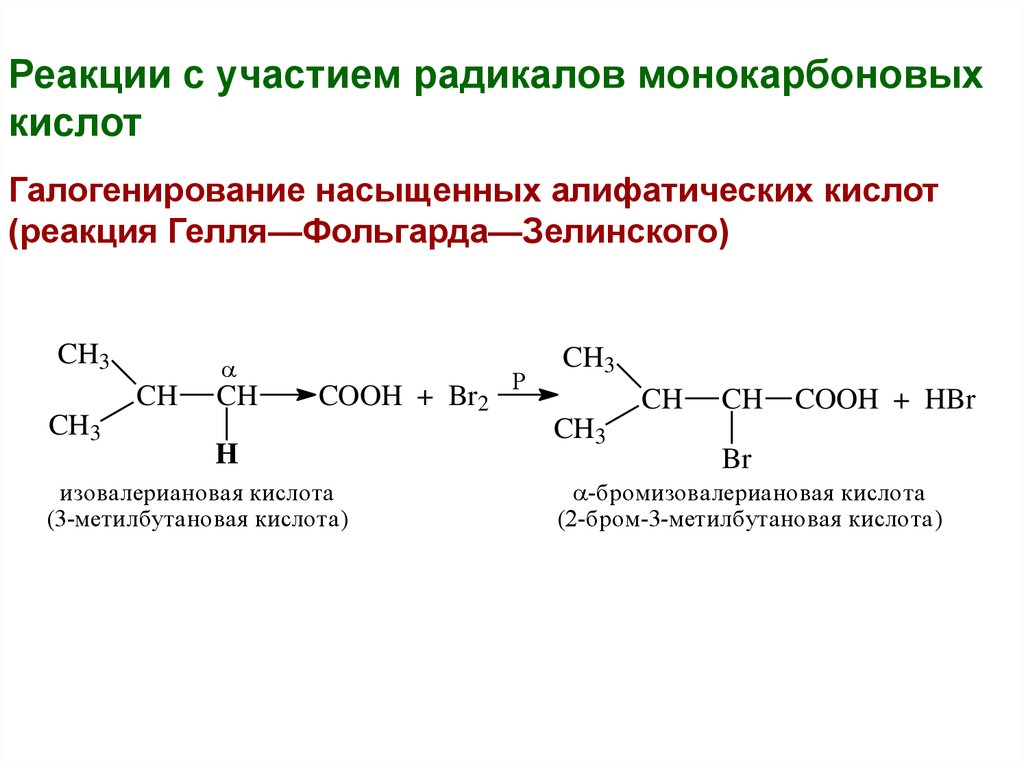
Реакции с участием радикалов монокарбоновыхкислот
Галогенирование насыщенных алифатических кислот
(реакция Гелля—Фольгарда—Зелинского)
CH3
CH
CH3
CH
COOH + Br2
H
изовалериановая кислота
(3-метилбутановая кислота)
P
CH3
CH
CH3
CH
COOH + HBr
Br
-бромизовалериановая кислота
(2-бром-3-метилбутановая кислота)
18. ДИКАРБОНОВЫЕ КИСЛОТЫ
19.
В живом мире наибольшее значение имеют:Диссоциируют ступенчато.
С
и
л
а
у
м
е
н
ь
ш
а
е
т
с
я
Кислотные свойства значительно выше, чем
монокарбоновых, из-за электроноакцепторного влияния
второй –СООН группы.
20.
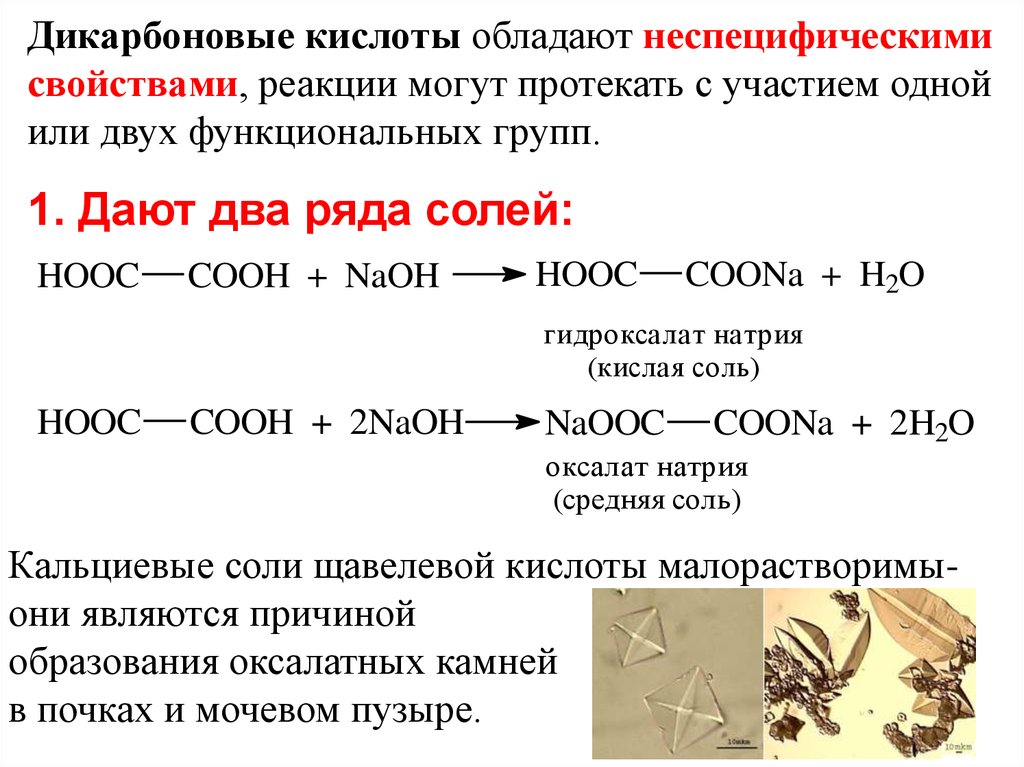
Дикарбоновые кислоты обладают неспецифическимисвойствами, реакции могут протекать с участием одной
или двух функциональных групп.
1. Дают два ряда солей:
HOOC
COOH + NaOH
HOOC
COONa + H2O
гидроксалат натрия
(кислая соль)
HOOC
COOH + 2NaOH
NaOOC
COONa + 2H2O
оксалат натрия
(средняя соль)
Кальциевые соли щавелевой кислоты малорастворимыони являются причиной
образования оксалатных камней
в почках и мочевом пузыре.
21.
2. Образуют функциональные производные –полные и неполные эфиры (амиды):
O
C2H5OH
-H2O
O
C
C
HO
OC2H5
этилгидроксалат
HOOC
COOH
O
2C2H5OH
-2H2O
O
C
C2H5O
C
OC2H5
диэтилгидроксалат
22.
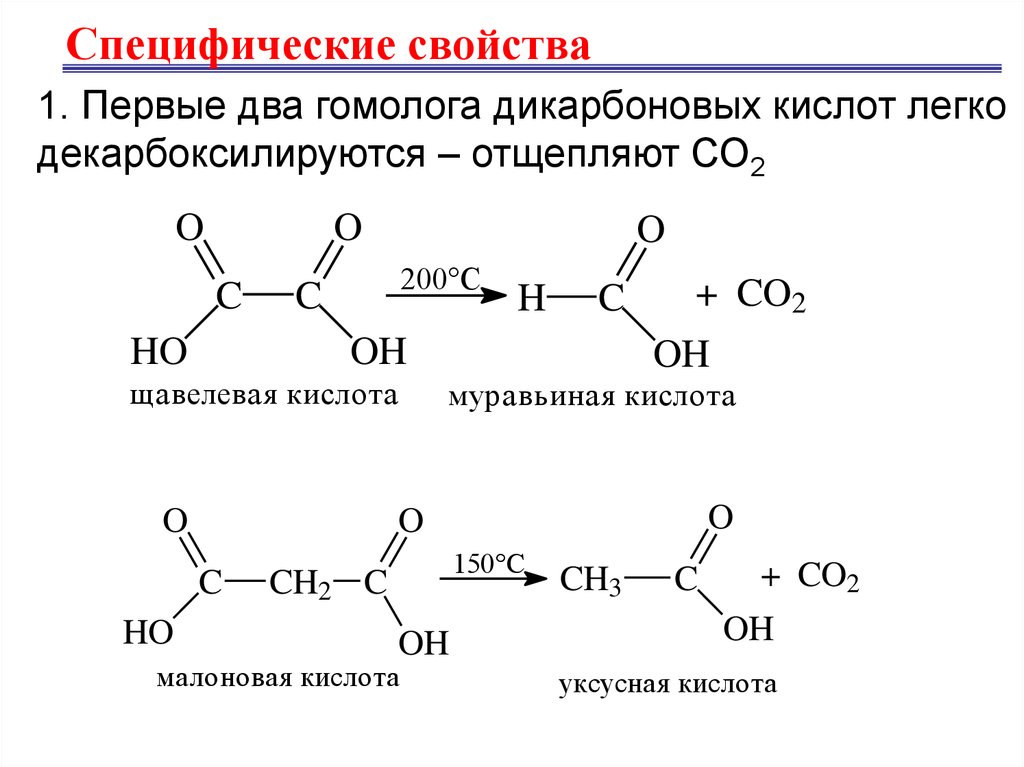
Специфические свойства1. Первые два гомолога дикарбоновых кислот легко
декарбоксилируются – отщепляют СО2
O
O
C
HO
O
200°С
C
C
OH
щавелевая кислота
O
+ CO2
OH
муравьиная кислота
O
O
C
HO
H
150°С
CH2 C
OH
малоновая кислота
CH3
C
+ CO2
OH
уксусная кислота
23.
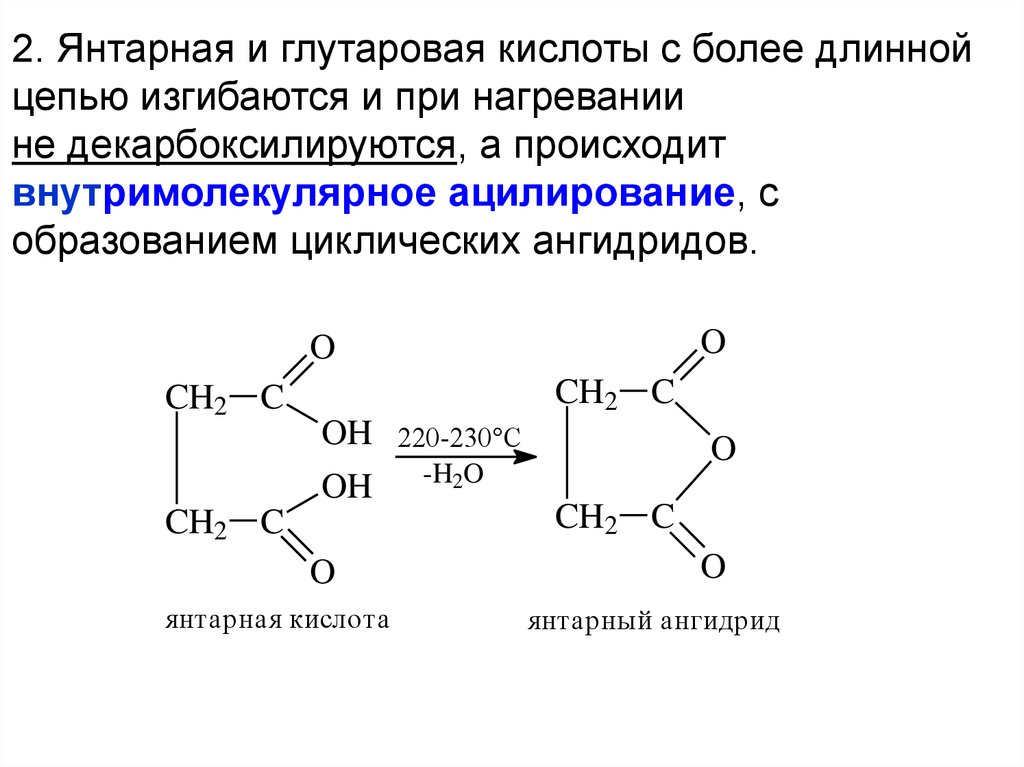
2. Янтарная и глутаровая кислоты с более длиннойцепью изгибаются и при нагревании
не декарбоксилируются, а происходит
внутримолекулярное ацилирование, с
образованием циклических ангидридов.
O
O
CH2 C
CH2 C
OH
OH
CH2 C
O
янтарная кислота
220-230°C
-H2O
O
CH2 C
O
янтарный ангидрид
24.
3. Дикарбоновые кислоты являются бидентатнымилигандами и легко образуют прочные хелатные
комплексы:
25.
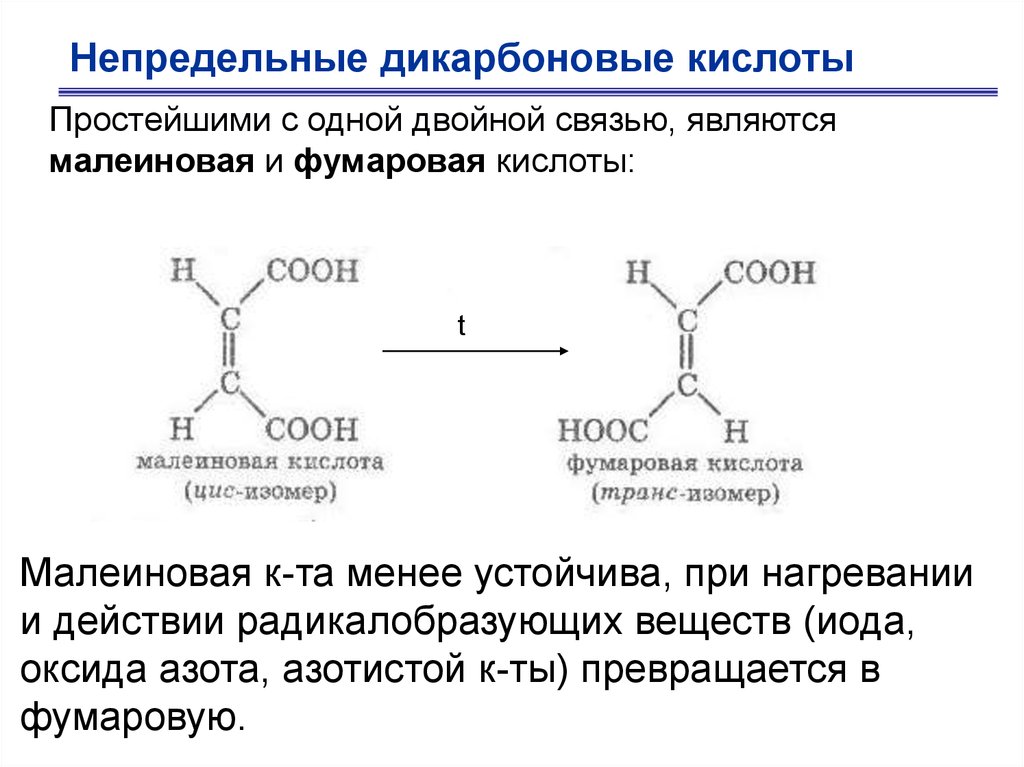
Непредельные дикарбоновые кислотыПростейшими с одной двойной связью, являются
малеиновая и фумаровая кислоты:
t
Малеиновая к-та менее устойчива, при нагревании
и действии радикалобразующих веществ (иода,
оксида азота, азотистой к-ты) превращается в
фумаровую.
26.
По химическим свойствам отличаются от предельныхспособностью присоединять галогены,
галогенводороды, водород и т.д.
Только малеиновая кислота способна давать
циклический ангидрид (вследствие близкого
расположения -СООН).
27. ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ
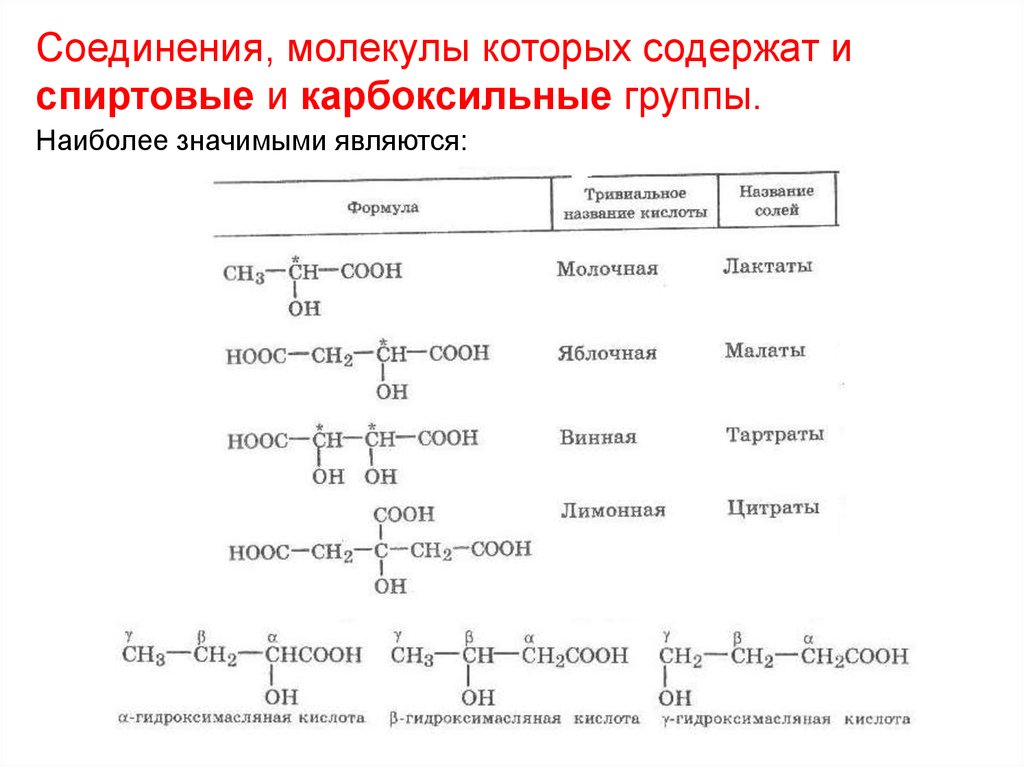
28.
Соединения, молекулы которых содержат испиртовые и карбоксильные группы.
Наиболее значимыми являются:
29.
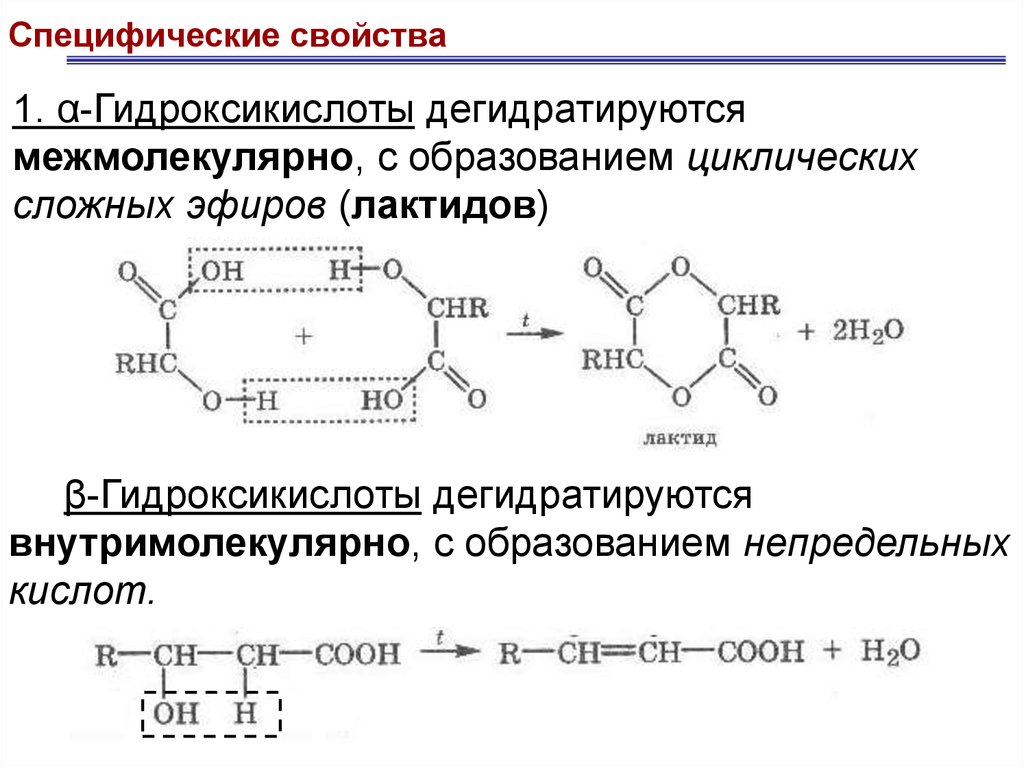
Специфические свойства1. α-Гидроксикислоты дегидратируются
межмолекулярно, с образованием циклических
сложных эфиров (лактидов)
β-Гидроксикислоты дегидратируются
внутримолекулярно, с образованием непредельных
кислот.
30.
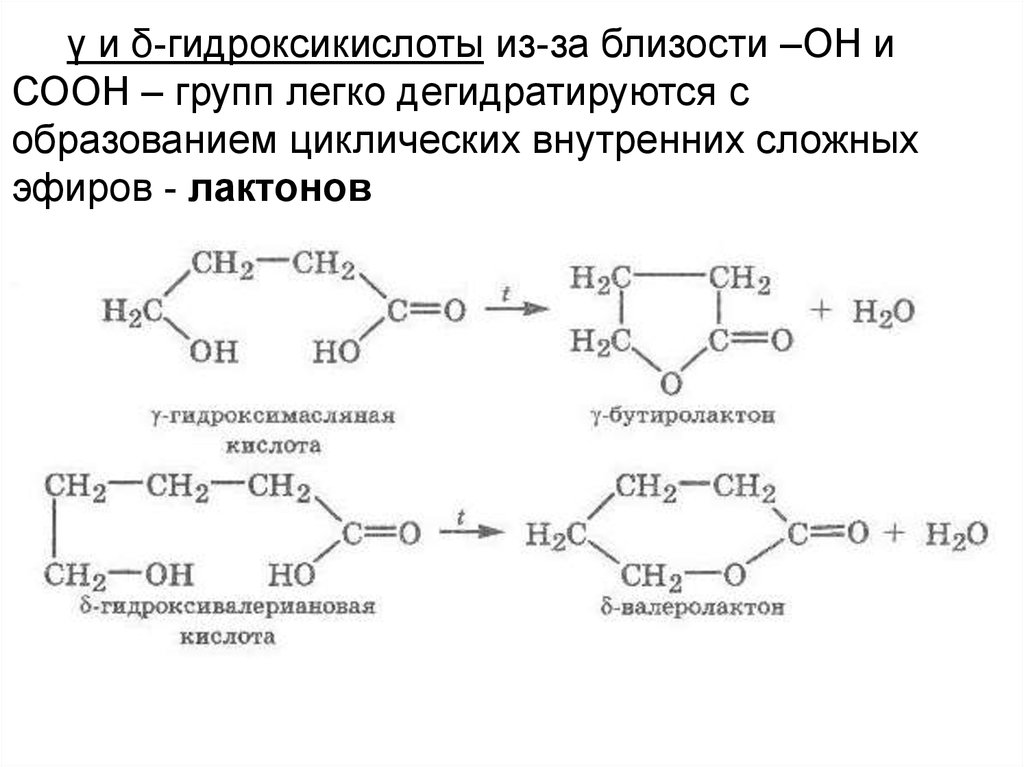
γ и δ-гидроксикислоты из-за близости –ОН иСООН – групп легко дегидратируются с
образованием циклических внутренних сложных
эфиров - лактонов
31.
2. Внутримолекулярная Ox/Red дисмутация αгидроксикислот приводит к образованиюмуравьиной к-ты и альдегида или кетона:
Лимонная к-та
32.
АРОМАТИЧЕСКИЕи
ГЕТЕРОАРОМАТИЧЕСКИЕ
карбоновые кислоты
33.
Бензойная кислотаПрименяют при кожных заболеваниях, как
наружное антисептическое
(противомикробное) и фунгицидное
(противогрибковое) средства, а её натриевую
соль — как отхаркивающее средство.
34.
Обезвреживание бензойной кислотыглицинтрансфераза
По скорости образования и выделения
гиппуровой кислоты с мочой после приема бензойной
кислоты судят о функции печени и ее роли в
обезвреживании токсичных продуктов.
35.
n-аминобензойная кислота(витамин В10)
- участвует: в усвоении белка, в выработке
красных кровяных телец;
- активизирует: кишечную микрофлору,
синтез интерферона;
- повышает эффективность витамина С;
- препятствует образованию тромбов;
- антиоксидант и др.
36.
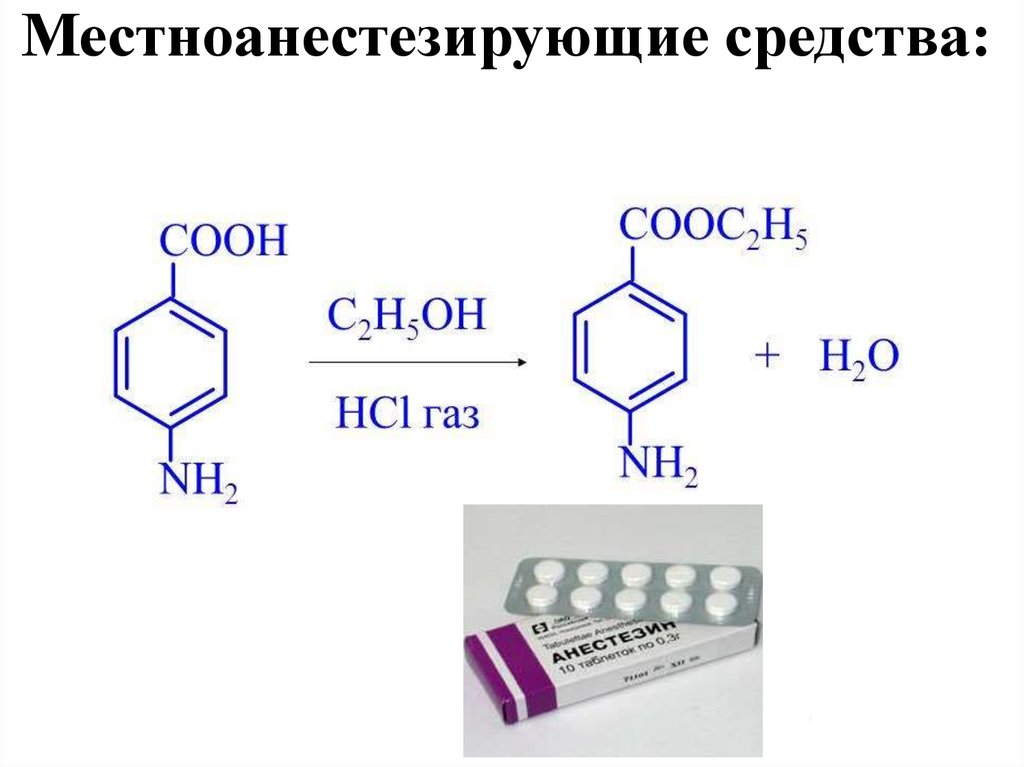
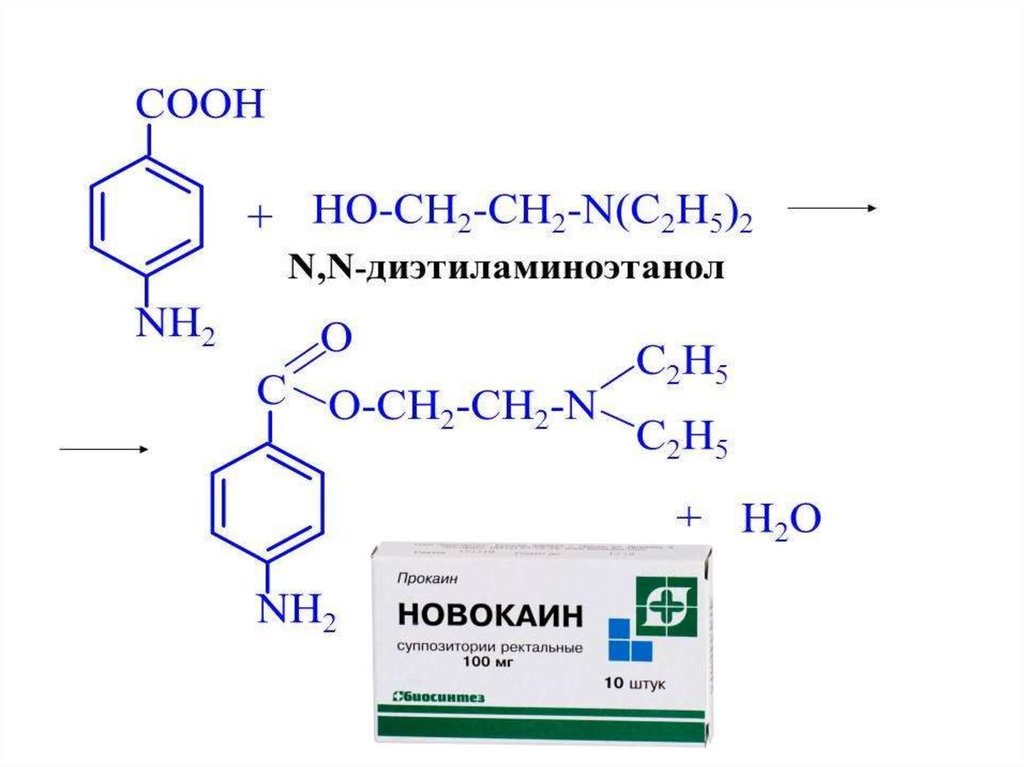
Местноанестезирующие средства:АНЕСТЕЗИН
37.
38.
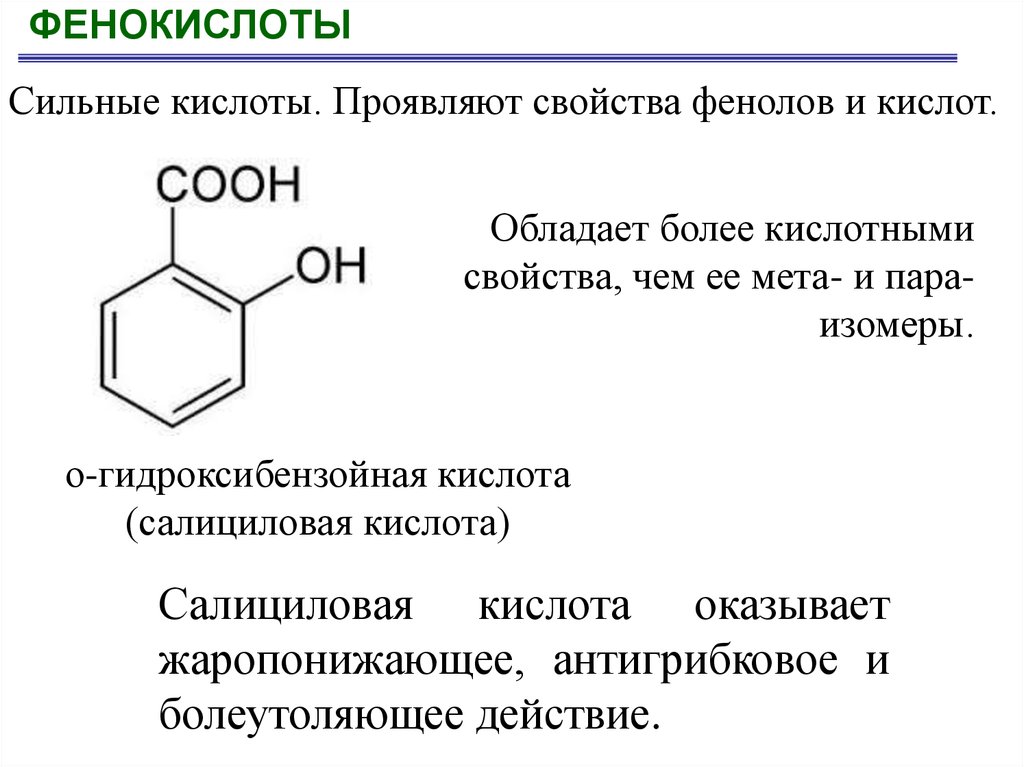
ФЕНОКИСЛОТЫСильные кислоты. Проявляют свойства фенолов и кислот.
Обладает более кислотными
свойства, чем ее мета- и параизомеры.
о-гидроксибензойная кислота
(салициловая кислота)
Салициловая кислота оказывает
жаропонижающее, антигрибковое и
болеутоляющее действие.
39.
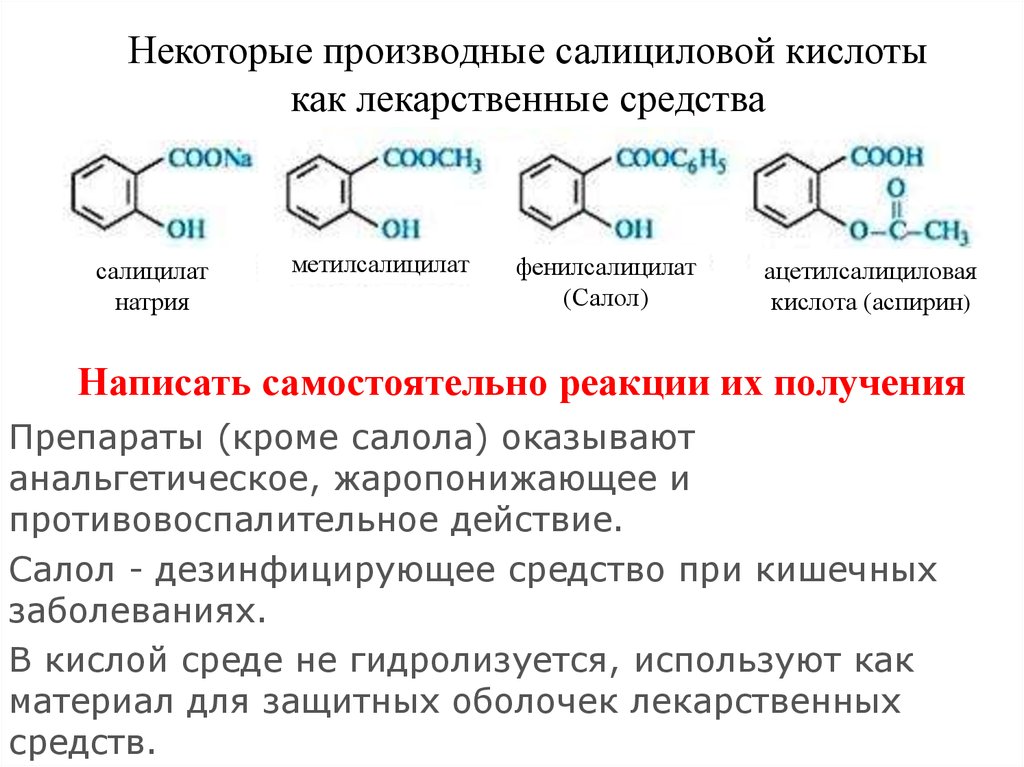
Некоторые производные салициловой кислотыкак лекарственные средства
салицилат
натрия
метилсалицилат
фенилсалицилат
(Салол)
ацетилсалициловая
кислота (аспирин)
Написать самостоятельно реакции их получения
Препараты (кроме салола) оказывают
анальгетическое, жаропонижающее и
противовоспалительное действие.
Салол - дезинфицирующее средство при кишечных
заболеваниях.
В кислой среде не гидролизуется, используют как
материал для защитных оболочек лекарственных
средств.
40.
Никотиновая кислота(витамин РР, витамин В3)
Никотинамид
В организме никотиновая кислота превращается
в никотинамид, который связывается с
коферментами НАД и НАДФ, переносящими
водород, участвует в метаболизме белков, жиров,
аминокислот, пуринов, тканевом дыхании.
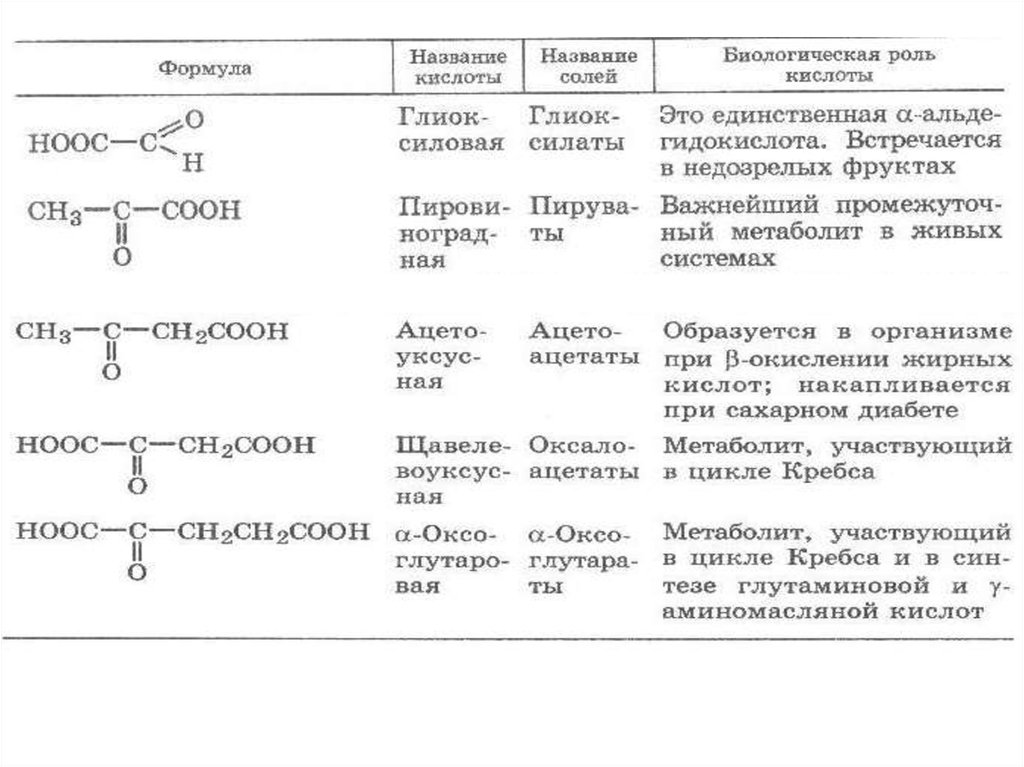
41. ОКСОКАРБОНОВЫЕ КИСЛОТЫ
42.
43.
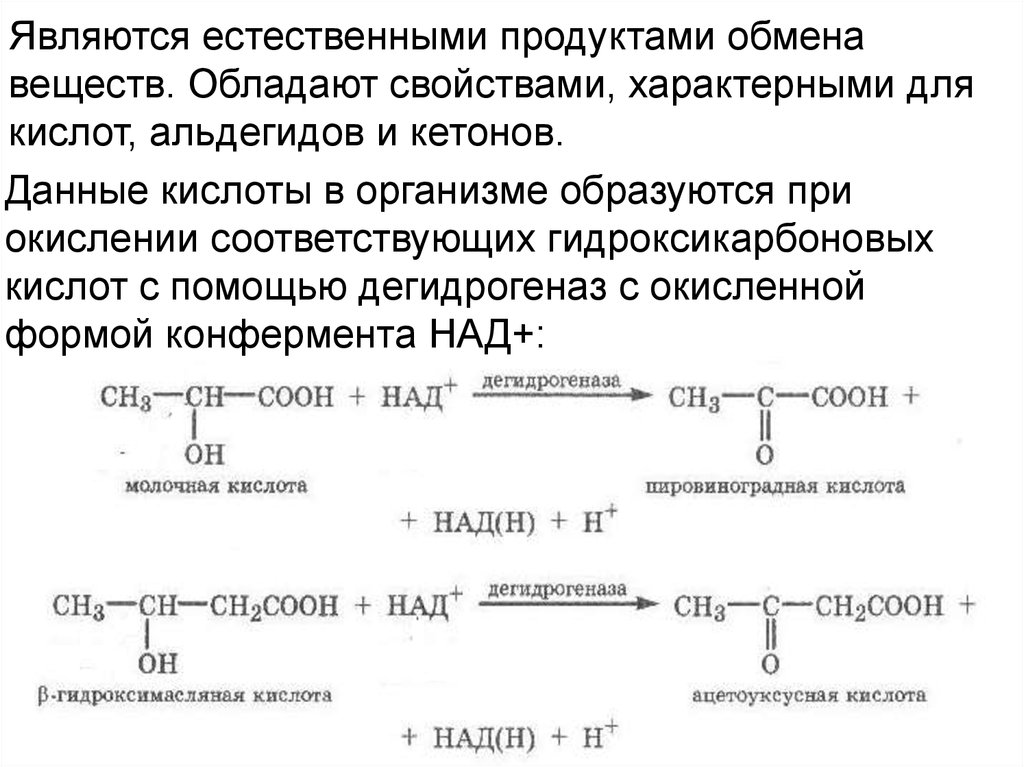
Являются естественными продуктами обменавеществ. Обладают свойствами, характерными для
кислот, альдегидов и кетонов.
Данные кислоты в организме образуются при
окислении соответствующих гидроксикарбоновых
кислот с помощью дегидрогеназ с окисленной
формой конфермента НАД+:
44.
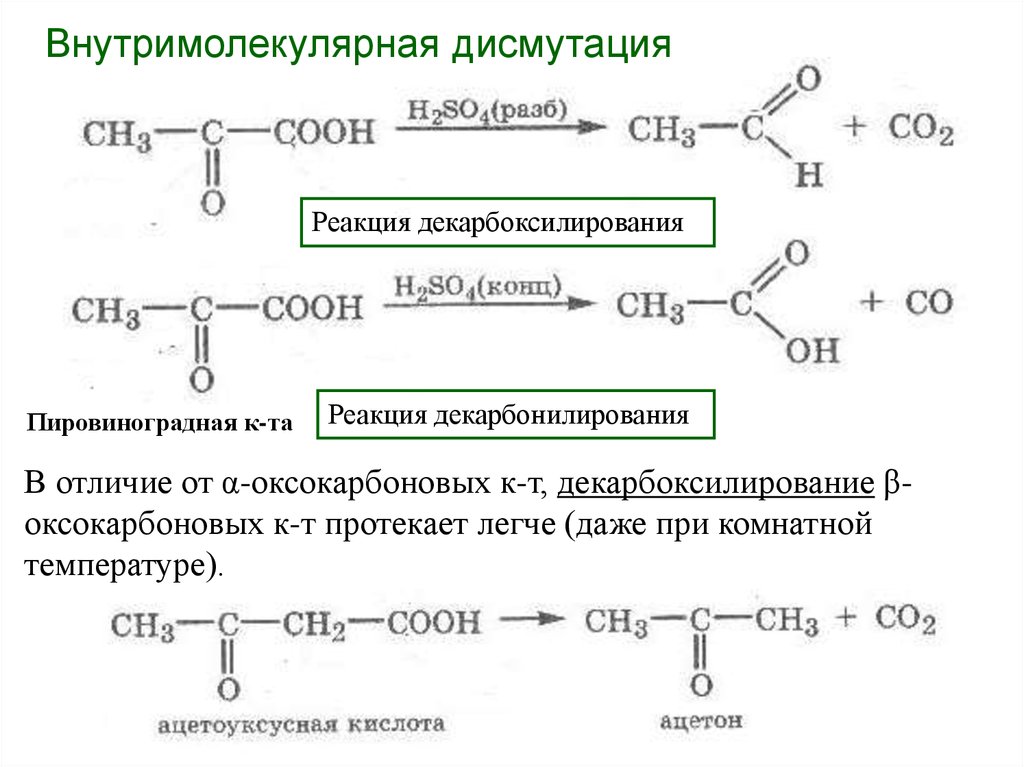
Внутримолекулярная дисмутацияРеакция декарбоксилирования
Пировиноградная к-та
Реакция декарбонилирования
В отличие от α-оксокарбоновых к-т, декарбоксилирование βоксокарбоновых к-т протекает легче (даже при комнатной
температуре).
45.
ОКСОКИСЛОТЫ. РЕАКЦИОННАЯ СПОСОБНОСТЬ.Пировиноградная кислота является одним из промежуточных продуктов
молочнокислого и спиртового брожения углеводов, ее соли называют
пируватами.
ПВК легко декарбоксилируется при нагревании с разбавленной Н2SO4
O
CH3 — C — COOH
CH3 — C
t , H SO
-CO
H
2
4
2
O
ацетальдегид
пировиноградная
кислота
In vivo эта реакция протекает в присутствии фермента
декарбоксилазы и соответствующего кофермента. Образующийся
“активный ацетальдегид” далее окисляется в в ацетилкофермент А.
CH3 — C — COOH декарбоксилаза
O
-CO2
CH3 — C
O НАД+, HSСоА
H
-НАДН Н+
CH3 — C
O
SСoA
ацетилкофермент А
46.
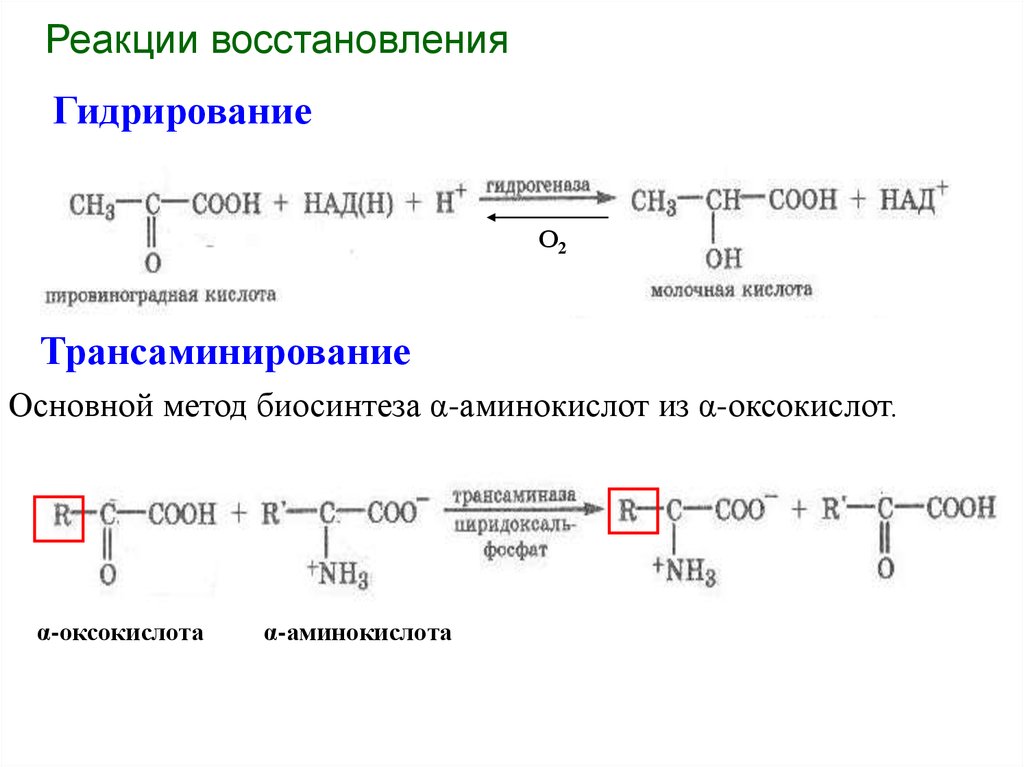
Реакции восстановленияГидрирование
О2
Трансаминирование
Основной метод биосинтеза α-аминокислот из α-оксокислот.
α-оксокислота
α-аминокислота
47.
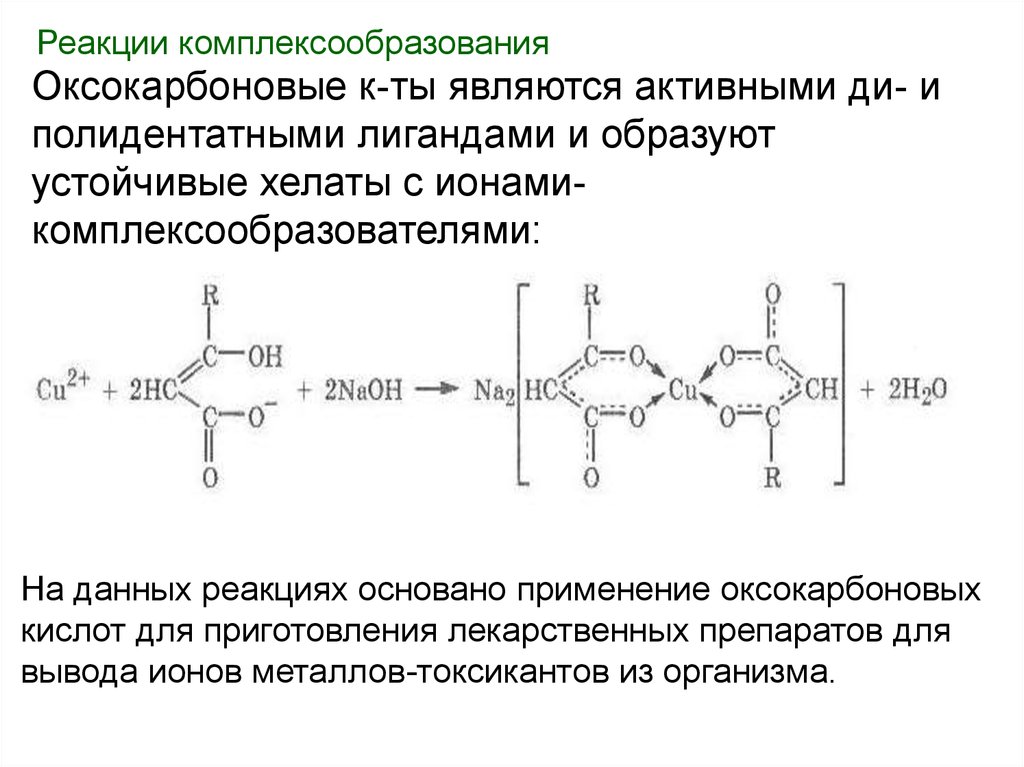
Реакции комплексообразованияОксокарбоновые к-ты являются активными ди- и
полидентатными лигандами и образуют
устойчивые хелаты с ионамикомплексообразователями:
На данных реакциях основано применение оксокарбоновых
кислот для приготовления лекарственных препаратов для
вывода ионов металлов-токсикантов из организма.
48.
«КЕТОНОВЫЕ» ТЕЛА.«Кетоновые» или «ацетоновые» образуются in vivo в процессе
метаболизма высших жирных кислот. Процесс образования кетоновых тел
активируется при сахарном диабете и голодании.
кетоновые тела
CH3 — CH — CH2 — COOH
OH
-гидроксимасляная
кислота
[O]
CH 3 — C — CH 2 — COOH
O
ацетоуксусная
кислота
-CO2
CH 3 — C — CH 3
O
ацетон
49.
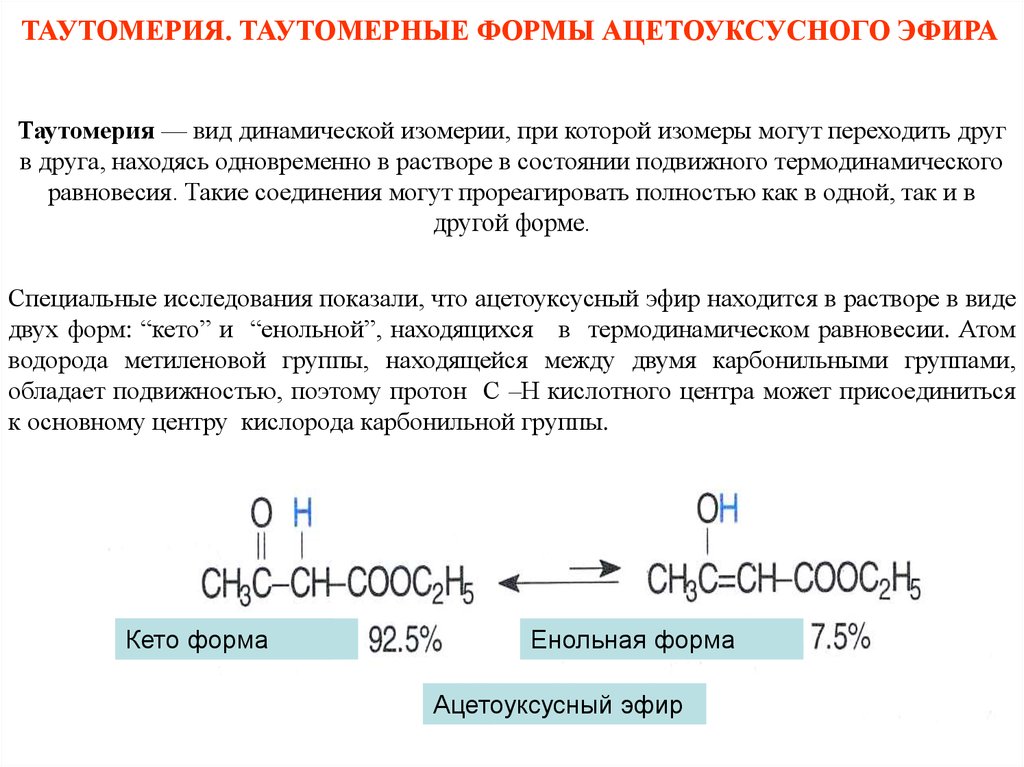
ТАУТОМЕРИЯ. ТАУТОМЕРНЫЕ ФОРМЫ АЦЕТОУКСУСНОГО ЭФИРАТаутомерия — вид динамической изомерии, при которой изомеры могут переходить друг
в друга, находясь одновременно в растворе в состоянии подвижного термодинамического
равновесия. Такие соединения могут прореагировать полностью как в одной, так и в
другой форме.
Специальные исследования показали, что ацетоуксусный эфир находится в растворе в виде
двух форм: “кето” и “енольной”, находящихся в термодинамическом равновесии. Атом
водорода метиленовой группы, находящейся между двумя карбонильными группами,
обладает подвижностью, поэтому протон С –Н кислотного центра может присоединиться
к основному центру кислорода карбонильной группы.
КЕТОформа
Кето
форма
Енольная форма
Ацетоуксусный эфир
50.
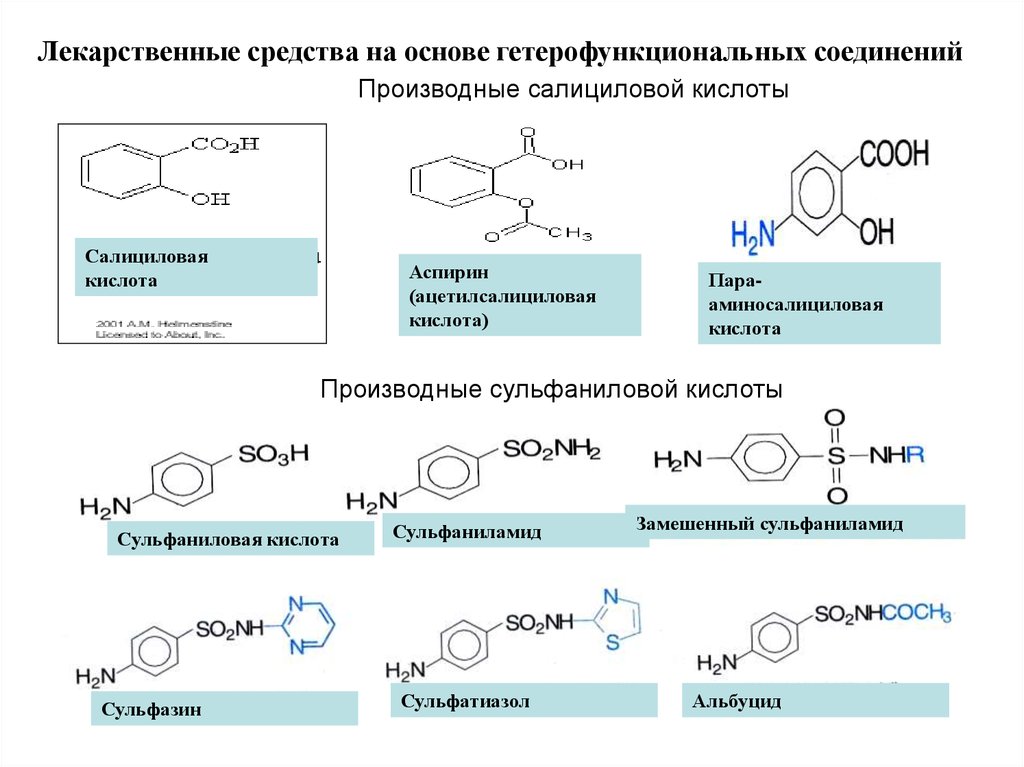
Лекарственные средства на основе гетерофункциональных соединенийПроизводные салициловой кислоты
Салициловая
кислота
Аспирин
(ацетилсалициловая
кислота)
Парааминосалициловая
кислота
Производные сульфаниловой кислоты
Сульфаниловая кислота
Сульфазин
Сульфаниламид
Сульфатиазол
Замешенный сульфаниламид
Альбуцид
51. ВЫСШИЕ КАРБОНОВЫЕ КИСЛОТЫ
52.
- это КК с числом углеродных атомов больше 10.насыщенные
мононенасыщенные
полиненасыщенные
Пальмитиновая к-та
Олеиновая к-та
Линолевая к-та
С15Н31СООН
С17Н33СООН
С17Н31СООН
Стеариновая к-та
Линоленовая к-та
С17Н35СООН
С17Н29СООН
ТВЕРДЫЕ
Арахидоновая к-та
С19Н31COOH
ЖИДКИЕ
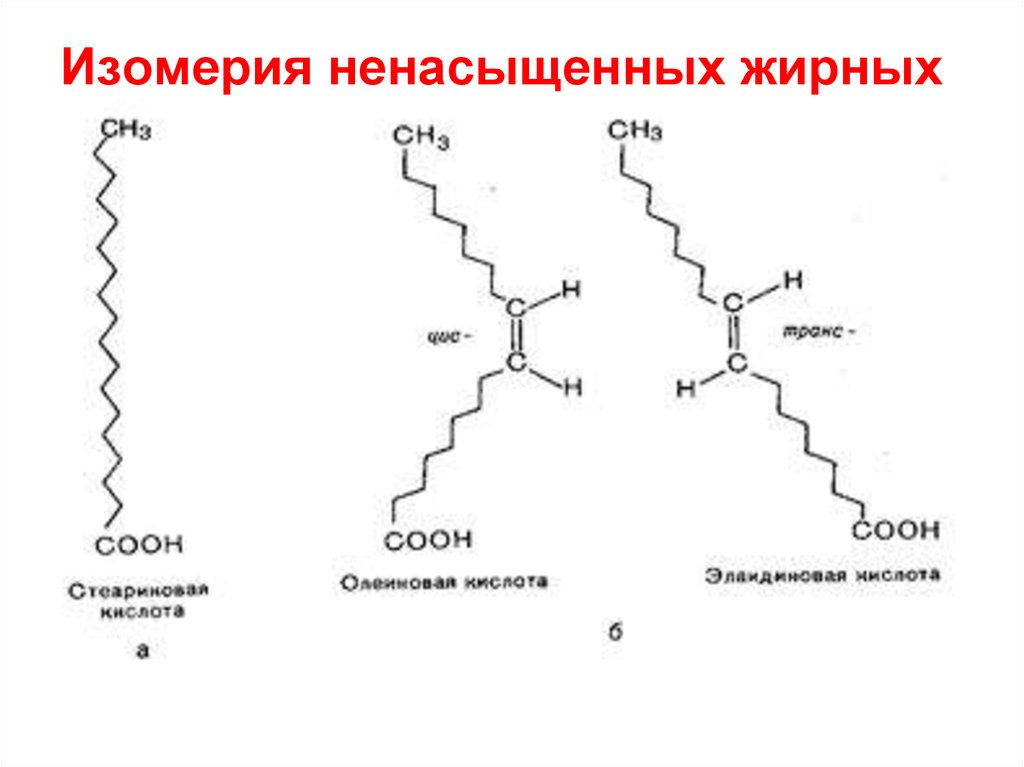
53.
Изомерия ненасыщенных жирныхкислот
54.
Высший карбоновые кислоты проявляютсвойства низших карбоновых кислот.
Ненасыщенные легко вступают в реакции по
кратным связям.
55.
Ненасыщенные ВКК значительно легчеокисляются в организме и могут ограничивать в
нем свободнорадикальное окисление.
При полном гидрировании превращаются в
предельные:




























 Химия
Химия








