Похожие презентации:
Реакция нейтрализации
1. Реакция нейтрализации
Урок Беликовой Г.Аучителя химии МОУ
«СОШ№6» города
Тихвина
Ленинградской
области
2.
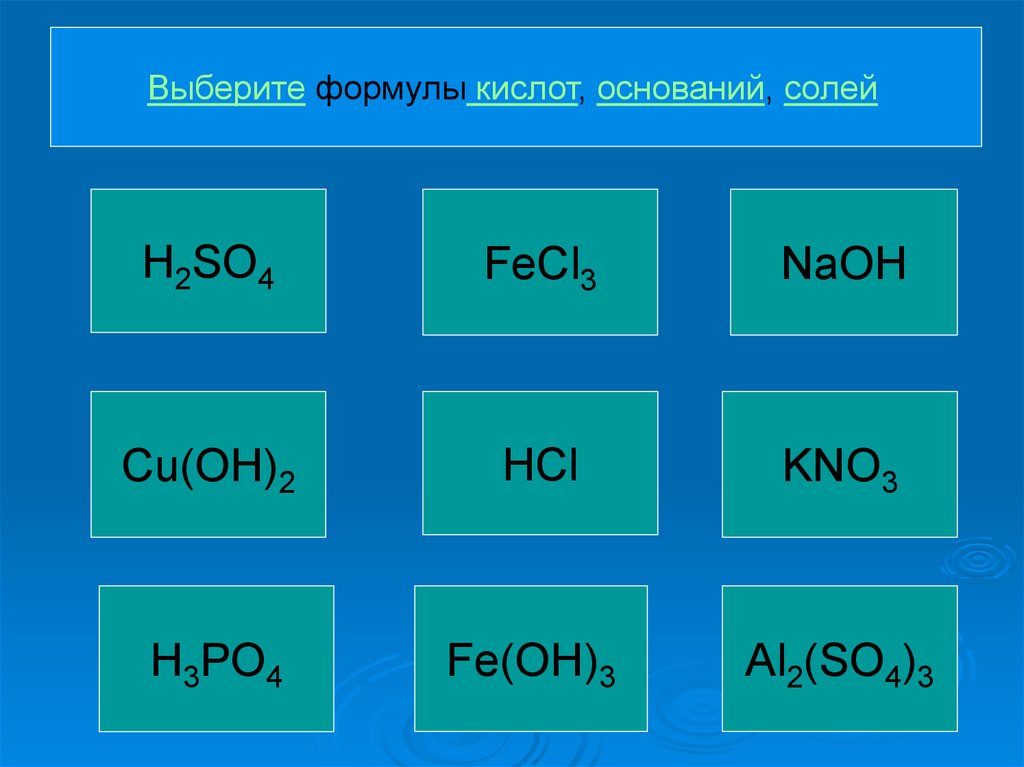
Выберите формулы кислот, оснований, солейH2SO4
FeCl3
NaOH
Cu(OH)2
HCl
KNO3
H3PO4
Fe(OH)3
Al2(SO4)3
3.
Кислоты- это сложные вещества,состоящие из атомов водорода,
способных замещаться на атомы
металлов, и кислотных остатков.
-x
HxKt
4.
Основания- это сложные вещества,состоящие из атомов металлa и
одной или нескольких гидроксогрупп
+n
M (OH) n
5.
Соли- это сложные вещества,образованные атомами металла и
кислотными остатками.
+n
M x Kt
-x
n
6.
В трёх пробирках находятся раствор щёлочи, растворкислоты и вода. Как опытным путём определить, в какой
пробирке что находится?
7. Изменение цвета индикаторов
индикаторыНейтральная Кислая среда Щелочная
среда
среда
лакмус
фиолетовый
красный
синий
Метиловый
оранжевый
оранжевый
красный
желтый
Фенолфта
леин
бесцветный
бесцветный
малиновый
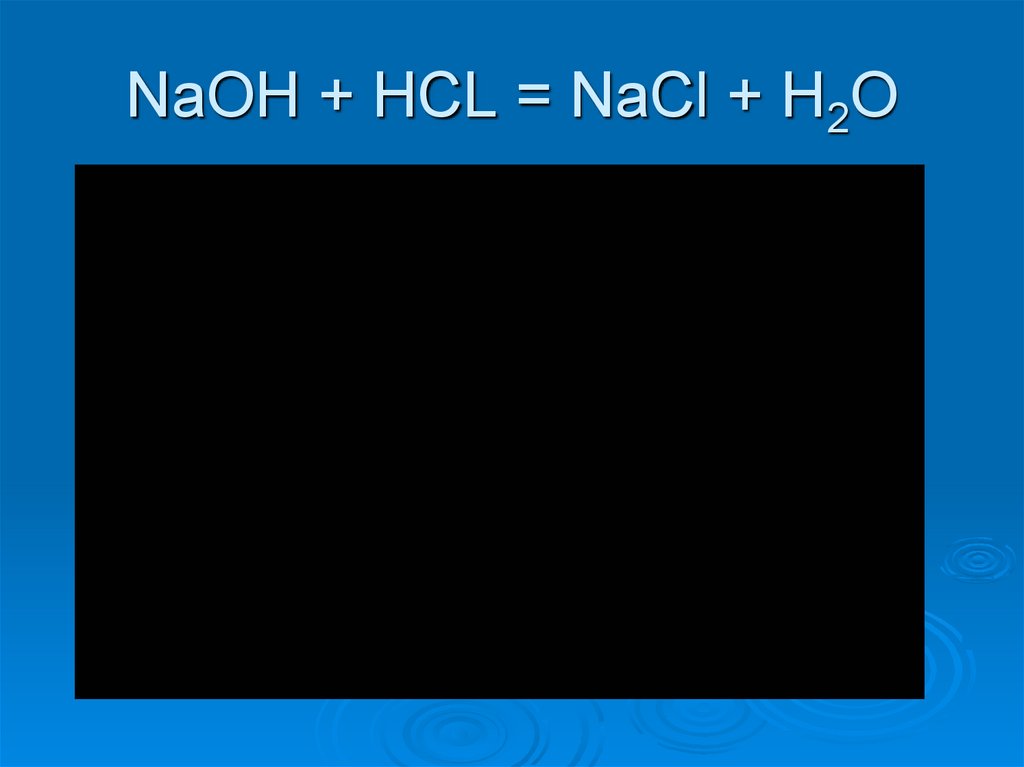
8. NaOH + HCL = NaCl + H2O
9.
+Na OH
+
H Cl
10. 2KOH + H2SO4 = K2SO4 + 2H2O
11.
Растворимоеоснование
+
кислота
=
соль
+
вода
12.
Лабораторная работан/р основание
Cu
OH
+
OH
+
Гидроксид меди (2)
+
кислота
HCl
HCl
= вода +
соль
+2
-1
= 2 H2O + Cu Cl 2
Соляная кислота
Вода
Хлорид меди (2)
13.
Fe(OH)3 + 3HCl =FeCl3 + 3H3O
Гидроксид
железа(3)
Хлорид
железа(3)
Соляная
кислота
Вода
2Fe(OH)3 + 3H2SO4 =Fe2 (SO4)3+ 6H2O
Гидроксид
железа(3)
Серная
кислота
Сульфат
железа(3)
Вода
14.
кислота+
основание
=
соль
+
вода
15.
Самостоятельная работаНапишите уравнения реакций
нейтрализации, с помощью которых
можно получить:
1 вариант а) нитрат алюминия
б) сульфат натрия
2 вариант а) сульфат бария
б) нитрат калия
16.
Взаимопроверка1 вариант
а) Al(OH)3 + 3HNO3 = Al(NO3)3 +3H2O
б) 2NaOH + H2SO4 = Na2SO4 + 2H2O
2 вариант
а) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
б) KOH + HNO3 = KNO3 + H2O














 Химия
Химия








