Похожие презентации:
Реакции подлинности лекарственных веществ
1. КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
РЕАКЦИИ ПОДЛИННОСТИЛЕКАРСТВЕННЫХ ВЕЩЕСТВ.
1
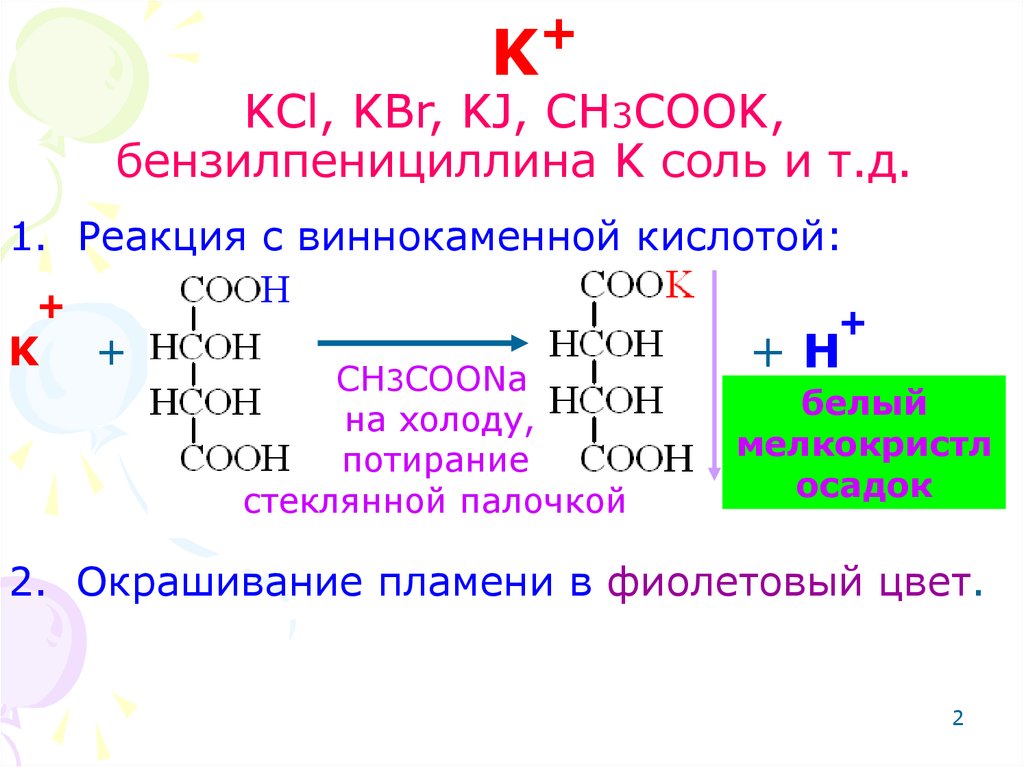
2. K KCl, KBr, KJ, CH3COOK, бензилпенициллина K соль и т.д.
K+
KCl, KBr, KJ, CH3COOK,
бензилпенициллина K соль и т.д.
1. Реакция с виннокаменной кислотой:
+
K
+
+
CH3COONa
на холоду,
потирание
стеклянной палочкой
+H
белый
мелкокристл
осадок
2. Окрашивание пламени в фиолетовый цвет.
2
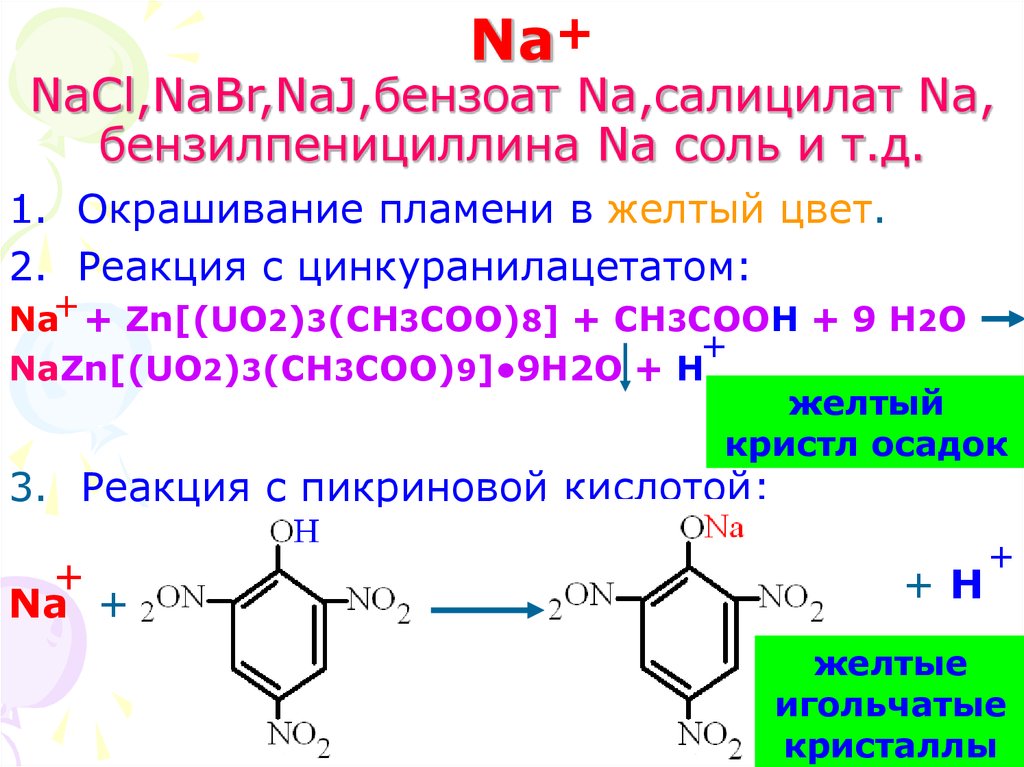
3. Na NaCl,NaBr,NaJ,бензоат Na,салицилат Na, бензилпенициллина Na соль и т.д.
Na+NaCl,NaBr,NaJ,бензоат Na,салицилат Na,
бензилпенициллина Na соль и т.д.
1. Окрашивание пламени в желтый цвет.
2. Реакция с цинкуранилацетатом:
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9 H2O
+
NaZn[(UO2)3(CH3COO)9]●9H2O + H
желтый
кристл осадок
3. Реакция с пикриновой кислотой:
+
Na +
+H
+
желтые
игольчатые
3
кристаллы
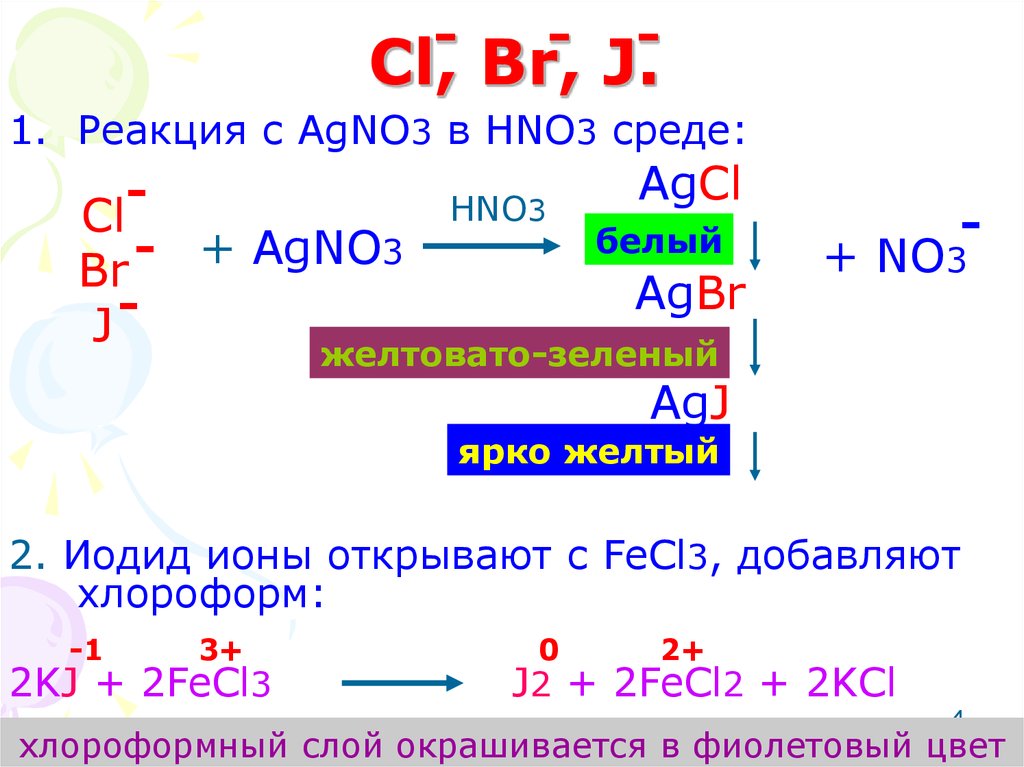
4. Cl, Br, J.
--
-
Cl, Br, J.
1. Реакция с AgNO3 в HNO3 среде:
Cl
+
AgNO
3
Br
J
HNO3
AgCl
белый
AgBr
-
+ NO3
желтовато-зеленый
AgJ
ярко желтый
2. Иодид ионы открывают с FeCl3, добавляют
хлороформ:
-1
3+
2KJ + 2FeCl3
0
2+
J2 + 2FeCl2 + 2KCl
4
хлороформный слой окрашивается в фиолетовый цвет
5. Cl, Br, J.
--
-
Cl, Br, J.
3. Бромид ионы открывают с хлорамином в
кислой среде:
+ HCl
2KBr + Cl2
+ Cl2
Br2 + 2KCl
5
хлороформный слой окрашивается в желтый цвет
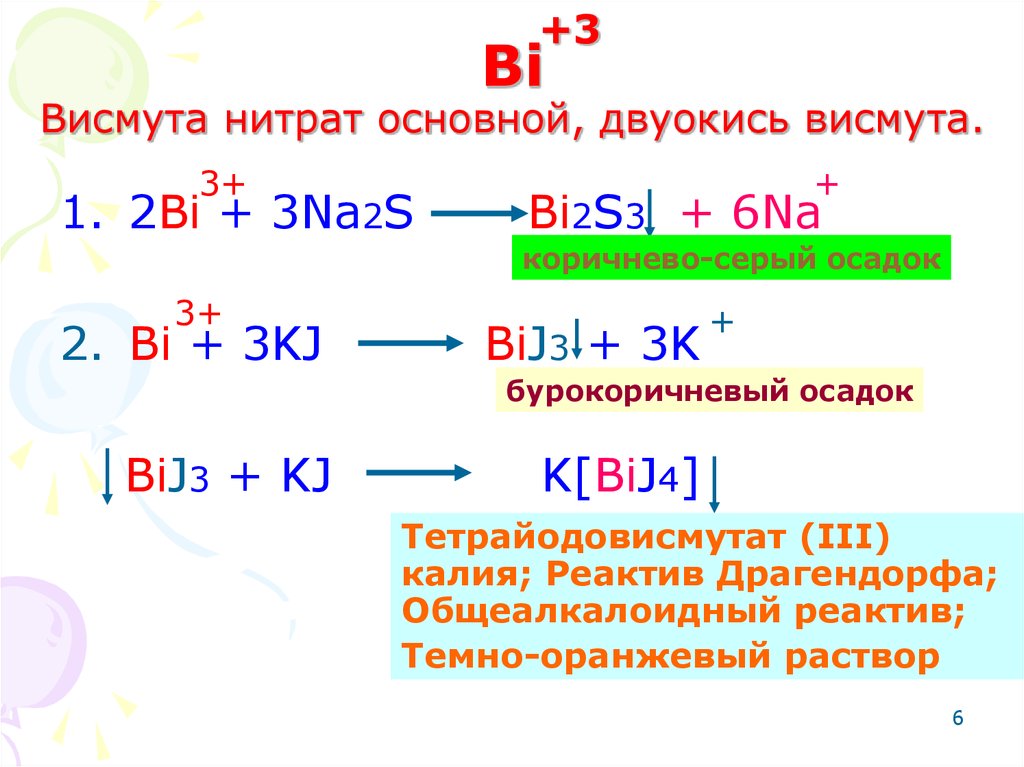
6. Bi Висмута нитрат основной, двуокись висмута.
+3Bi
Висмута нитрат основной, двуокись висмута.
3+
1. 2Bi + 3Na2S
+
Bi2S3 + 6Na
коричнево-серый осадок
3+
2. Bi + 3KJ
BiJ3 + 3K
+
бурокоричневый осадок
BiJ3 + KJ
K[BiJ4]
Тетрайодовисмутат (III)
калия; Реактив Драгендорфа;
Общеалкалоидный реактив;
Темно-оранжевый раствор
6
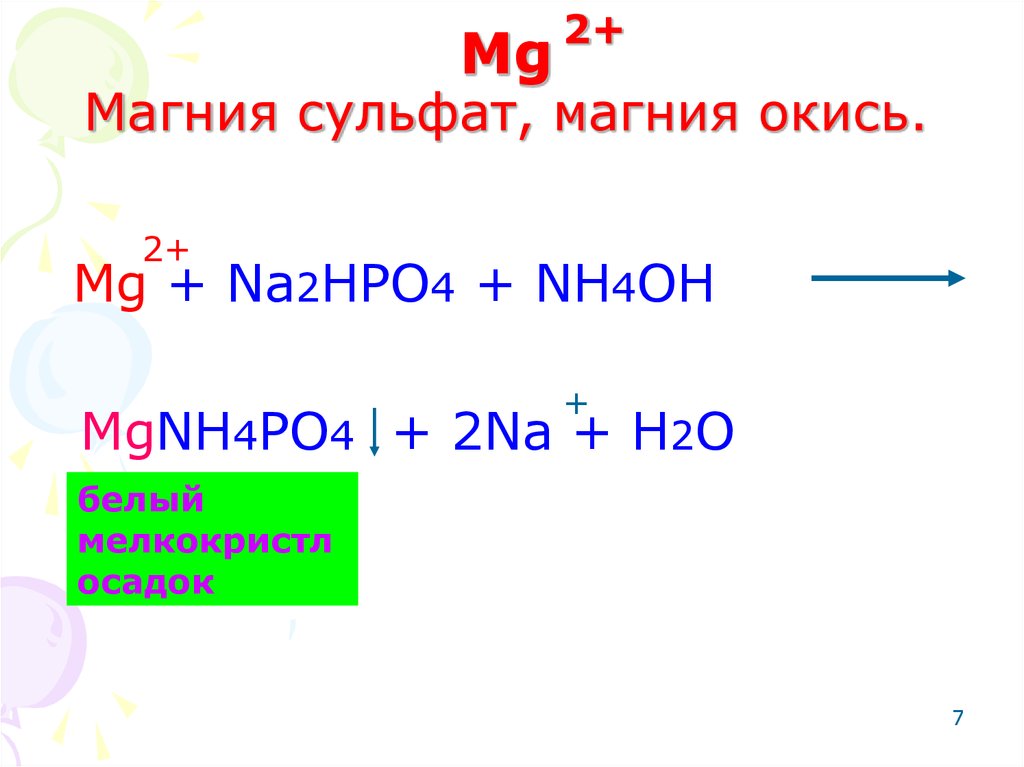
7. Mg Магния сульфат, магния окись.
Mg2+
Магния сульфат, магния окись.
2+
Mg + Na2HPO4 + NH4OH
+
MgNH4PO4 + 2Na + H2O
белый
мелкокристл
осадок
7
8. Zn Цинка окись, цинка сульфат.
2+Zn
Цинка окись, цинка сульфат.
2+
1. Zn + Na2S
+
ZnS + 2Na
белый осадок
2. Реакция с гексацианоферратом (II)
калия (желтая кровяная соль):
2+
3Zn + 2K4[Fe(CN)6]
+
Zn3K2[Fe(CN)6]2 + 6K
студенистый белый осадок
3. ZnO при нагревании желтеет , при
охлаждении белеет .
8
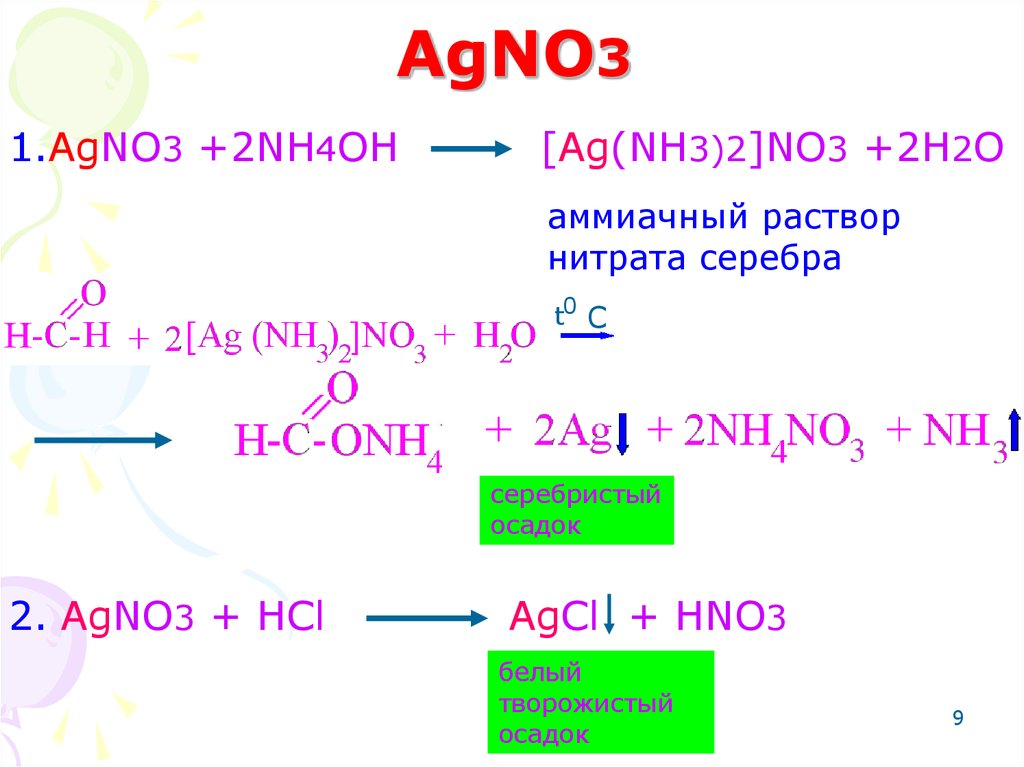
9. AgNO3
1.AgNO3 +2NH4OH[Ag(NH3)2]NO3 +2H2O
аммиачный раствор
нитрата серебра
0
+H2Ot C
серебристый
осадок
2. AgNO3 + HCl
AgCl + HNO3
белый
творожистый
осадок
9
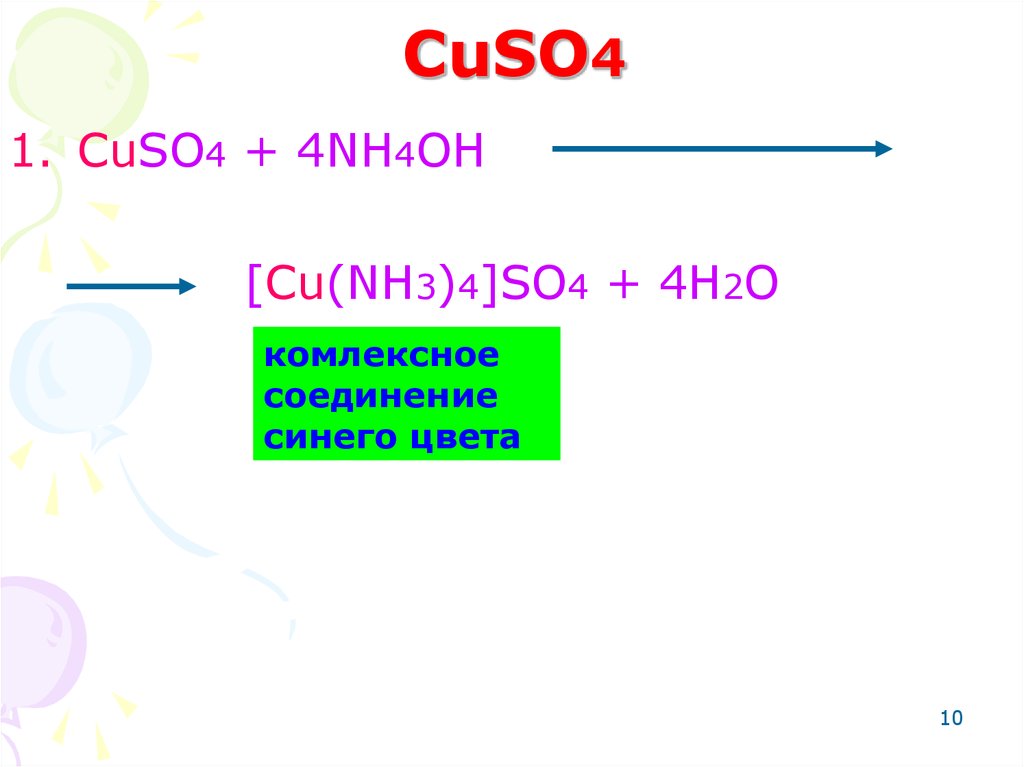
10. CuSO4
1. CuSO4 + 4NH4OH[Cu(NH3)4]SO4 + 4H2O
комлексное
соединение
синего цвета
10
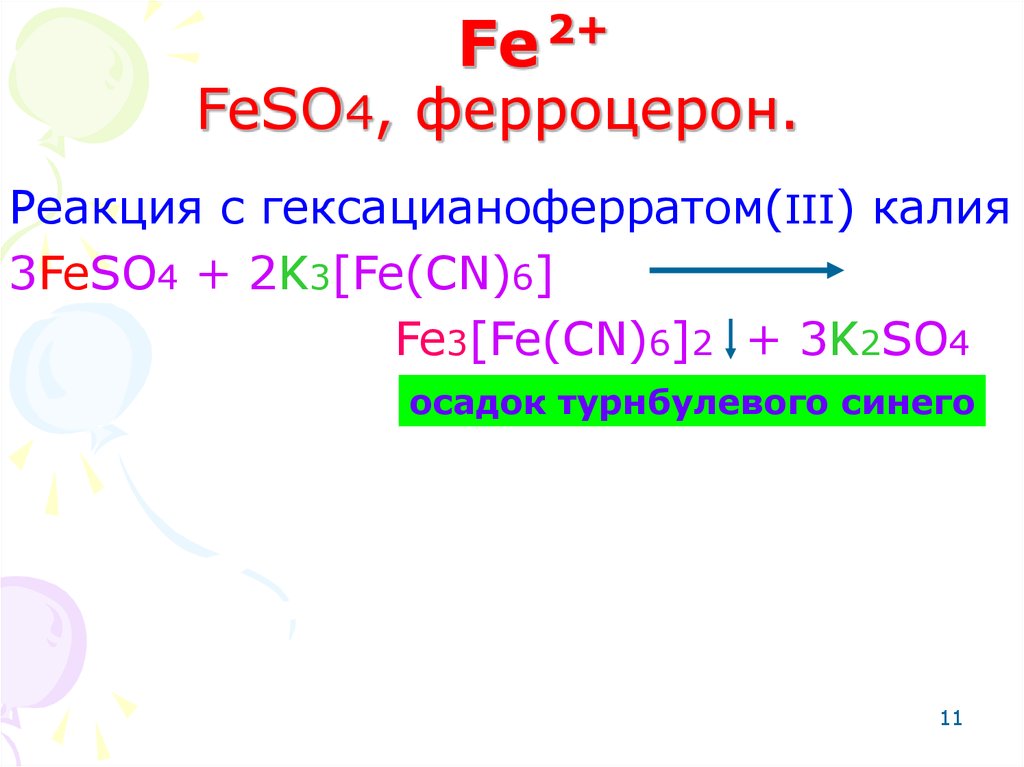
11. Fe FeSO4, ферроцерон.
Fe2+
FeSO4, ферроцерон.
Реакция с гексацианоферратом(III) калия
3FeSO4 + 2K3[Fe(CN)6]
Fe3[Fe(CN)6]2 + 3K2SO4
осадок турнбулевого синего
11
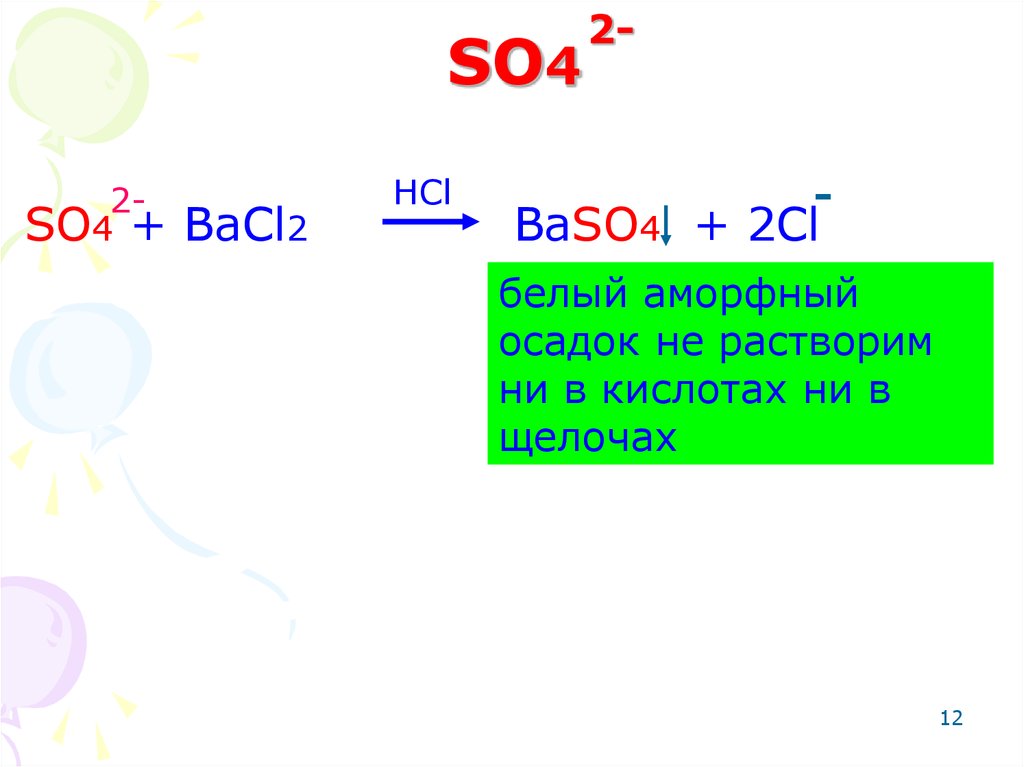
12. SO4
2SO4 +BaCl2
HCl
2-
-
BaSO4 + 2Cl
белый аморфный
осадок не растворим
ни в кислотах ни в
щелочах
12
13. Ca CaCl2, кальция лактат, кальция глюконат.
Ca2+
CaCl2, кальция лактат, кальция глюконат.
2+
Ca + (NH4)2C2O4
NH4OH
NH4Cl
CaC2O4 +
+
2NH4
белый кристл осадок
13
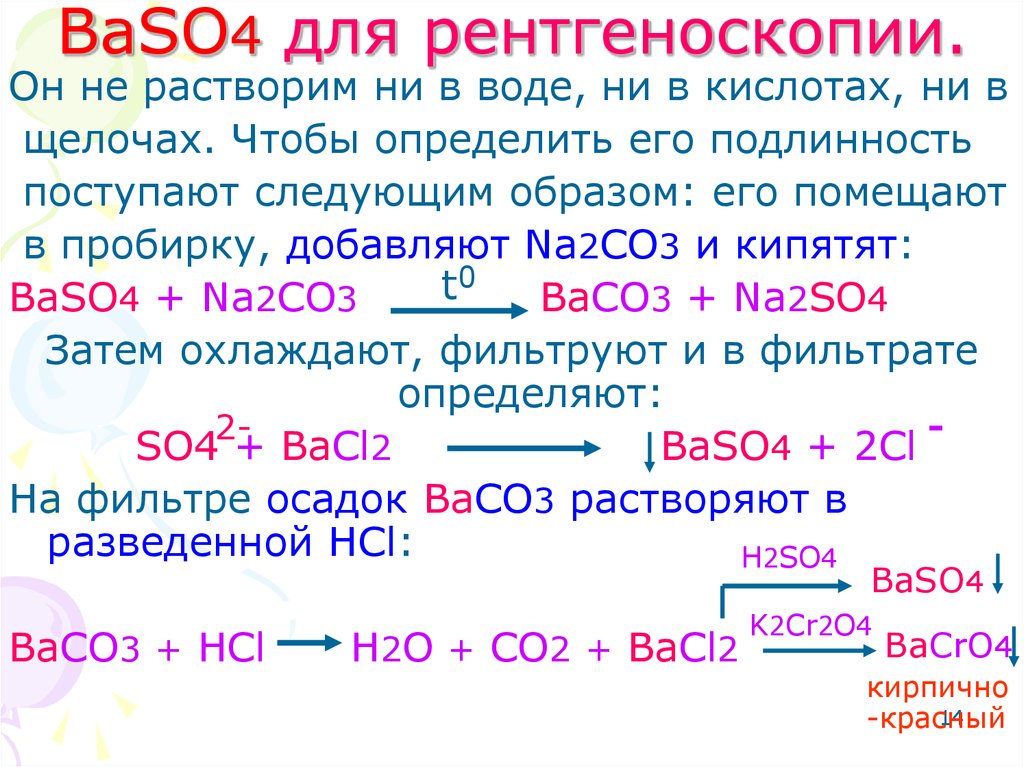
14. BaSO4 для рентгеноскопии.
Он не растворим ни в воде, ни в кислотах, ни вщелочах. Чтобы определить его подлинность
поступают следующим образом: его помещают
в пробирку, добавляют Na2CO3 и кипятят:
0
t
BaSO4 + Na2CO3
BaCO3 + Na2SO4
Затем охлаждают, фильтруют и в фильтрате
определяют:
2SO4 + BaCl2
BaSO4 + 2Cl
На фильтре осадок BaCO3 растворяют в
разведенной HCl:
H2SO4
BaSO4
BaCO3 + HCl
H2O + CO2 + BaCl2
K2Cr2O4
BaCrO4
кирпично
14
-красный
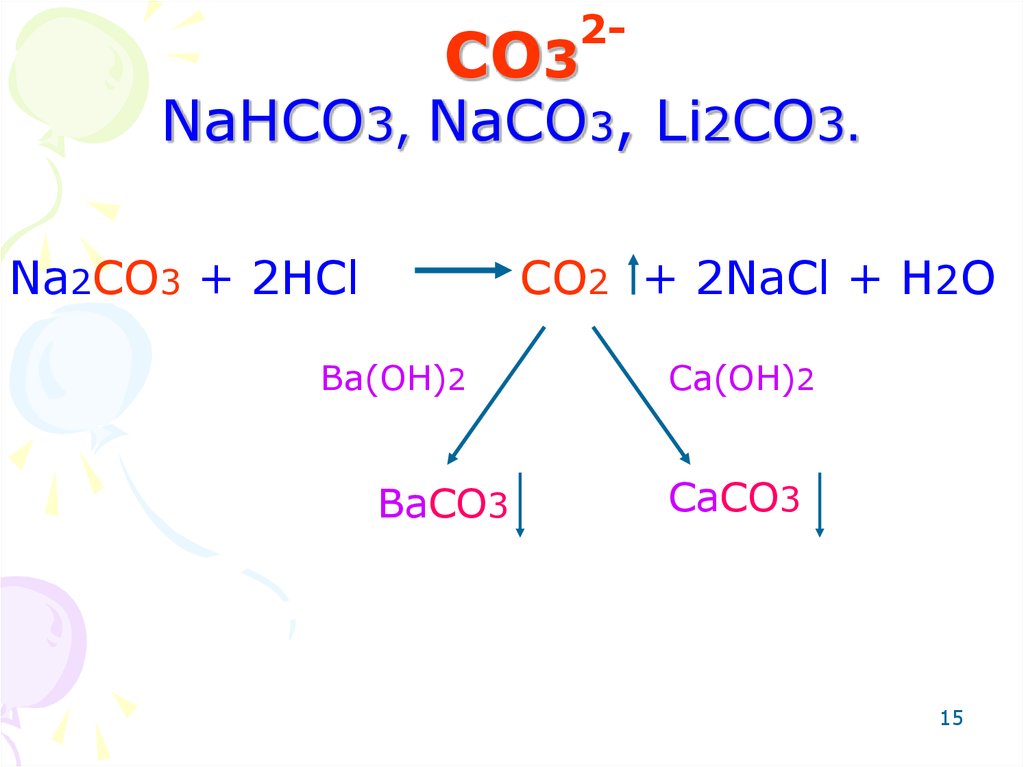
15. CO3 NaHCO3, NaCO3, Li2CO3.
2-CO3
NaHCO3, NaCO3, Li2CO3.
Na2CO3 + 2HCl
CO2 + 2NaCl + H2O
Ba(OH)2
BaCO3
Ca(OH)2
CaCO3
15
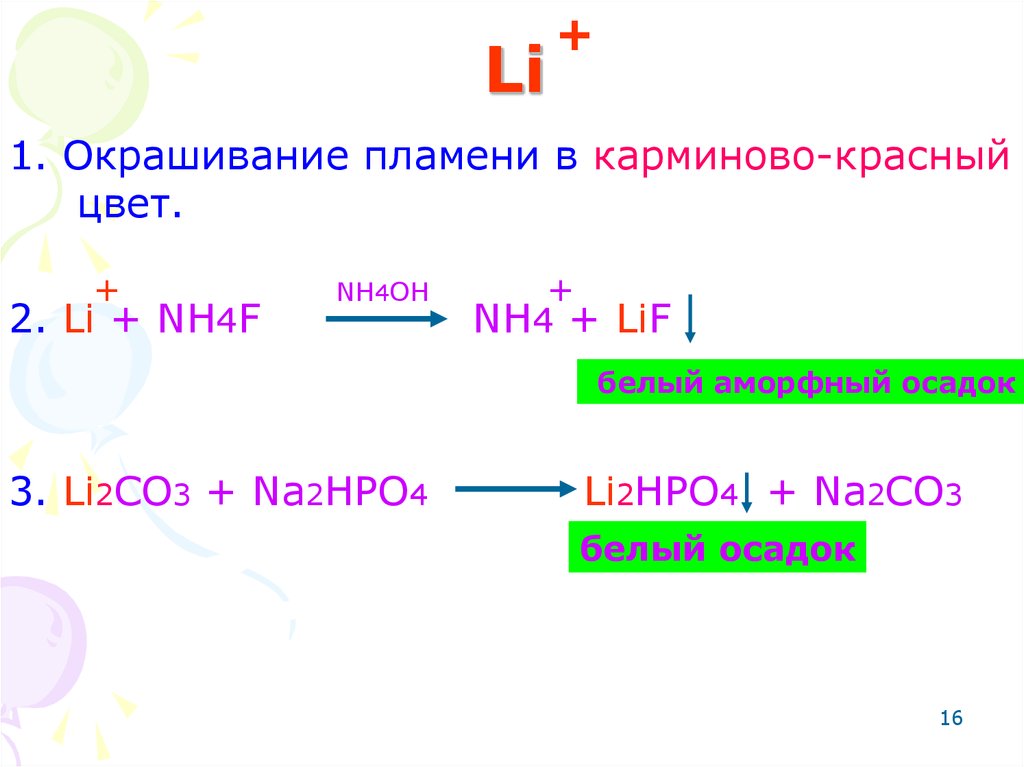
16. Li
+1. Окрашивание пламени в карминово-красный
цвет.
+
2. Li + NH4F
NH4OH
+
NH4 + LiF
белый аморфный осадок
3. Li2CO3 + Na2HPO4
Li2HPO4 + Na2CO3
белый осадок
16
17. BO3 Борная кислота, тетраборат натрия.
BO33-
Борная кислота, тетраборат натрия.
1. Реакция с куркумовой бумагой.
Химизм смотри учебник В.Г.Беликов,
2003 год, стр. 189.
2.Образование борноэтилового эфира:
OH
B OH
OH
+ 3HO-H5C2
H2SO4 (k)
-3H2O
B
OC2H5
OC2H5
OC2H5
горит зеленым пламенем
17
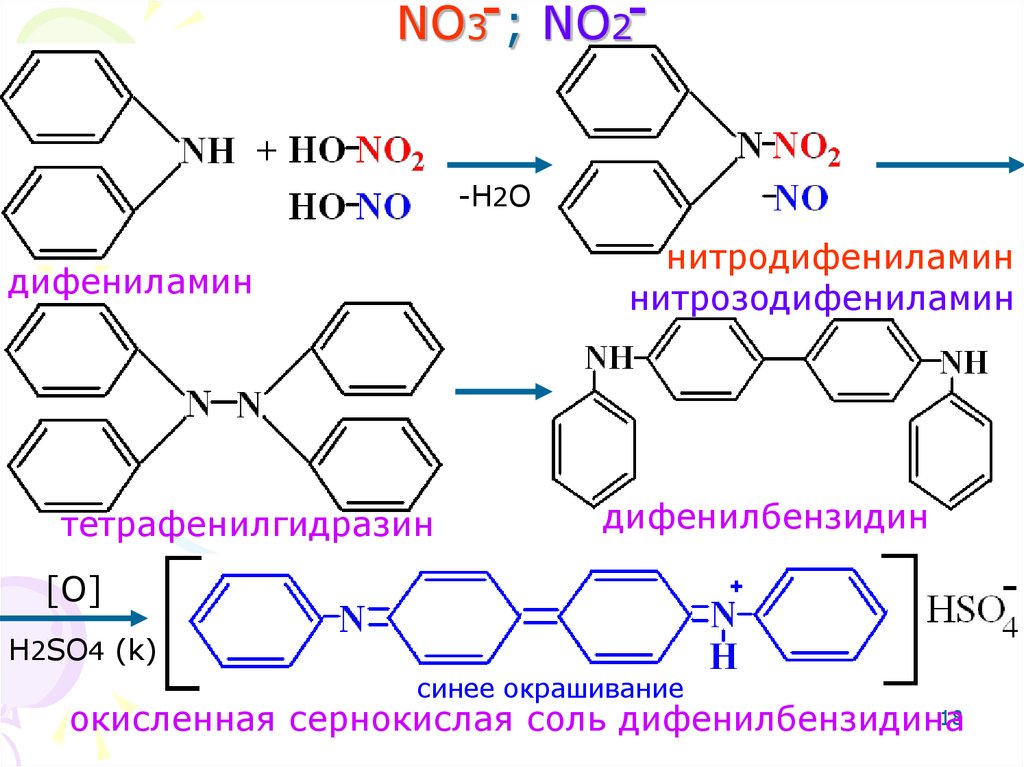
18. NO3 ; NO2
NO3- ; NO2--H2O
нитродифениламин
нитрозодифениламин
дифениламин
тетрафенилгидразин
дифенилбензидин
[O]
H2SO4 (k)
синее окрашивание
18
окисленная сернокислая соль дифенилбензидина
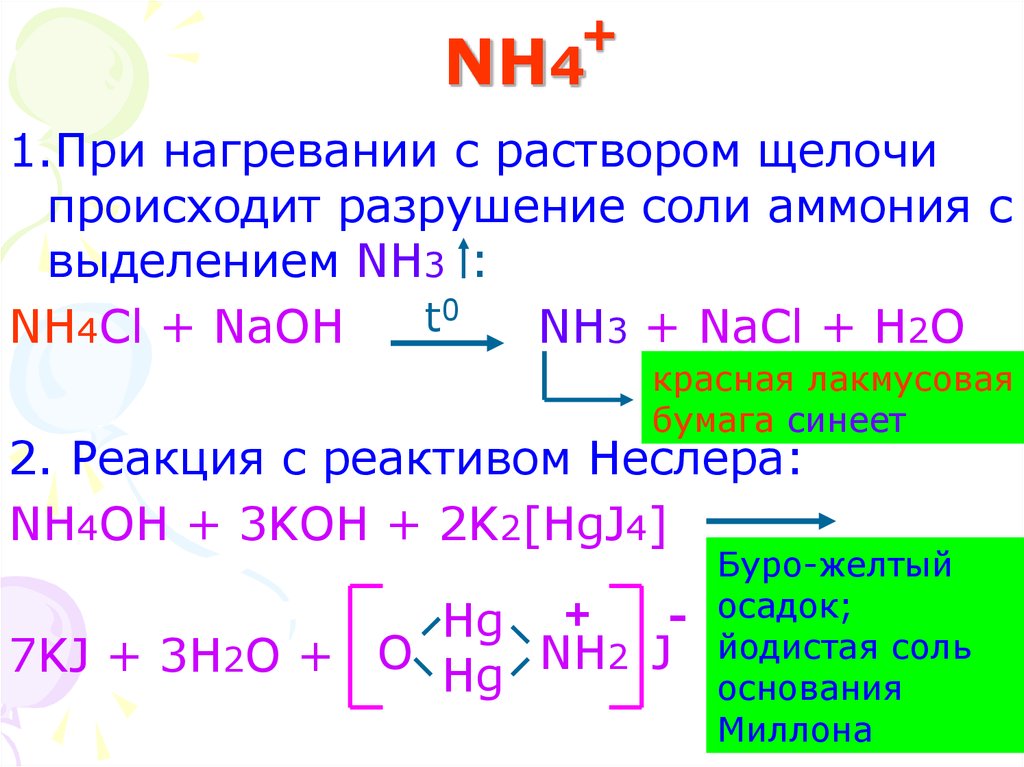
19. NH4
+NH4
1.При нагревании с раствором щелочи
происходит разрушение соли аммония с
выделением NH3 :
0
t
NH4Cl + NaOH
NH3 + NaCl + H2O
красная лакмусовая
бумага синеет
2. Реакция с реактивом Неслера:
NH4OH + 3KOH + 2K2[HgJ4]
Hg
7KJ + 3H2O + O Hg
Буро-желтый
+
- осадок;
NH2 J йодистая соль
основания
19
Миллона
20. ОРГАНИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Особенности анализагалогенпроизводных
(этилхлорид, фторэтан,
хлороформ, йодоформ).
20
21.
1. Галоген связан ковалентной связью,проводят процесс минерализации с целью
перевода галогена в ионогенное состояние.
2. Если лекарственные вещества содержат
хлор, бром , то их переводят в ионогенное
состояние путем нагревания с крепким
раствором гидроксида натрия (30%)
или сухим карбонатом натрия. Для
определения фтора препарат нагревают с
металлическим натрием (жесткая
минерализация).
3. Если лекарственные вещества содержат
йод, то минерализацию проводят с
концентрированными серной или
азотной кислотами при нагревании. При
этом выделяется фиолетовые пары йода.21
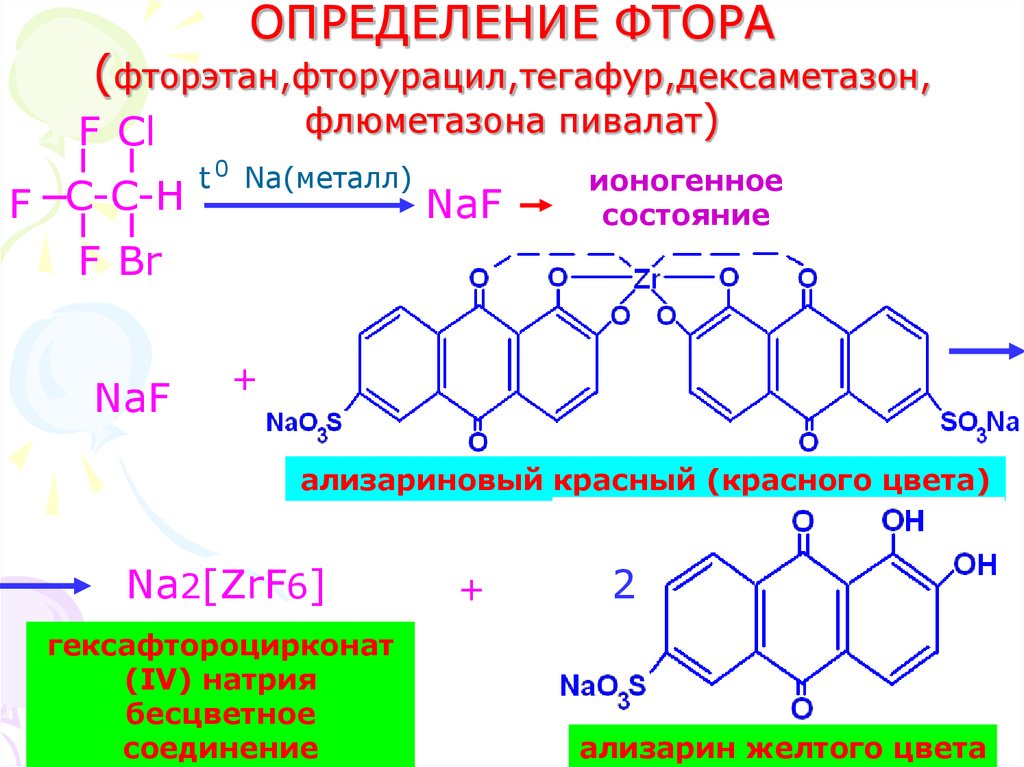
22. ОПРЕДЕЛЕНИЕ ФТОРА (фторэтан,фторурацил,тегафур,дексаметазон, флюметазона пивалат)
F ClF C-C-H
F Br
NaF
t 0 Na(металл)
NaF
ионогенное
состояние
+
ализариновый красный (красного цвета)
Na2[ZrF6]
гексафтороцирконат
(IV) натрия
бесцветное
соединение
+
2
22
ализарин желтого цвета
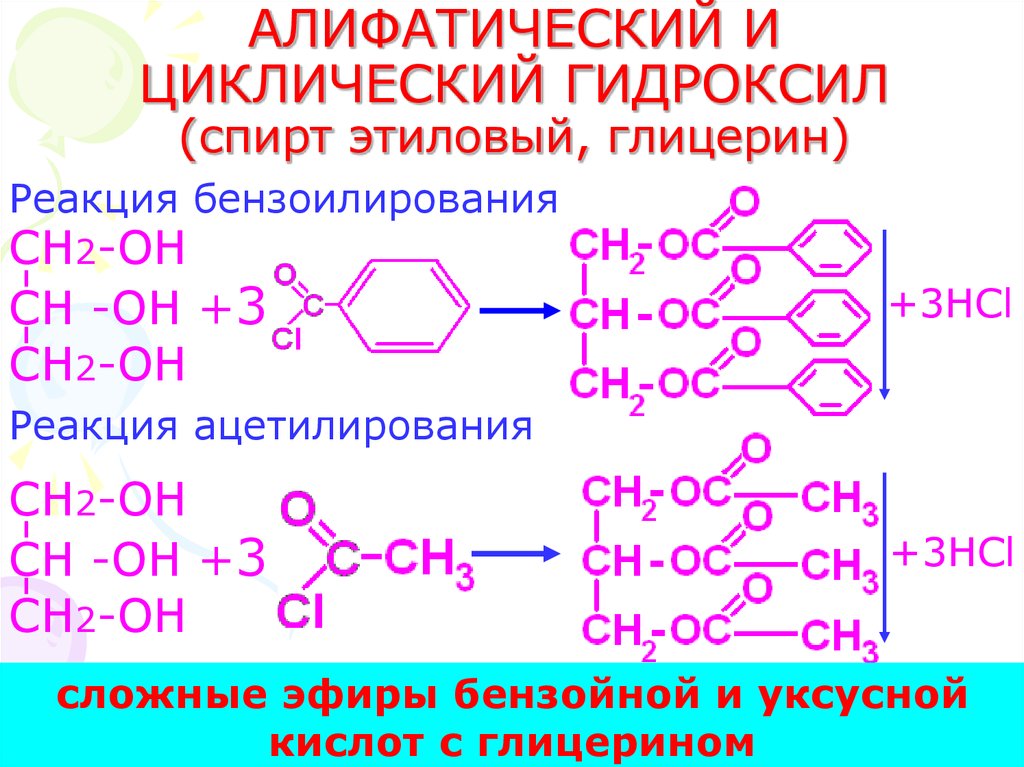
23. АЛИФАТИЧЕСКИЙ И ЦИКЛИЧЕСКИЙ ГИДРОКСИЛ (спирт этиловый, глицерин)
Реакция бензоилированияCH2-OH
CH -OH +3
CH2-OH
+3HCl
Реакция ацетилирования
CH2-OH
CH -OH +3
CH2-OH
+3HCl
сложные эфиры бензойной и уксусной
23
кислот с глицерином
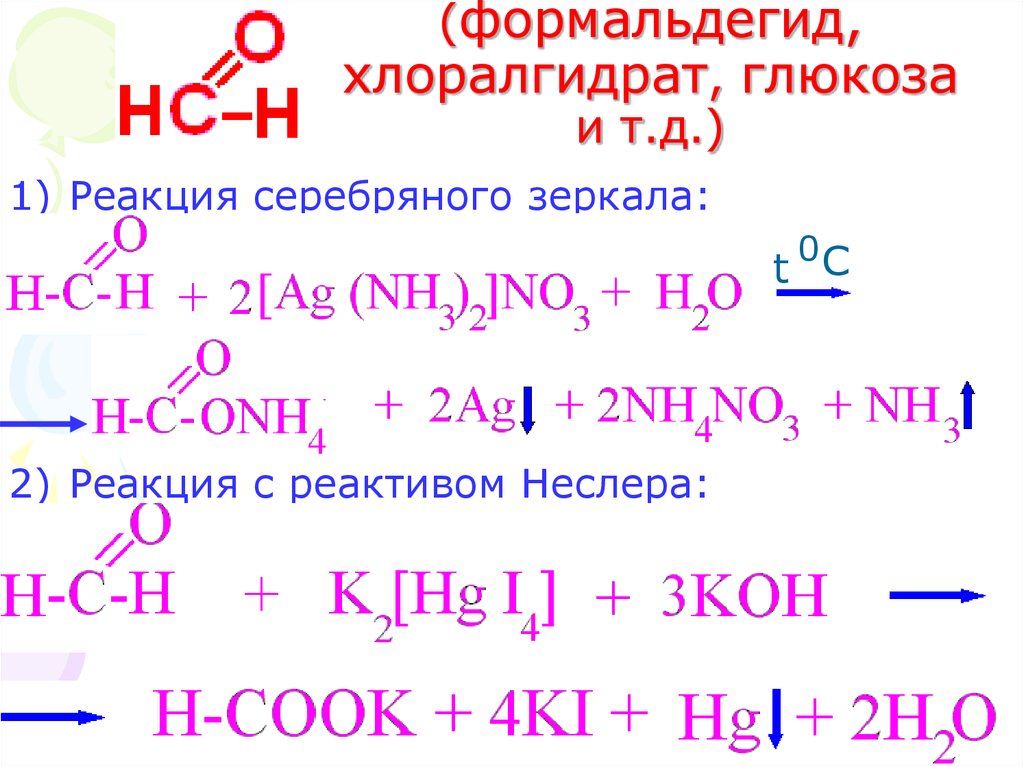
24. (формальдегид, хлоралгидрат, глюкоза и т.д.)
1) Реакция серебряного зеркала:0
t C
2) Реакция с реактивом Неслера:
24
25.
3) Реакция конденсации. Образованиеауринового красителя:
+
H2SO4 (k)
-H2O
[O]
окрашивание
раствора в 25
красный цвет
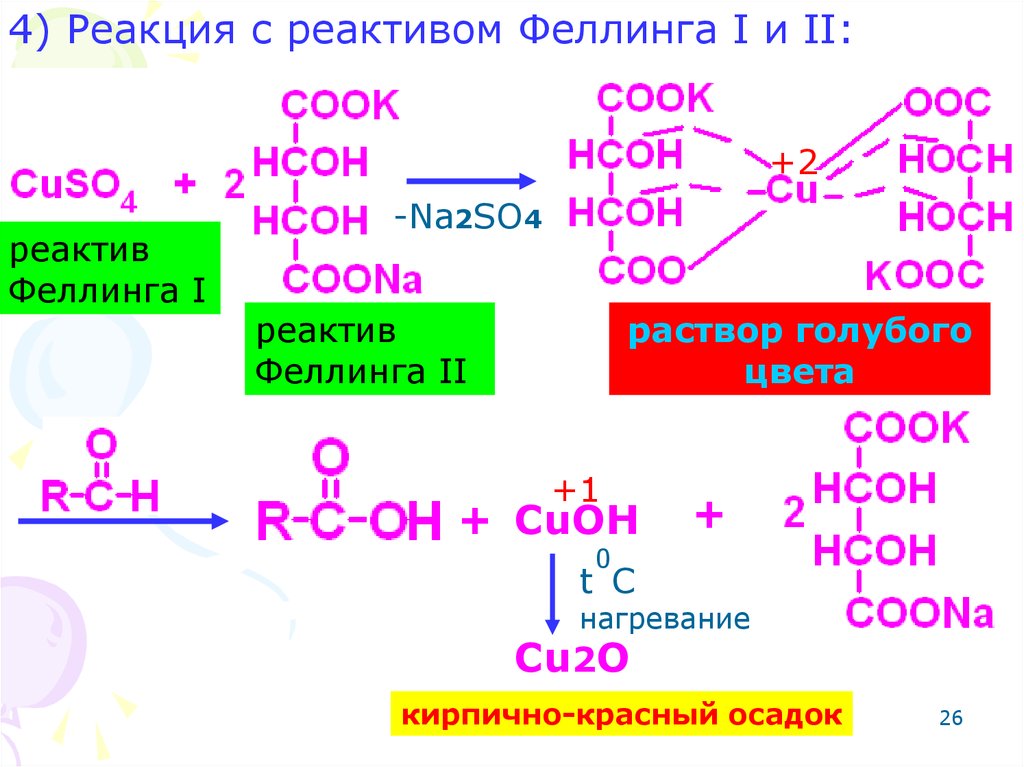
26.
4) Реакция с реактивом Феллинга I и II:+2
реактив
Феллинга I
-Na2SO4
реактив
Феллинга II
раствор голубого
цвета
+1
+ CuOH
+
0
t C
нагревание
Cu2O
кирпично-красный осадок
26
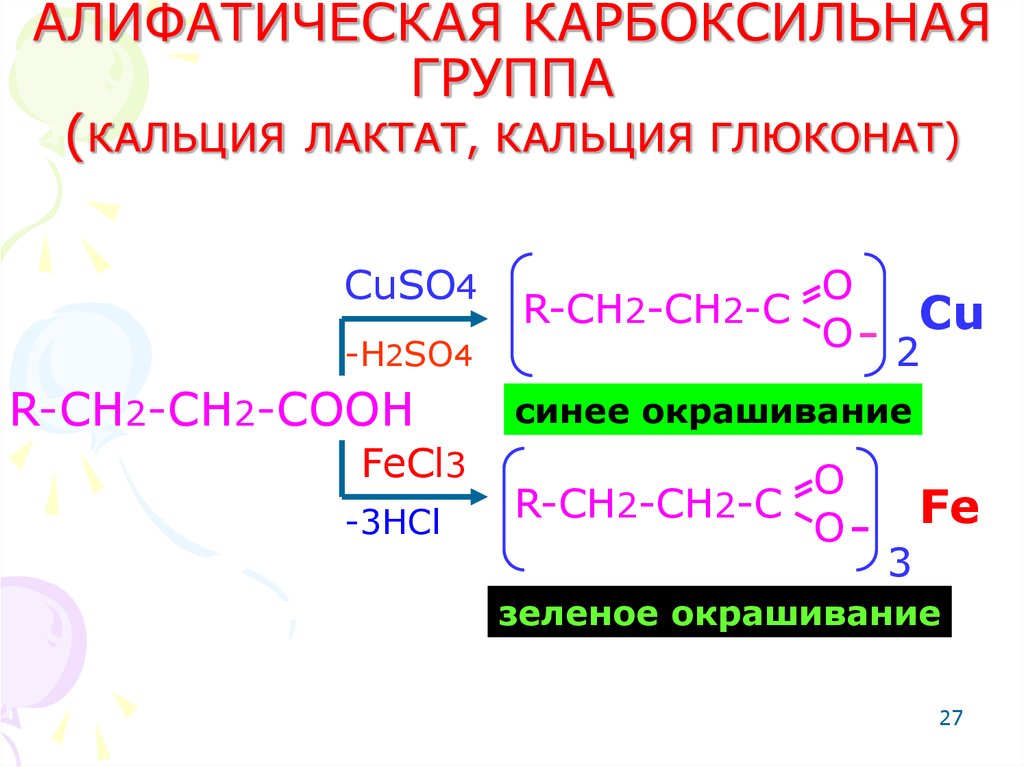
27. АЛИФАТИЧЕСКАЯ КАРБОКСИЛЬНАЯ ГРУППА (КАЛЬЦИЯ ЛАКТАТ, КАЛЬЦИЯ ГЛЮКОНАТ)
CuSO4-H2SO4
R-CH2-CH2-COOH
FeCl3
-3HCl
O
R-CH2-CH2-C
O
Cu
2
синее окрашивание
O
R-CH2-CH2-C
O
Fe
3
зеленое окрашивание
27
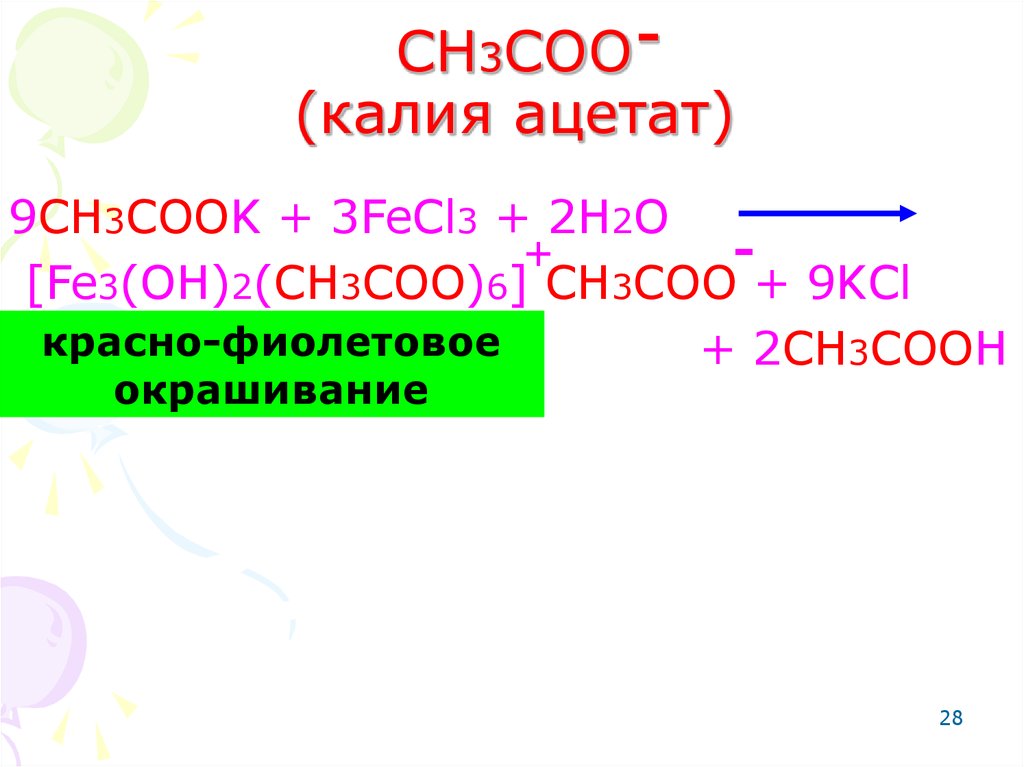
28. СH3COO (калия ацетат)
9CH3COOK + 3FeCl3 + 2H2O+
[Fe3(OH)2(CH3COO)6] CH3COO + 9KCl
красно-фиолетовое
+ 2CH3COOH
окрашивание
28
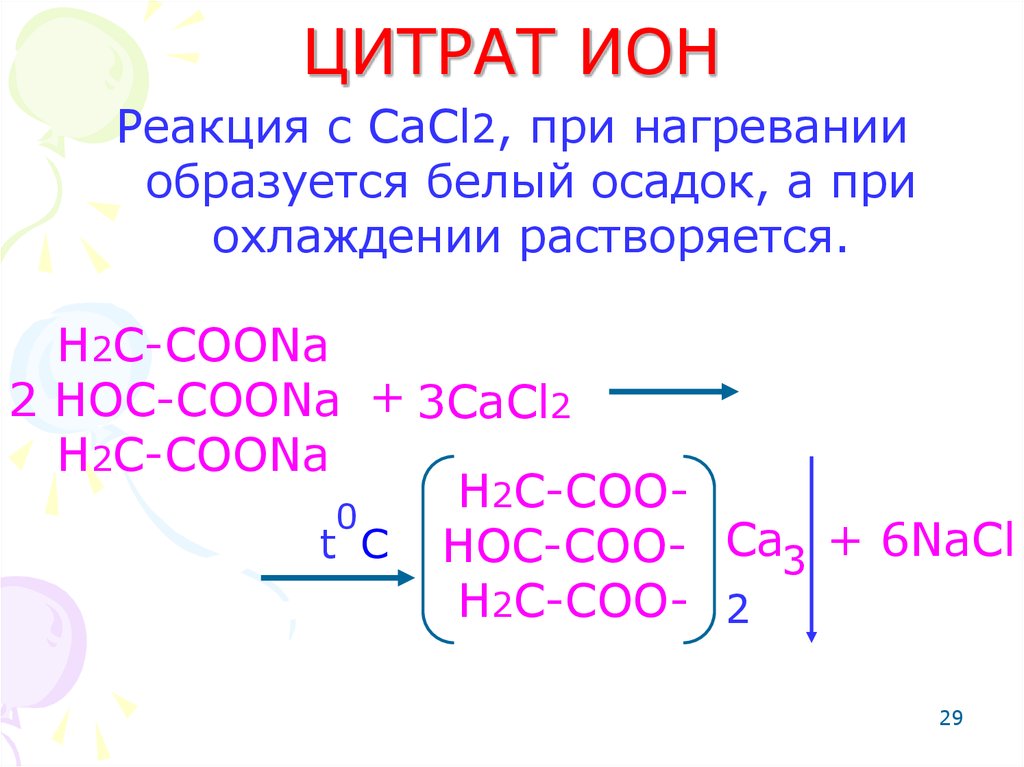
29. ЦИТРАТ ИОН
Реакция с CaCl2, при нагреванииобразуется белый осадок, а при
охлаждении растворяется.
H2C-COONa
2 HOC-COONa + 3CaCl2
H2C-COONa
H2C-COO0
t C HOC-COO- Ca3 + 6NaCl
H2C-COO- 2
29
30. АЛИФАТИЧЕСКАЯ АМИНОГРУППА
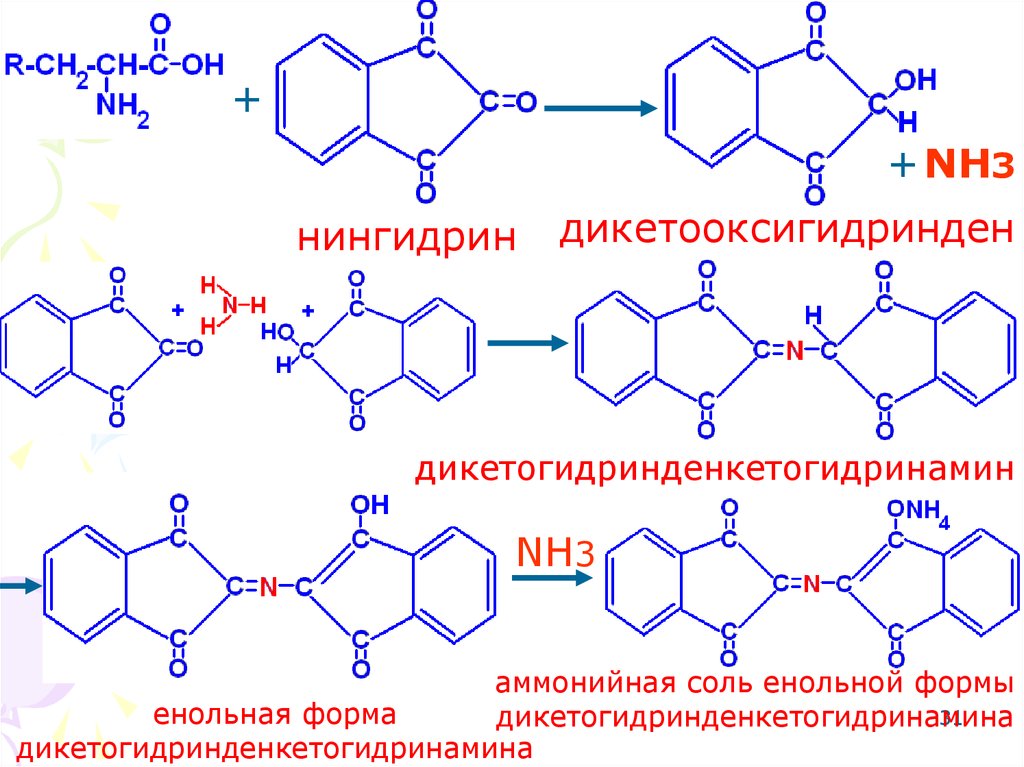
Реакция с нингидриномсине-фиолетовое
окрашивание.
30
31.
++ NH3
нингидрин
дикетооксигидринден
дикетогидринденкетогидринамин
NH3
аммонийная соль енольной формы
енольная форма
31
дикетогидринденкетогидринамина
дикетогидринденкетогидринамина
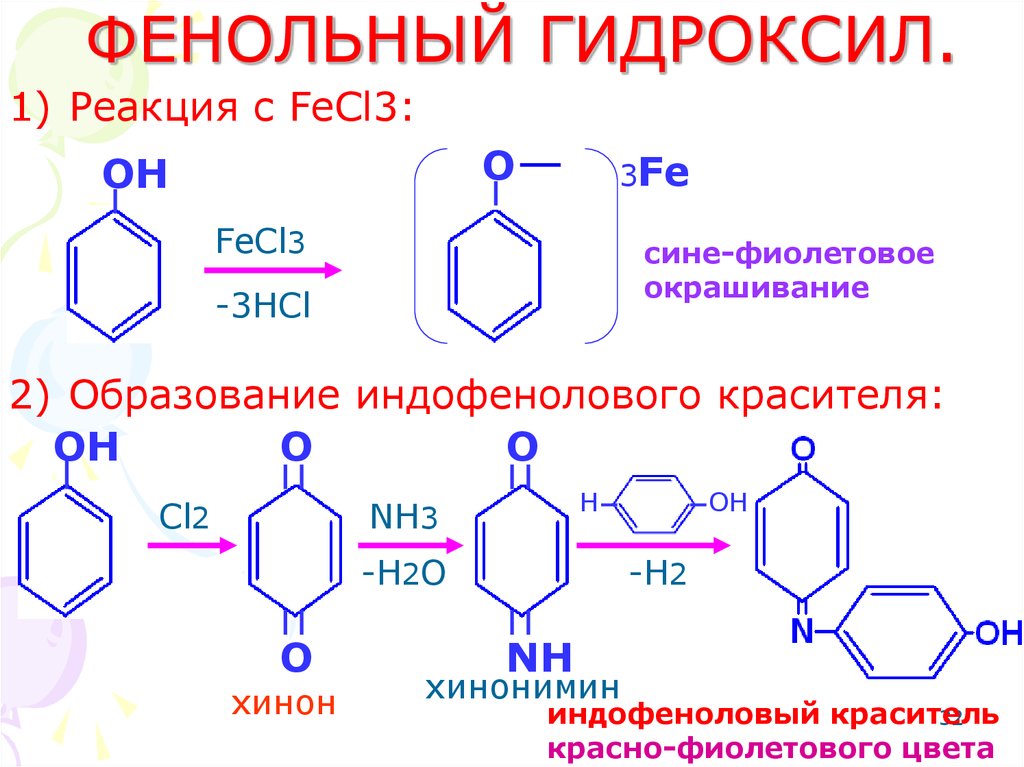
32. ФЕНОЛЬНЫЙ ГИДРОКСИЛ.
1) Реакция с FeCl3:O
OH
3Fe
FeCl3
сине-фиолетовое
окрашивание
-3HCl
2) Образование индофенолового красителя:
OH
O
O
Cl2
H
NH3
-H2O
O
хинон
OH
-H2
NH
хинонимин
индофеноловый краситель
32
красно-фиолетового цвета
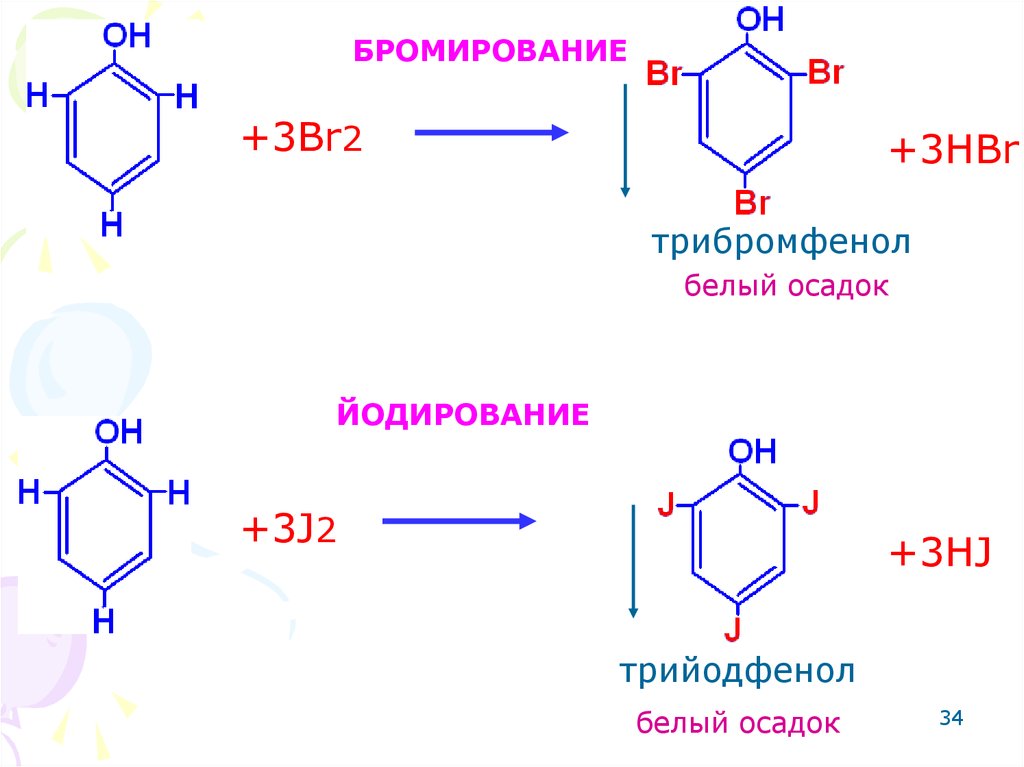
33. АРОМАТИЧЕСКОЕ КОЛЬЦО.
Реакции электрофильногозамещения. Это реакции
бромирования, йодирования,
нитрования. Фенольный гидроксил
- ориентант I рода, направляет
последующие заместители в орто и
пара положения.
33
34.
БРОМИРОВАНИЕ+3Br2
+3HBr
трибромфенол
белый осадок
ЙОДИРОВАНИЕ
+3J2
+3HJ
трийодфенол
белый осадок
34
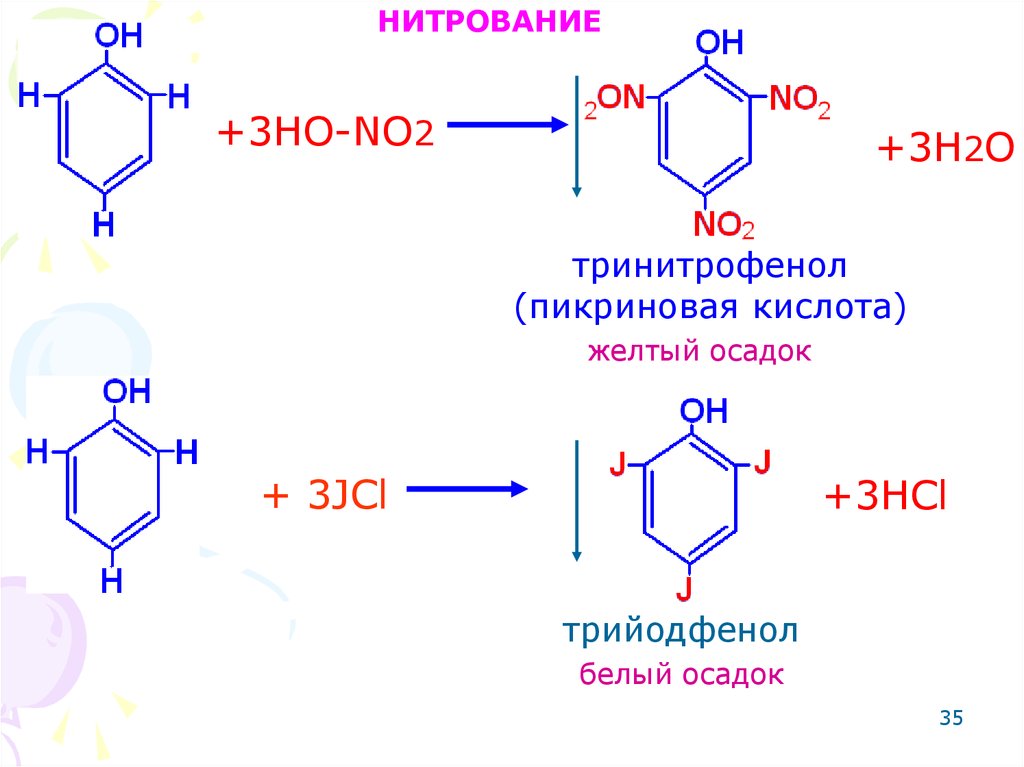
35.
НИТРОВАНИЕ+3HO-NO2
+3H2O
тринитрофенол
(пикриновая кислота)
желтый осадок
+ 3JCl
+3HCl
трийодфенол
белый осадок
35
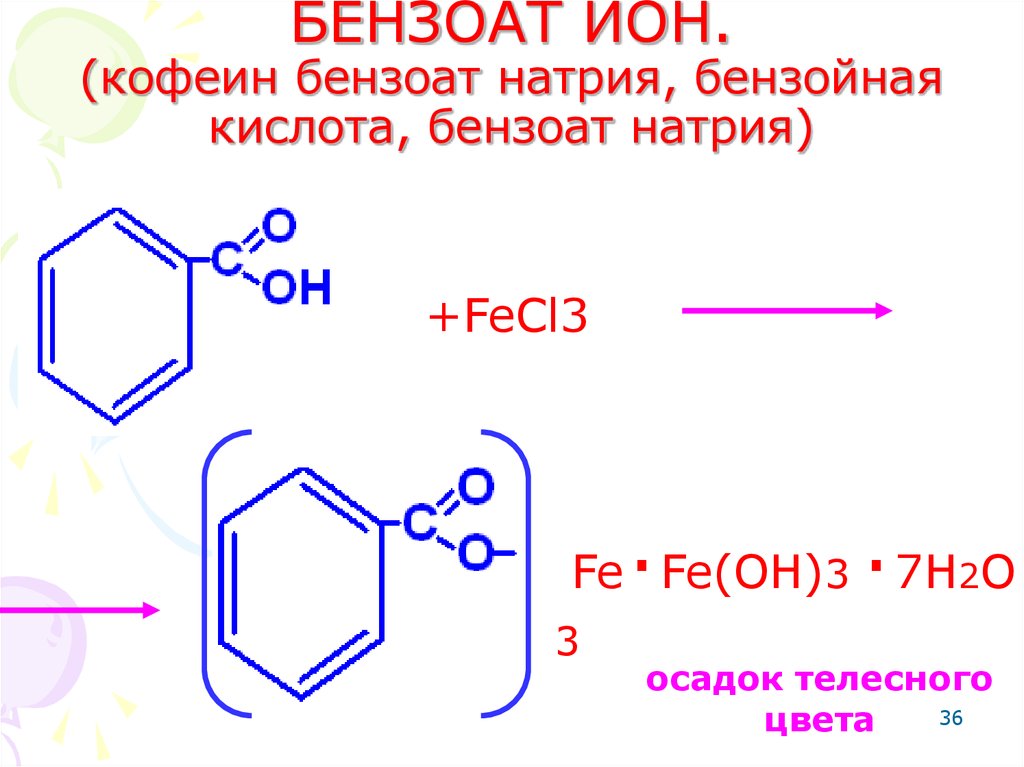
36. БЕНЗОАТ ИОН. (кофеин бензоат натрия, бензойная кислота, бензоат натрия)
+FeCl3.
.
Fe Fe(OH)3 7H2O
3
осадок телесного
36
цвета
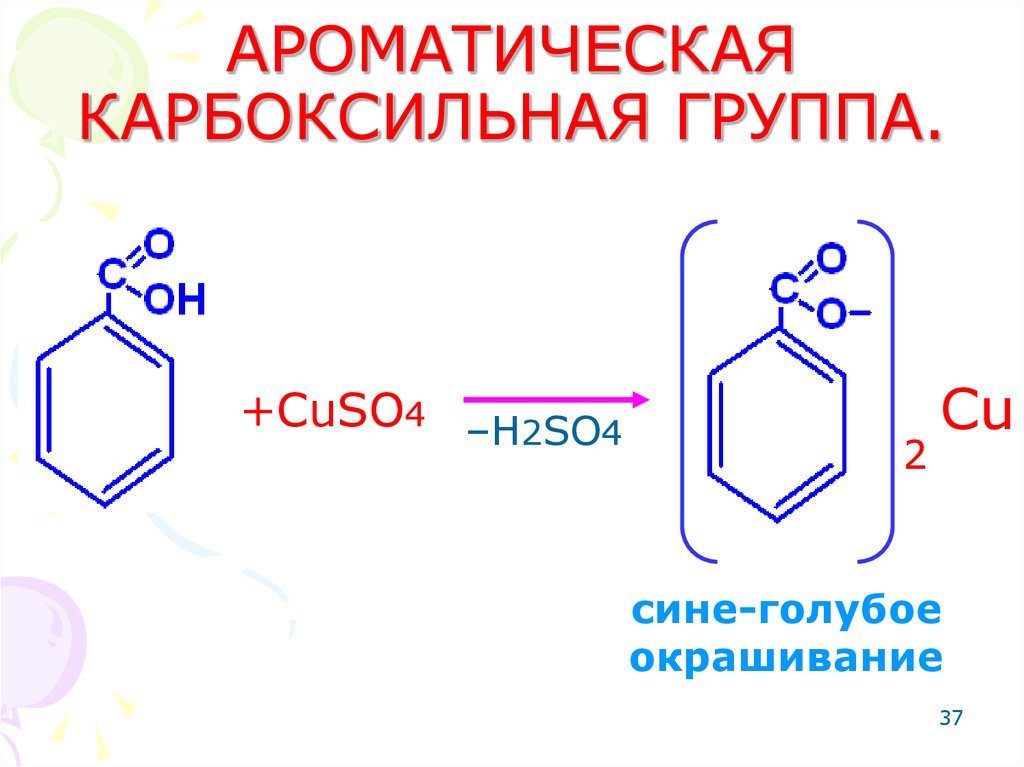
37. АРОМАТИЧЕСКАЯ КАРБОКСИЛЬНАЯ ГРУППА.
+CuSO4 –H2SO42
Cu
сине-голубое
окрашивание
37
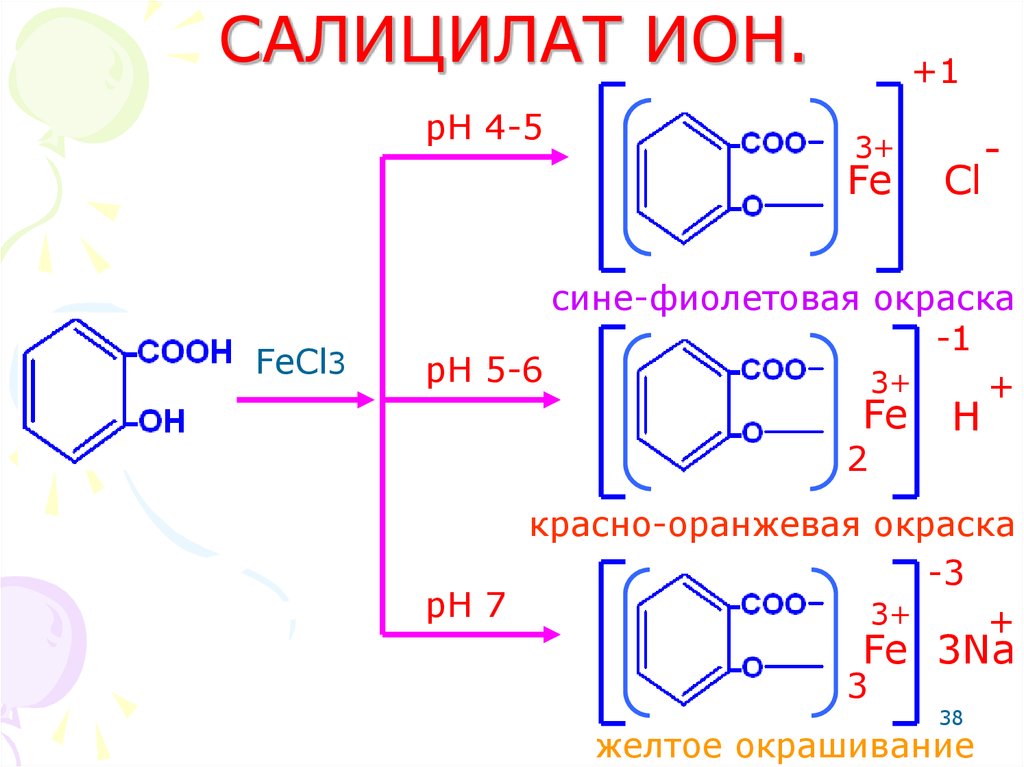
38. САЛИЦИЛАТ ИОН.
pH 4-5+1
3+
Fe
FeCl3
Cl
-
сине-фиолетовая окраска
-1
pH 5-6
3+
+
Fe
2
H
красно-оранжевая окраска
-3
pH 7
3+
+
Fe 3Na
3
38
желтое окрашивание
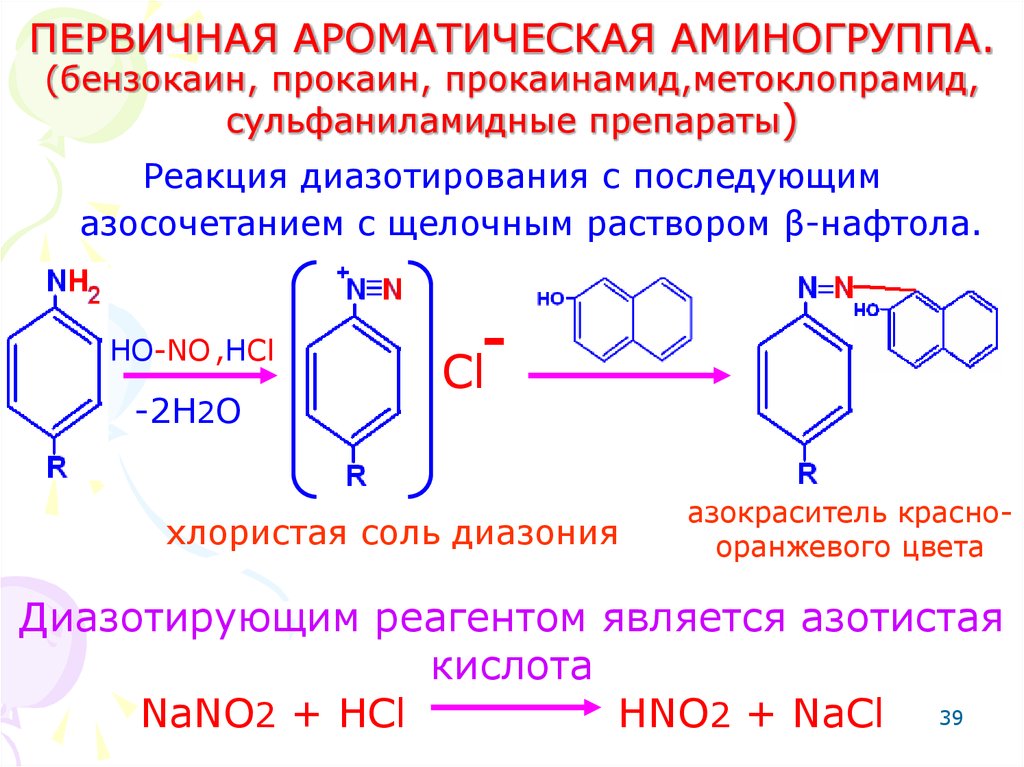
39. ПЕРВИЧНАЯ АРОМАТИЧЕСКАЯ АМИНОГРУППА. (бензокаин, прокаин, прокаинамид,метоклопрамид, сульфаниламидные препараты)
Реакция диазотирования с последующимазосочетанием с щелочным раствором β-нафтола.
HO-NO ,HCl
-2H2O
-
Cl
хлористая соль диазония
азокраситель краснооранжевого цвета
Диазотирующим реагентом является азотистая
кислота
NaNO2 + HCl
HNO2 + NaCl 39
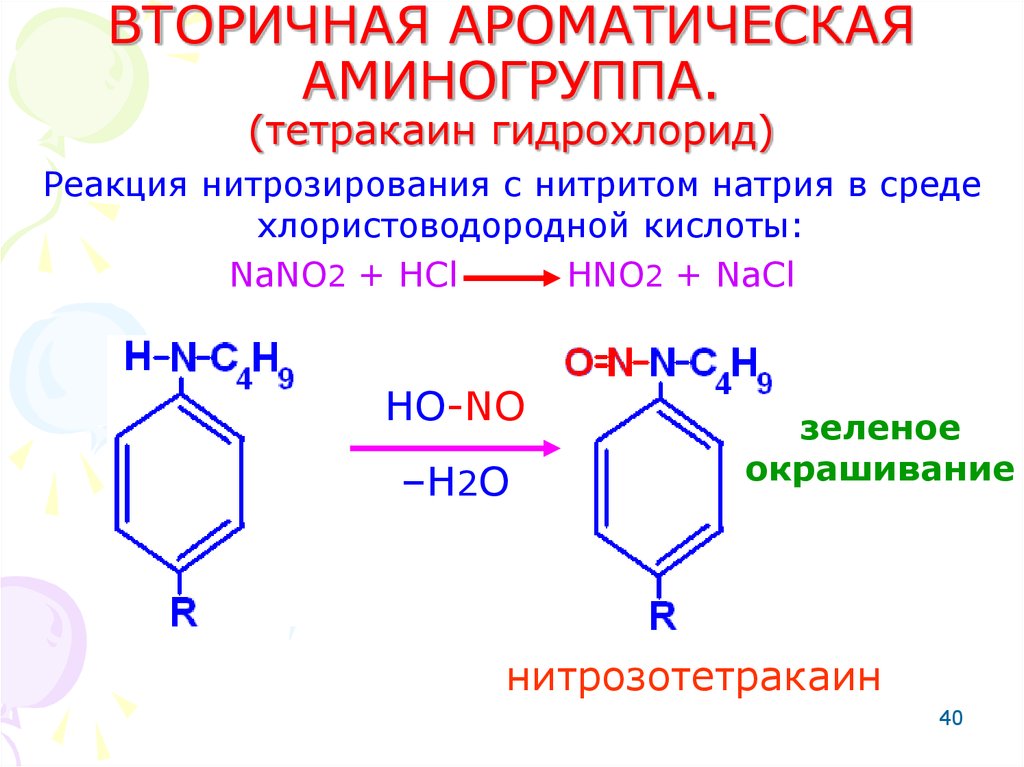
40. ВТОРИЧНАЯ АРОМАТИЧЕСКАЯ АМИНОГРУППА. (тетракаин гидрохлорид)
Реакция нитрозирования с нитритом натрия в средехлористоводородной кислоты:
NaNO2 + HCl
HNO2 + NaCl
HO-NO
–H2O
зеленое
окрашивание
нитрозотетракаин
40
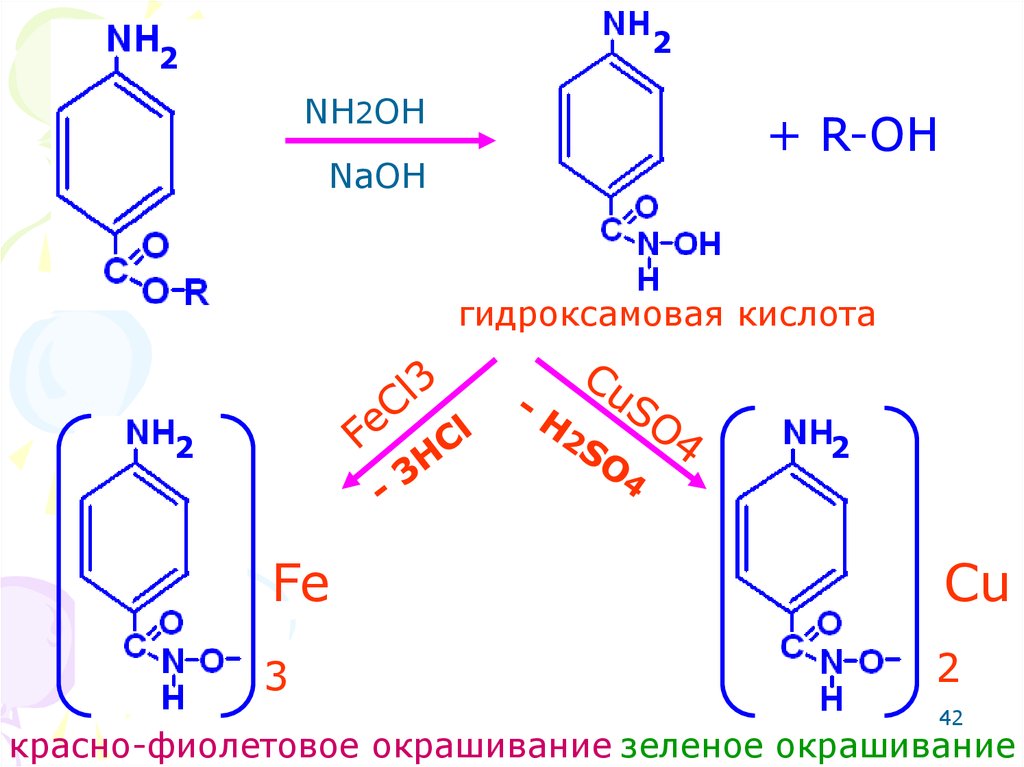
41. СЛОЖНО-ЭФИРНАЯ ГРУППА (бензокаин, прокаин, тетракаин и т.д.)
Реакция со щелочным растворомгидроксиламина при нагревании
образуется гидроксамовая кислота,
которая с хлоридом железа (III)
дает красно-фиолетовое
окрашивание, а сульфатом меди
(II) дает зеленое окрашивание.
41
42.
22
NH2OH
NaOH
+ R-OH
гидроксамовая кислота
2
2
Fe
Cu
3
2
42
красно-фиолетовое окрашивание зеленое окрашивание
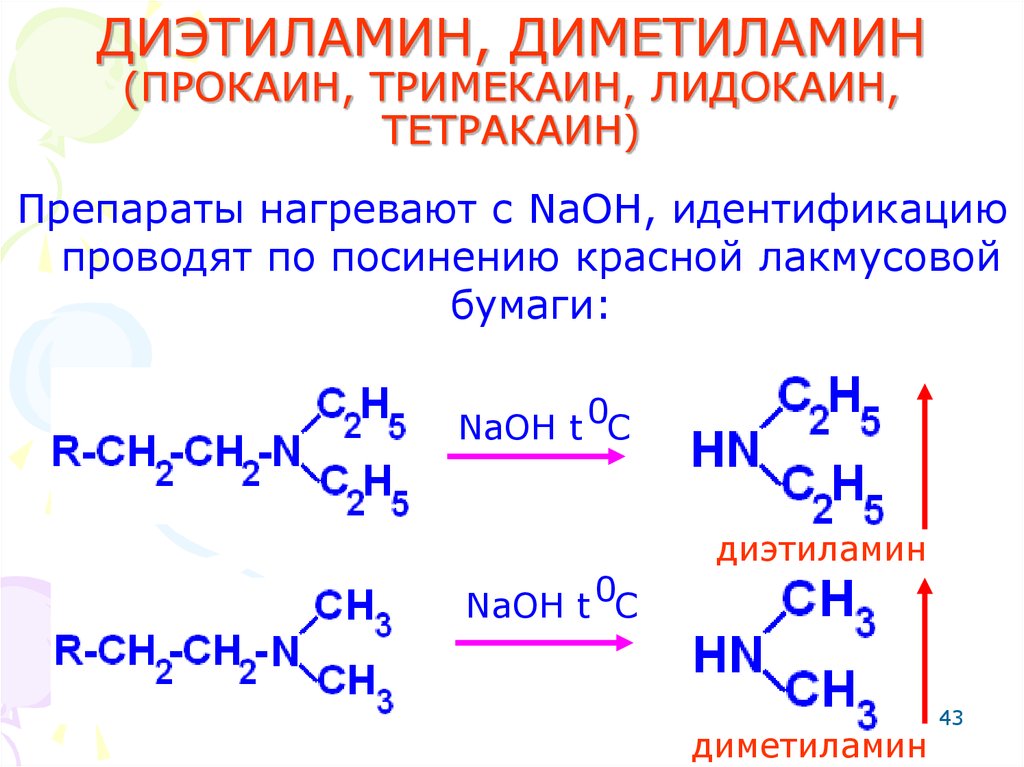
43. ДИЭТИЛАМИН, ДИМЕТИЛАМИН (ПРОКАИН, ТРИМЕКАИН, ЛИДОКАИН, ТЕТРАКАИН)
Препараты нагревают с NaOH, идентификациюпроводят по посинению красной лакмусовой
бумаги:
NaOH t 0C
NaOH t 0C
диэтиламин
диметиламин
43
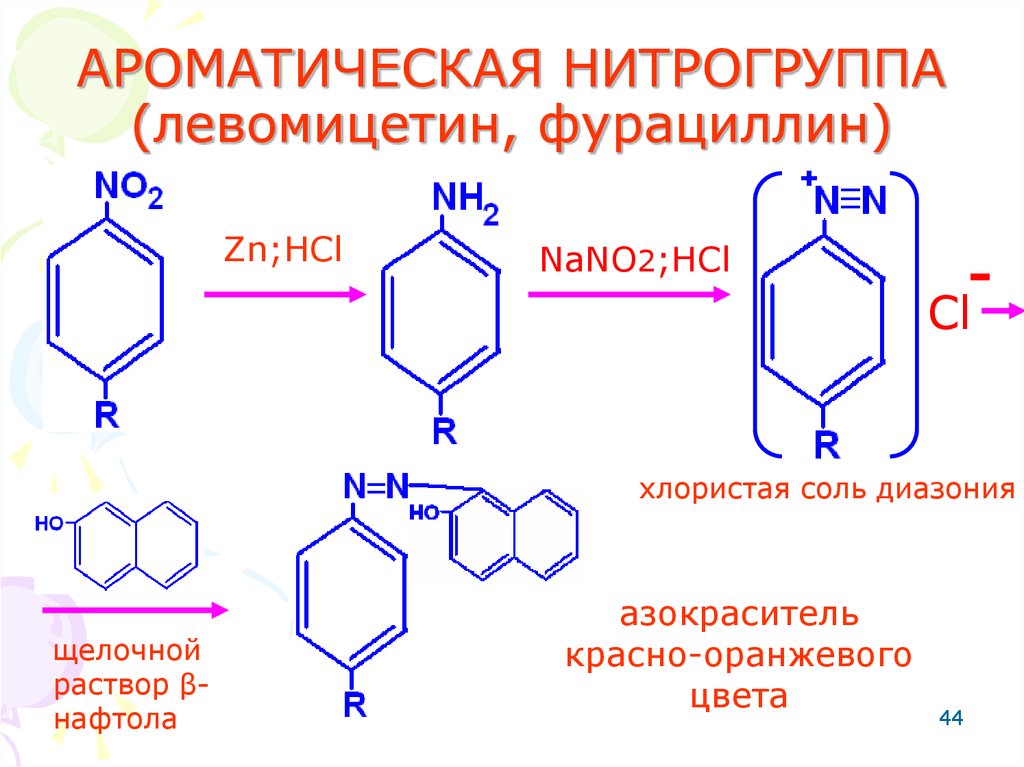
44. АРОМАТИЧЕСКАЯ НИТРОГРУППА (левомицетин, фурациллин)
Zn;HClNaNO2;HCl
-
Cl
хлористая соль диазония
щелочной
раствор βнафтола
азокраситель
красно-оранжевого
цвета
44
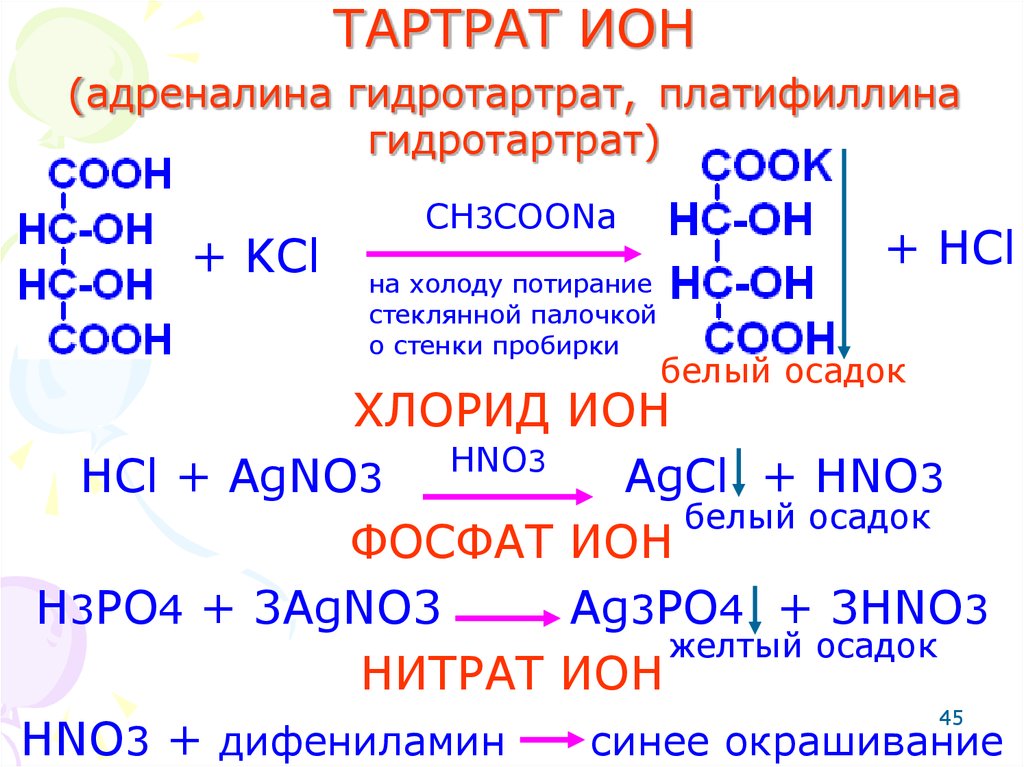
45. ТАРТРАТ ИОН (адреналина гидротартрат, платифиллина гидротартрат)
+ KClCH3COONa
на холоду потирание
стеклянной палочкой
о стенки пробирки
+ HCl
белый осадок
ХЛОРИД ИОН
HNO3
HCl + AgNO3
AgCl + HNO3
белый осадок
ФОСФАТ ИОН
H3PO4 + 3AgNO3
Ag3PO4 + 3HNO3
желтый осадок
НИТРАТ ИОН
45
HNO3 + дифениламин
синее окрашивание
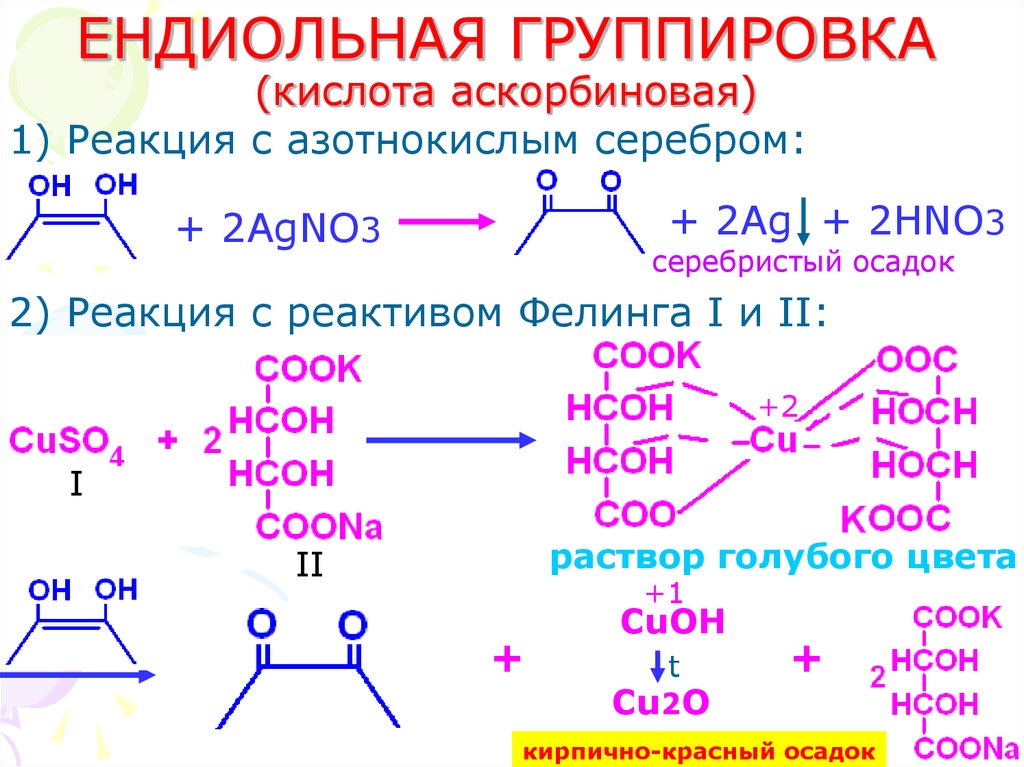
46. ЕНДИОЛЬНАЯ ГРУППИРОВКА (кислота аскорбиновая)
1) Реакция с азотнокислым серебром:+ 2Ag + 2HNO3
+ 2AgNO3
серебристый осадок
2) Реакция с реактивом Фелинга I и II:
+2
I
раствор голубого цвета
II
+1
+
CuOH
t
Cu2O
+
кирпично-красный осадок
46
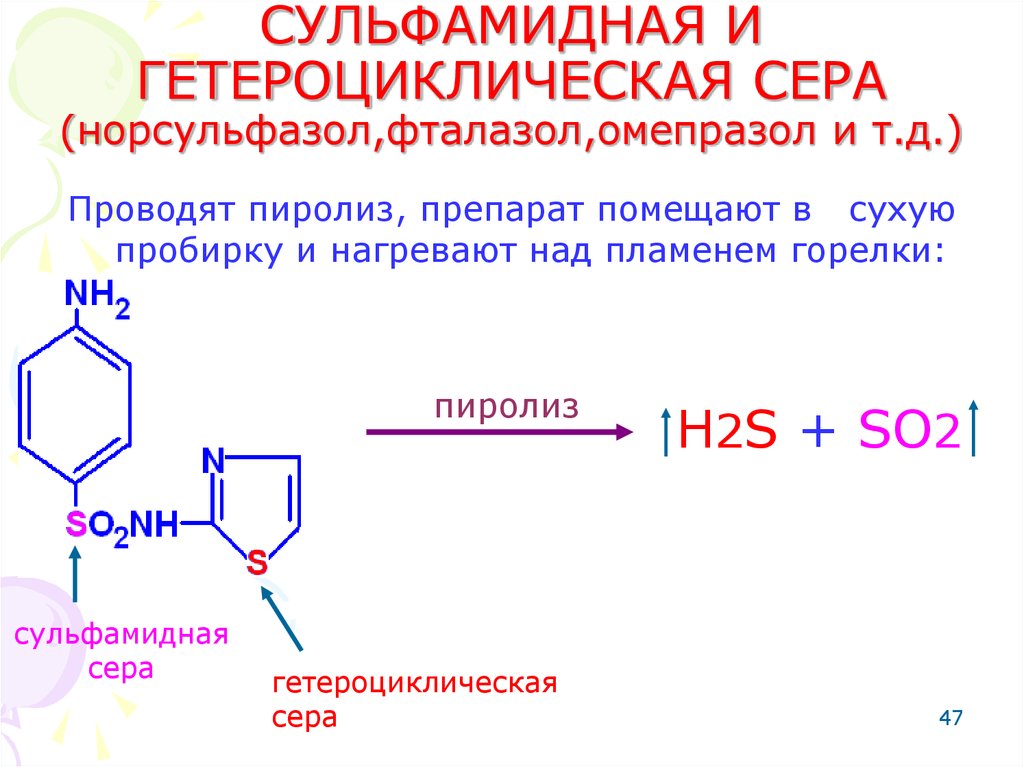
47. СУЛЬФАМИДНАЯ И ГЕТЕРОЦИКЛИЧЕСКАЯ СЕРА (норсульфазол,фталазол,омепразол и т.д.)
Проводят пиролиз, препарат помещают в сухуюпробирку и нагревают над пламенем горелки:
пиролиз
сульфамидная
сера
гетероциклическая
сера
H2S + SO2
47
48.
ГЕТЕРОЦИКЛИЧЕСКАЯ СЕРАПробирку закрывают бумагой, смоченной
ацетатом свинца
бумага чернеет
H2S + Pb(CH3COO)2
PbS + 2CH3COOH
черный осадок
СУЛЬФАМИДНАЯ СЕРА
Пробирку закрывают бумагой, пропитанной
йодатом калия и крахмалом
бумага
синеет от выделения свободного йода
5SO2 + 2KJO3
K2SO4 + 4SO3 + J2
48












 Химия
Химия








