Похожие презентации:
Типичные реакции оснований
1.
гидроксид аммония NH4OHОснования – это сложные вещества,
состоящие из ионов металлов и связанных с
ними гидроксид-ионов.
2.
Химические свойства основанийобусловлены наличием у них гидроксо-ионов ОН- .
3.
Взаимодействие основанийс кислотами
с оксидами неметаллов
с солями
4.
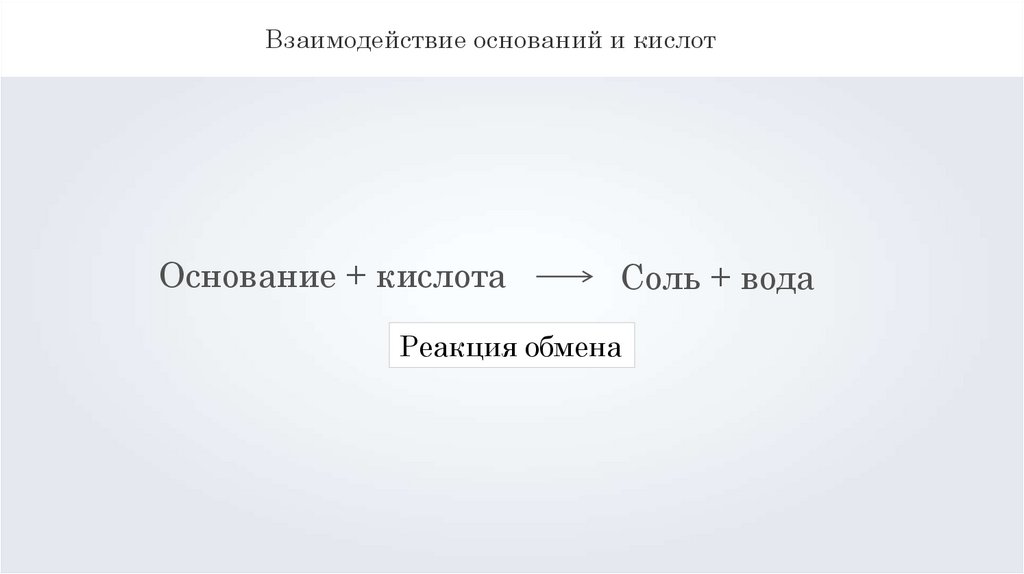
Взаимодействие оснований и кислотОснование + кислота
Соль + вода
Реакция обмена
5.
Взаимодействие оснований и кислотH2SO4
Фенолфталеин
NaOH
Na2SO4
6.
Взаимодействие оснований и кислотH2SO4 + 2NaOH = Na2SO4 + 2H2O
соль
Н+ + ОН- = H2O
Реакция нейтрализации
вода
7.
Взаимодействие щёлочи и оксидов неметалловЩёлочь + оксид неметалла
Соль + вода
8.
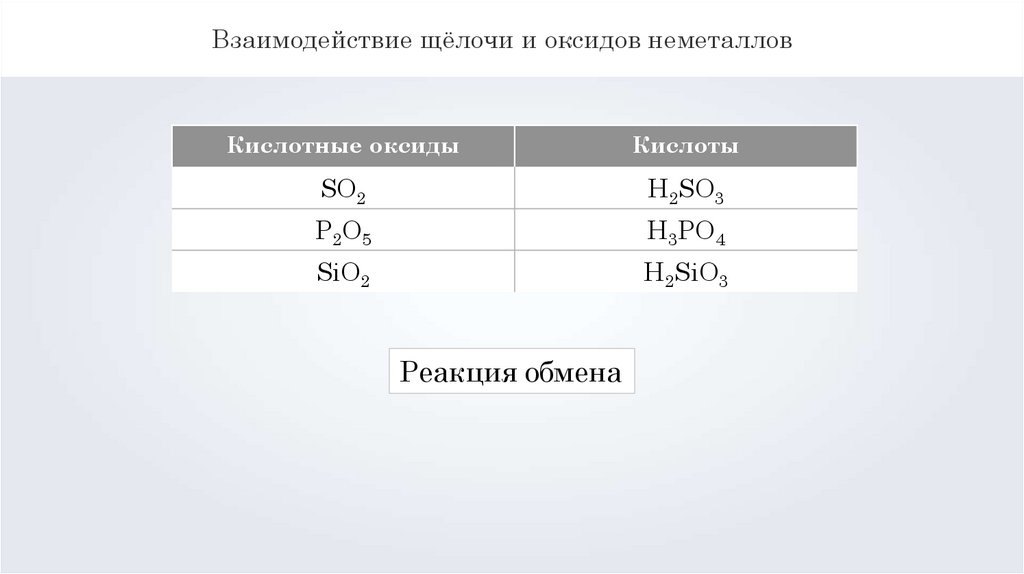
Взаимодействие щёлочи и оксидов неметалловКислотные оксиды
Кислоты
SO2
H2SO3
P2O5
H3PO4
SiO2
H2SiO3
Реакция обмена
9.
Взаимодействие щёлочи и оксидов неметалловСО2
СО2
Н2 O
Са(ОН)2
Са(CО)3 ↓
10.
Взаимодействие щёлочи и оксидов неметалловСа(ОН)2 + СО2 = СаСО3↓ + Н2О
соль
(осадок)
вода
11.
Взаимодействие щёлочи и солиСа(ОН)2 + СО2 = СаСО3↓ + Н2О
соль
(осадок)
вода
12.
Взаимодействие щёлочи и солиПротекание реакции взаимодействия щелочей и
солей происходит только в случае образования
нерастворимого осадка или газа.
Реакция ионного обмена
13.
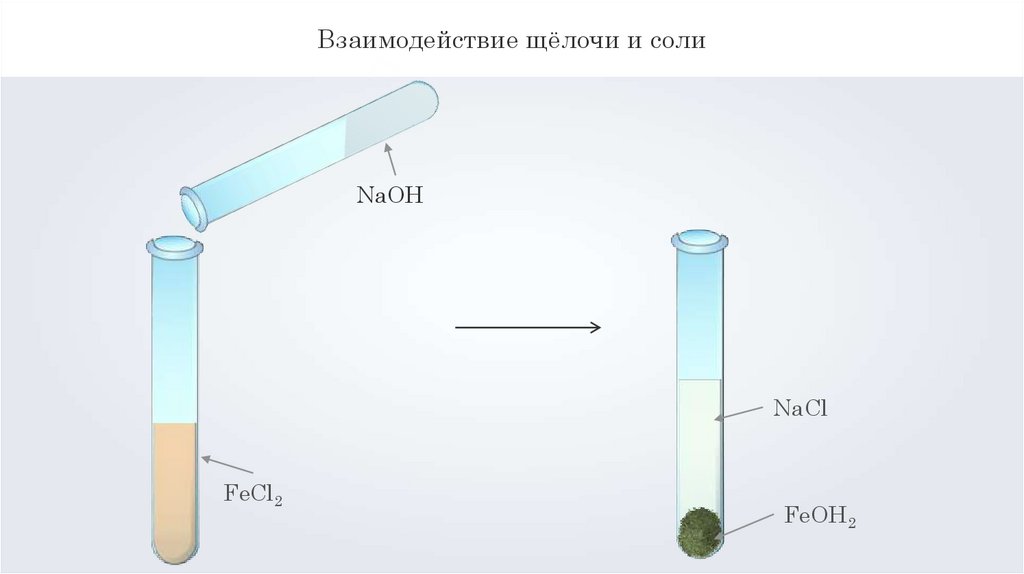
Взаимодействие щёлочи и солиNaOH
NaСl
FeСl2
FeOH2
14.
Взаимодействие щёлочи и соли2NaOH + FeCl2 = 2NaCl + Fe(OH)2↓
хлорид натрия
гидроксид железа
2OH- + Fe2+ = Fe(OH)2↓
15.
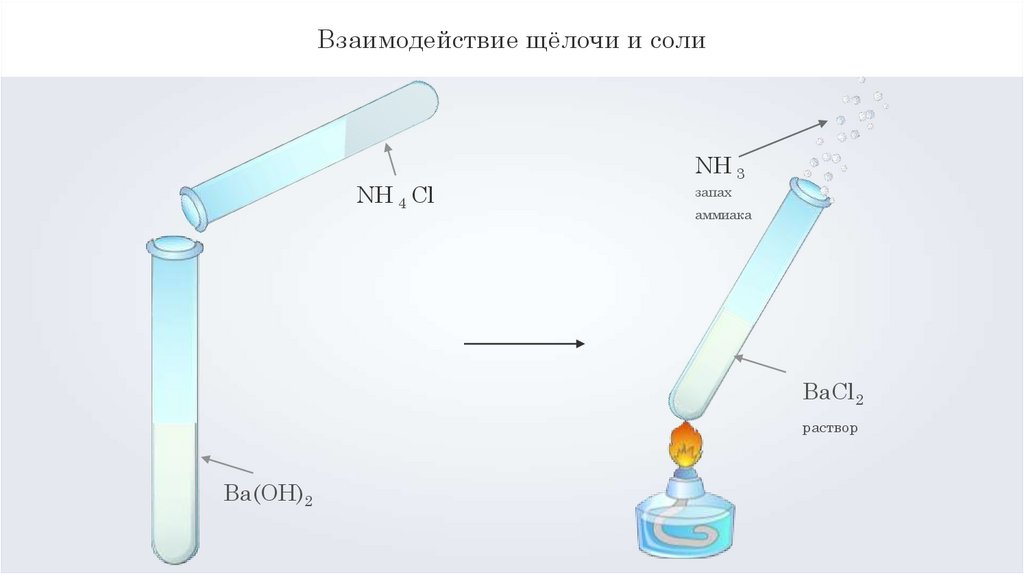
Взаимодействие щёлочи и солиNH 4 Cl
NH 3
запах
аммиака
BaCl2
раствор
Ba(OH)2
16.
Взаимодействие щёлочи и солиBa(OH)2 + 2NH4Cl = BaCl2 + 2NH3↑ + 2Н2О
хлорид
бария
аммиак
2OH- + 2NH4+ = 2NH3↑ + 2Н2О
вода
17.
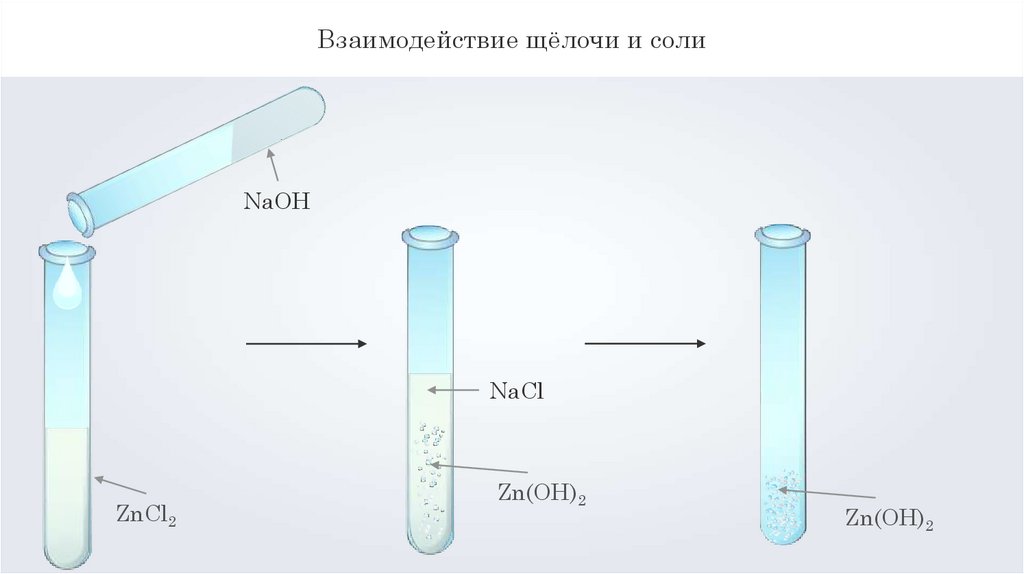
Взаимодействие щёлочи и солиNaOH
NaCl
ZnCl2
Zn(OH)2
Zn(OH)2
18.
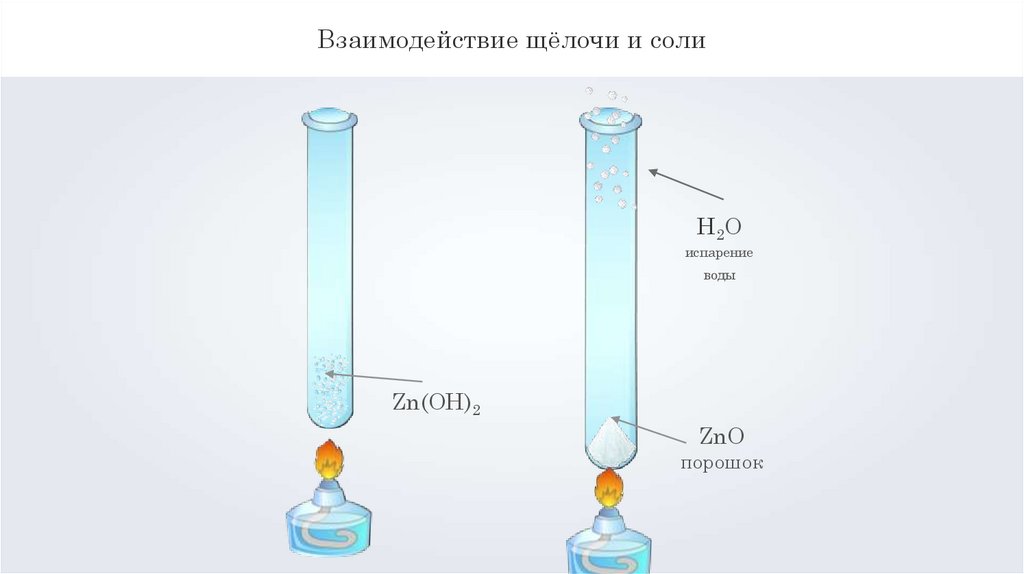
Взаимодействие щёлочи и солиH2O
испарение
воды
Zn(OH)2
ZnO
порошок
19.
Взаимодействие щёлочи и соли2NaOH + ZnCl2 = 2NaCl + Zn(OH)2↓
2OH- + Zn2+ = Zn(OH)2↓
Zn(OH)2t= ZnO + H2O
20.
Основания взаимодействуют с кислотами,оксидами металлов и солями, а также
разлагаются под воздействием температуры на
оксид и воду.













 Химия
Химия








