Похожие презентации:
Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления-восстановления
1.
Свойства оксидов, кислот,оснований и солей в свете
теории электролитической
диссоциации и процессов
окисления-восстановления
2.
Химическиесвойства
Оксидов
Кислот
Оснований
Солей
3.
ОксидыВ составсостоят
оксидаиз
может
двух
элементов,
входить какодин
металл,
из так
которых
и неметалл
– кислород
4.
O2Кислотный
оксид
O2
Основный
Кислотный
оксид
Валентность
Валентность >< IV
IV
5.
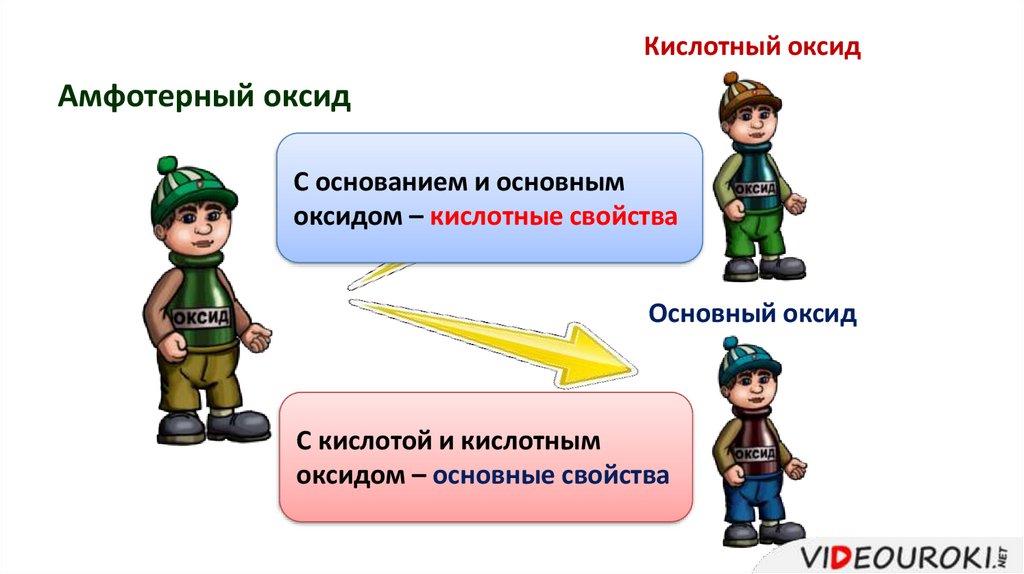
Кислотный оксидАмфотерный оксид
С основанием и основным
оксидом – кислотные свойства
Основный оксид
С кислотой и кислотным
оксидом – основные свойства
6.
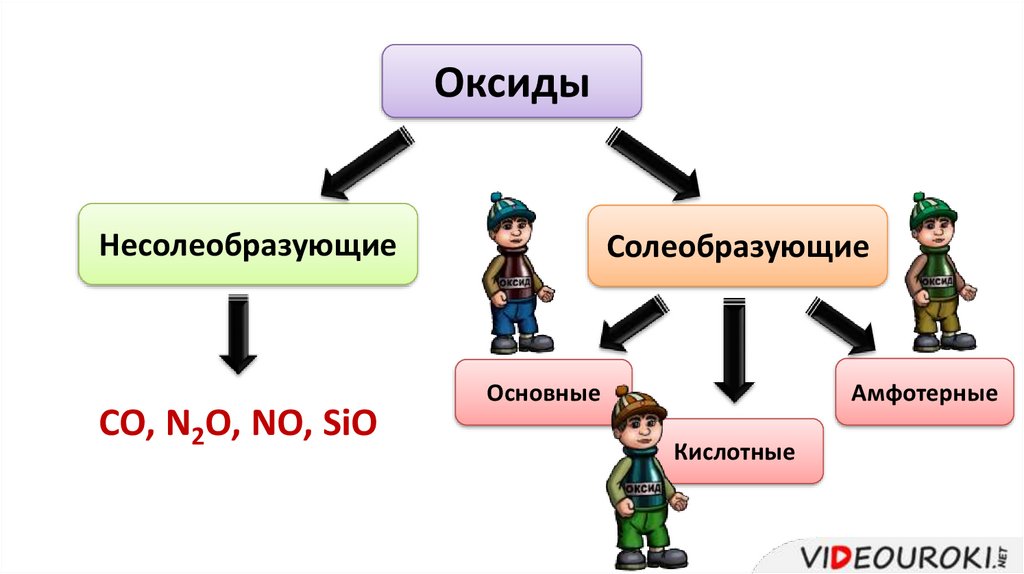
ОксидыНесолеобразующие
CO, N2O, NO, SiO
Солеобразующие
Амфотерные
Основные
Кислотные
7.
Несолеобразующие оксиды невзаимодействуют ни с
кислотами, ни с основаниями
и не образуют солей
8.
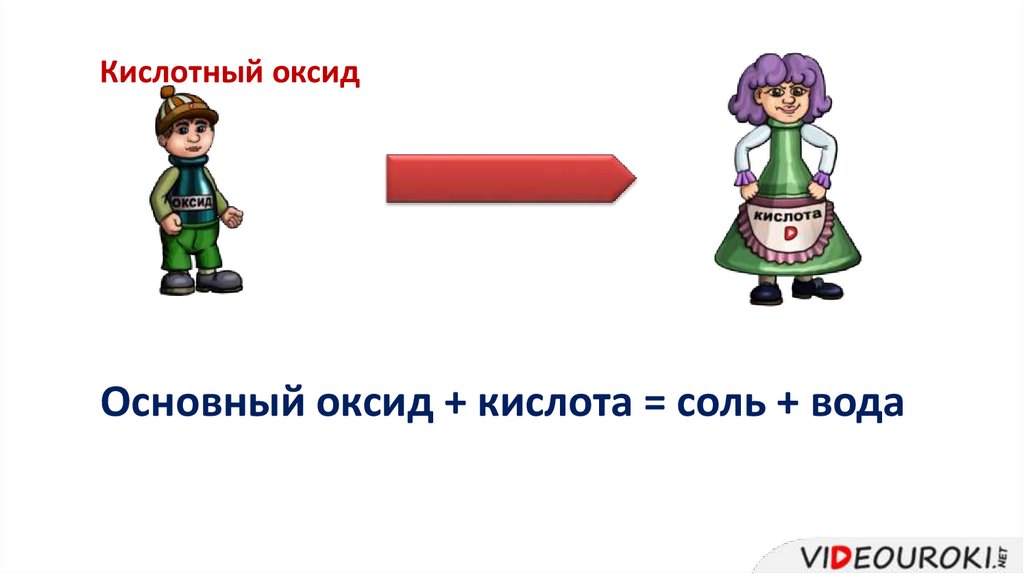
Основный оксидОсновный оксид + кислота = соль + вода
9.
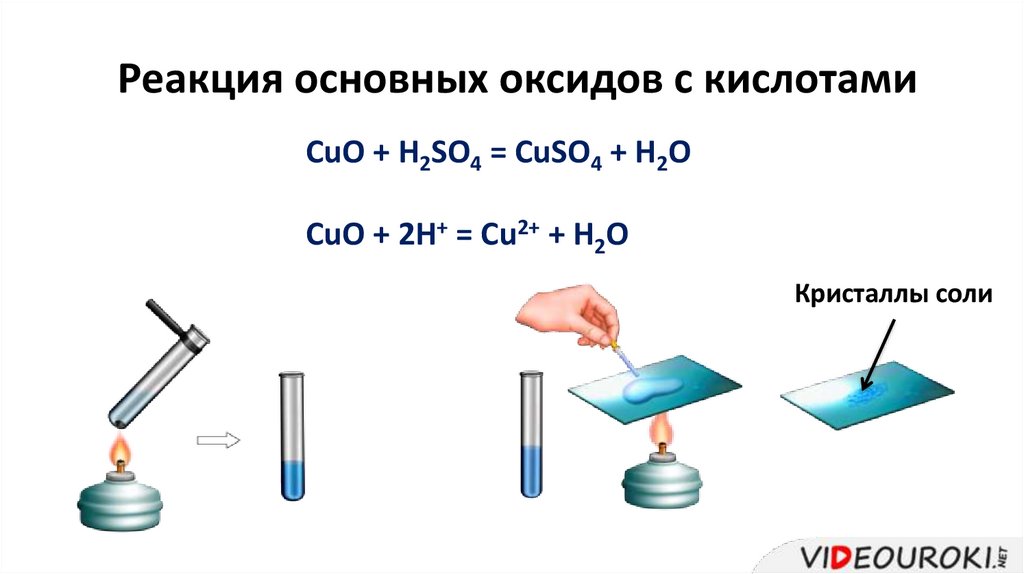
Реакция основных оксидов с кислотамиCuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Кристаллы соли
10.
Реакция основных оксидов с кислотнымиОсновный оксид + кислотный оксид = соль
3Na2O + P2O5 = 2Na3PO4
MgO + SO3 = MgSO4
CaO + CO2 = CaCO3
11.
Реакция основных оксидов с водойОсновный оксид + вода = основание
CaO
CaO + H2O = Ca(OH)2
CuO
CuO + H2O ≠
12.
Кислотный оксидОсновный оксид + кислота = соль + вода
13.
Реакция кислотных оксидов с основаниямиCO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
14.
Кислотные оксиды реагируютс основными оксидами с
образованием солей
15.
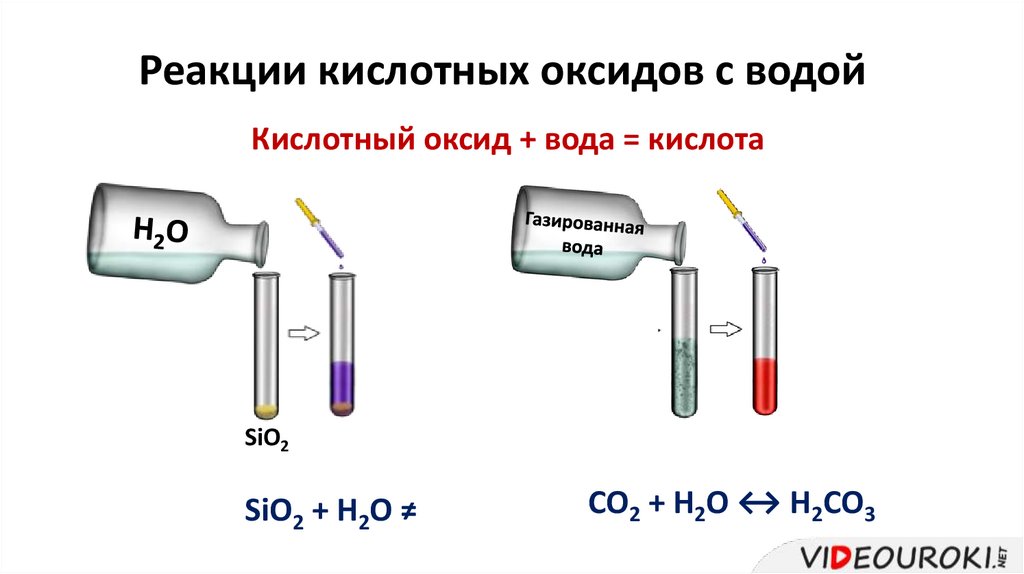
Реакции кислотных оксидов с водойКислотный оксид + вода = кислота
SiO2
SiO2 + H2O ≠
CO2 + H2O ↔ H2CO3
16.
Амфотерные оксидыреагируют и с кислотами,
и с основаниями
17.
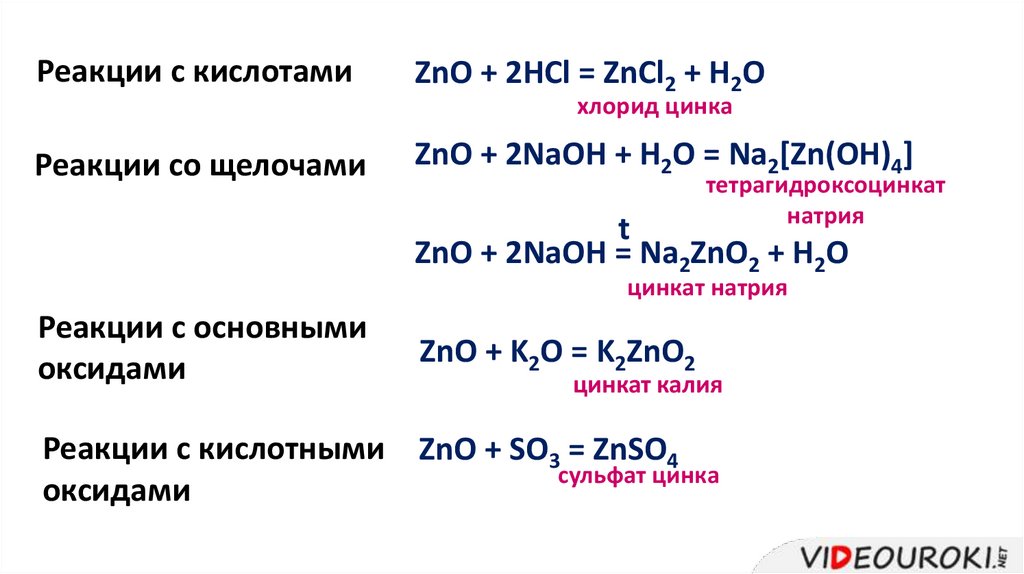
Реакции с кислотамиZnO + 2HCl = ZnCl2 + H2O
хлорид цинка
Реакции со щелочами
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
тетрагидроксоцинкат
натрия
t
ZnO + 2NaOH = Na2ZnO2 + H2O
цинкат натрия
Реакции с основными
оксидами
ZnO + K2O = K2ZnO2
цинкат калия
Реакции с кислотными ZnO + SO3 = ZnSO4
сульфат цинка
оксидами
18.
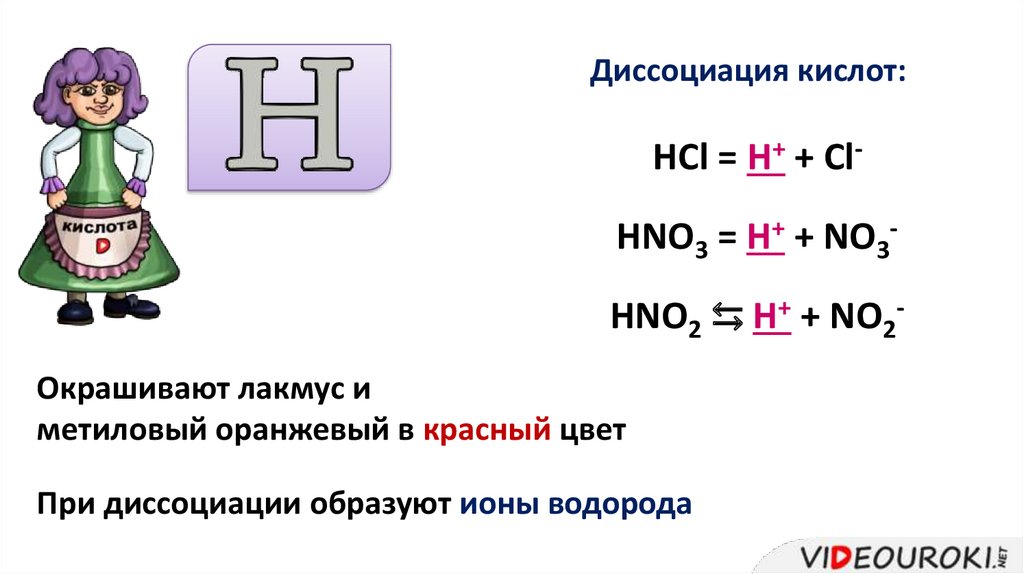
Диссоциация кислот:HCl = H+ + ClHNO3 = H+ + NO3HNO2 ⇆ H+ + NO2Окрашивают лакмус и
метиловый оранжевый в красный цвет
При диссоциации образуют ионы водорода
19.
NaOH + HCl = NaCl + H2OОН- + Н+ = Н2О
Кристаллы соли
20.
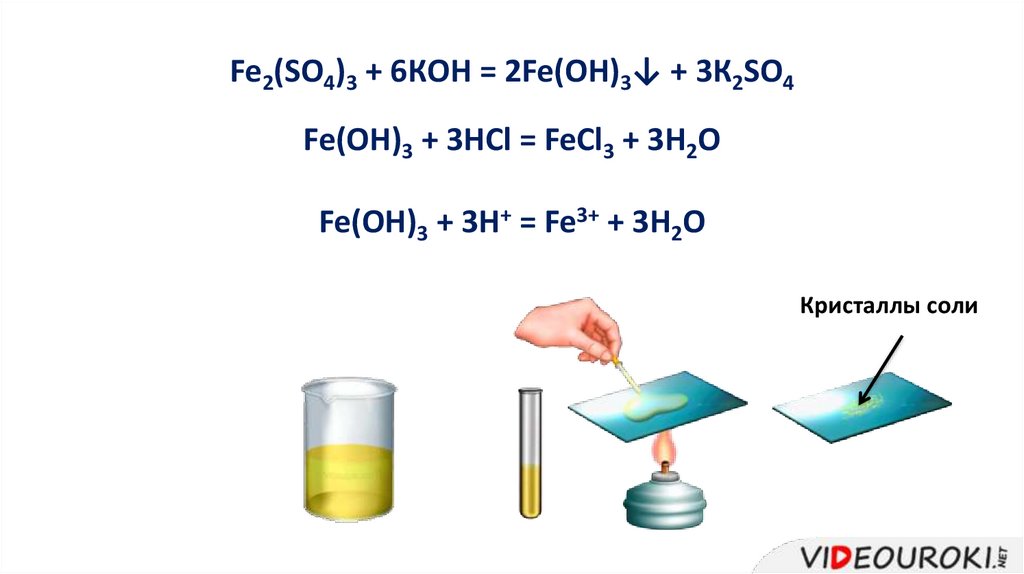
Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Кристаллы соли
21.
В результатереакции
Кислоты
вступают
в
образуется
соль ис
реакции
обмена
вода
основными
оксидами
22.
При этомреагируютобразуетсяс
Кислоты
Это реакции замещения
соль и водород
металлами
23.
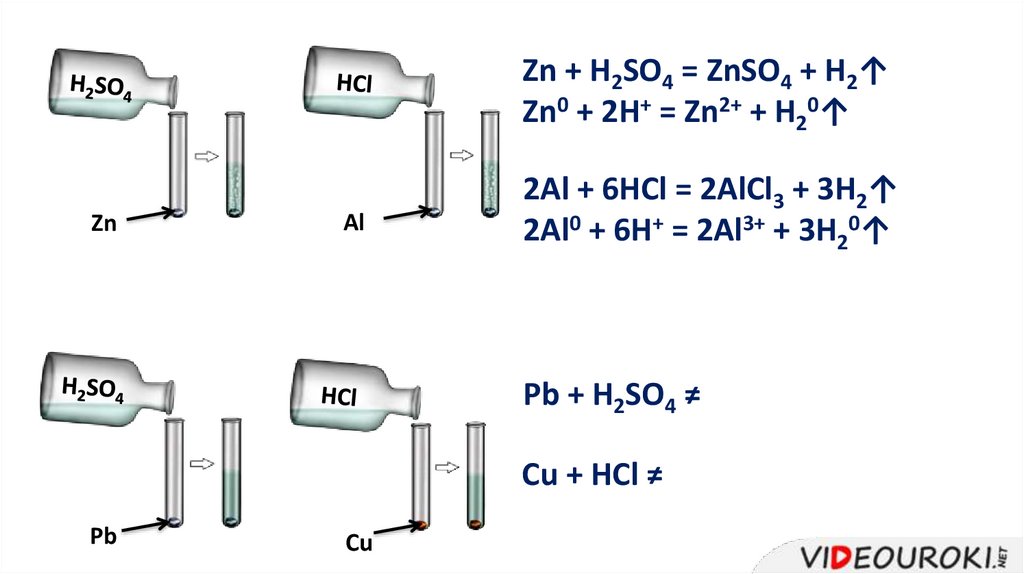
Для этих реакций необходимы условия:• Металл должен находиться в ряду напряжений до
водорода;
• Должна получиться растворимая соль;
• Нерастворимые кислоты не вступают в реакцию
с металлами;
24.
Zn + H2SO4 = ZnSO4 + H2↑Zn0 + 2H+ = Zn2+ + H20↑
Zn
Al
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠
Pb
Cu
25.
ПриРеакция
этом образуется
идёт, еслив
Кислоты
вступают
новая
образуется
кислота
осадок
и новая
реакции
обмена
с
соль
или газ
солями
26.
Na2SiO3K2CO3
BaCl2
2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
2H+ + SiO32- = H2SiO3↓
H2SO4 + K2CO3 = K2SO4 + CO2↑ + H2O
2H+ + CO32- = CO2↑ + H2O
HCl + BaCl2 ≠
27.
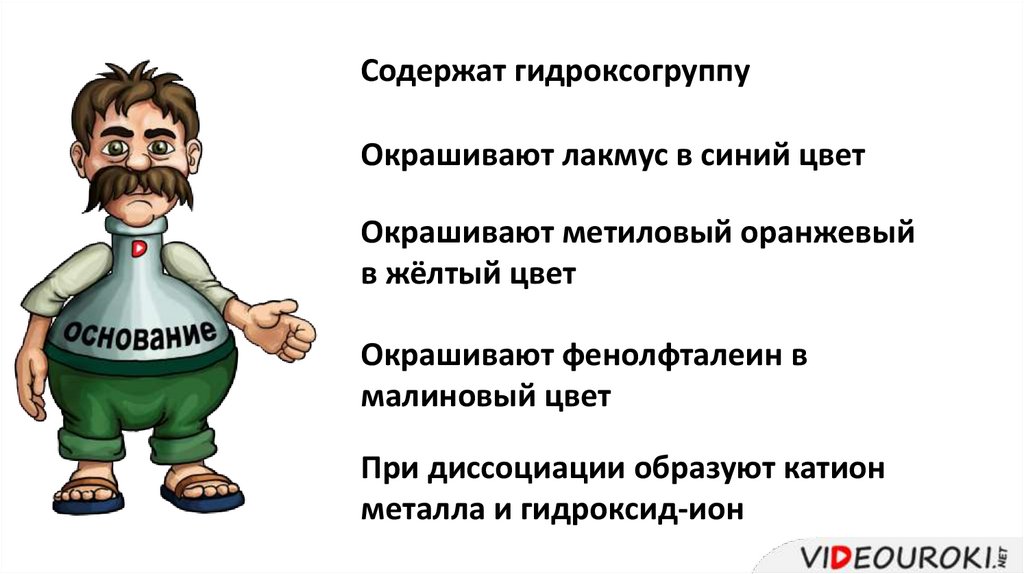
Содержат гидроксогруппуОкрашивают лакмус в синий цвет
Окрашивают метиловый оранжевый
в жёлтый цвет
Окрашивают фенолфталеин в
малиновый цвет
При диссоциации образуют катион
металла и гидроксид-ион
28.
Вступаютв–реакциюс
Щёлочи
Щёлочи
реагируют
нейтрализации
растворимые
кислотными
и вс воде
кислотами
основания оксидами
амфотерными
29.
Реакции с амфотерными основаниямиZn(OH)2 + 2NaOH = Na2[Zn(OH)4]
тетрагидроксоцинкат
натрия
t
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
цинкат натрия
30.
Щёлочивступают в
Должен
образоваться
Образуется
новая соль и
реакцию
осадок
илиобмена
слабый с
новое основание
солями
электролит
31.
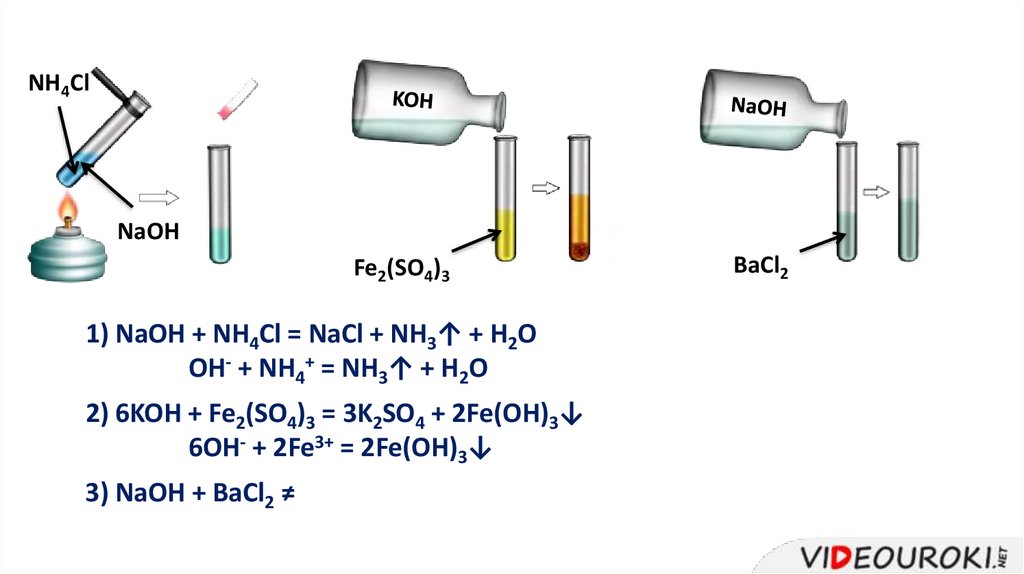
NH4ClNaOH
Fe2(SO4)3
1) NaOH + NH4Cl = NaCl + NH3↑ + H2O
OH- + NH4+ = NH3↑ + H2O
2) 6KOH + Fe2(SO4)3 = 3K2SO4 + 2Fe(OH)3↓
6OH- + 2Fe3+ = 2Fe(OH)3↓
3) NaOH + BaCl2 ≠
BaCl2
32.
Нерастворимыеоснования
Щёлочи при нагревании
при
не нагревании
разлагаются
разлагаются
33.
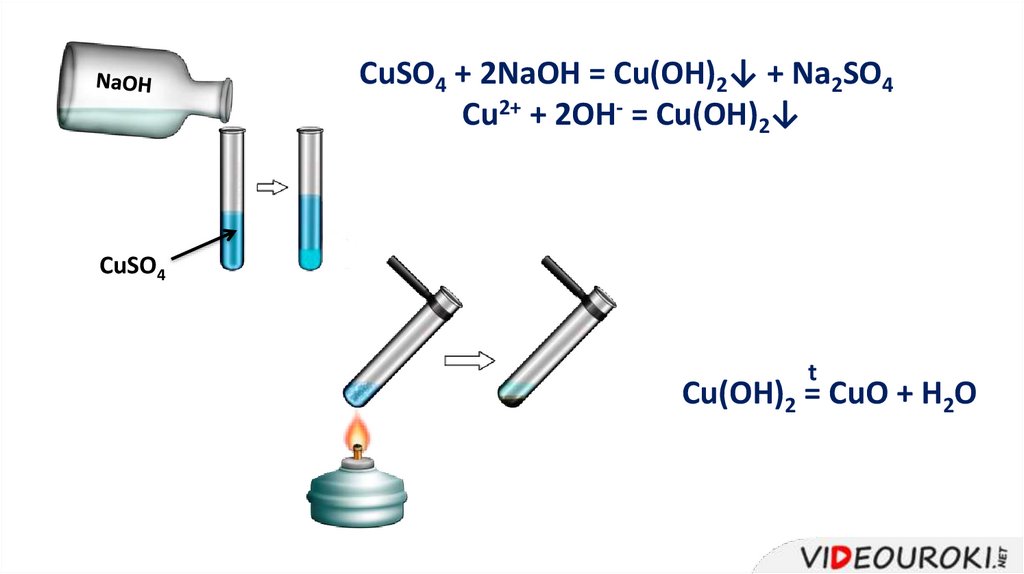
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4Cu2+ + 2OH- = Cu(OH)2↓
CuSO4
t
Cu(OH)2 = CuO + H2O
34.
При диссоциации образуютСоли – особый класс
катионы металла и анионы
кислотного остатка
35.
Соли реагируют друг с другом с образованием новых солейAgNO3 + NaCl = AgCl↓ + NaNO3
Ag+ + Cl- = AgCl↓
В реакциях с кислотами образуется более слабая кислота
Na2CO3 + 2HCl = NaCl + H2CO3 (H2O + CO2↑)
CO32- + 2H+ = H2O + CO2↑
В реакциях с основаниями образуется новая соль
и новое основание
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Cu2+ + 2OH- = Cu(OH)2↓
36.
Для этого нужноСоли реагируют
использовать
ряд с
металлами
активности
металлов
37.
Каждый металл вытесняет израствора соли металлы,
расположенные правее его в
этом ряду
Обе соли (и реагирующая, и
образующаяся) должны быть
растворимыми
Металлы не должны реагировать
с водой
38.
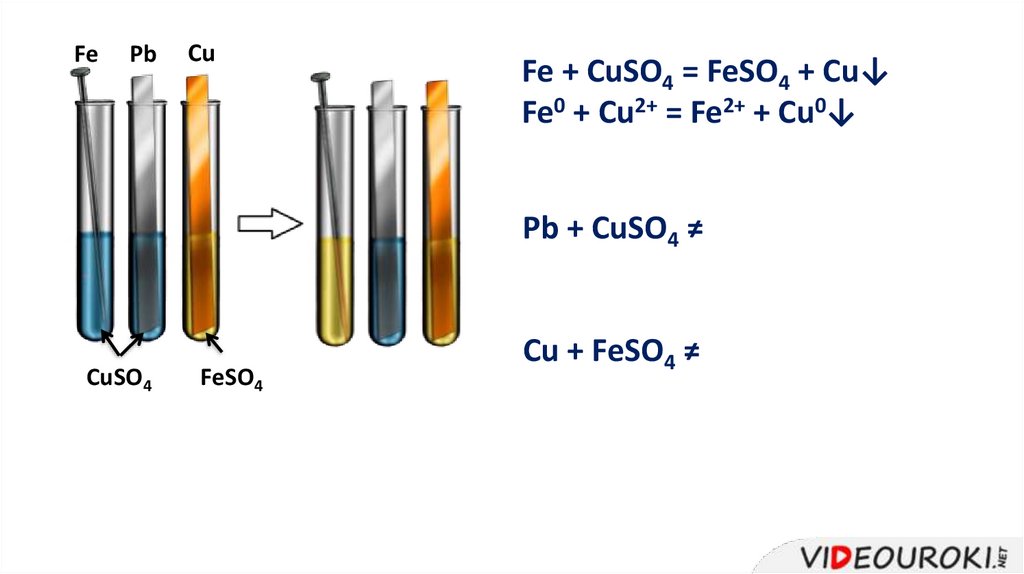
FePb
Cu
Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
CuSO4
FeSO4
Cu + FeSO4 ≠
39.
Известны ли вам детиКакие есть оксиды на планете?
Основные
оксиды
У оксидов пристрастия разные
То кислоты им нравятся праздные
То к воде их душа склоняется –
скажите, как они называются?
40.
А эти спешат к основаниям,Растворимые, очень желанные,
Кислотные
оксиды
Но с водой дружбу водят не все
Уж поверь…
Назовите оксиды теперь.
41.
Мы состоим из двух частей:Во-первых, водород, о’кей!
Кислоты
Во-вторых, остаток наш.
Ну, вот и весь наш экипаж!
Окрасим лакмус в красный цвет,
Без нас и удобрений нет.
42.
Мы – жители непростые,Нас очень много на Земле!
Особым даром обладая,
Мы растворяемся в воде.
А как на кожу попадём,
Мы тут же сильно обожжем.
Окрасим лакмус в синий цвет,
Без нас нейтрализации нет.
Без нас не обойдётесь тут!
Скажите, как же нас зовут?
Щёлочи
43.
Хоть мы разные на цвет,Но важней нас в мире нет!
И нитраты, и сульфаты,
Карбонаты и фосфаты!
Все важны и все нужны!
Догадались, кто же мы?
Соли






























 Химия
Химия








