Похожие презентации:
Состав вещества
1.
NH32.
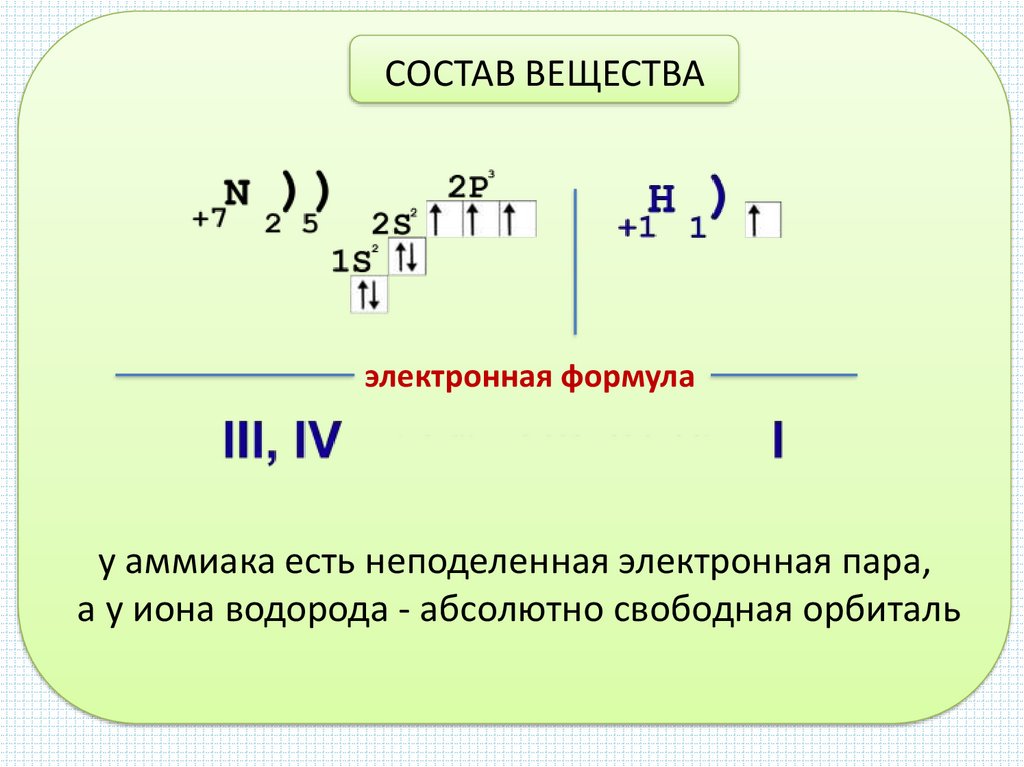
СОСТАВ ВЕЩЕСТВАэлектронная формула
у аммиака есть неподеленная электронная пара,
а у иона водорода - абсолютно свободная орбиталь
3.
СТРОЕНИЕ..
H
N H
H
..
H
N
H
Молекула образована
ковалентной полярной связью
Есть возможность образовать
донорно – акцепторную связь
.
+
H+ H
H
H N H
H
..
+
4.
ФИЗИЧЕСКИЕ СВОЙСТВА NH3При нормальных условиях —
бесцветный газ с резким
характерным запахом
Жидкий аммиак
практически не проводит
электрический ток.
Твёрдый аммиак —
бесцветные кубические
кристаллы
почти вдвое
легче воздуха
ядовит
жидкий аммиак —
хороший растворитель
хорошо
растворим в воде
5.
ХИМИЧЕСКИЕ СВОЙСТВА NH3Реакции с изменением степени окисления атома азота
(реакции окисления) N-3 → N0 → N+2 (NH3 – сильный
восстановитель)
с кислородом
1. Горение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака
(катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
6.
ХИМИЧЕСКИЕ СВОЙСТВА NH3Реакции с изменением степени окисления атома азота
(реакции окисления) N-3 → N0 → N+2 (NH3 – сильный
восстановитель)
с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O
с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
при нагревании разлагается
2NH3↔ N2 + 3H2
7.
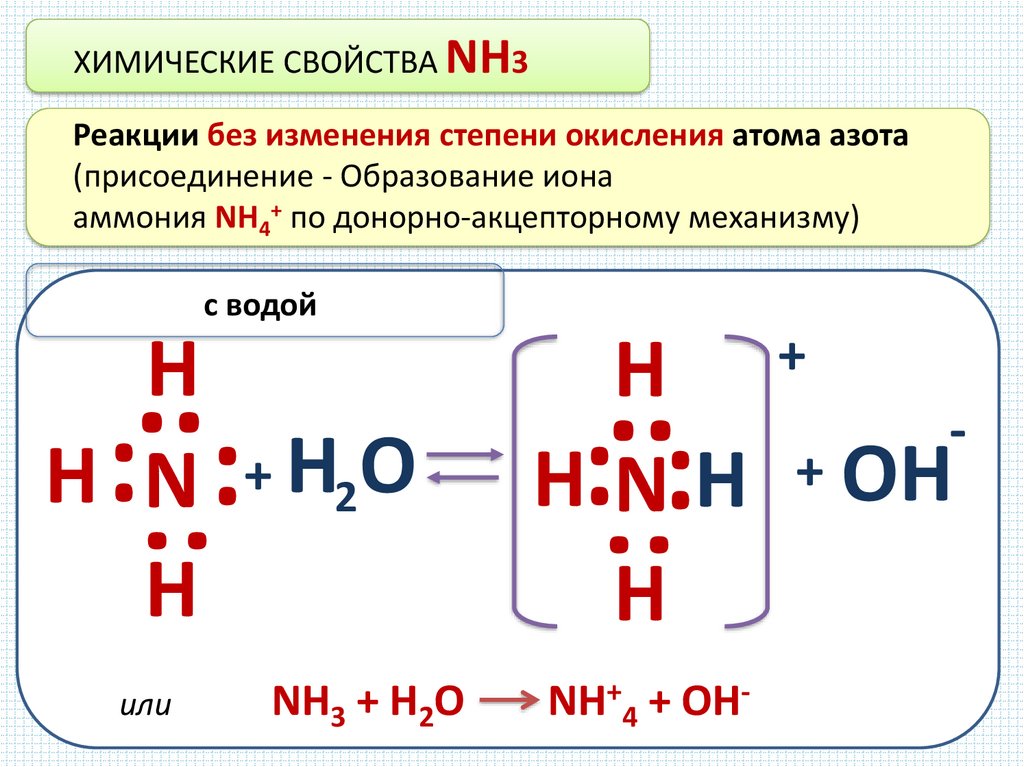
ХИМИЧЕСКИЕ СВОЙСТВА NH3Реакции без изменения степени окисления атома азота
(присоединение - Образование иона
аммония NH4+ по донорно-акцепторному механизму)
с водой
или
NH3 + H2O
H
..
H:N:H
H
:
:
H
.. + H О
H :N : 2
H
NH+4 + OH-
+
-
+ ОH
8.
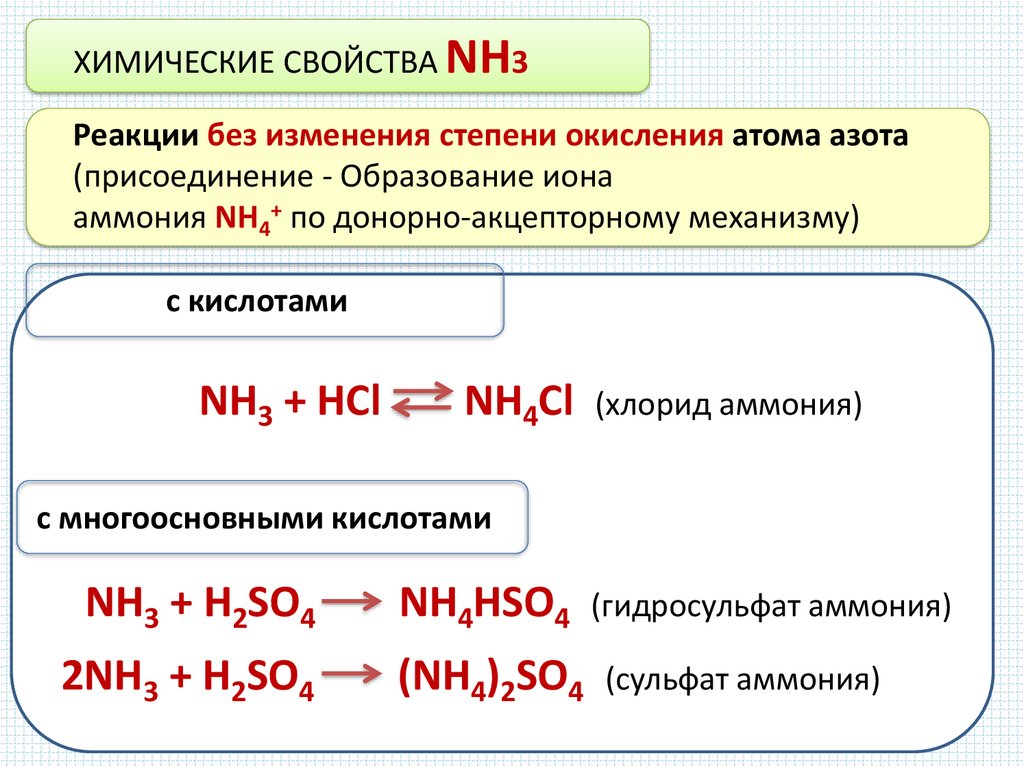
ХИМИЧЕСКИЕ СВОЙСТВА NH3Реакции без изменения степени окисления атома азота
(присоединение - Образование иона
аммония NH4+ по донорно-акцепторному механизму)
с кислотами
NH3 + HCl
NH4Cl
(хлорид аммония)
с многоосновными кислотами
NH3 + H2SO4
NH4HSO4
2NH3 + H2SO4
(NH4)2SO4
(гидросульфат аммония)
(сульфат аммония)
9.
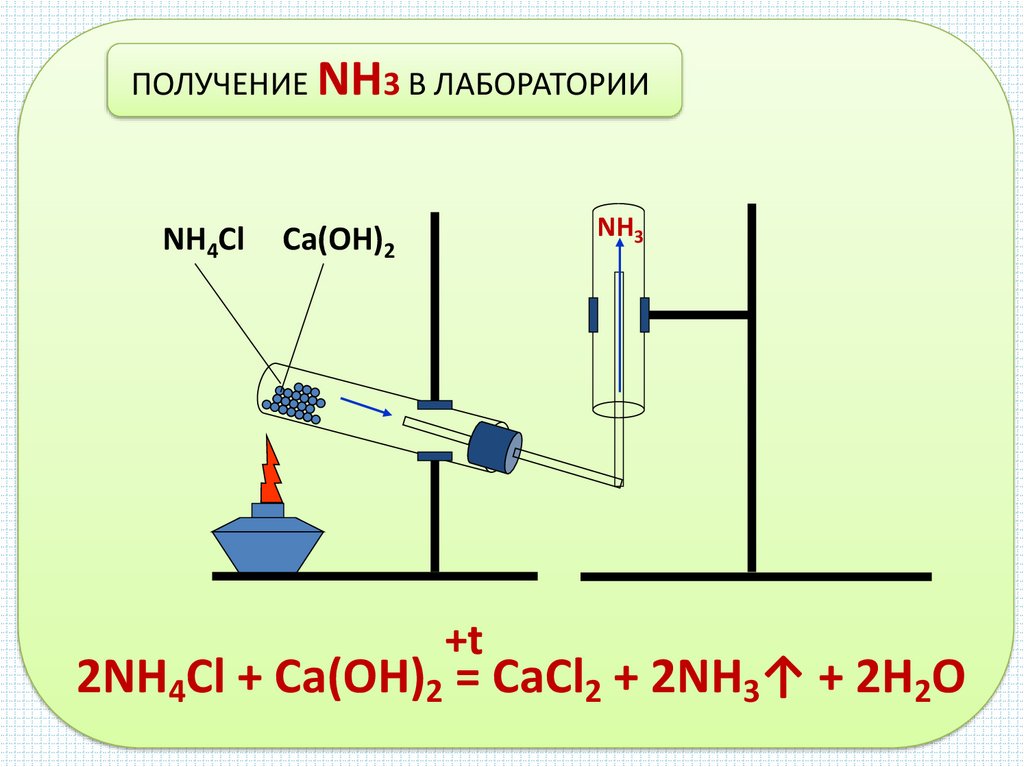
ПОЛУЧЕНИЕ NH3 В ЛАБОРАТОРИИNH4Cl
NH3
Ca(OH)2
+t
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
10.
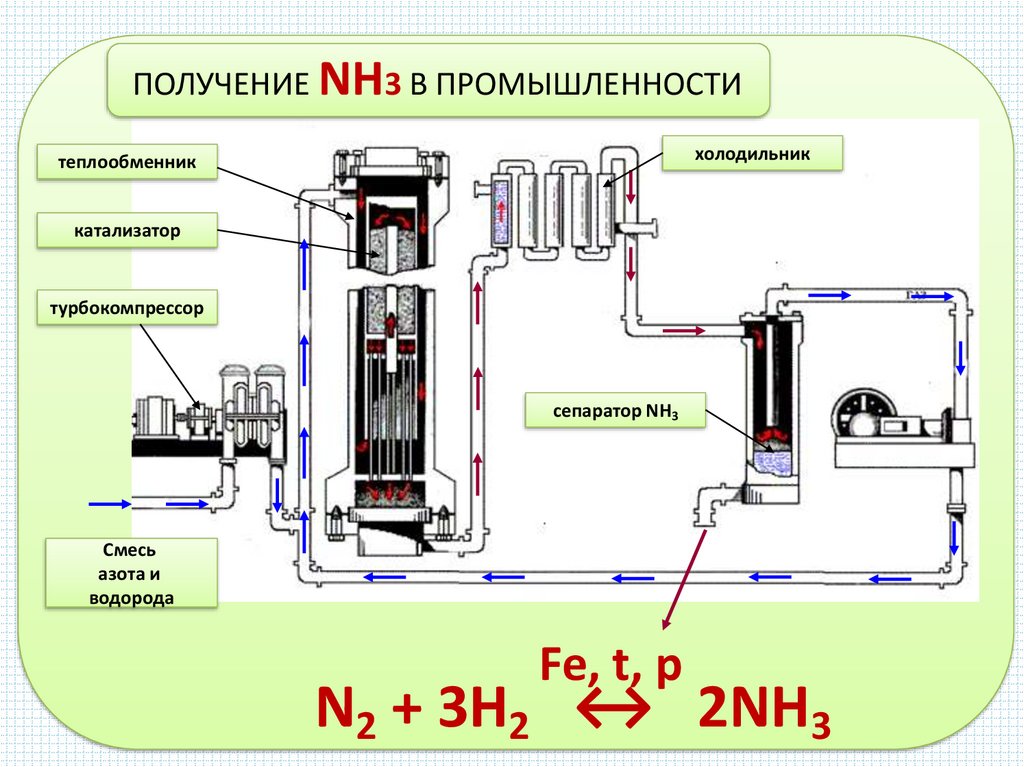
ПОЛУЧЕНИЕ NH3 В ПРОМЫШЛЕННОСТИхолодильник
теплообменник
катализатор
турбокомпрессор
сепаратор NH3
Смесь
азота и
водорода
Fe, t, p
N2 + 3H2 ↔ 2NH3
11.
ПРИМЕНЕНИЕ NH3для получения азотной
кислоты
производство удобрений
в качестве дешевого
хладагента
в медицине (нашатырный
спирт)
для получения синтетических волокон
при очистке и крашении
хлопка, шерсти и шелка
12.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные
уравнения.
№2. Напишите четыре уравнения химических реакций, в
результате которых образуется аммиак.






 Химия
Химия








