Похожие презентации:
Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям
1. ТЕОРИЯ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС И ЕГО ПРИМЕНЕНИЕ К ГЕТЕРОГЕННЫМ РАВНОВЕСИЯМ лектор – проф. Васюк С. А. 2016
2. План
1. Теория сильных электролитов.2. Закон действующих масс. Константа равновесия.
3. Гетерогенные равновесия в системе «осадок насыщенный раствор малорастворимого электролита».
4. Произведение растворимости и его связь с
растворимостью.
5. Условия образования осадков.
6. Факторы, влияющие на растворимость.
7. Дробное осаждение.
8. Перевод одних малорастворимых осадков в другие.
9. Применение реакций осаждения в аналитической химии.
3. Теория сильных электролитов Дебая- Хюккеля
Активность (а) - это мера реального поведения вещества врастворе. Ее значение связано с молярной концентрацией иона:
а = f ∙ СМ,
где f – коэффициент активности, характеризующий степень
отклонения свойств реальных растворов от свойств идеальных
растворов.
Для бесконечно разбавленных растворов f=1, для реальных
растворов а< СМ.
Ионная сила раствора (I) равна полусумме произведений
концентраций отдельных ионов на квадрат их зарядов:
1
2
I Ci Zi
2
где Ci –концентрация иона, моль/л;
Zi – величина заряда иона.
4.
Для равновесной химической реакции:aA + bB cC + dD
Скорость прямой реакции:
Скорость обратной реакции:
V1 = k1[A]a ∙ [B]b;
V2 = k2[C]c ∙ [D]d ,
где k1, k2 – константы скоростей прямой и обратной
реакции, постоянные при данной температуре;
[A], [B], [C], [D] – концентрации исходных веществ и
продуктов реакции, моль/л;
a, b, c, d – стехиометрические коэффициенты.
5.
k 1 С DK равн. К С
a
b
k 2 [A] [B]
с
d
6.
Kгде a A , a B , a C , a D
0
равн.
К
0
Т
a
a
a a
c
C
a
A
d
D
b
B
- активности исходных веществ А и В и
продуктов реакции С и D.
7.
Для электролитаКnАm ↔ nКm+ + mАn-
К равн.
а
n
K m
a
m
A n
a KnAm
a KnAm 1
ПР т а nК m а mА n
8.
Концентрационное произведение растворимости:ПРс = [Кm +]n ∙ [А n-]m
9.
Для BaSO4 – электролита однотипногосостава (бинарного электролита)
ПР BaSO 4 a Ba 2 a SO 2 4
2
ПР BaSO 4 [Ba ] [SO ]
24
10.
Для Cа3(РО4)2 – электролита неоднотипногосостава
ПР Ca 3 (P O4 ) 2 a
3
Ca 2
a
2
P O34 -
ПР Ca 3 (P O4 ) 2 [Ca 2 ] 3 [PO 34- ] 2
11.
Для бинарных электролитов:Р КА ПР КА
Для любых осадков:
Р КnАm n m
ПР К n А m
nn mm
ПР = mm ∙ nn ∙ Pm+n
12.
ПР Ca 3 (P O 4 ) 2 [Ca 2 ] 3 [PO 34- ] 2 2 ,0 10 29Р м Ca 3 (P O4 ) 2
-29
ПР
2,0
10
3 2 3 2 5
7,13 10 7 моль/л
108
3 2
13.
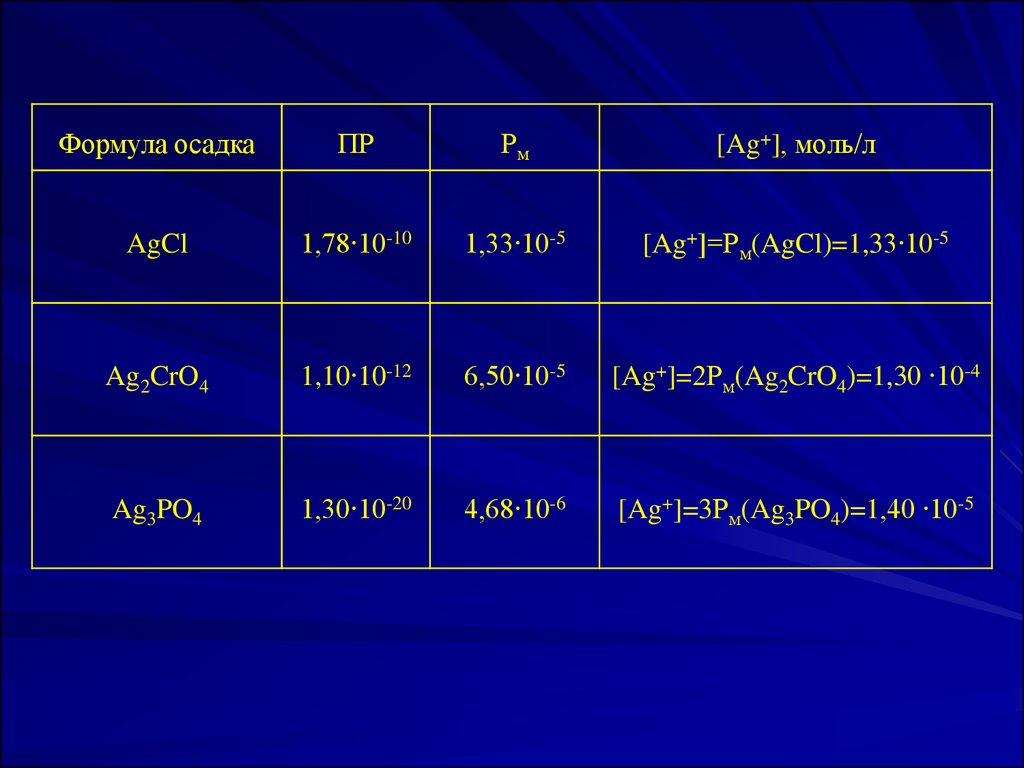
ПР AgCl 1,78 10 10 , [Ag ] ПР AgCl 1,78 10 10 1,33 10 5 моль/лПР AgI 8,30 10 17 , [Ag ] ПР AgI 8,30 10 17 9 ,1 10 9 моль/л
14.
Формула осадкаПР
Рм
[Ag+], моль/л
AgCl
1,78∙10-10
1,33∙10-5
[Ag+]=Рм(AgCl)=1,33∙10-5
Ag2CrO4
1,10∙10-12
6,50∙10-5
[Ag+]=2Рм(Ag2CrO4)=1,30 ∙10-4
Ag3PO4
1,30∙10-20
4,68∙10-6
[Ag+]=3Рм(Ag3PO4)=1,40 ∙10-5
15.
Природа осадка: ПРPbSO = 1,6∙10-8ПРPbCl = 1,6∙10-5
ПРPbCO = 7,5∙10-14
4
2
3
16.
Пример. Вычислите, во сколько раз растворимость (в г/л)карбоната марганца(II)
в чистой воде превышает
растворимость этой соли в 0,05 М растворе карбоната натрия.
ПР MnCO3 = 1,8∙10-11.
В воде
Р м ПР 1,8 10 11 4,24 10 6 моль/л
M MnCO3 = 114,95 г/моль
Ps = Pм . М MnCO3 = 4,24. 10-6 . 114,95 = 4,87 . 10-4 г/л
Растворимость MnCO3 в 0,05 М растворе Na2CO3 определяется
концентрацией ионов Mn2+.
[Na2CO3] = [CO32-] = 0,05 M
ПРMnCOз = [Mn2+].[CO32-]
17.
11ПР
1,8
10
10
[Mn 2 ]
3,6
10
моль/л
2[CO 3 ]
0,05
Ps= 3,6.10-10 . 114,95 = 4,14 . 10-8 г/л
Ps
Ps
в Η 2Ο
в Na 2 CO 3
4,87 10 4
4
1
,
18
10
раз
8
4,14 10
18.
Пример. Вычислите, во сколько раз растворимость сульфита кальция вчистой воде меньше растворимости его в 0,1 М растворе нитрата
натрия. ПРCaSO3 = 1,3 . 10-8.
В воде:
Р м ПР 1,3 10 8 1,14 10 4 моль/л
В растворе NaNO3:
I
1
1
2
C
Z
( 0,1 12 0,1 12 1,14 10 4 2 2 1,14 10 4 2 2 ) 0,10
i i
2
2
f Ca 2 f SO 2 0,37
По табл.
3
ПР [C a 2 ] [SO 32 ] f Ca 2 f SO 2
Т.к.
3
Рм
Pм
Pм
в NaNO3
в H2 O
ПР
1,3 10 8
3,08 10 4 моль/л
2
2
f
0,37
3,08 10 4
2,7 раза
1,14 10 4
19.
ПР СaSO4(в воде) = 2,5· 10-5ПР СaSO4(в этаноле) = 10-10
20.
ПР CaSO4 = 2,5∙10-5; ПР ВaSO4 = 1,0∙10-10ПР CaSO 4
2,5 10 5
3
[SO ]
2,5
10
моль/л
2
0,01
[Ca ]
2
4
ПР BaSO 4
10
1,0
10
8
[SO 24 ]
1,0
10
моль/л
2
0,01
[Ba ]
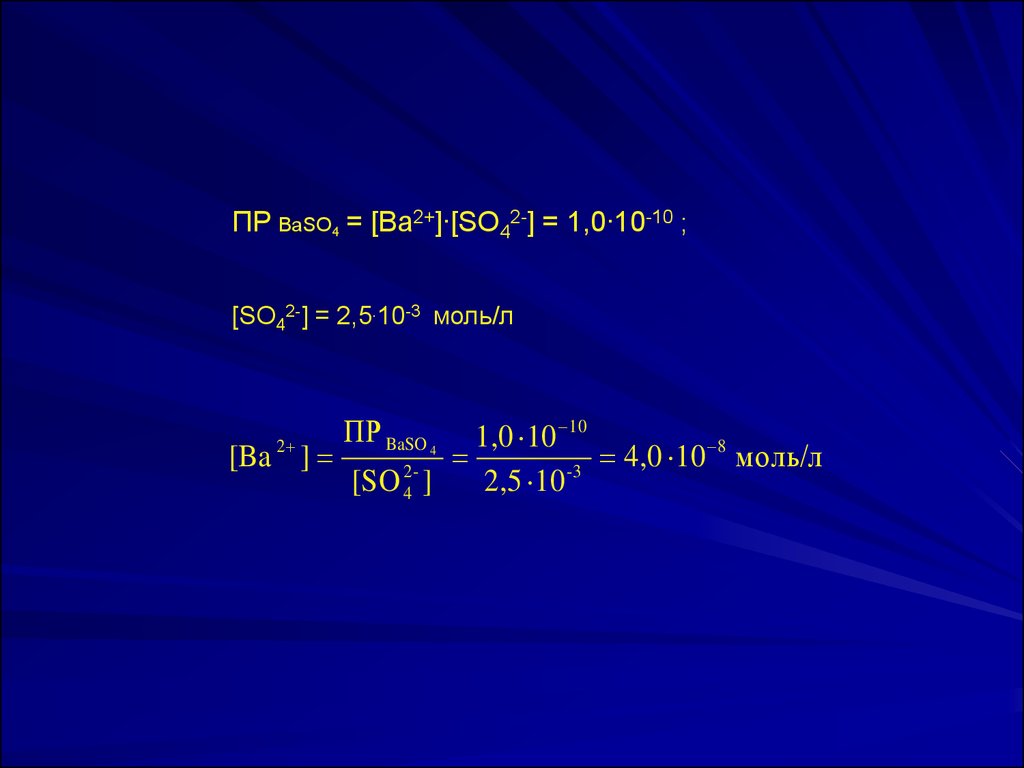
21.
ПР ВaSO4 = [Ba2+]∙[SO42-] = 1,0∙10-10 ;[SO42-] = 2,5.10-3 моль/л
1,0 10 10
8
[Ba ]
4,0
10
моль/л
2-3
[SO 4 ]
2,5 10
2
ПР BaSO 4
22.
СaSO4↓ + Na2СО3 ↔ СaСО3↓ + Na2SO4Кр
ПР СaSO 4
ПР СаСО 3
2,5 10 5
3
6
,58
10
3,8 10 -9
23.
Применение реакций осаждения:• обнаружения катионов и анионов;
• разделения по группам катионов или удаления групп ионов
из раствора, например, при дробном анализе на К+ удаляют
все остальные катионы добавлением Na2СО3;
• выделения из смеси определенных ионов и
концентрирования малых (следовых) количеств,
соосаждения на коллекторе с органическими и
неорганическими осадителями;
• количественного анализа (гравиметрия, осадительное
титрование).





















 Химия
Химия








