Похожие презентации:
Закон действующих масс и его применение в аналитической химии
1.
Закон действующих масс и егоприменение в аналитической химии
1
2.
Като ГульдбергПетер Вааге
2
3.
1867 г.К.М. Гульдберг
и П. Вааге
Скорость химической реакции прямо
пропорциональна произведению
концентраций реагирующих веществ
3
4.
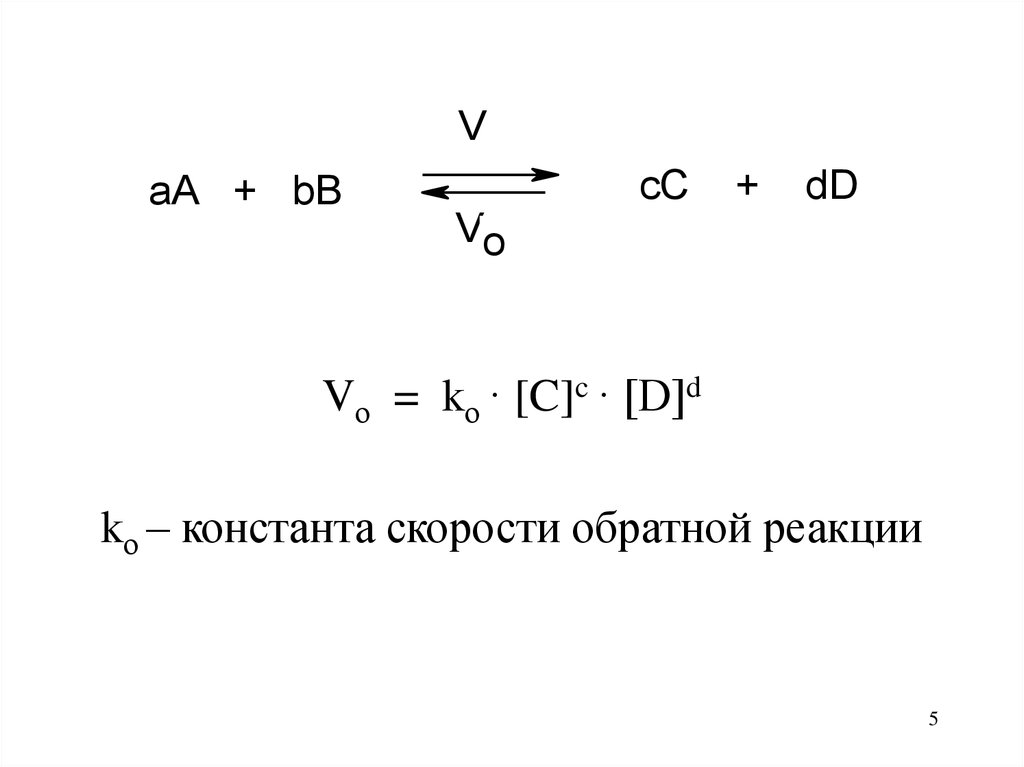
Гомогенная реакцияV
cC
aA + bB
+
dD
Vo
Vп = kп · [A]a · [B]b
kп – константа скорости прямой реакции
4
5.
VcC
aA + bB
+
dD
Vo
Vо = kо · [C]c · [D]d
kо – константа скорости обратной реакции
5
6.
При установившемся химическомравновесии
Vп = V о
kп · [A]a · [B]b = kо · [C]c · [D]d
6
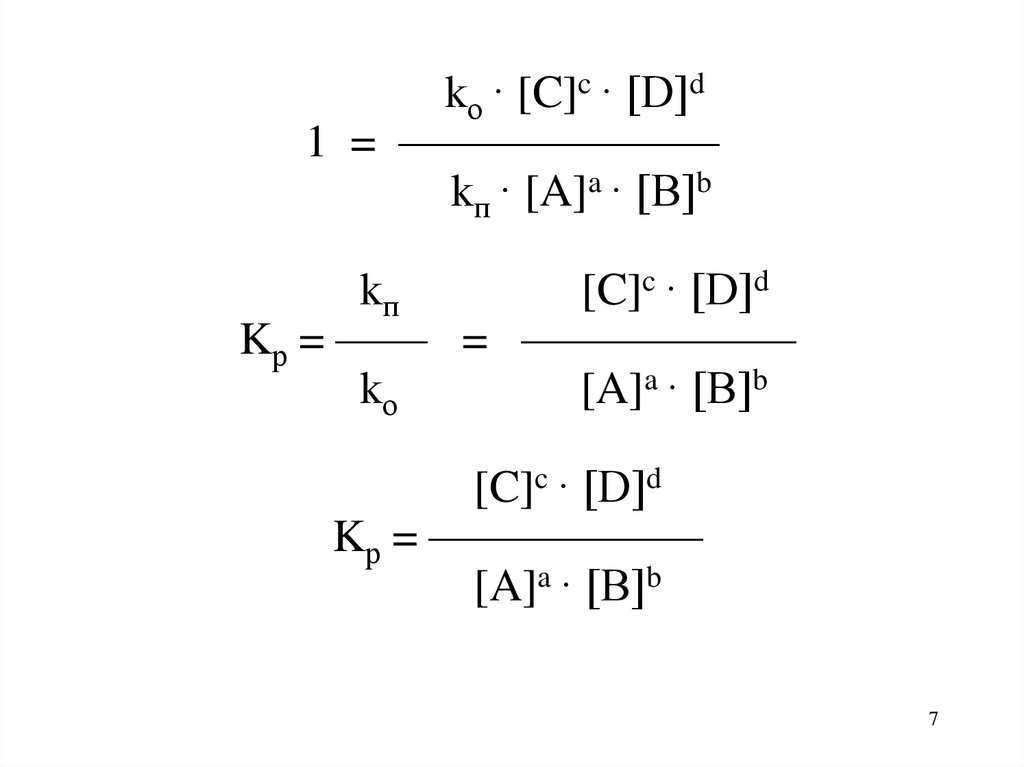
7.
kо · [C]c · [D]d1 = ———————
kп · [A]a · [B]b
kп
[C]c · [D]d
Kр = —— = ——————
kо
[A]a · [B]b
[C]c · [D]d
Kр = ——————
[A]a · [B]b
7
8.
При установившемся химическомравновесии произведение концентраций
продуктов реакции, деленное на
произведение концентраций исходных
веществ, есть величина постоянная (для
данной реакции, при данной
температуре), называемая константой
химического равновесия
8
9.
Константа равновесия зависит оттемпературы и давления и не зависит от
концентрации реагирующих веществ
Kр > 1 – преобладает прямая реакция
Kр < 1 – преобладает обратная реакция
pK = - lg Kp
рKp < 0 – преобладает прямая реакция
рKp > 0 – преобладает обратная реакция
9
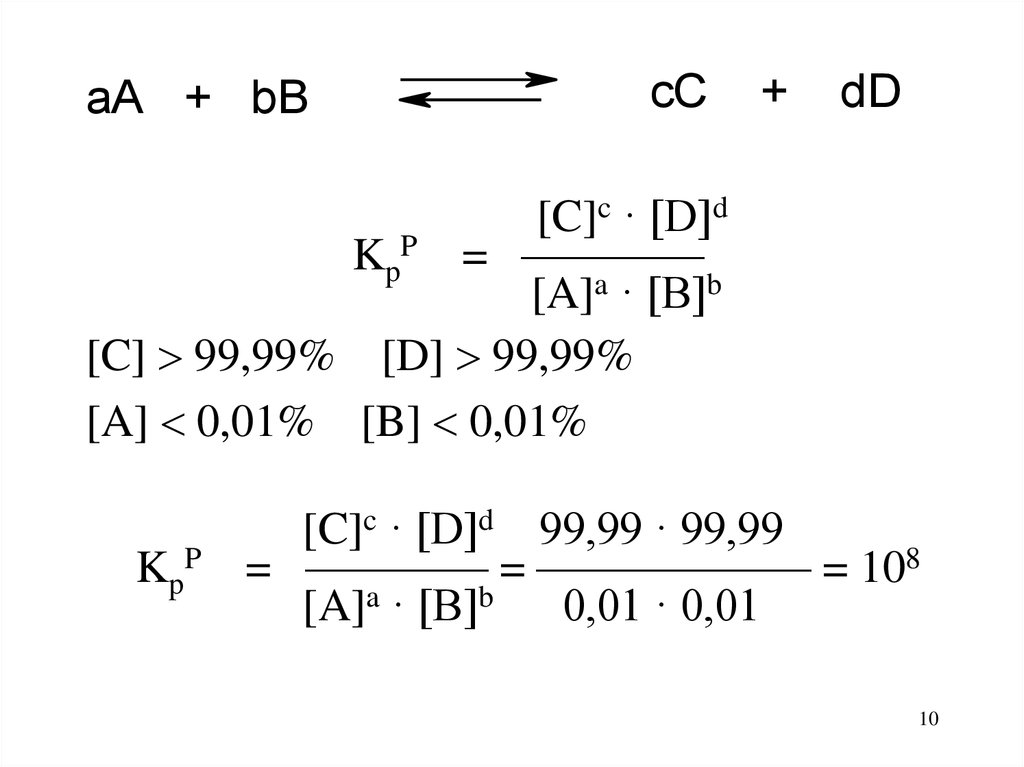
10.
aA + bBcC
+
dD
[C]c · [D]d
KpP = ————
[A]a · [B]b
[C] 99,99% [D] 99,99%
[A] 0,01% [B] 0,01%
KpP
[C]c · [D]d 99,99 · 99,99
= ———— = —————— = 108
[A]a · [B]b
0,01 · 0,01
10
11.
Равновесие в гомогенной системе.Термодинамическая и концентрационная
(реальная) константы равновесия.
Связь между ними.
11
12.
aA + bBKpT
cC
+
dD
aCc · aDd
= ————
aAa · aBb
KpT зависит от температуры, давления и
природы растворителя.
12
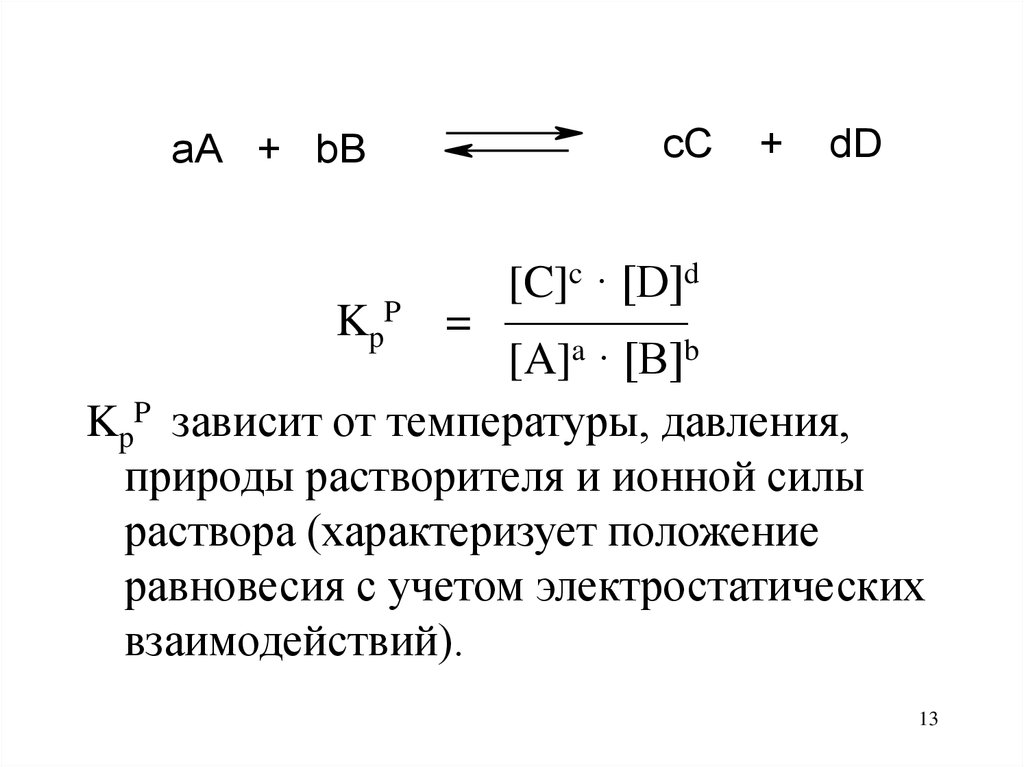
13.
aA + bBcC
+
dD
[C]c · [D]d
KpP = ————
[A]a · [B]b
KpP зависит от температуры, давления,
природы растворителя и ионной силы
раствора (характеризует положение
равновесия с учетом электростатических
взаимодействий).
13
14.
KpP[C]c · [D]d
= ————
[A]a · [B]b
aA = fA · [A]
[A] = aA / fA
aB = fB · [B]
[B] = aB / fB
aC = fC · [C]
[C] = aC / fC
aD = fD · [D]
[D] = aD / fD
14
15.
KpP[C]c · [D]d
aCc · aDd
fAa · fBb
= ———— = ———— · ————
[A]a · [B]b
aAa · aBb
fCc · fDd
KpP
[C]c · [D]d
fAa · fBb
= ———— = KpT · ————
[A]a · [B]b
fCc · fDd
при I = 0
KpP = KpT
15
16.
-коэффициент (молярная доля)16
17.
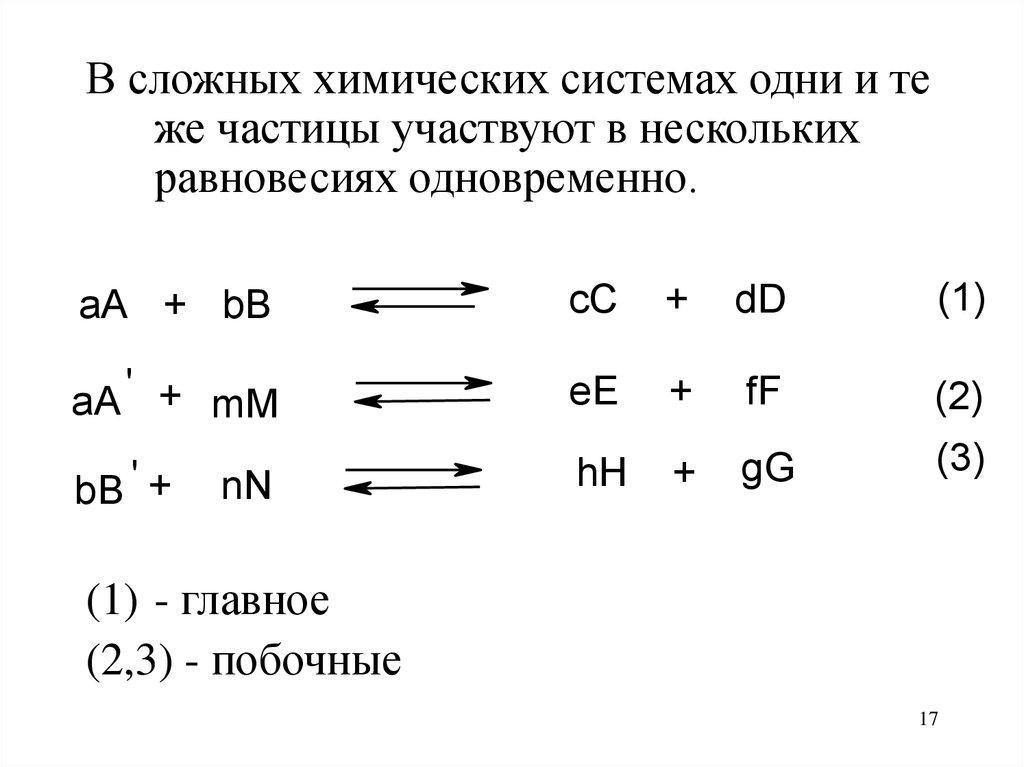
В сложных химических системах одни и теже частицы участвуют в нескольких
равновесиях одновременно.
aA + bB
cC
+
dD
(1)
aA ' + mM
eE
+
fF
(2)
bB ' +
hH
+
gG
(3)
nN
(1) - главное
(2,3) - побочные
17
18.
Характеристикой глубины протеканияконкурирующих реакций служит
-коэффициент или молярная доля –
отношение равновесной концентрации
частиц, участвующих в основной
реакции, к общей концентрации этих
частиц.
18
19.
aA + bBcC
+
dD
aA ' + mM
eE
+
fF
CA = [A] + [A']
Аналогично:
CB = [B] + [B']
CA – суммарная концентрация компонента А
[A] – кон-ция ч-цы А, участв. в главной реакции
[A'] – кон-ция ч-цы А, участв. в побоч. реакции
19
20.
aA + bBcC
aA ' + bB '
eE
[A]
A = —— ;
CA
+
+
dD
fF
[B]
B = —— ;
CB
[C]
[D]
C = —— ;
D = —— ;
CC
CD
=0—1
При отсутствии конкурирующих реакций
CA = [A]; CB = [B];
20
21.
Например: Насыщенный водный раствор HgSв присутствии HCl
гетерогенное: HgS = Hg2+ + S2
и гомогенные: Hg2+ + Cl = HgCl+
Hg2+ + 2Cl = HgCl2
Hg2+ + 3Cl = HgCl3
Hg2+ + 4Cl = HgCl42
S2 + H+ = HS
S2 + 2H+ = H2S
21
22.
HgS = Hg2+ + S2Hg2+ + Cl = HgCl+
Hg2+ + 2Cl = HgCl2
Hg2+ + 3Cl = HgCl3
Hg2+ + 4Cl = HgCl42
[Hg2+]
(Hg2+) = ———————————————————
[Hg2+]+[HgCl+]+[HgCl2]+[HgCl3 ]+[HgCl42 ]
22
23.
HgS = Hg2+ + S2S2 + H+ = HS
S2 + 2H+ = H2S
[S2 ]
(S2 ) = —————————
[S2 ] + [HS ] + [H2S]
23
24.
-коэффициенты служат мерой степенихимических взаимодействий в системе
подобно
активности
тому,
как
служат
коэффициенты
мерой
степени
электростатических взаимодействий.
24
25.
Условная константа равновесиягомогенной реакции.
Связь с термодинамической и
концентрационной константами
25
26.
aA + bBcC
+
dD
aA ' + bB '
eE
+
fF
CCc · CDd
KpY = —————
CAa · CBb
KpY зависит от t, P, природы растворителя,
ионной силы раствора и глубины
протекания конкурирующих реакций
26
27.
CCc · CDd Aa · Bb [C]c · [D]dKpY = ———— = ———— · ———— =
CAa · CBb Cc · Dd [A]a · [B]b
Aa · Bb · fAa · fBb aCc · aDd
= ——————— · ————
C c · D d · fC c · f D d a A a · a B b
Aa · Bb
Aa · Bb · fAa · fBb
KpY = ———— · KpK = ——————— · KpT
Cc · D d
Cc · Dd · fCc · fDd
27
28.
1. В реальной системе при наличии химическихи электростатических взаимодействий
рассчитывается условная KpY
2. Если влиянием конкурирующих реакций
пренебречь, то все =1, тогда KY = KP , т.е.
необходим учет только электростатических
взаимодействий
3. Если можно пренебречь электростатическими
взаимодействиями (н-р, в очень разбавленных
растворах), то все f=1 и KY = KP = KT
KK и KT отличаются на 1-2 порядка
KY и KK отличаются на 10 и более порядков
28
29.
Равновесие в гетерогенной системе29
30.
1A mB n
m A
+
n B
3
2
A mB n
раствор
1 – для соединений с ионной кристаллической
решеткой BaSO4, CaC2O4
2 – для соединений с молекулярной кристаллической решеткой (характерно для слабых
электролитов C6H5COOH и др.)
30
31.
AB
B
A
A
B
A mB n
A mB n
A m Bn
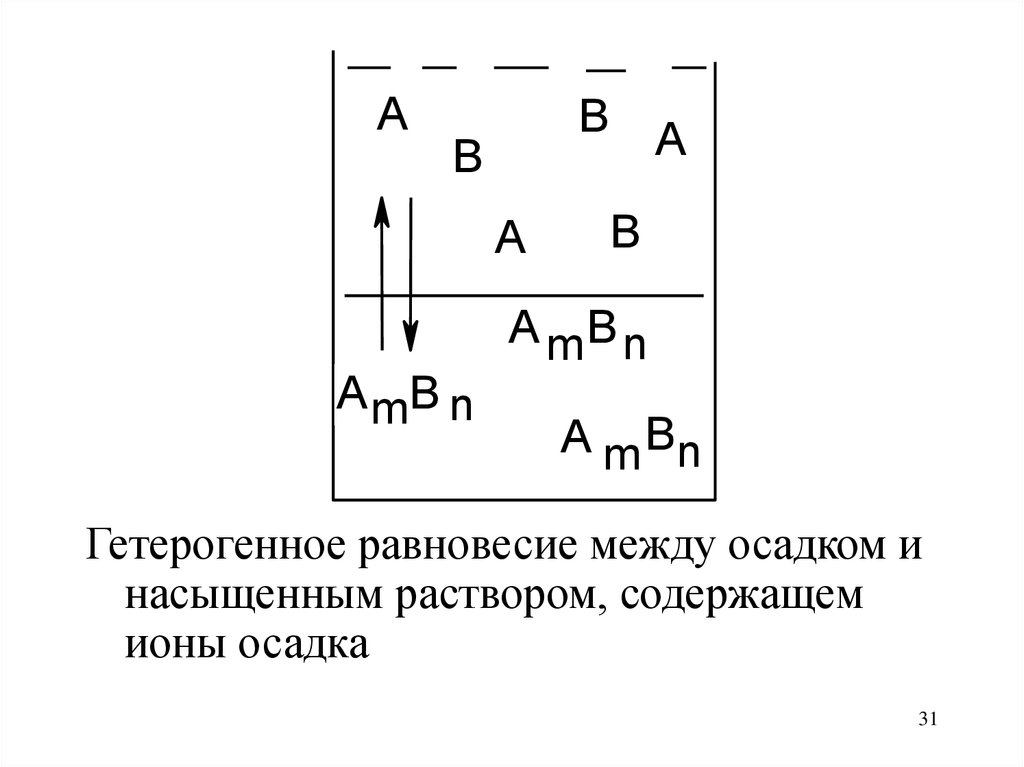
Гетерогенное равновесие между осадком и
насыщенным раствором, содержащем
ионы осадка
31
32.
A mB nm A
+
n B
Vп = k п · P
Vп – скорость растворения твердого
вещества
P – величина поверхности твердого тела
kп – константа скорости прямой реакции
Vo = ko[A]m[B]n
ko – константа скорости обратной реакции
32
33.
Vп = VoP=0
kп = ko[A]m[B]n
kп /ko = [A]m[B]n
kп /ko = Kp = ПР
ПР – константа равновесия гетерогенной
реакции
ПР = [A]m[B]n
33
34.
Термодинамическая, концентрационная иусловная константы равновесия
гетерогенной реакции
34
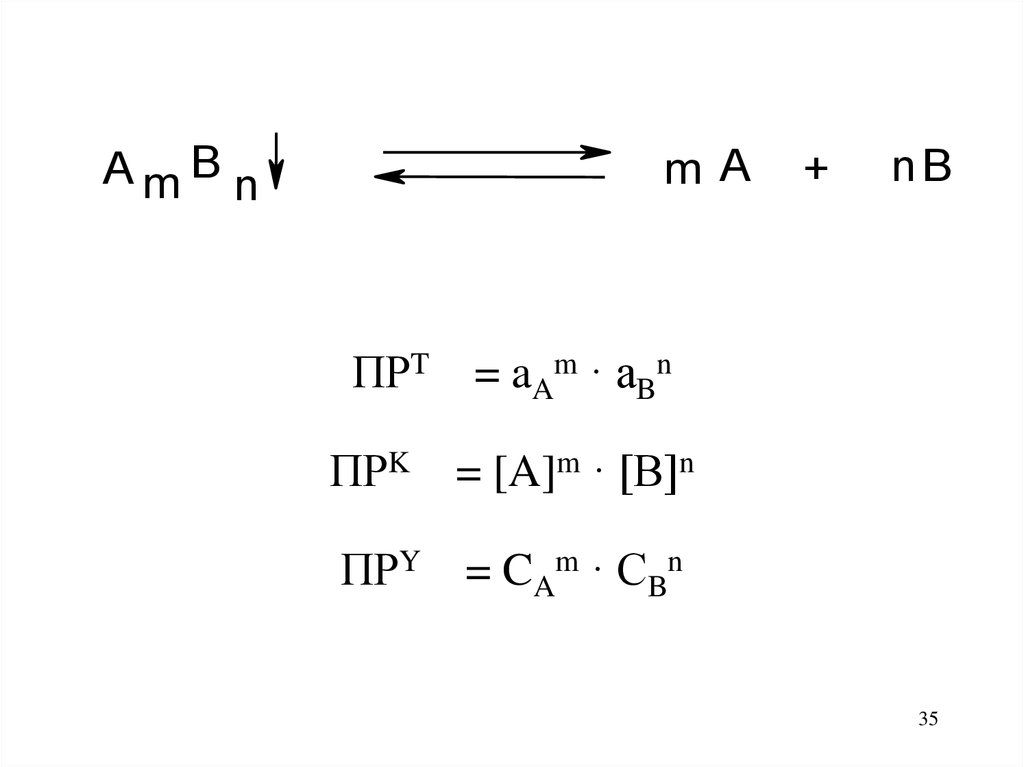
35.
AmB nm A
+
nB
ПРT = aAm · aBn
ПРK = [A]m · [B]n
ПРY = CAm · CBn
35
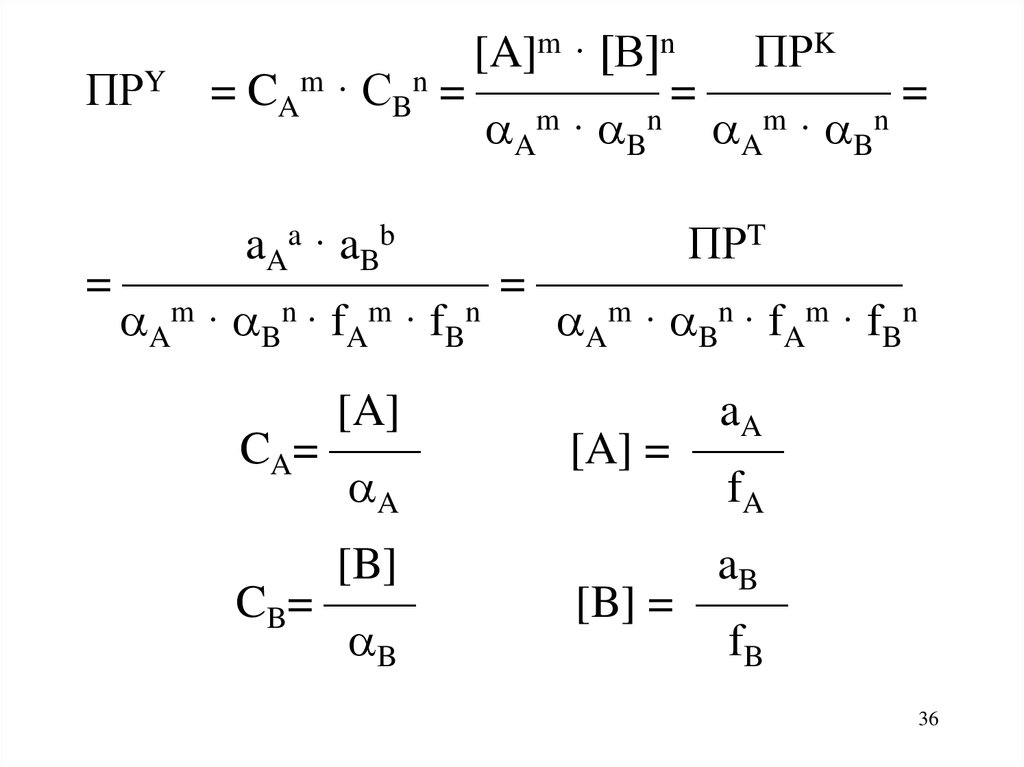
36.
ПРY[A]m · [B]n
ПРK
= CAm · CBn = ———— = ———— =
Am · Bn Am · Bn
a A a · a Bb
ПРT
= ———————— = ————————
Am · Bn · fAm · fBn
Am · Bn · fAm · fBn
[A]
CA= ——
A
aA
[A] = ——
fA
[B]
CB= ——
B
aB
[B] = ——
fB
36
















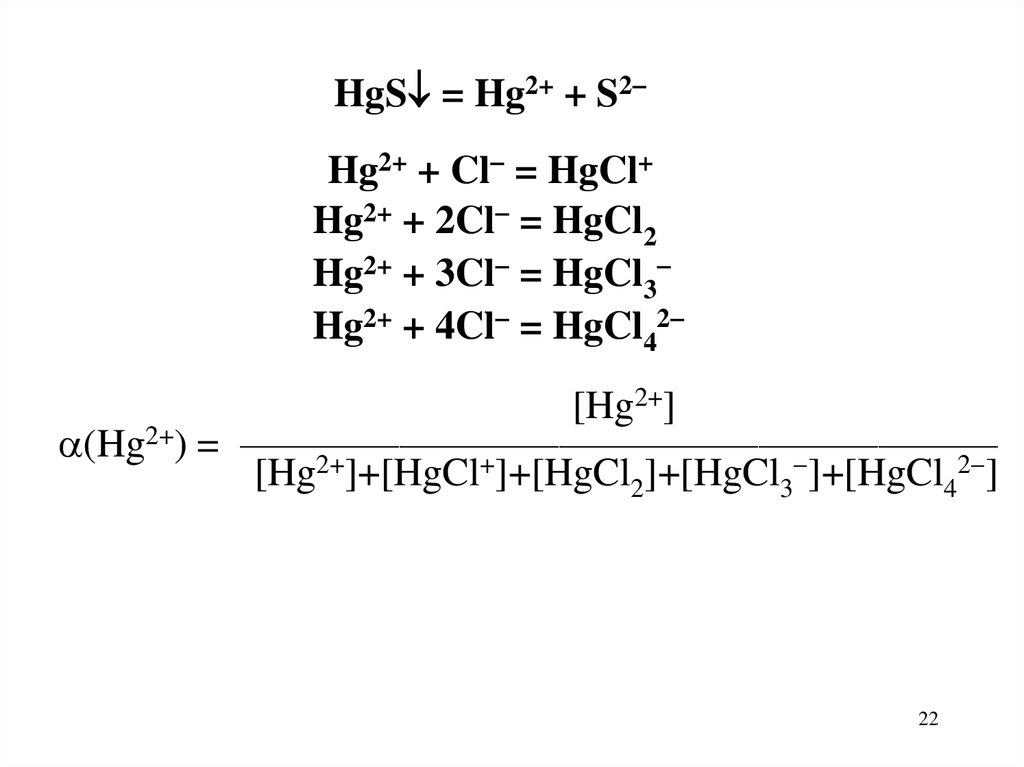
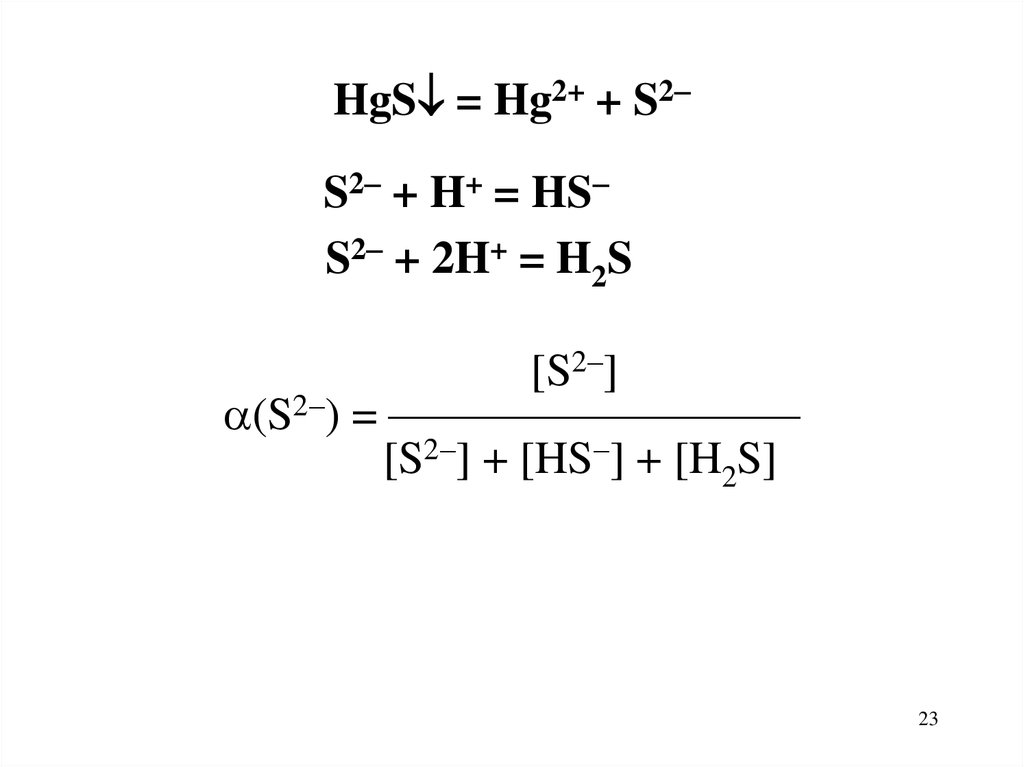










 Химия
Химия








