Похожие презентации:
Растворимость малорастворимого сильного электролита
1.
Растворимость малорастворимого сильногоэлектролита.
Влияние ионной силы раствора на
растворимость осадка.
Солевой эффект.
1
2.
Растворимость –концентрация вещества в егонасыщенном растворе.
Молярная растворимость S – число молей
растворенного вещества, содержащихся в 1 л
насыщенного раствора (моль/л)
Массовая растворимость Cm – масса
растворенного вещества, содержащаяся в 1 л
насыщенного раствора (г/л)
2
3.
S < 1·10–4 малорастворимые электролитыS < 1·10–2 среднерастворимые электролиты
S > 1·10–2 хорошо растворимые электролиты
3
4.
AmB nm A
S ì /ë
mS ì /ë
+
nB
n S ì /ë
ПРK(AmBn) = [A]m·[B]n = (mS)m·(nS)n = mmnnSm+n
ПРK(AmBn) = mmnnSm+n
m+n
Ï Ð
SA m B n =
m+n
K
m
m
Am B n
n
n
Ï
=
m
T
ÐA B
m n
m
n
m n n fA f
B
4
5.
Малорастворимый электролит AmBn в воде:I < 10 4 0,
f=1
Тогда:
m+n
SA m B n =
Ï
T
ÐA B
m n
m
m
n
n
5
6.
Малорастворимый электролит AmBn врастворе сильного индифферентного
электролита CH :
Например Ag2CrO4 + KNO3
I > 10 4 f 1,
Тогда
6
7.
Солевой эффект проявляется в увеличениирастворимости малорастворимого сильного
электролита с увеличением ионной силы
раствора
(разные сильные электролиты, прилитые в
одинаковом количестве, дают разный солевой
эффект)
7
8.
Задача: Какая соль более растворима в воде: фосфатцинка или цианид цинка, и во сколько раз?
Решение:
Zn3(PO4)2
m=3
n=2
ПР = 9,1·10–33
m+n
SA m B n =
Zn(CN)2
m=1
n= 2
ПР = 2,6·10–13
T
Ï ÐA
m
m
m
n
B
n
n
8
9.
3+2S Zn
3
(PO4 ) 2
=
3
3 . 2
1+2
S Zn (CN)
2
=
- 33
.
10
9,1
2,6 . 10
1
1 .2
4,02 . 10
1,53 . 10
-
2
-7
= 1,53 . 10
- 13
2
= 4,02 . 10
-
5
5
7
= 262
9
10.
Задача: Вычислить растворимость Ag2CrO4 в чистойводе, в 0,01 М растворе NaNO3 и 0,01 М растворе
Na3PO4.
Решение:
В чистой воде I 0, f = 1
m+n
SA m B n =
T
Ï ÐA
m
m
m
n
B
n
n
10
11.
Ag2CrO4m=2
n=1
ПР=1,1·10–12
2+1
S Ag
2 CrO 4
=
1,1 . 10
2
2 .1
- 12
1
= 6,50 . 10
5
11
12.
в растворе 0,01 М NaNO3 I = 0,01 моль/лf(Ag) = 0,898 f(CrO4) = 0,660
m+n
SA m B n =
2+1
S Ag
2 CrO 4
=
T
Ï ÐA
m
B
m
m
n
n
m n n fA f
B
1,1 . 10
- 12
1
2
11.
.
2 1 0,898 . 0,660
2
= 8,02 . 10 -
12
5
13.
в растворе 0,01 М Na3PO4Na3PO4 3Na+
0,01
0,03
+ PO3–
0,01
I = ½(0,03 · 12 + 0,01 · 32) = 0,045 0,05 (M)
f(Ag) = 0,80
f(CrO4) = 0,445
2+1
S Ag
2 CrO 4
=
1,1 . 10
- 12
11
2
1
.
2 1 . 0,80 . 0,445
2
= 9,85 . 10 13
5
14.
РастворимостьAg2CrO4
в чистой воде
6,50 ·10–5
в 0,01 М NaNO3
8,02 ·10–5
(1,23 )
в 0,01 М Na3PO4 9,85 ·10–5
(1,52 )
14
15.
Задача: Сколько г роданида серебра растворяется в 250 мл воды? ПР(AgSCN) = 1,1 ·10–12Решение.
1. Найдем растворимость AgSCN в чистой воде
2. Найдем массу растворившегося AgSCN в
250 мл раствора
S
AB
=
Ï Ð
T
15
16.
SAgSCN
=
- 12
-6
.
.
1,1 10
= 1,05 10
m
S AgSCN =
M(AgSCN) . V
(ì î ëü/ë)
m(AgSCN) = S(AgSCN) . M(AgSCN) . V
-6 .
.
m(AgSCN) = 1,05 10 165,94 .
- 5(ã)
.
0,25 = 4,35 10
16
17.
Растворимость малорастворимогоэлектролита в присутствии
одноименных ионов
17
18.
AmBn + ACAmBn + DB
(AgCl + AgNO3)
(AgCl + KCl)
18
19.
AmB nm A
S
m S +[A]
+
nB
nS
ПРK(AmBn) = [A]m·[B]n = [A]m·(nS)n =
nn · Sn · [A]m
ПРK(AmBn) = nn · Sn · [A]m
19
20.
AmB nS
m A
mS
+
nB
n S +[B]
ПРK(AmBn) = [A]m·[B]n = [B]n · (mS)m =
mm · Sm · [B]n
ПРK(AmBn) = mm · Sm · [B]n
20
21.
Задача. Вычислить растворимостьгидроксида железа(III) в чистой воде и
0,025 М растворе гидроксида натрия.
Решение. В чистой воде:
Fe(OH)3
ПР = 6,3 ·10–38
m=1
n=3
1+3
S Fe(OH) =
3
- 38
.
6,3 10
1
1.
3
1
3
.
.
1
1
3
= 2,9 . 10
- 10
21
22.
В 0,025 М растворе NaOHI = 0,025 M fFe= 0,325
S Fe(OH)
fOH = 0,855
- 38
.
6,3 10
=
3
1
1.
(0,025) 3. 0,325 1 . 0,855 3
- 32
= 1,9 . 10
Ответ: 2,9 ·10–10
1,9 ·10–32
22
23.
Условие образования осадковмалорастворимых электролитов
23
24.
ИП > ПРИП < ПР
ИП = ПР
осадок выпадет
осадок не выпадет
система в состоянии
равновесия
AmBn
ПР = [A]m · [B]n для насыщенного раствора
ИП = [A]m · [B]n для данного раствора
ИП = ПК
ИП – ионное произведение
ПК – произведение концентраций
24
25.
Задача. Выпадет ли осадок присмешивании 10 мл 0,01 М раствора CaCl2
и 5 мл 0,05 М раствора K2CrO4.
Решение.
CaCl2 + K2CrO4 CaCrO4 + 2KCl
ИП(CaCrO4)
?
ПР(CaCrO4)
ИП(CaCrO4) = [Ca] · [CrO4]
C(Ca) = ?
С(CrO4) = ?
25
26.
C(CaCl2)1· V1 0,01 · 10С(CaCl2) = ————— = ———— = 6,7·10–3 M
V2
15
Т.к. CaCl2 Ca + 2Cl
C(Ca) = С(CaCl2) = 6,7·10–3 M
C(CrO4)1· V1 0,05 · 5
С(K2CrO4) = ————— = ———— = 1,7·10–2 M
V2
15
Т.к. K2CrO4 2K + CrO4
C(CrO4) = С(K2CrO4) = 1,7·10–2 M
26
27.
ИП(CaCrO4) = [Ca] · [CrO4]ИП(CaCrO4) = 6,7·10–3 · 1,7·10–2 = 1,1·10–4
ПР(CaCrO4) = 7,1·10–4
ИП(CaCrO4)
?
ПР(CaCrO4)
1,1·10–4
<
7,1·10–4
Ответ: Осадок не выпадет.
27
28.
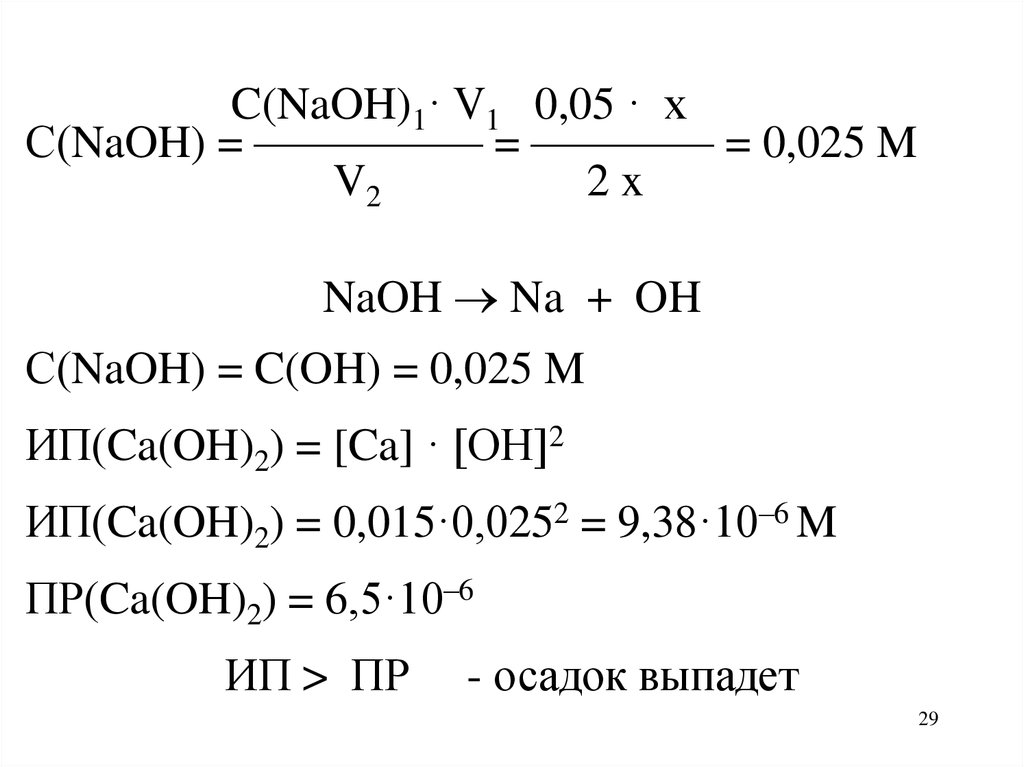
Задача. Образуется ли осадок гидроксидакальция, если смешать равные объемы 0,03 М
раствора CaCl2 и 0,05 М раствора NaOH.
Решение.
CaCl2 + 2NaOH Ca(OH)2 + 2NaCl
ИП(Ca(OH)2) = [Ca] · [OH]2
C(CaCl2)1· V1 0,03 · x
С(CaCl2) = ————— = ———— = 0,015 M
V2
2x
C(Ca) = 0,015 M
28
29.
C(NaOH)1· V1 0,05 · xС(NaOH) = ————— = ———— = 0,025 M
V2
2x
NaOH Na + OH
С(NaOH) = C(OH) = 0,025 M
ИП(Ca(OH)2) = [Ca] · [OH]2
ИП(Ca(OH)2) = 0,015·0,0252 = 9,38·10–6 M
ПР(Ca(OH)2) = 6,5·10–6
ИП > ПР
- осадок выпадет
29
30.
Задача. Образуется ли осадок гидроксидакальция, если смешать равные объемы 0,03 М
раствора CaCl2 и 0,05 М раствора аммиака.
Решение.
CaCl2 + 2NH4OH Ca(OH)2 + 2NH4Cl
ИП(Ca(OH)2) = [Ca] · [OH]2
C(CaCl2)1· V1 0,03 · x
С(CaCl2) = ————— = ———— = 0,015 M
V2
2x
C(Ca) = 0,015 M
30
31.
C(NH4OH)1· V1 0,05 · xС(NH4OH) = —————— = ———— = 0,025 M
V2
2x
NH4OH NH4 + OH
С(NH4OH) C(OH) 0,025 M
[OH] =
[OH] =
< 3%
Kосн = 1,76·10–5
K î ñí . C î ñí
-4
5.
.
.
0,025 = 6,63 10
1,76 10
31
32.
ИП(Ca(OH)2) = [Ca] · [OH]2ИП(Ca(OH)2) = 0,015·(6,63·10–4 )2 =
= 6,59·10–9 M
ПР(Ca(OH)2) = 6,5·10–6
ИП < ПР
- осадок не выпадет
32
33.
Задача. При какой концентрации ионовкальция будет образовываться осадок
гидроксида кальция из раствора с рН = 9.
Решение.
ПР(Ca(OH)2) = [Ca] · [OH]2 = 6,5·10–6
ПР(Ca(OH)2)
[Ca] = ——————
[OH]2
[OH] = 10–pOH
т.к. pH + pOH = 14 pOH = 14 – 9 = 5
33
34.
ПР(Ca(OH)2)6,5·10–6
[Ca] = —————— = ———— = 6,5·103
[OH]2
(10 –5)2
Ответ: При рН=9 осадок Ca(OH)2 выпадет,
если концентрация Ca2+ будет 6,5·103 М и
выше.
34
35.
Задача. При каком значении рН начнетсяобразование осадка Zn(OH)2 из 0,01 М
раствора хлорида цинка.
Решение.
ПР(Zn(OH)2) = [Zn] · [OH]2 = 1,4·10–17
[OH] =
Ï Ð(Zn(OH) 2 )
[Zn]
1,4 . 10 - 5
[OH] =
0,01
= 3,74 . 10 - 8
35
36.
pOH = – lg[OH] = – lg 3,74·10–8 = 7,43т.к. pH + pOH = 14
pH = 14 – 7,43 = 6,57
Ответ: При рН = 6,57 выпадет Zn(OH)2 из
0,01 М раствора хлорида цинка.
36
37.
Перевод малорастворимого осадка враствор
Mg(OH)2 Mg2+ + 2OH–
+
2HCl 2Cl– + 2H+
2H2O
Mg(OH)2 Mg2+ + 2OH–
+
2NH4Cl 2Cl– + 2NH4+
2NH4OH
37
38.
Перевод одного малорастворимогоэлектролита в другой
Ag2CrO4 2Ag+ + CrO42–
+
2KCl 2Cl– + 2K+
2AgCl
ПР(AgCl) = 1,78·10–10
S(AgCl) = 1,33·10–5
ПР(Ag2CrO4) = 3,5·10–11 S(Ag2CrO4) = 2,06·10–4
38
39.
Перевод СaSO4,,, SrSO4 , BaSO4 в карбонаты:Реакция
идет слева направо практически до конца, т.к.
ПР(CaCO3) = 4,8·10–9 много
ПР(CaSO4) = 2,37·10–5
39
40.
Реакцияидет труднее, т.к. разность между
ПР(SrCO3) = 1,1·10–10 и ПР(SrSO4) = 3,2·10–7
значительно меньше, чем в предыдущей
реакции
40
41.
РеакцияBaSO4 + Na2CO3 BaCO3 + Na2SO4
сама по себе не идет, т.к. слабая угольная кислота не
может вытеснить из солей более сильную серную
кислоту и к тому же S(BaSO4) = 1,05·10–5 меньше
S(BaCO3) = 7,14·10–5
ПР(BaSO4) = 1,1·10–10
ПР(BaCO3) = 5,1·10–9
Однако если, учитывая закон действующих масс,
действовать на осадок BaSO4 большим избытком
Na2CO3, то можно вызвать смещение равновесия
слева направо и получить осадок BaCO3
41
42.
Осадок BaCO3 образуется тогда, когда ПР егобудет превышенным, т.е.
[Ba2+][CO3 2–] > ПР(BaCO3)
Здесь концентрация [Ba2+] определяется
растворимостью BaSO4 и равна:
ПР(BaSO4)
= —————
[SO4 2–]
Если увеличивать концентрацию только [CO3 2–]
и добиваться, чтобы
ПР(BaSO4)
ПР(BaCO3)
—————
> —————
2–
[SO4 ]
[CO3 2–]
[Ba2+]
42
43.
или[CO3 2–]
ПР(BaCO3)
————— > —————
[SO4 2–]
ПР(BaSO4)
тогда
[CO3 2–]
5,1·10–9
————— > ————— = 46,4
[SO4 2–]
1,1·10–10
Т. обр., чтобы превращение BaSO4 в BaCO3
происходило, необходимо, чтобы концентрация
[CO3 2–] в растворе была в 46,4 раза больше
[SO4 2–].
43
44.
На практике используют 1-1,5 М растворNa2CO3.
К осадку приливают раствор Na2CO3, нагревают
до кипения и после отстаивания осадка
сливают раствор с сульфатом натрия.
Повторяют операцию до полного перевода
BaSO4 в BaCO3
44

























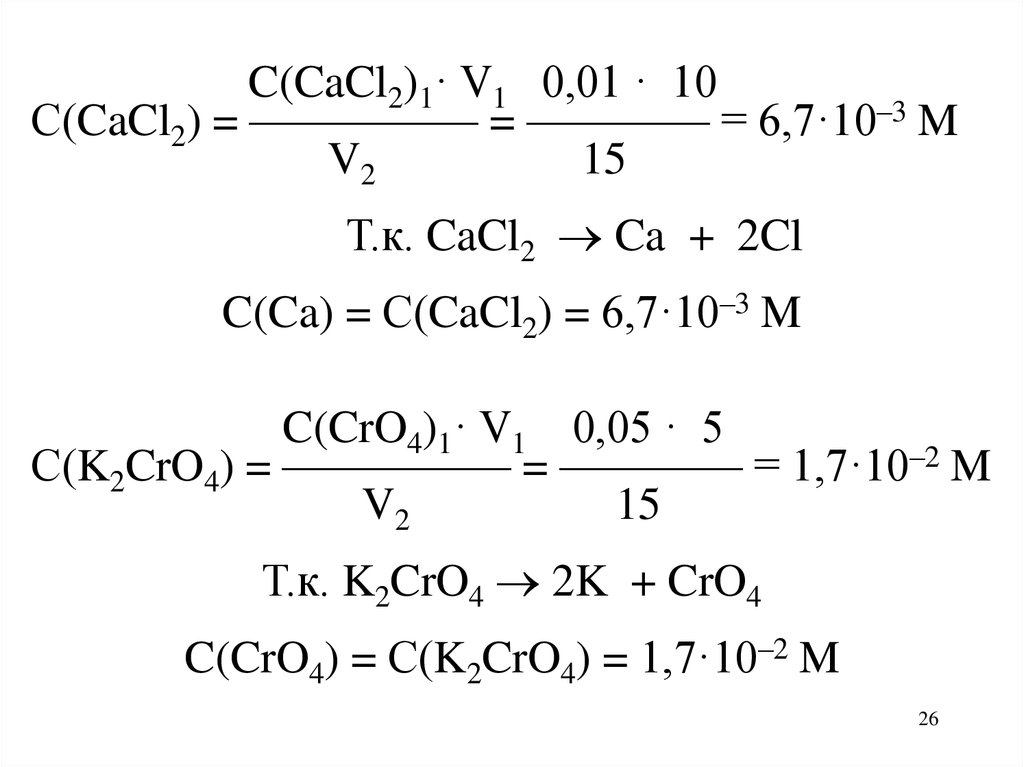

















 Химия
Химия