Похожие презентации:
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
1. ПРИМЕНЕНИЕ ЗДМ к кислотно-основным равновесиям и их роль в аналитической химии лектор – проф. Васюк С. А. 2016
ПРИМЕНЕНИЕ ЗДМ К КИСЛОТНООСНОВНЫМ РАВНОВЕСИЯМ И ИХРОЛЬ В АНАЛИТИЧЕСКОЙ ХИМИИ
лектор – проф. Васюк С. А.
2016
2. План
1. Протолитическая теория кислот и оснований. Типы протолитов.2. Протолитические равновесия в воде, шкала рН.
3. Сила кислот и оснований, константы кислотности и основности.
4. Вычисления рН и рОН в водных растворах.
5. Протолитическое равновесие в неводных растворителях.
Константа автопротолиза.
6. Гидролиз.
7. Протолитическое равновесие в буферных растворах.
8. Протолитическое равновесие в растворах амфолитов.
9. Роль кислотно-основных равновесий в аналитической химии.
3.
Электронная теория Г. Н. Льюиса (1926 г.).H
H N
H
Î ñí î âàí èå
ï î Ëüþ èñó
H+ =
Êèñëî òà
ï î Ëüþ èñó
H
H NH
H
4. Протолитическая теория кислот и оснований (ПТКО) Бренстеда-Лоури
НА Н+ + Аа1b1
В + Н+ НВ+
b2
а2
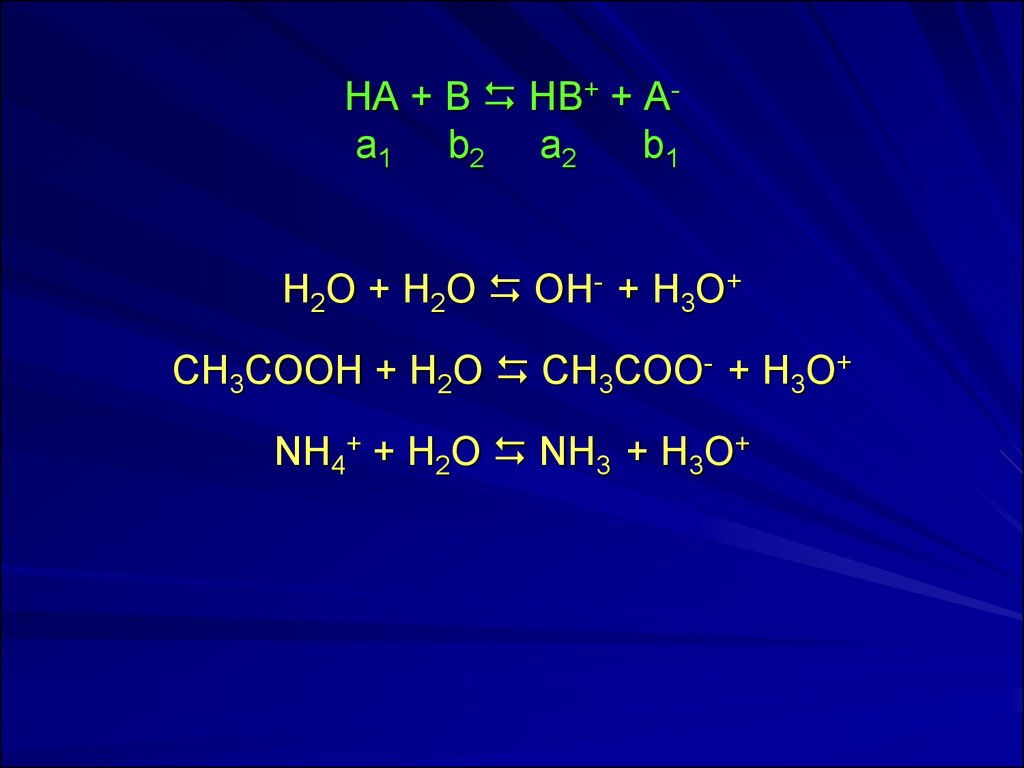
5. НА + В НВ+ + А- а1 b2 а2 b1
НА + В НВ+ + Аа1 b2 а2b1
H2O + H2O OH- + H3O+
CH3COOH + H2O CH3COO- + H3O+
NH4+ + H2O NH3 + H3O+
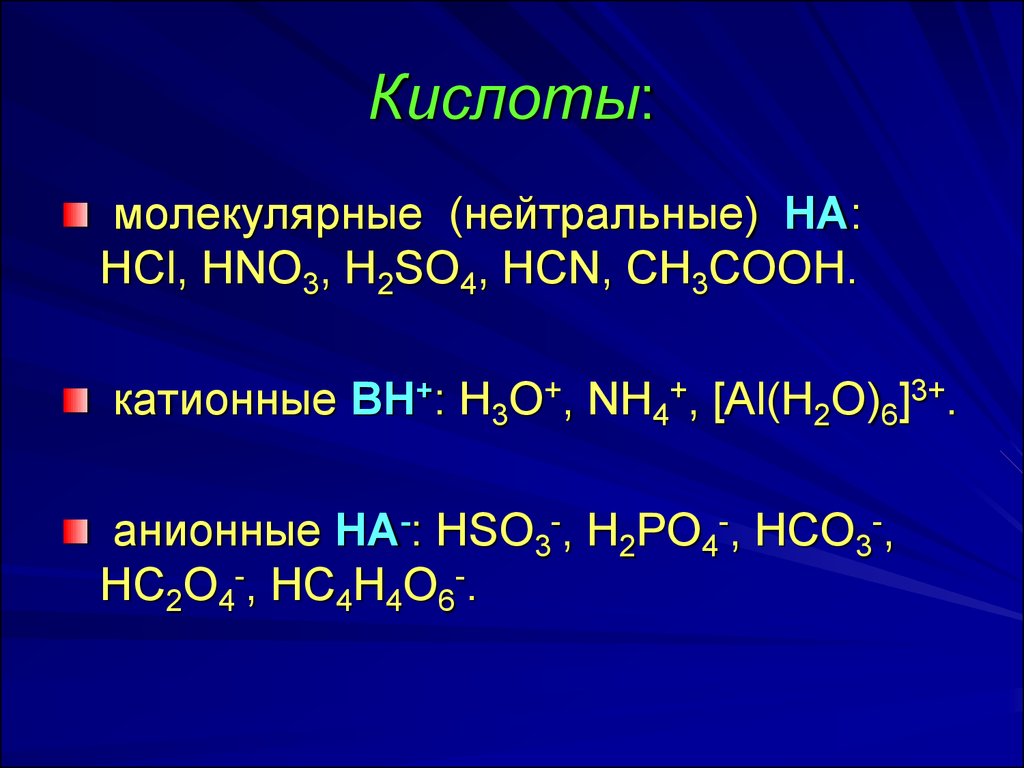
6. Кислоты:
молекулярные (нейтральные) НА:HCl, HNO3, H2SO4, HCN, CH3COOH.
катионные ВН+: H3O+, NH4+, [Al(H2O)6]3+.
анионные НА-: HSO3-, H2PO4-, HCO3-,
HC2O4-, HC4H4O6-.
7. Основания:
молекулярные (нейтральные) В: NH3, CH3NH2, C6H5N, NaOH, H2N-NH2.катионные В+: H2N-NH3+, [Zn(OH)(H2O)3]+.
анионные А-: Сl-, OH-, CN-, CH3СOO-, CO32-,
SO42-.
8. Амфолиты:
анионные кислоты, они же анионныеоснования НА-: HSO3-, H2PO4-, HCO3-, HC2O4-,
HC4H4O6-.
CO32-
+ H3O+
- H3O+
HCO3
-
+ H3O+
- H3O+
H2CO3
9. Амфолиты:
нейтральные молекулы В: [Zn(OH)2(H2O)2],[Al(OH)3(H2O)3], [Cr(OH)3(H2O)3].
10. Амфолиты:
катионные основания, они же катионныекислоты В+: H2N-NH3+, [Zn(OH)(H2O)3]+,
[Al(OH)2(H2O)4]+, [Cr(OH)2(H2O)4]+.
11. Протолитические равновесия в воде
H2O + H2O OH- + H3O+H2О H+ + OH-
[ H ] [OH ]
KС
[H 2 O]
В разбавленных растворах концентрация воды как растворителя
постоянна и равна 1000,0/18,0 = 55,56 моль/л.
[ H ] [OH ]
16
KС
1,86 10
[H 2O]
(при 25°С, табличные данные)
12. Протолитические равновесия в воде
КС∙[Н2О] = КН О = Кw = 1,86∙10-16 ∙55,56 =10-142
КН О = Кw =[H3O+] ∙ [OH-] =10-14
2
или упрощенно Kw
= [H+] ∙ [OH-]
13. Протолитические равновесия в воде
рКw = - lg Kw = -lg 10-14 = 14[H3O+] = [OH-] = 10-7
рН = - lg [H3O+] = - lg 10-7 = 7
рОН = - lg [ОH-] = - lg 10-7 = 7
pKw = pH + pOH = 14
рKw = рН + рОН
14.
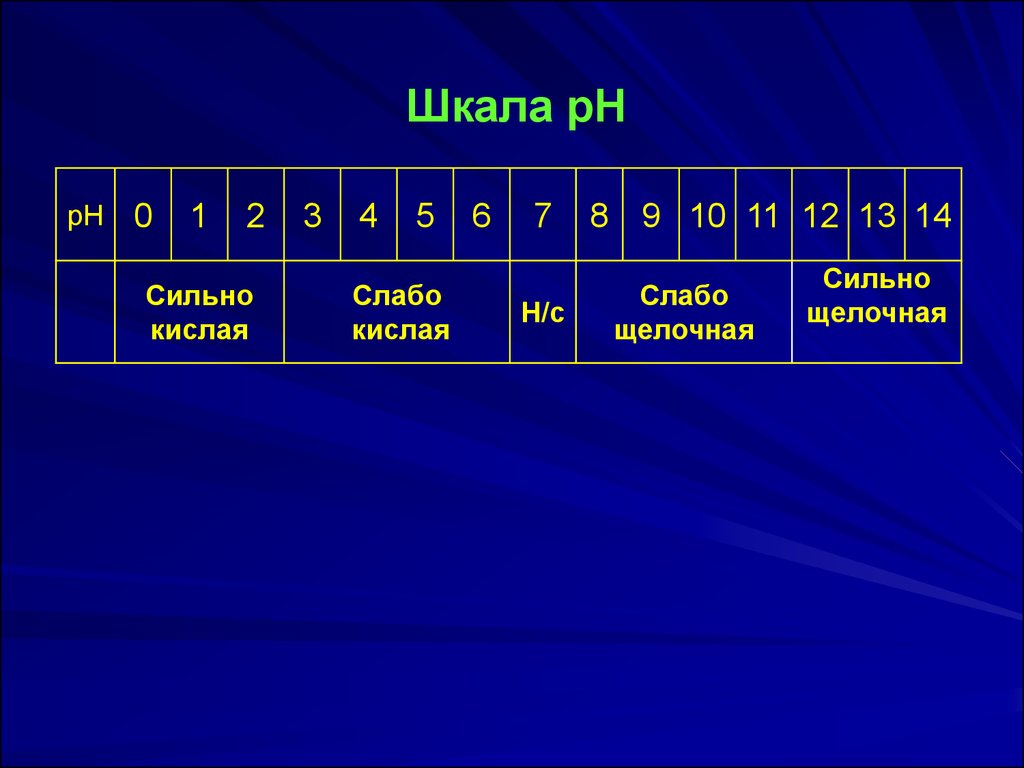
Шкала рНрН
0
1
2
Сильно
кислая
3
4
5
Слабо
кислая
6
7
Н/с
8 9 10 11 12 13 14
Слабо
щелочная
Сильно
щелочная
15. [H3O+] = 10-рН [OH-] = 10-рОН
При 100°С (Кw = 55∙10-14) чистая водаимеет рН = 6,12.
При 15°С (Кw = 0,46∙10-14) – рН = 7,17.
16. HA + H2О H3O+ + A-
HA + H2О H3O+ + A[H 3 O ] [A ]
КС
[HA] [H 2 O]
[H 3 O ] [A ]
Ка
[HA]
17. B + H2O BH+ + OH-
B + H2O BH+ + OH[BH ] [OH ]
Кb
[B]
18. закон разбавления (законом разведения) Оствальда:
CКi
1-
2
При α<<1
Кi C
2
19. рKа = –lg Kа; pKb = –lg Kb Кw = Ка ∙ Кb или рКw = рКа +рКb
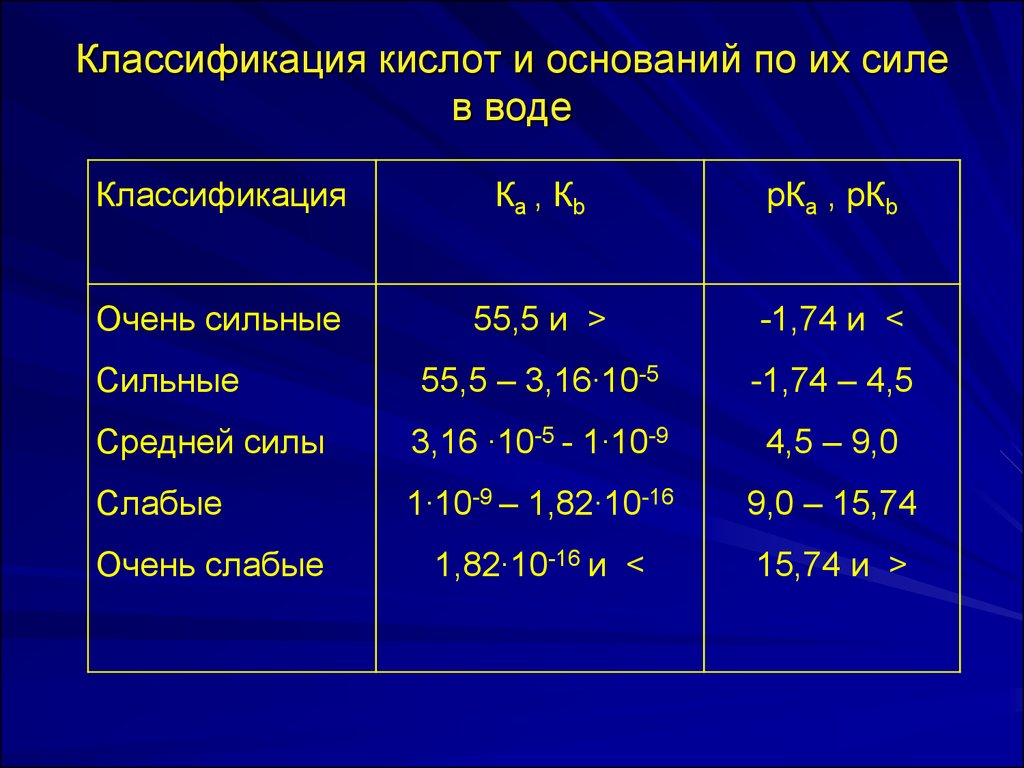
20. Классификация кислот и оснований по их силе в воде
КлассификацияКа , Кb
рКа , рКb
Очень сильные
55,5 и >
-1,74 и <
Сильные
55,5 – 3,16∙10-5
-1,74 – 4,5
Средней силы
3,16 ∙10-5 - 1∙10-9
4,5 – 9,0
Слабые
1∙10-9 – 1,82∙10-16
9,0 – 15,74
1,82∙10-16 и <
15,74 и >
Очень слабые
21. Автопротолиз
CH3СООН + CH3СООН CH3COO- + CH3COOH2+NH3 + NH3 NH2- + NH4+
CH3ОН + CH3ОН CH3O- + CH3OH2+
HSolv + HSolv H2Solv+ + Solv-
22.
[H 2Solv ] [Solv ]KС
2
[HSolv]
Поскольку [НSolv] = const, то
КС∙[НSolv] = const = Ks
Ks = [H2Solv+]∙[Solv-]
рКs = рH2Solv + рSolv
23. Степень сольволиза
Cshs
Co
24.
•Кислотные:CH3COOH + CH3COONa (pH = 3,8 – 6,3)
HCl + H2N-CH2-COOH (pH =1,1 – 3,5)
KH2PO4 + Na2HPO4 (pH = 4,8 – 8,0)
•Основные:
Na2B4O7 + HCl (pH = 7,71 – 9,23)
Na2B4O7 + H2N-CH2-COOH (pH = 9,23 – 11,02)
NaOH + H2N-CH2-COOH (pH = 8,53 – 12,90)
NH4OH + NH4Cl (pH до 10,24)
•Универсальные:
буферный раствор H3BO3 + H3PO4 + CH3COOH + NaOH
(pH = 1,8 –11,98)
•Буферные растворы индивидуальных веществ:
а) нас. водный раствор гидротартрата калия КНС4Н4О6
(рН = 3,567 при 25°С);
б) 0,05 М водный раствор гидрофталата калия КНС8Н4О4
(рН = 4,008 при 25°С);
в) 0,05 М водный раствор тетрабората натрия Na2B4O7·10Н2О
(рН = 9,18 при 25°С).
25.
HA + ОH- ⇄ A- + H2OA- + H3O+ ⇄ HA + H2О
СН3СООН + ОH- ⇄ СН3СОО- + H2O СН3СОО- + H3O+ ⇄ СН3СООН + H2О
NH4+ + ОH- ⇄ NH3 + H2O
NH3 + H3O+ ⇄ NH4+ + H2О
26. Буферная емкость
βC M(HA или MeOH)
ΔpH
27.
[Zn(H2O)4]2+ + H2O[Zn(Î Í )(H2O)3]+ + H2O
[Zn(OH)(H2O)3] + + H3O+
[Zn(OH)2(H2O)2] 0 + H3O+
28.
Кислотные свойства:[Zn(OH)2(H2O)2] + OH-
[Zn(OH)3H2O] - + H2O
Основные свойства:
[Zn(OH)2(H2O)2] + H3O+
[Zn(OH) (H2O)3]+ + H2O
29.
Bi(OH)3 + H2O H2BiO3- + H3O+-
[H 2 BiO 3 ] [H 3O ]
Ка1 =
; [Bi(OH) 3 (m)] const
[Bi(OH) 3 (m)]
Ка 1 = [H 2 BiO 3 ] [H 3O ] 5,0 10
-
-20
В сильно щелочной среде [H3O+] = 10-14 моль/л
-20
Ka
5,0
10
6
1
[H 2 BiO 3 ]
5,0 10 моль/л
14
[H 3O ] 1 10
30.
Для реакции Pb(OH)2 + H2O HPbO2- + H3O+Ка 1 = [HPbO 2 ] [H 3O ] 3,2 10
-
-16
В сильно щелочной среде [H3O+] = 10-14 моль/л
-16
Ka
3,2
10
2
1
[HPbO 2 ]
3
,2
10
моль/л
14
[H 3O ] 1 10











![[H3O+] = 10-рН [OH-] = 10-рОН [H3O+] = 10-рН [OH-] = 10-рОН](https://cf.ppt-online.org/files/slide/z/Za6QUgxRJ9MpAw2fCVOoYc8WTmj7FBGb5tXLlv/slide-14.jpg)
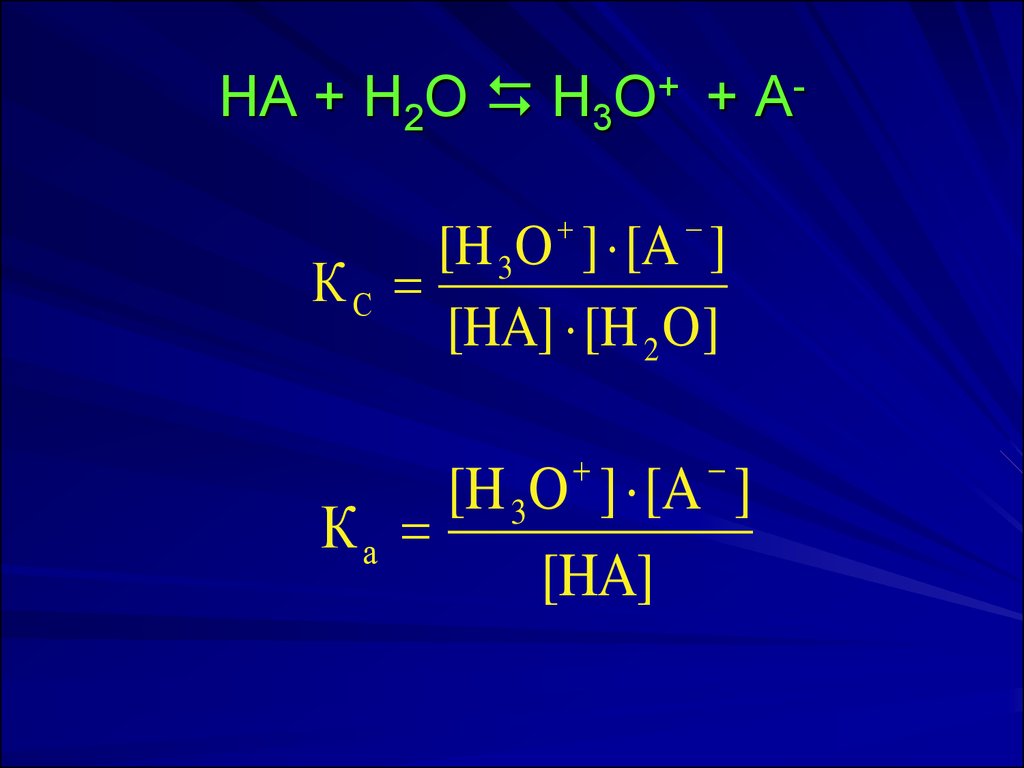
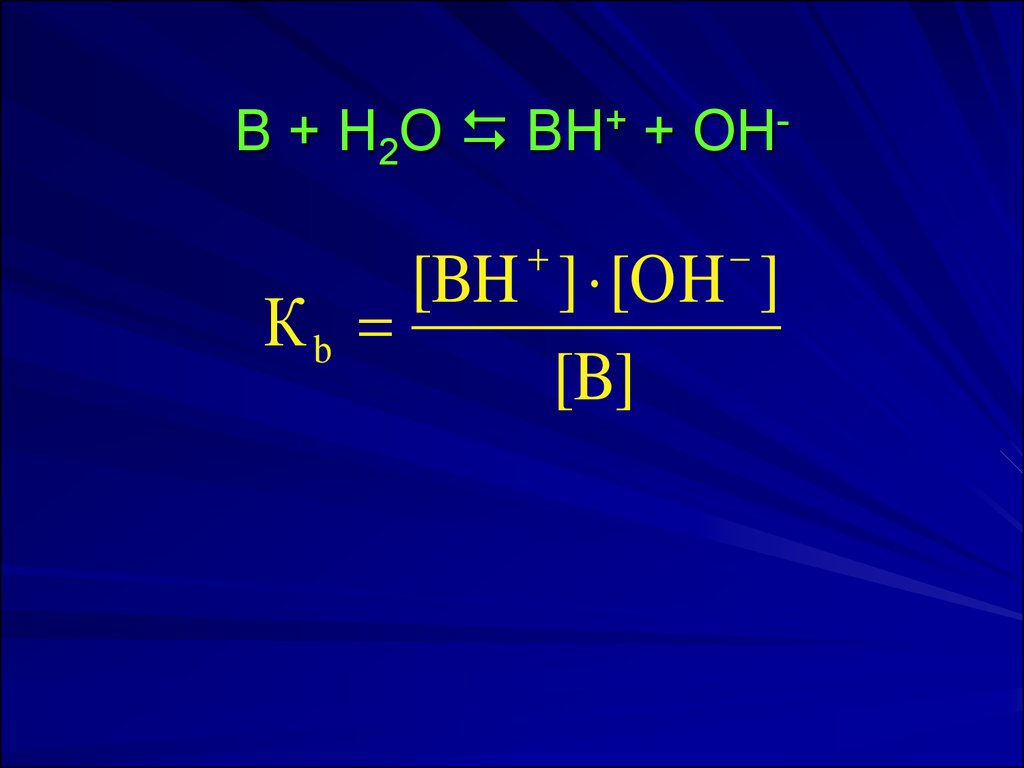












 Химия
Химия








