Похожие презентации:
Электролиты. Неэлектролиты
1.
9 класс2. Все вещества по отношению к элект- рическому току можно разделить на :
Все вещества по отношению к электрическому току можно разделить на :их растворы
или расплавы
их растворы
или расплавы
ПРОВОДЯТ
НЕ ПРОВОДЯТ
электрический ток
электрический ток
Вид химической связи
Ионная или
ковалентная
сильно полярная
Ковалентная
неполярная
или мало полярная
3.
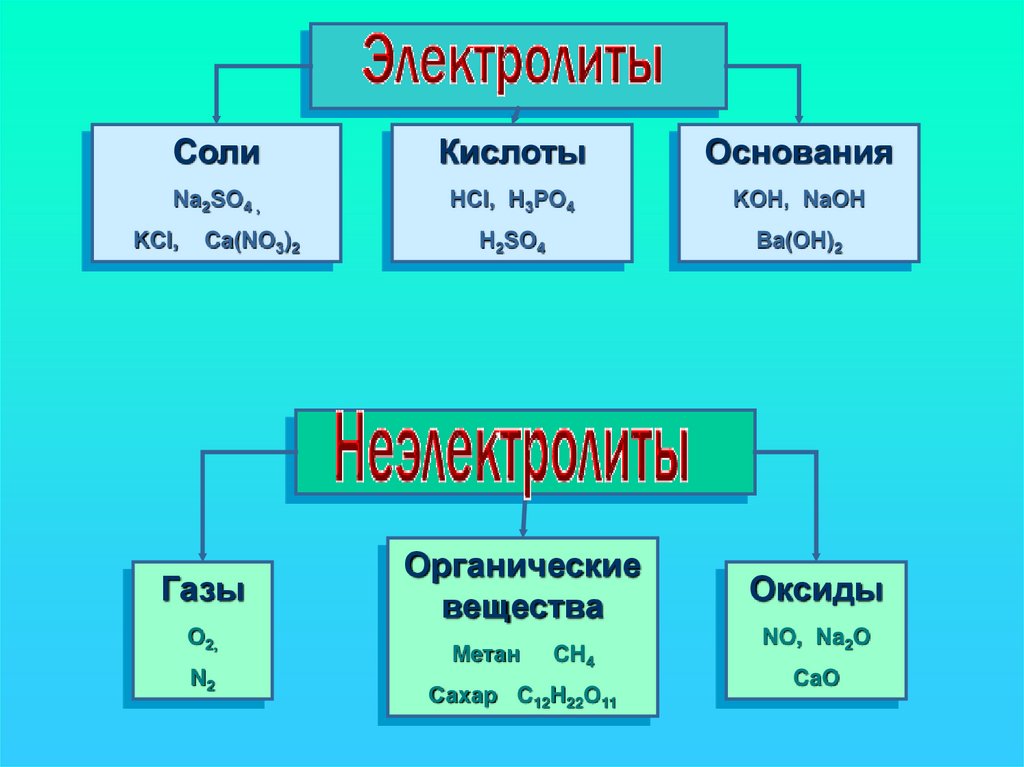
CолиКислоты
Основания
Na2SO4 ,
HCl, H3PO4
KOH, NaOH
H2SO4
Ba(OH)2
KCl,
Ca(NO3)2
Газы
O2,
N2
Органические
вещества
Метан
CH4
Сахар C12H22O11
Оксиды
NO, Na2O
CaO
4.
процесс растворенияэлектролитов сопровождается
образованием заряженных
частиц, способных проводить
электрический ток.
Процесс появления гидратированных ионов в
водном растворе называется электролитической
диссоциацией
(С. Аррениус, 1887 г.) .
5.
Все вещества по их способности проводитьэлектрический ток в растворах или
расплавах делятся на электролиты и
неэлектролиты.
6.
В растворах электролитыдиссоциируют ( распадаются) на
положительные и отрицательные ионы.
NaOH Na OH
2
H 2SO 4 2H SO 4
MgCl 2 Mg
2
2Cl
Процесс распада электролита на ионы
в растворе или расплаве называется
электролитической диссоциацией.
7.
Причиной диссоциации электролитаявляется его взаимодействие с
молекулами воды, т.е. его гидратация
8.
Под действиемтока
положительные
ионы движутся
к катоду и
называются
катионы, а
отрицательные
– к аноду и
называются
анионы.
9.
Не все электролиты в одинаковой мередиссоциируют на ионы
Сильные
электролиты
Электролиты
средней силы
Слабые
электролиты
> 30%
3% 30%
< 3%
10.
Сильные электролиты> 30%
1. Все растворимые соли (NaCl,
K2SO4, Ba(NO3)2 и т д.)
2. 10!!! щелочей
(LiOH, NaOH, KOH, RbOH, CsOH, FrOH
Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2
3. 10!!! кислот
(HClO3, HClO4, H2SO4, HNO3, HCl, HBr,
HJ, HMnO4, H2Cr2O7, H2CrO4)
11.
Свойства растворовэлектролитов
определяются свойствами
тех ионов, которые они
образуют при диссоциации.
12. Классы неорганических веществ с точки зрения ТЭД
13.
+-
HCl H + Cl
+
HNO3 H +
+
NO3
H2SO4 2H +
2SO4
Кислоты – это электролиты,
которые диссоциируют на
катионы водорода и
анионы кислотного остатка.
14.
Диссоциация кислотСильный электролит
+
2-
H2SO4 2H + SO4
+
HNO3 H + NO3
+
-
HCl H + Cl
-
Слабый электролит
+
H2SO3 H + HSO3
1
-
+
HSO3 H +
2SO3 2
1>> 2
+
-
H2SO3 H + HSO3
Многоосновные кислоты диссоциируют ступенчато. Каждая
последующая степень протекает хуже предыдущей.
15.
NaOH Na+ + OHBa(OH)2 Ba2+ + 2OHKOH K+ + OH-Основания – это электролиты,
которые диссоциируют на катионы
металла и анионы гидроксогрупп
16.
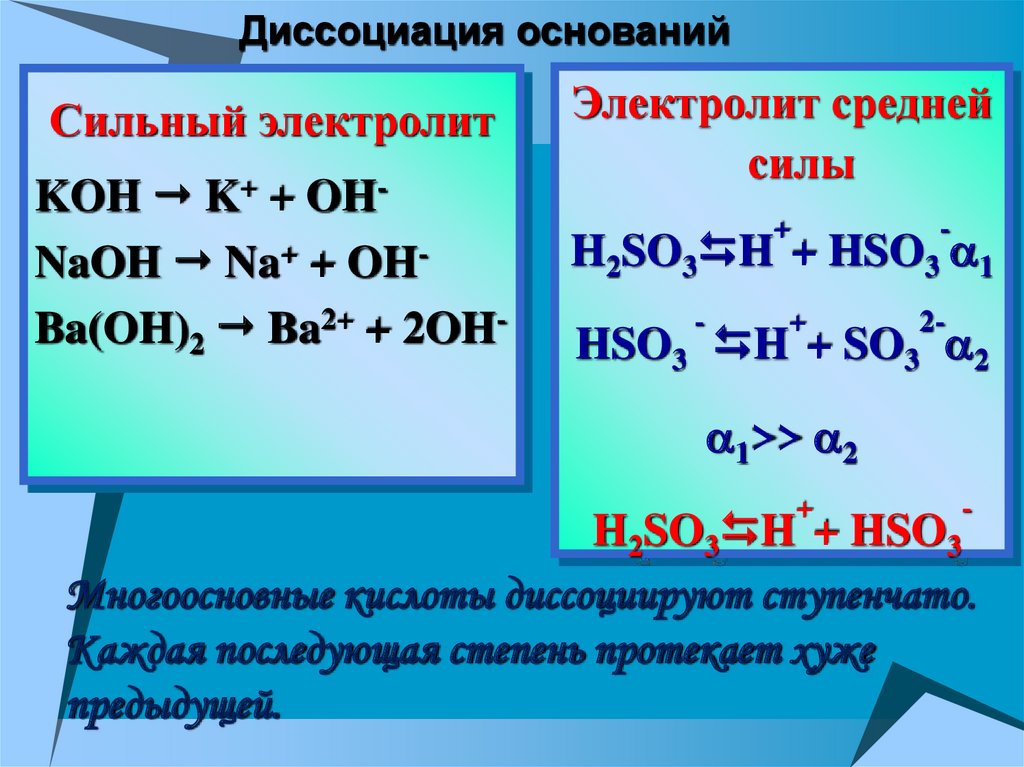
Диссоциация основанийСильный электролит
KOH K+ + OHNaOH Na+ + OHBa(OH)2 Ba2+ + 2OH-
Электролит средней
силы
+
H2SO3 H +
-
HSO3 1
+
2-
HSO3 H + SO3 2
1>> 2
+
-
H2SO3 H + HSO3
Многоосновные кислоты диссоциируют ступенчато.
Каждая последующая степень протекает хуже
предыдущей.
17.
NaCl Na+ + ClKNO3 K+ + NO3Al2(SO4)3 2Al3+ + 3SO42-Соли – это электролиты, которые
диссоциируют на катионы металла или
аммония NH4+ и анионы кислотных
остатков.
18.
Классификация солейсредние
кислые
основные
Образованы
катионами
металла и
анионами
кислотного
остатка
Кроме
металла
и кислотного
остатка
содержат
водород
Кроме
металла
и кислотного
остатка
содержат
гидроксогруппу
19.
+-
HSO4 H +
2SO4 2
NaHSO4 Na + HSO4 1
-
+
1 2
+
NaHSO4 Na +
HSO4
С точки зрения ТЭД, кислыми солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют ионы водорода .
20.
Ba(OH)Cl-
BaOH
BaOH+
Ba2+
-
+ Cl 1
-
+ OH 2
1 2
Ba(OH)Cl
BaOH+
-
+ Cl
С точки зрения ТЭД, основными солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют гидроксид ионы.
21.
Условия протекания реакцииионного обмена
Реакции в растворах электролитов
протекают до конца если:
Образуется или растворяется
осадок;
Выделяется газ;
Образуется малодиссоциирующее
вещество (например Н2О)
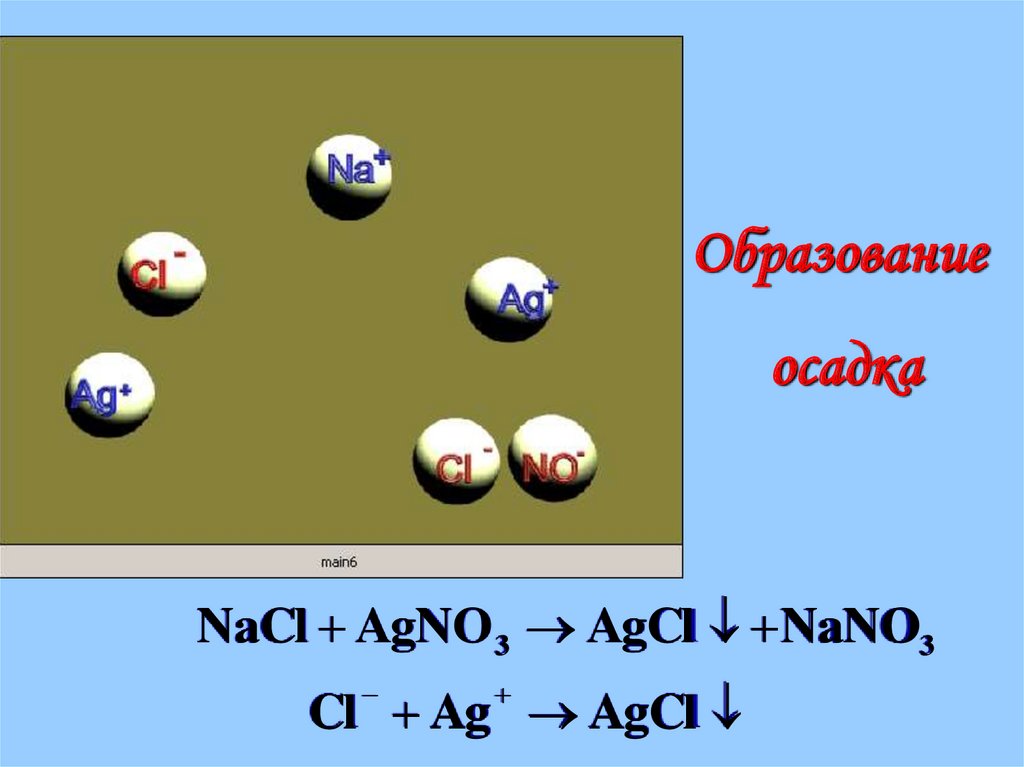
22.
Образованиеосадка
NaCl AgNO 3 AgCl NaNO3
Cl Ag AgCl
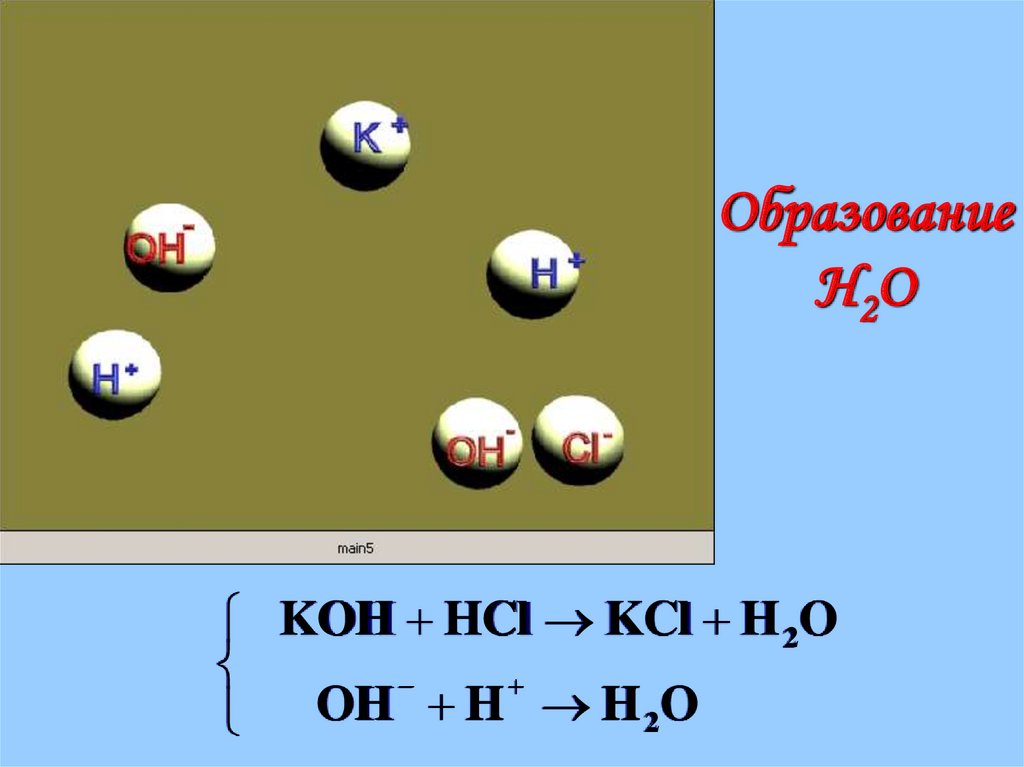
23.
ОбразованиеH 2O
KOH HCl KCl H 2O
OH H H 2O
24.
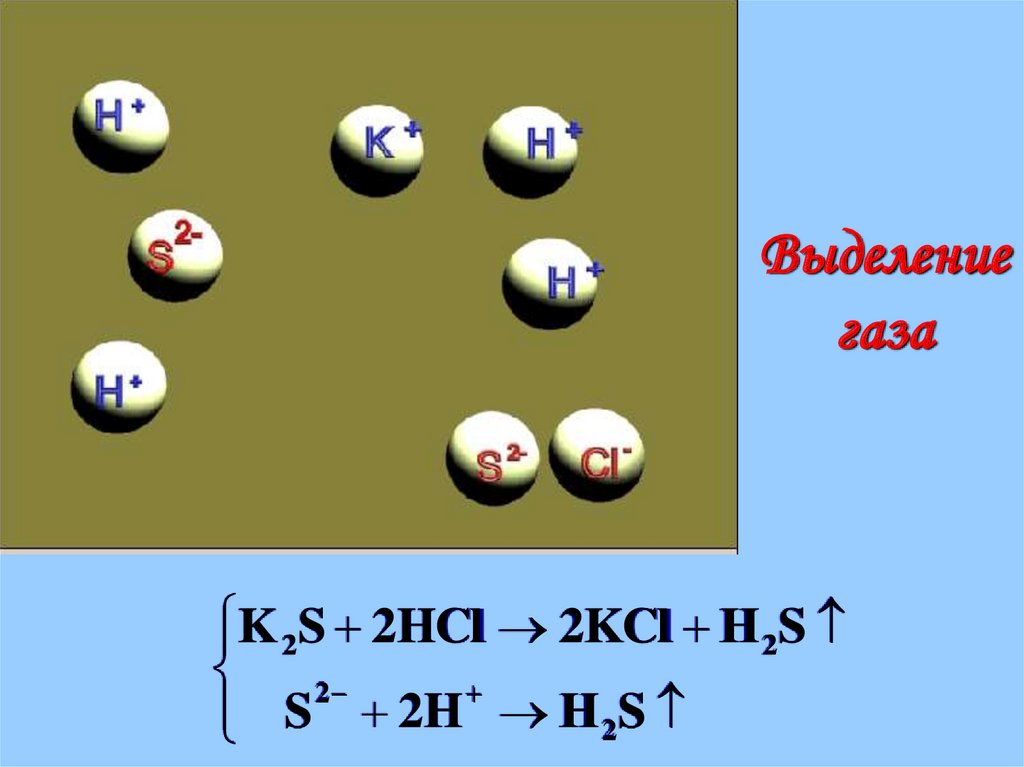
Выделениегаза
K 2S 2HCl 2KCl H 2S
2
S 2H H 2S



















 Химия
Химия








