Похожие презентации:
Химическая связь
1. Химическая связь
2. Ковалентная связь
-это химическая связь, возникающая
между атомами за счет образования
общих электронных пар.
Рассмотрим механизм образования
ковалентной связи на примере молекулы
водорода H2.
3. МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ
Если встречаются два одинаковых атомаводорода,
то в этом случае проблему завершения
электронного слоя эти атомы будут решать на
паритетных началах — просто объединят
свои электроны, т. е. создадут общую
электронную пару. При этом электронные
облака-орбитали перекроются, и в
пространстве между ядрами двух водородных
атомов возникнет некоторая дополнительная
электронная плотность — отрицательный
заряд, стягивающий положительные ядра
взаимодействующих атомов.
Именно так возникает ковалентная связь у
всех двухатомных молекул простых веществ
(F2, Cl2, N2 и др.):
4. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Аналогичный механизм возникновения ковалентнойсвязи наблюдается и между атомами разных химических
элементов, например, в молекуле HCl.
Нетрудно заметить, что, так же как и в случае
образования ковалентной связи между атомами одного
элемента, химическая связь между атомами разных
элементов возникает за счёт образования общих
электронных пар. Но всё не так просто. Паритета между
атомами в этом случае не будет, так как начинает
проявляться так называемая
электроотрицательность.
Электроотрицательностью называется способность
атомов химических элементов оттягивать к себе общие
электронные пары.
5. Ковалентная полярная связь
Важнейшие неметаллы можно расположить таким образом —помере увеличения их электроотрицательности:
H → C → S → Br → N → Cl → O → F
Поскольку разные элементы обладают различной
электроотрицательностью, то общая электронная пара
оказывается смещённой в сторону элемента, обладающего
большей электроотрицательностью. В результате на атоме
такого элемента образуется частичный отрицательный заряд
(его обозначают δ–). Соответственно, на атоме элемента с
меньшей электроотрицательностью возникнет такой же
частичный, но уже положительный заряд (его обозначают δ+).
Следовательно, по линии ковалентной связи возникнет два
полюса — отрицательный и положительный. Поэтому такую
ковалентную связь называют полярной. Понятно, что
ковалентная связь между атомами одного химического
элемента будет неполярной, так как в этом случае зарядовполюсов по линии связи не возникает. В рассмотренных
примерах для молекул хлороводорода связь H Cl является
ковалентной полярной.
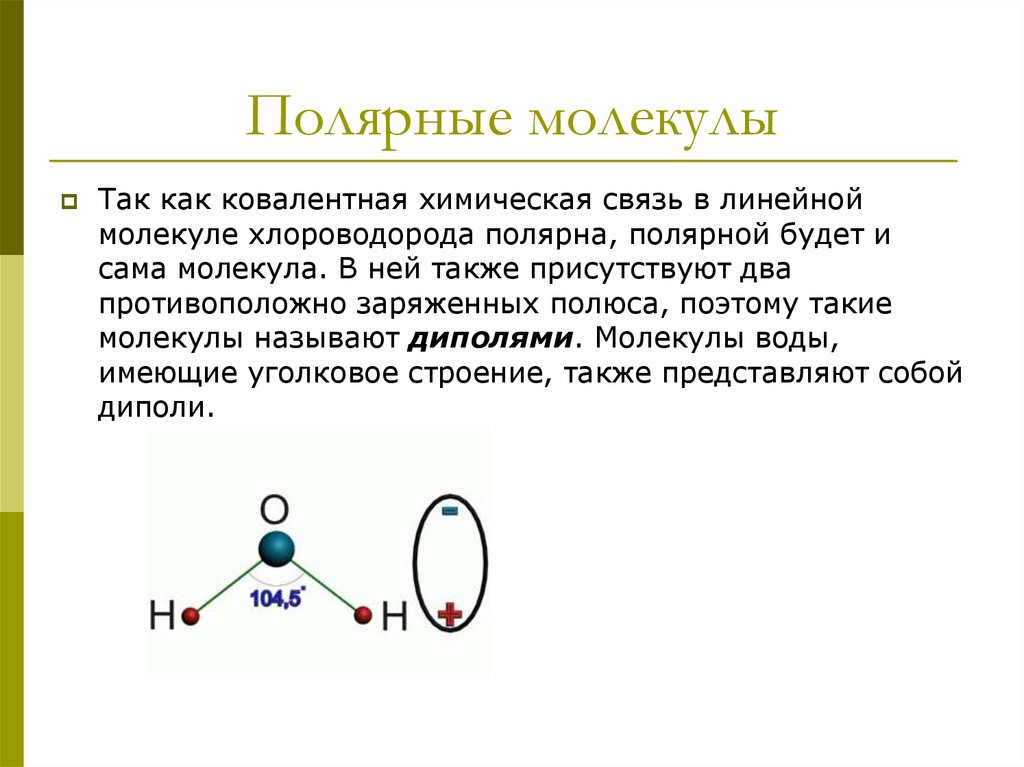
6. Полярные молекулы
Так как ковалентная химическая связь в линейноймолекуле хлороводорода полярна, полярной будет и
сама молекула. В ней также присутствуют два
противоположно заряженных полюса, поэтому такие
молекулы называют диполями. Молекулы воды,
имеющие уголковое строение, также представляют собой
диполи.
7. Молекулярная кристаллическая решетка
Для веществ с ковалентной связью характерны два типарешёток — молекулярные и атомные.
В узлах таких решёток находятся молекулы,
образованные за счёт прочных ковалентных связей. А
вот между молекулами действуют слабые силы
межмолекулярного притяжения (в физике их называют
ван-дер-ваальсовыми — по имени голландского учёного,
лауреата Нобелевской премии
Я. Д. Ван-дерВаа́льса (1837—1923)), поэтому вещества с
молекулярными кристаллическими решётками
непрочные, легкоплавкие, летучие. Такие
кристаллические решётки имеют
газы и жидкости в твёрдом состоянии, кристаллический
йод, сера, белый фосфор, большинство органических
веществ.
Кристаллическая
Кристаллическаярешетка
решетка
углекислого
углекислогогаза
газа
8. Атомная кристаллическая решетка
Ковалентные связи могут приводить к образованиювеществ не молекулярного, а атомного строения, т. е.
веществ с атомной кристаллической решёткой. Это такие
решётки, в узлах которых располагаются отдельные
атомы, соединённые между собой очень прочными
ковалентными связями. Примером веществ с таким типом
кристаллической решётки может служить аллотропная
модификация углерода —алмаз.
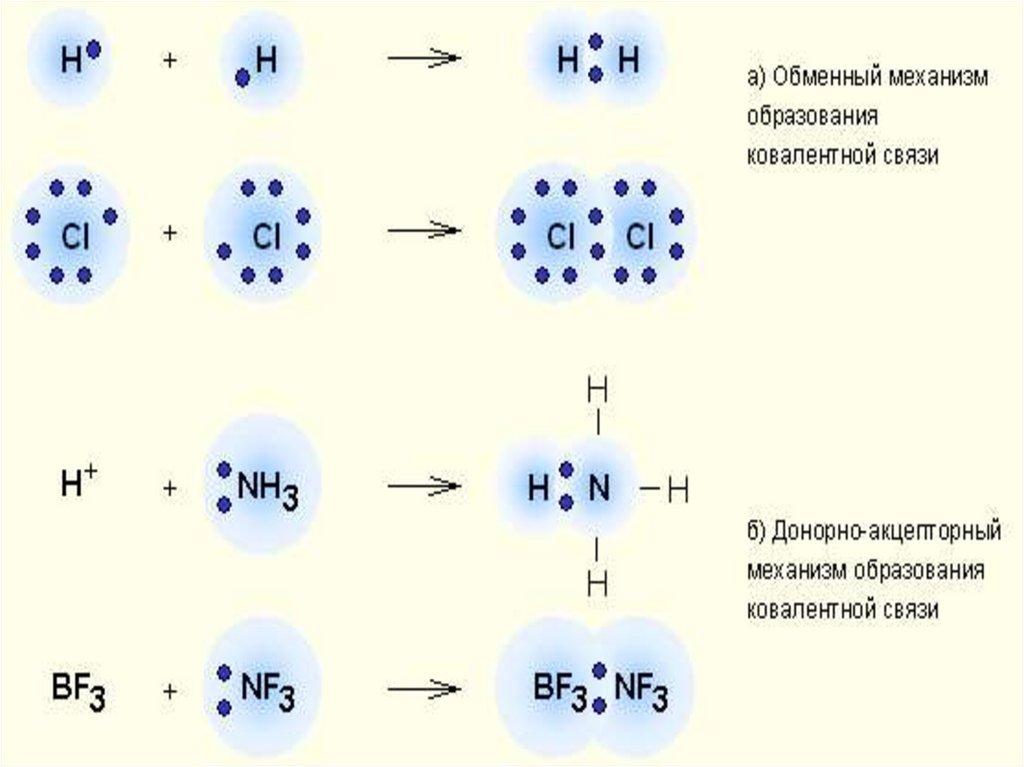
9. Классификация КС
1.По механизму
образования
Донорно-
Обменный
механизм
Каждый из
атомов
предоставляет
неспаренный
( неспаренные)
электроны для
образования
связи
акцепторный
механизм
Донор предоставляет
общую электронную
пару, акцептор
предоставляет свободную
электронную
орбиталь,которую эта
10.
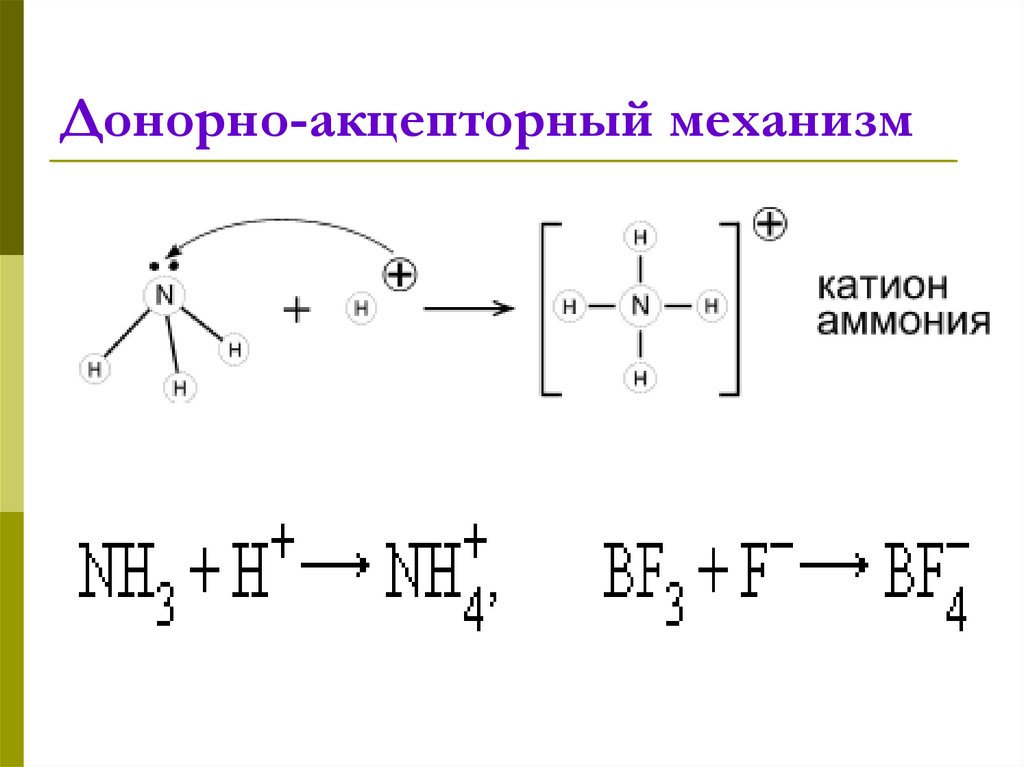
11. Донорно-акцепторный механизм
12. Донорно-акцепторный механизм
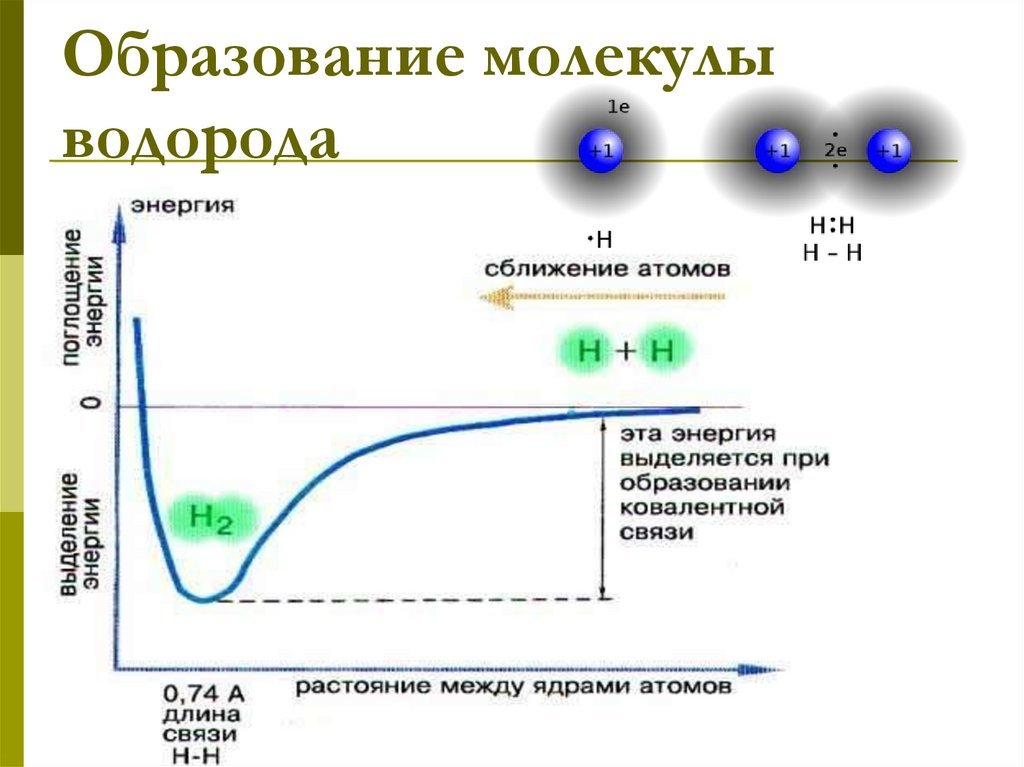
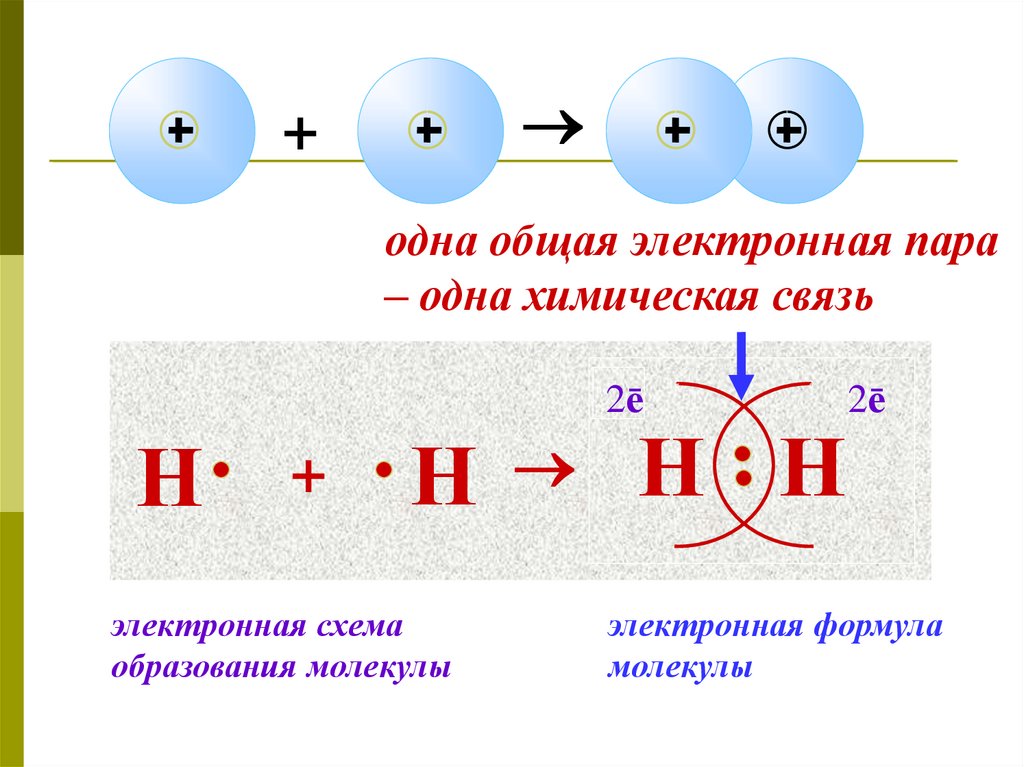
13. Образование молекулы водорода
14.
+одна общая электронная пара
– одна химическая связь
2ē
Н
+
Н
электронная схема
образования молекулы
Н Н
2ē
электронная формула
молекулы
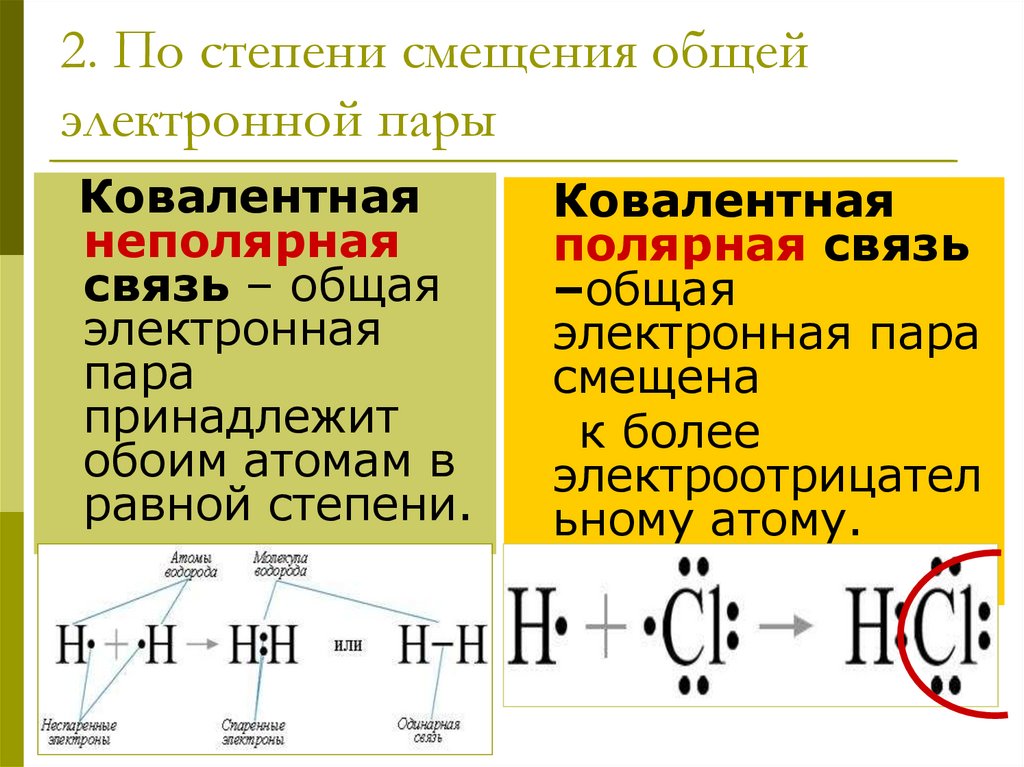
15. 2. По степени смещения общей электронной пары
Ковалентнаянеполярная
связь – общая
электронная
пара
принадлежит
обоим атомам в
равной степени.
Ковалентная
полярная связь
–общая
электронная пара
смещена
к более
электроотрицател
ьному атому.
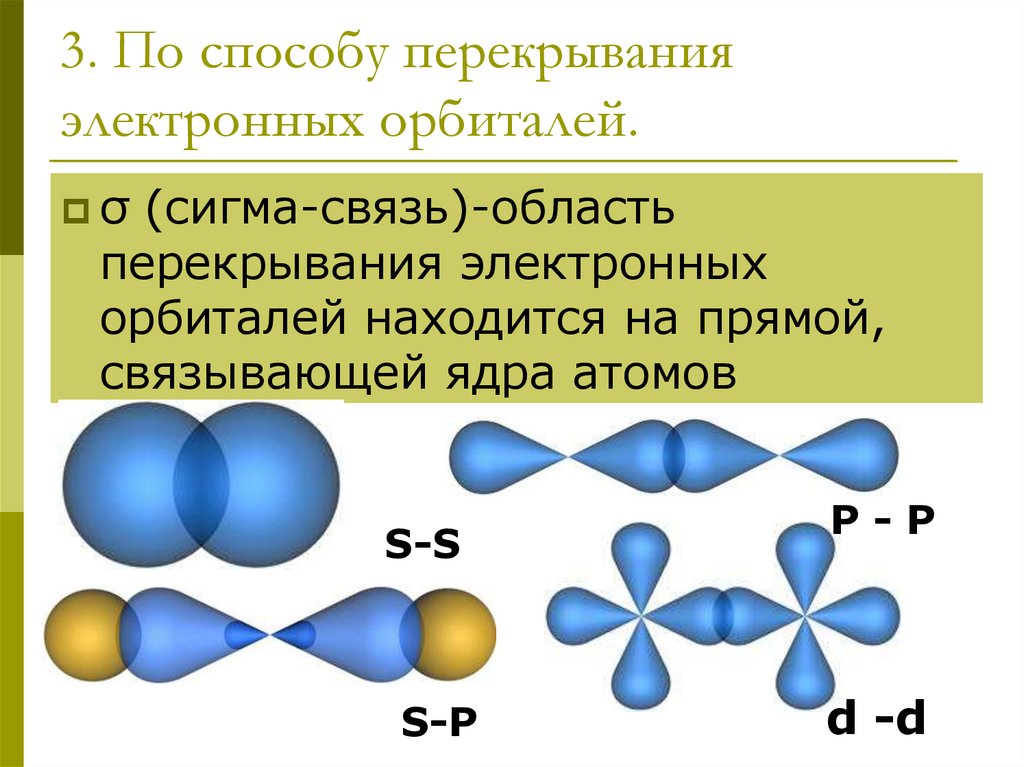
16. 3. По способу перекрывания электронных орбиталей.
σ(сигма-связь)-область
перекрывания электронных
орбиталей находится на прямой,
связывающей ядра атомов
S-S
S-P
P-P
d -d
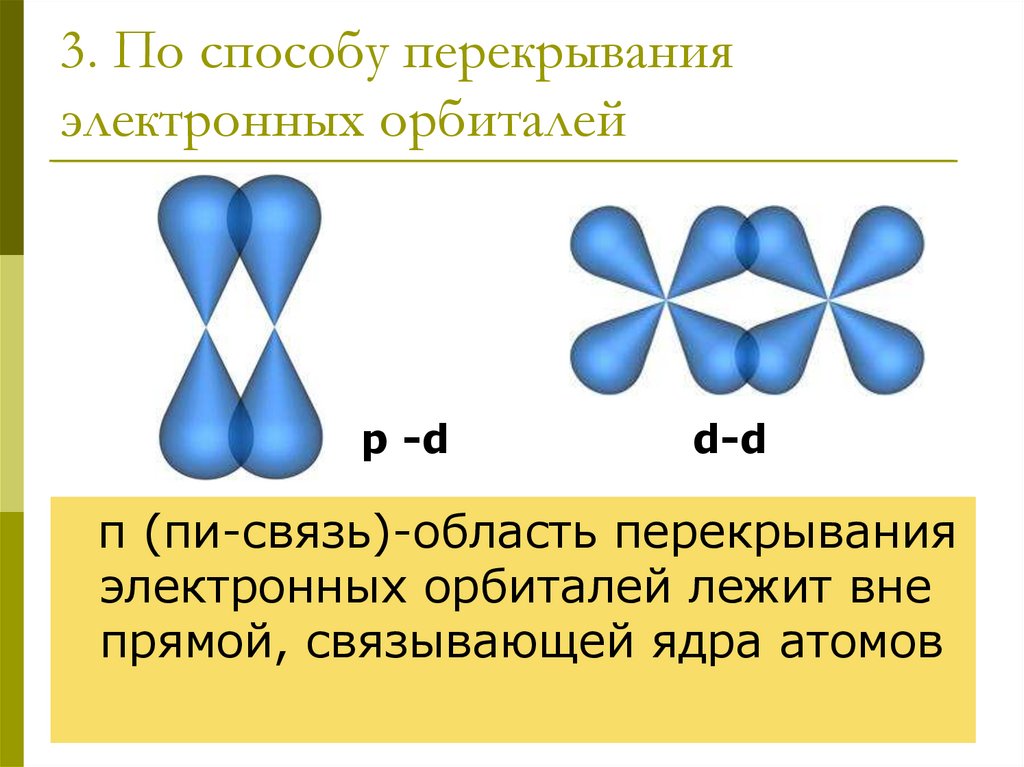
17. 3. По способу перекрывания электронных орбиталей
p -dd-d
π (пи-связь)-область перекрывания
электронных орбиталей лежит вне
прямой, связывающей ядра атомов
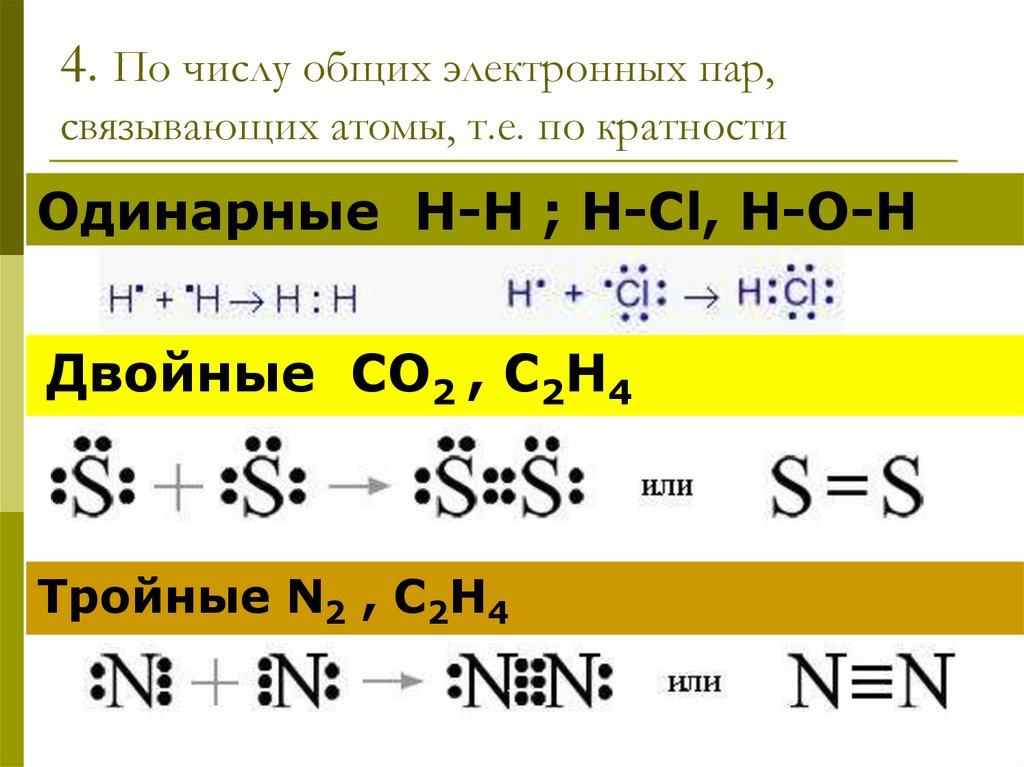
18. 4. По числу общих электронных пар, связывающих атомы, т.е. по кратности
Одинарные Н-Н ; H-Cl, H-O-HДвойные СО2 , С2Н4
Тройные N2 , С2Н4
19. Типы кристаллических решеток
Молекулярная
В узлах находятся
молекулы. Силы
притяжения слабые.
Вещества
непрочные,
легкоплавкие,
летучие.
Газы и жидкости в
твердом состоянии,
сера, иод, нафталин,
белый фосфор,
углекислый
газ(«сухой лёд»),
органические
Атомная
В узлах находятся
атомы. Силы
притяжения сильные.
Вещества прочные,
тугоплавкие,
нелетучие, не
проводят
электрический ток (
кроме графита)
Алмаз, кремний
кристаллический,
бор, оксид кремния(
кремнезем)
20.
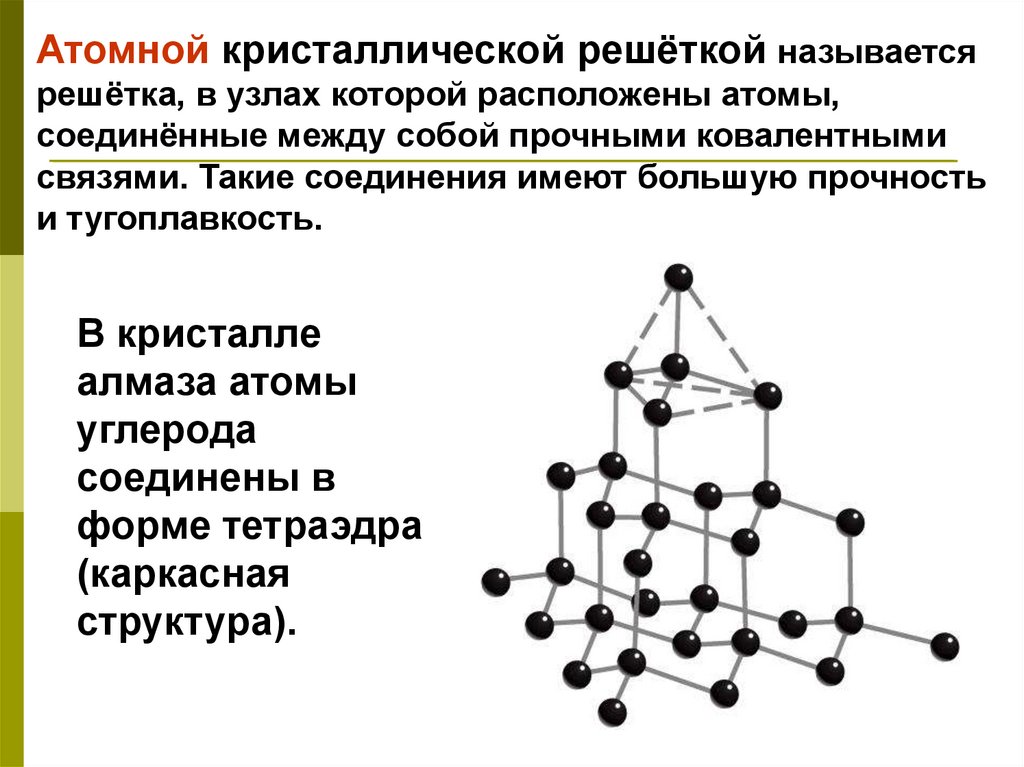
Атомной кристаллической решёткой называетсярешётка, в узлах которой расположены атомы,
соединённые между собой прочными ковалентными
связями. Такие соединения имеют большую прочность
и тугоплавкость.
В кристалле
алмаза атомы
углерода
соединены в
форме тетраэдра
(каркасная
структура).
21.
Алмаз.22.
23.
Молекулярной кристаллической решёткойназывается решётка, в узлах которой расположены
молекулы, удерживаемые силами межмолекулярного
взаимодействия . Такие соединения легко плавятся.
При н.у. часто являются газами или подвижными
жидкостями.
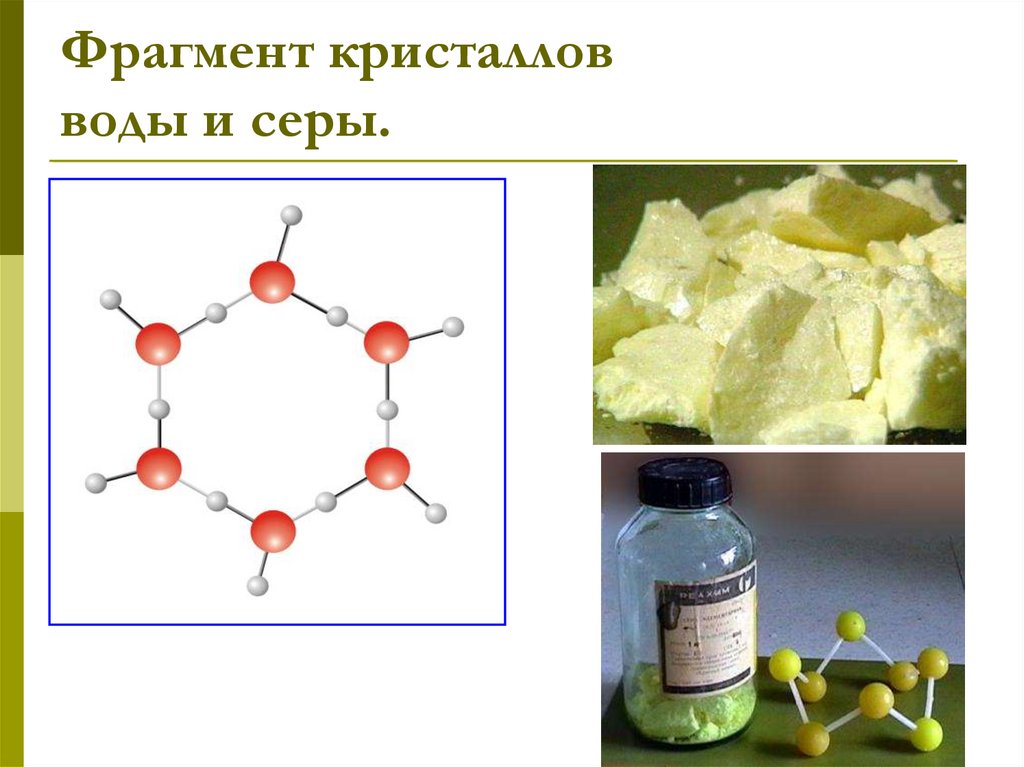
24. Фрагмент кристаллов воды и серы.
25. Кристаллическая решётка графита –слоистое строение.
Кристаллическая решётка графита –слоистое строение.
26. Графит.
27. Домашнее задание
Габриелян химия 11 базовыйуровень
§ 4 стр.37 вопросы 1. 2, 3,6, 7,8
Составьте формулу ионного
фторида и молекулярного оксида с
наименьшей молекулярной
массой. Рассчитайте массовые
доли фтора и кислорода в этих
соединениях
















 Химия
Химия








