Похожие презентации:
Функции метаболизма
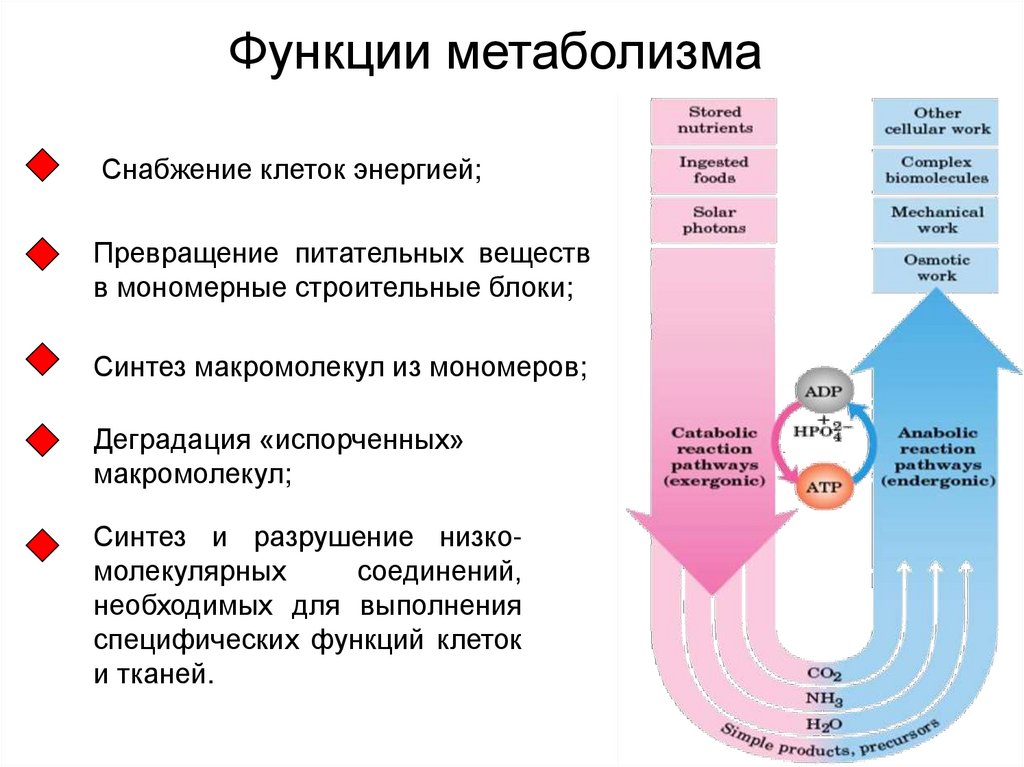
1. Функции метаболизма
Снабжение клеток энергией;Превращение питательных веществ
в мономерные строительные блоки;
Синтез макромолекул из мономеров;
Деградация «испорченных»
макромолекул;
Синтез и разрушение низкомолекулярных
соединений,
необходимых для выполнения
специфических функций клеток
и тканей.
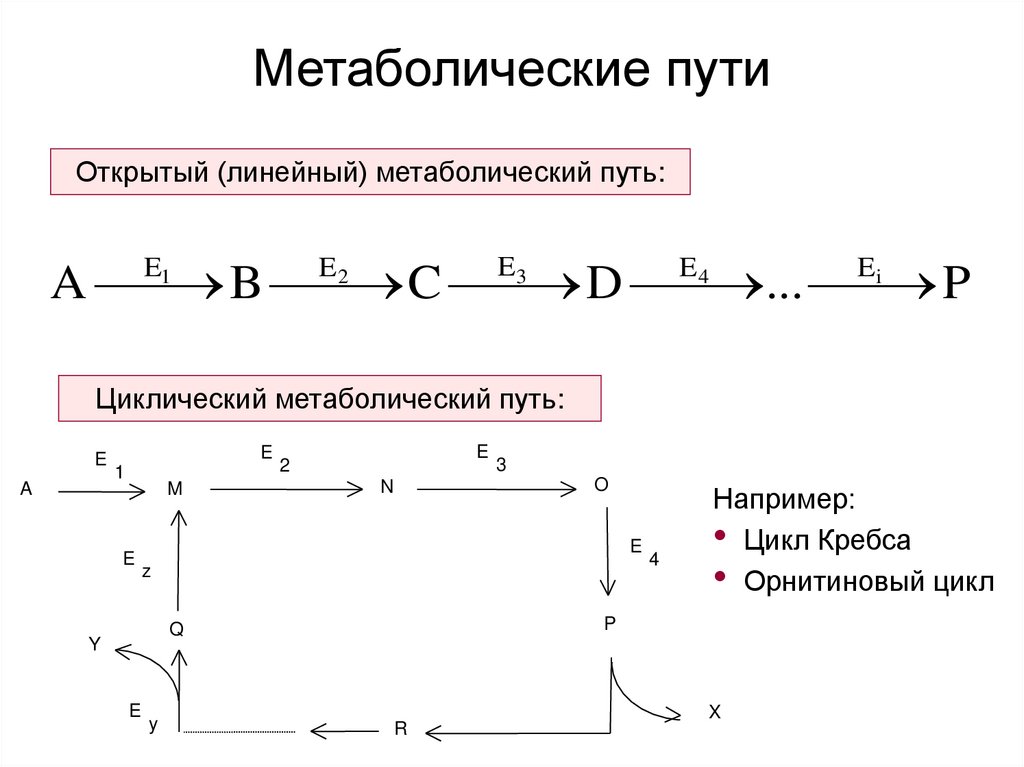
2. Метаболические пути
Открытый (линейный) метаболический путь:A B C D ... P
E1
E3
E2
E4
Ei
Циклический метаболический путь:
E
A
E
1
M
E
E
2
O
N
E
z
Y
y
4
Например:
• Цикл Кребса
• Орнитиновый цикл
P
Q
E
3
R
X
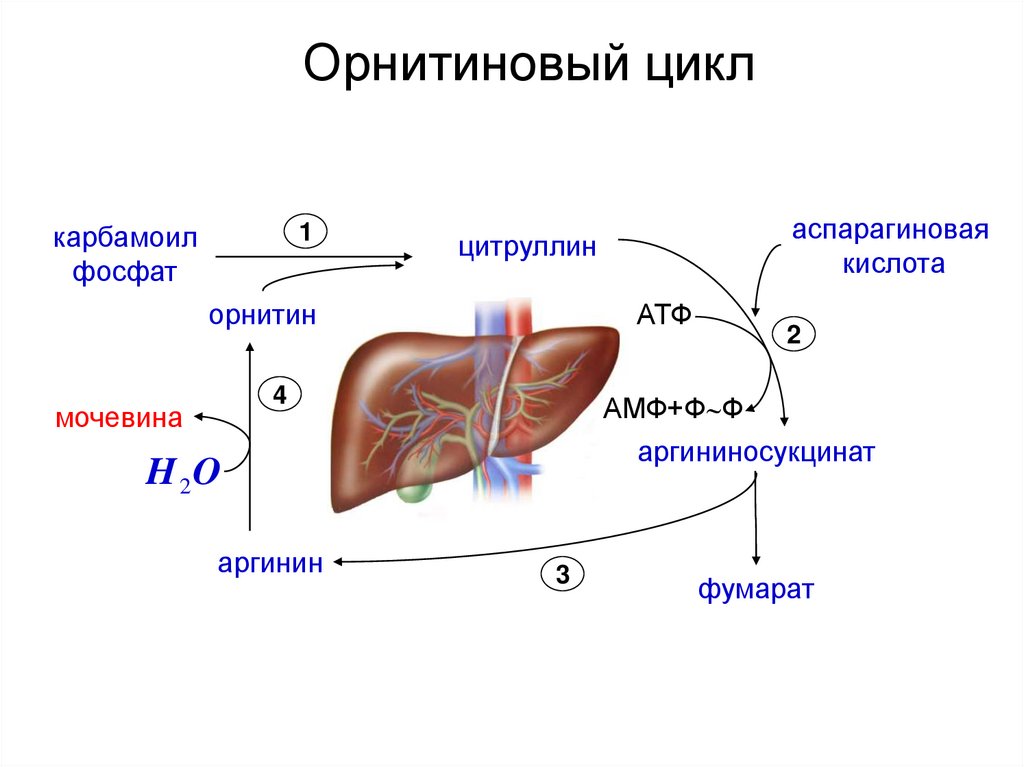
3.
Орнитиновый циклкарбамоил
фосфат
1
орнитин
АТФ
4
мочевина
2
АМФ+Ф Ф
аргининосукцинат
H 2O
аргинин
аспарагиновая
кислота
цитруллин
3
фумарат
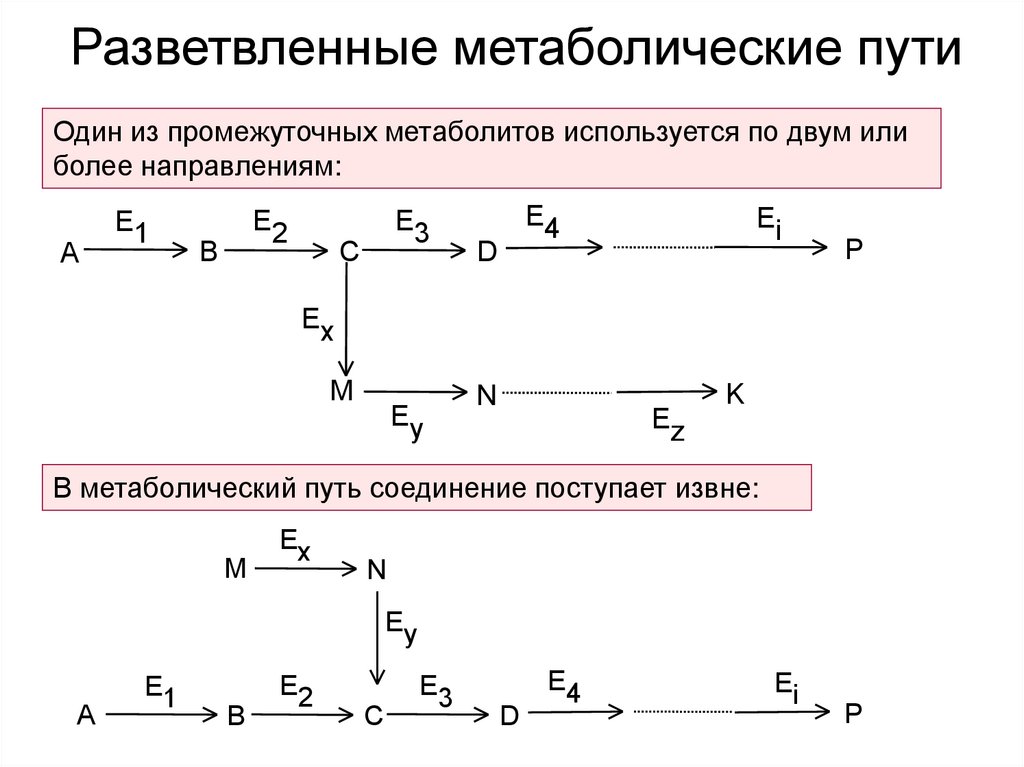
4. Разветвленные метаболические пути
Один из промежуточных метаболитов используется по двум илиболее направлениям:
A
E1
E2
B
E3
C
E4
D
Ei
P
Ex
M
Ey
N
Ez
K
В метаболический путь соединение поступает извне:
M
Ex
N
Ey
A
E1
B
E2
C
E3
D
E4
Ei
P
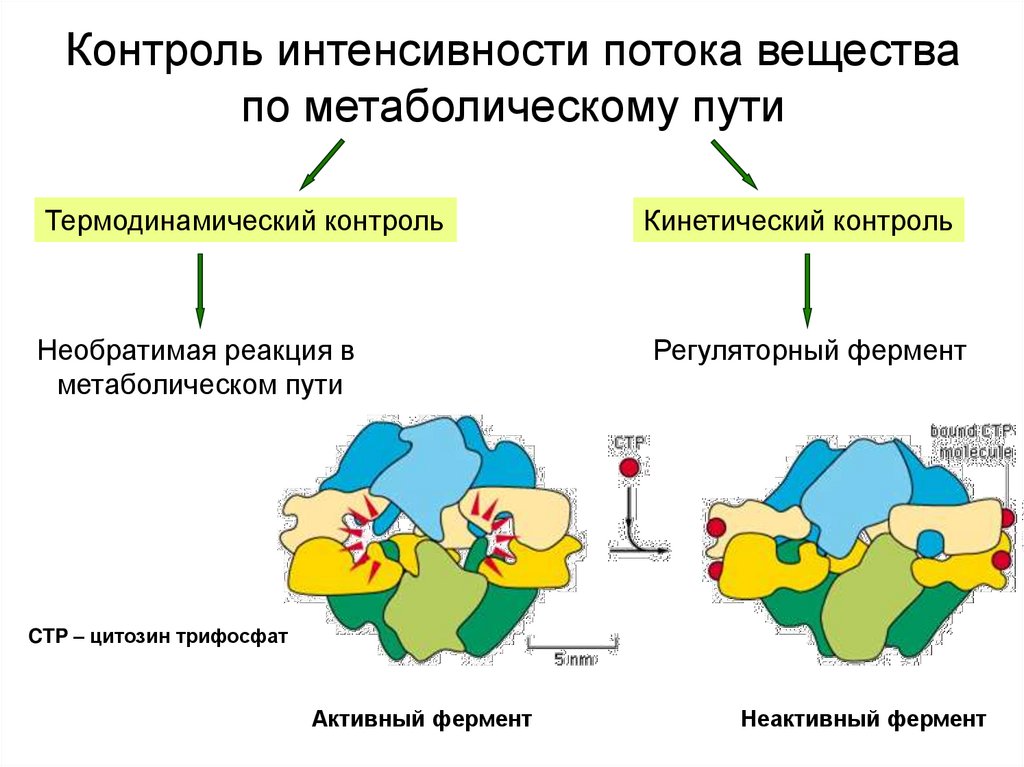
5. Контроль интенсивности потока вещества по метаболическому пути
Термодинамический контрольНеобратимая реакция в
метаболическом пути
Кинетический контроль
Регуляторный фермент
CTP – цитозин трифосфат
Активный фермент
Неактивный фермент
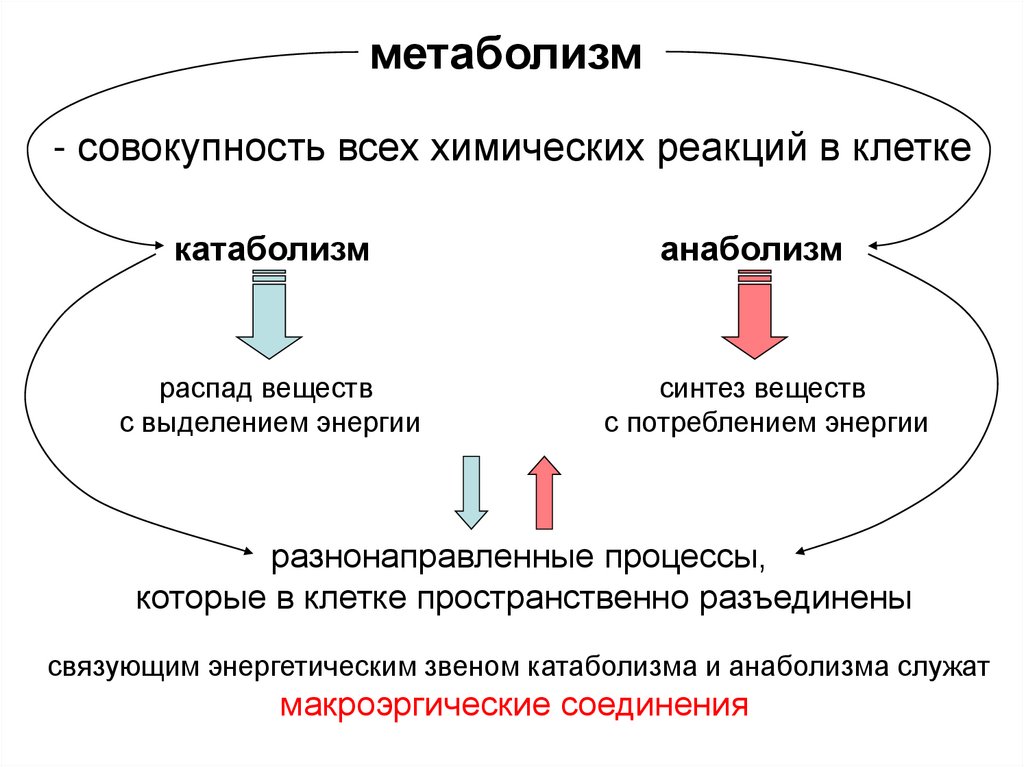
6.
метаболизм- совокупность всех химических реакций в клетке
катаболизм
распад веществ
с выделением энергии
анаболизм
синтез веществ
с потреблением энергии
разнонаправленные процессы,
которые в клетке пространственно разъединены
связующим энергетическим звеном катаболизма и анаболизма служат
макроэргические соединения
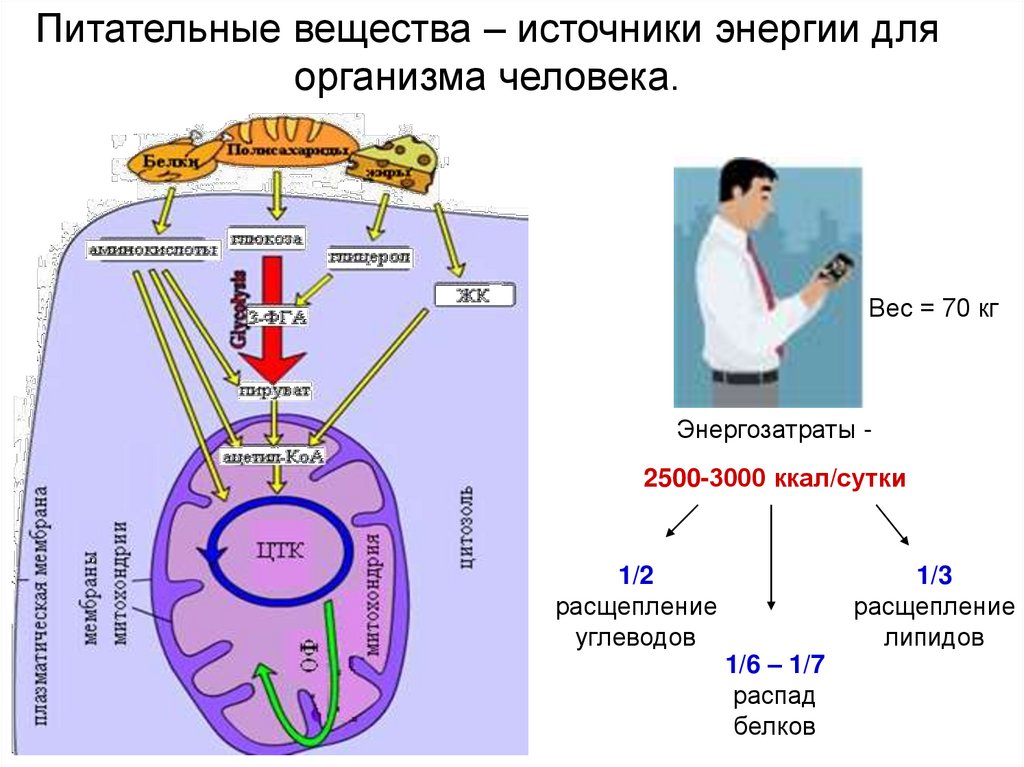
7.
Питательные вещества – источники энергии дляорганизма человека.
Вес = 70 кг
Энергозатраты 2500-3000 ккал/сутки
1/2
расщепление
углеводов
1/6 – 1/7
распад
белков
1/3
расщепление
липидов
8. Пища как источник незаменимых соединений
Витамины:B1,B2,B5,B7,B12,
K,C,E,D.
Макроэлементы:
Na (4-6 г), Cl (2-4 г), K (2-3 г),
Ca (0,7-0,8 г), P (1,2-2 г).
Микроэлементы:
Fe (10-18 мг), Zn (15 мг), Cu (2 мг),
Mo (500 мкг), I (100-130 мкг).
Аминокислоты:
• 8 незаменимых аминокислот Вал, Лей, Иле, Тре, Мет, Лиз, Фен и Три
• 2 условно заменимые аминокислоты - Арг и Гис
9. Законы термодинамики
I закон термодинамики:Организмы не могут создавать энергию из ничего, они могут лишь
извлекать энергию из окружающей среды, трансформировать её из
одного вида в другой и возвращать обратно в окружающею среду в
виде тепла:
E системы E среды 0
II закон термодинамики:
Все самопроизвольные процессы идут в направлении, соответствующем
возрастанию энтропии системы.
Увеличение энтропии окружающей среды превосходит уменьшение
энтропии в растущем организме:
Sсистемы Sсреды 0
10. Основное уравнение термодинамики
E G T Sгде
E – изменение общей энергии системы;
G – изменение свободной энергии системы;
S – изменение энтропии;
T – абсолютная температура (K).
Изменение общей энергии системы равно сумме изменений свободной
энергии системы и произведения изменения энтропии на абсолютную
температуру системы.
Свободная энергия системы – это часть общей энергии системы, которая
может быть использована для совершения работы:
• Поддержание физико-химических градиентов на клеточных мембранах
• Биоэлектрогенез
• Механическая работа (сокращение мышц)
11. Изменение свободной энергии в химической реакции
КравнA B
C D G 2,303 R T log K равн
0
где R = 8,34 Дж/моль K – газовая постоянная
Т – абсолютная температура (K)
Kравн – константа равновесия
Стандартные
условия:
P 1атм
0
T 25 C
pH 7, 0
C 1M
К равн 1 G 0
Экзергоническая реакция
К равн 1 G 0
Эндергоническая реакция
0
0
12.
Сопряжение биохимических реакцийМеханизм переноса свободной энергии:
А
В+С
E
X+Y
X Y
E
D
M+N
Классы макроэргических соединений (X Y; « » > 25 кДж/моль):
1. Полифосфаты нуклеозидов – АТФ, ГТФ, УТФ, ЦТФ
2. Ацилфосфаты – фосфоэнолпируват (ФЭП)
3. Тиоэфиры – ацетилКоА, сукцинилКоА
4. Гуанидинфосфаты – креатинфосфат (Кр ф)
13. Пути высвобождения энергии питательных веществ
гетеротрофы1.
2.
3.
4.
5.
Гидролиз – разрыв связей с участием молекул воды.
Фосфоролиз – разрыв связей с участием фосфорной кислоты.
Лиазное расщепление – разрыв связей с участием ферментов лиаз.
Тиолиз – разрыв связей с участием HS-KoA.
Окислительные распад
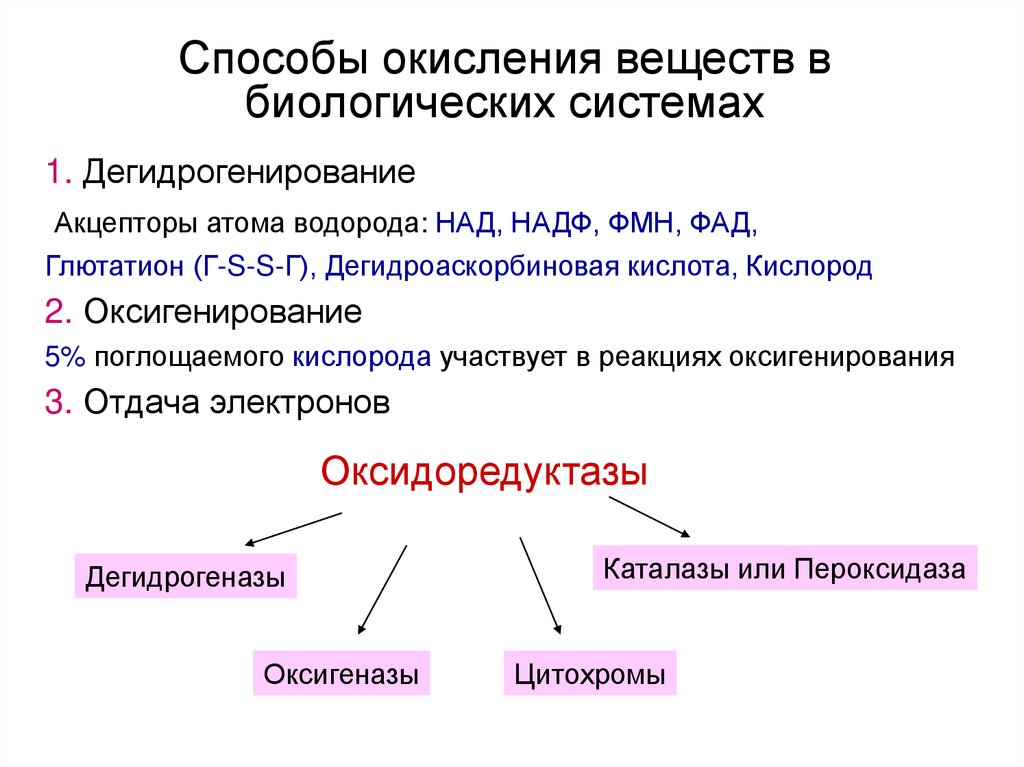
14. Способы окисления веществ в биологических системах
1. ДегидрогенированиеАкцепторы атома водорода: НАД, НАДФ, ФМН, ФАД,
Глютатион (Г-S-S-Г), Дегидроаскорбиновая кислота, Кислород
2. Оксигенирование
5% поглощаемого кислорода участвует в реакциях оксигенирования
3. Отдача электронов
Оксидоредуктазы
Дегидрогеназы
Оксигеназы
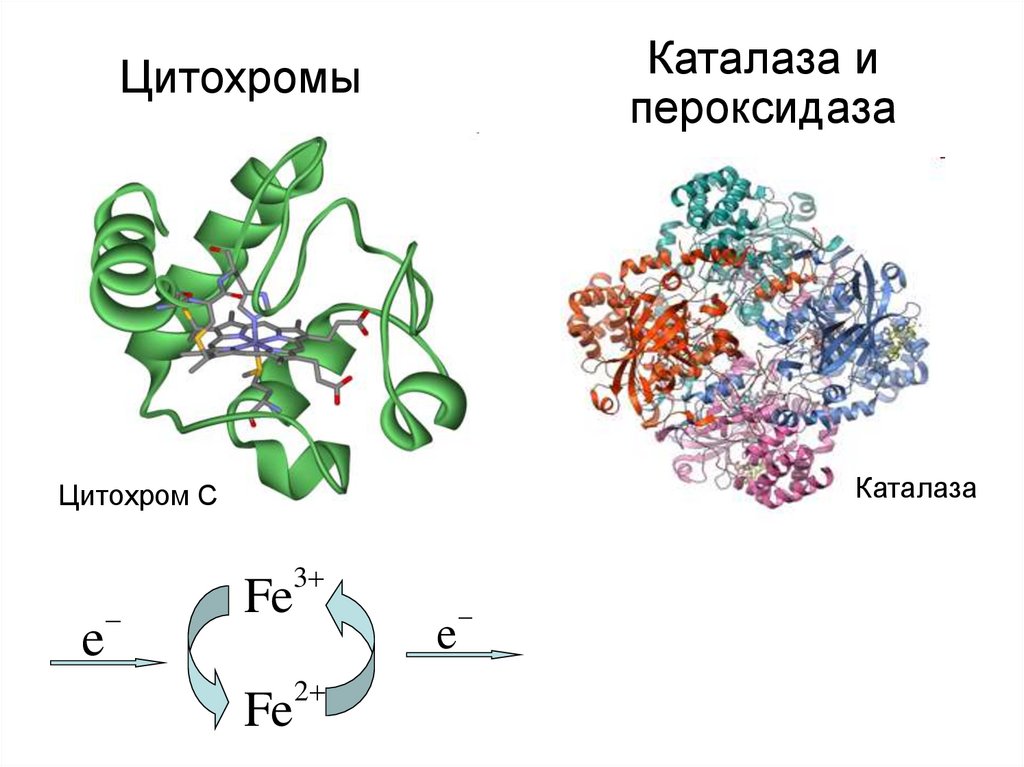
Каталазы или Пероксидаза
Цитохромы
15. Дегидрогеназы
Аэробные дегидрогеназы или оксидазыSH2 + 1/2O2 → Soкисл. + H2O
Анаэробные дегидрогеназы
SH2 X Sокисл. XH2
X – первичный акцептор атомов
водорода, отличный от кислорода
Например, лактатдегидрогеназа
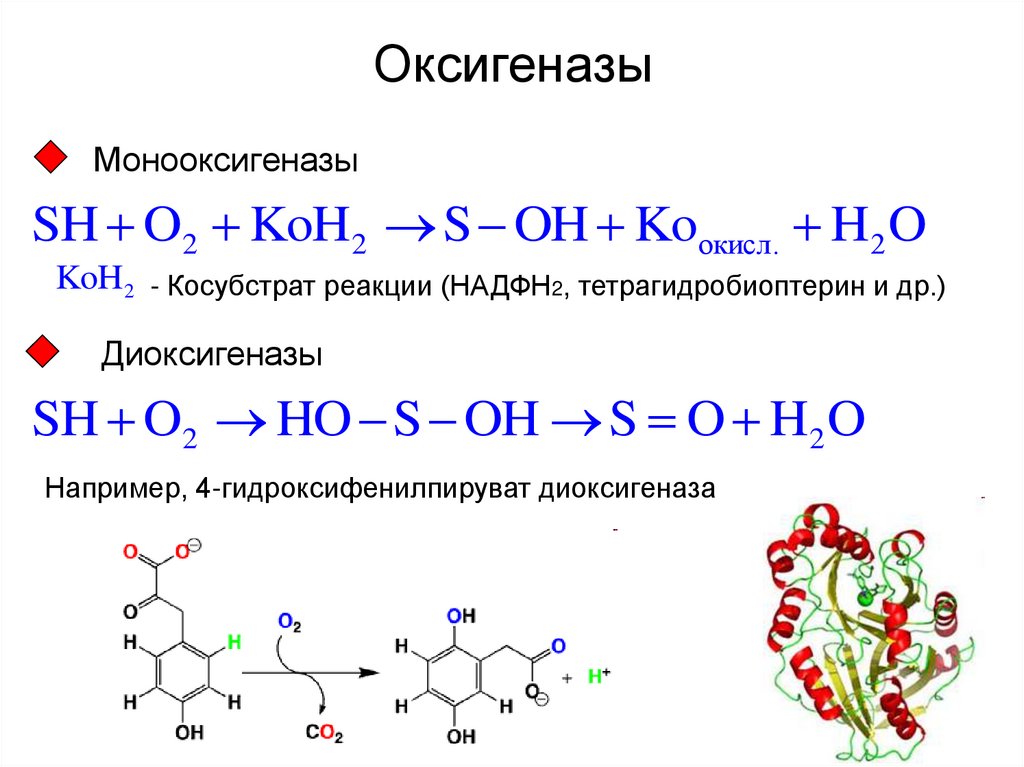
16. Оксигеназы
МонооксигеназыSH O2 KoH2 S OH Koокисл. H2 O
KoH2 - Косубстрат реакции (НАДФН2, тетрагидробиоптерин и др.)
Диоксигеназы
SH O2 HO S OH S O H2 O
Например, 4-гидроксифенилпируват диоксигеназа
17. Цитохромы
Каталаза ипероксидаза
Цитохромы
Каталаза
Цитохром С
3
e
Fe
Fe
e
2
18.
Фазы катаболизма (принцип конвергенции)I фаза
ЖКТ
Е = Q = 2%
II фаза
клетка
Е = 1/3
СО2, NH3
углеводы
моносахариды
липиды
белки
ВЖК +
глицерол
аминокислоты
1) ЩУК, 2) фумарат, 3) -кетоглутарат,
4) ацетилКоА, 5) сукцинилКоА
III фаза
митохондрия
Е = 2/3 (40% - АТФ)
CO2, Н2О
ЦТК
ЦДФ
общие пути катаболизма
19.
Цикл трикарбоновых кислот (цикл Кребса)1
2
3
8
Hans Krebs
(1900 – 1981)
7
4
6
5
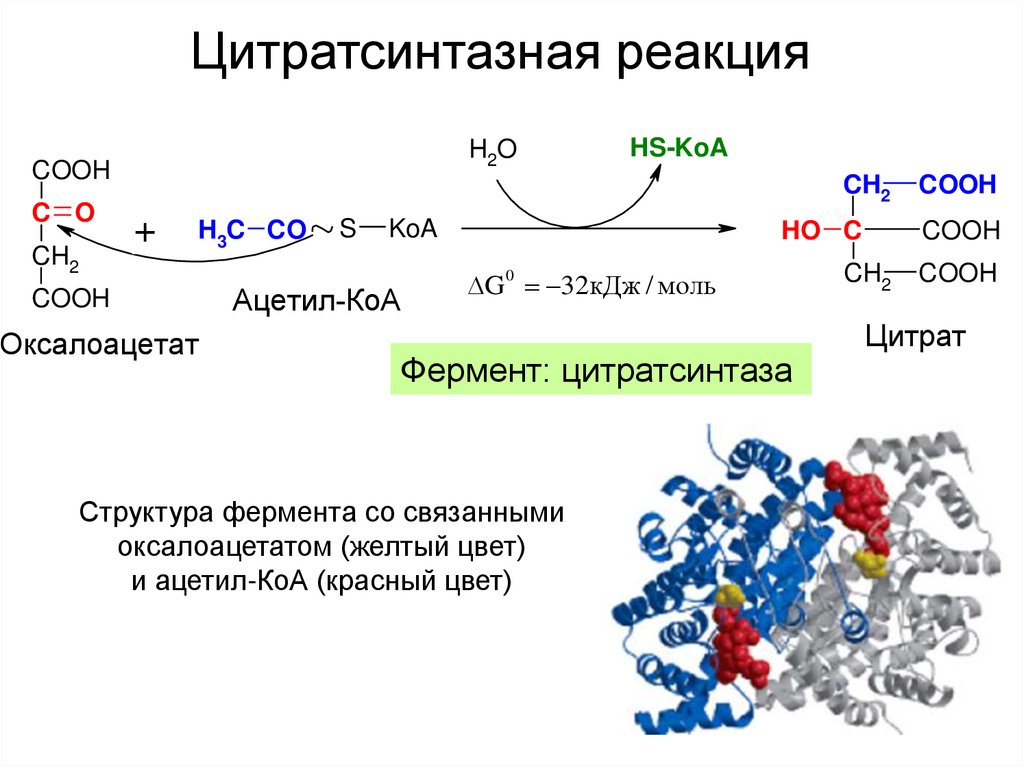
20. Цитратсинтазная реакция
H2OCOOH
C O
CH2
HS-KoA
CH2
+
H3C CO
COOH
Оксалоацетат
S
KoA
Ацетил-КоА
HO C
G 32кДж / моль
0
Фермент: цитратсинтаза
Структура фермента со связанными
оксалоацетатом (желтый цвет)
и ацетил-КоА (красный цвет)
COOH
COOH
CH2
COOH
Цитрат
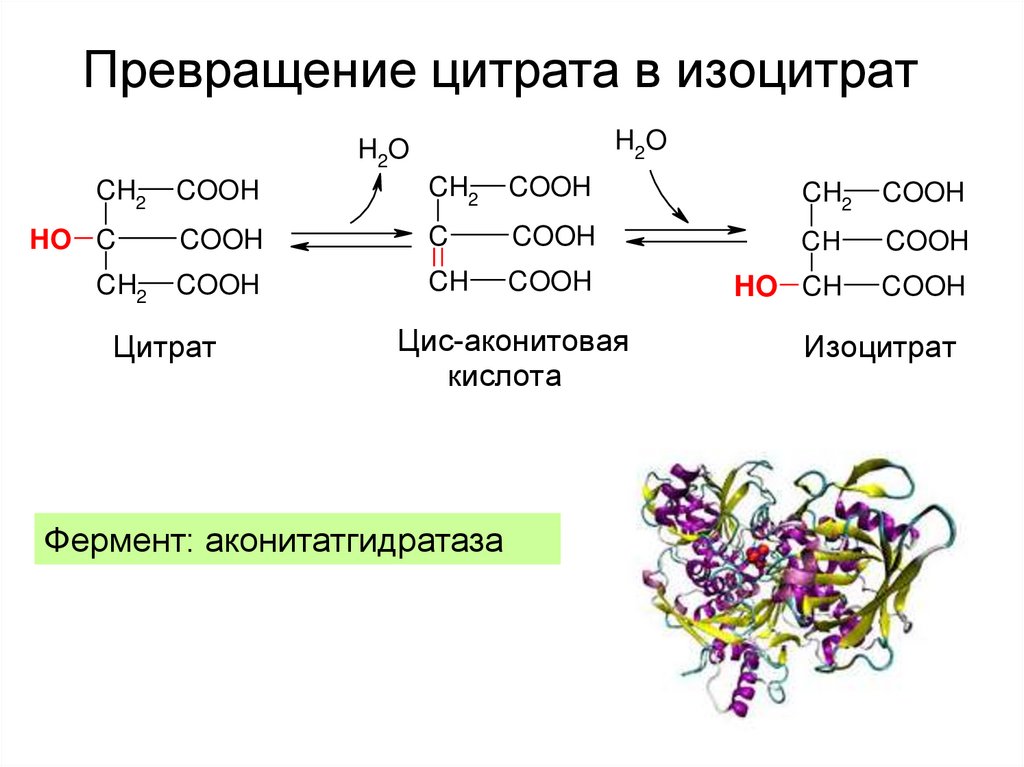
21. Превращение цитрата в изоцитрат
H2OH2O
CH2
HO C
CH2
COOH
CH2
COOH
CH2
COOH
COOH
C
COOH
CH
COOH
COOH
CH
COOH
HO CH
COOH
Цитрат
Цис-аконитовая
кислота
Фермент: аконитатгидратаза
Изоцитрат
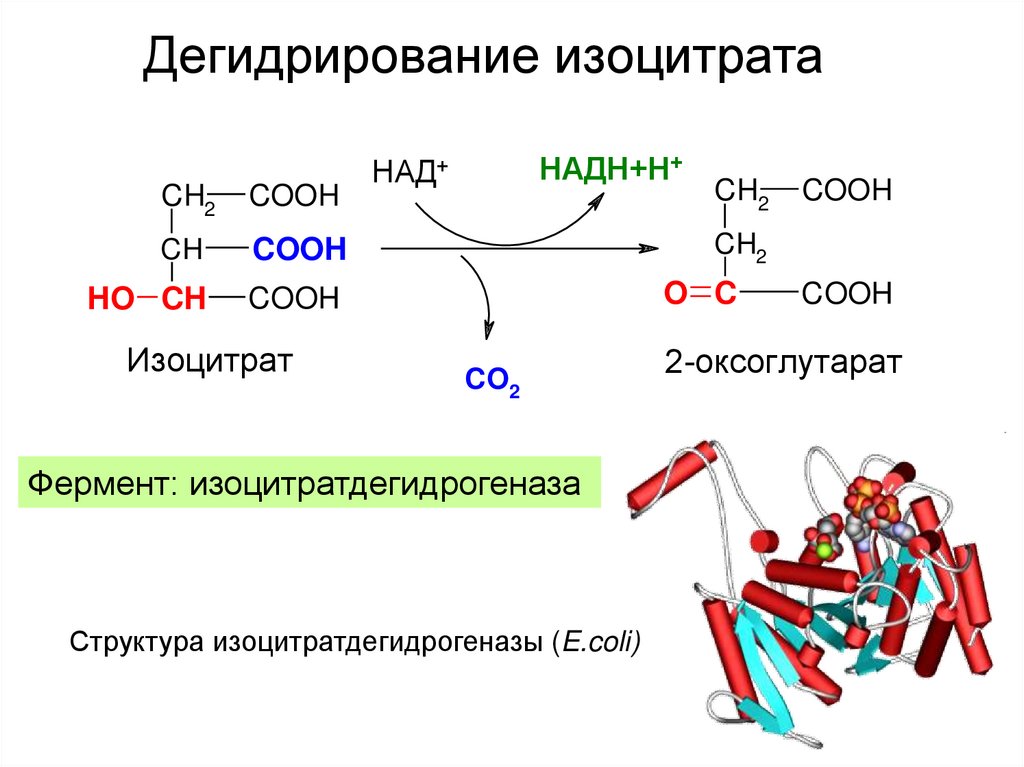
22. Дегидрирование изоцитрата
CH2COOH
CH
COOH
HO CH
COOH
Изоцитрат
НАДН+Н+
НАД+
CH2
COOH
CH2
O C
CO2
Фермент: изоцитратдегидрогеназа
Структура изоцитратдегидрогеназы (E.coli)
COOH
2-оксоглутарат
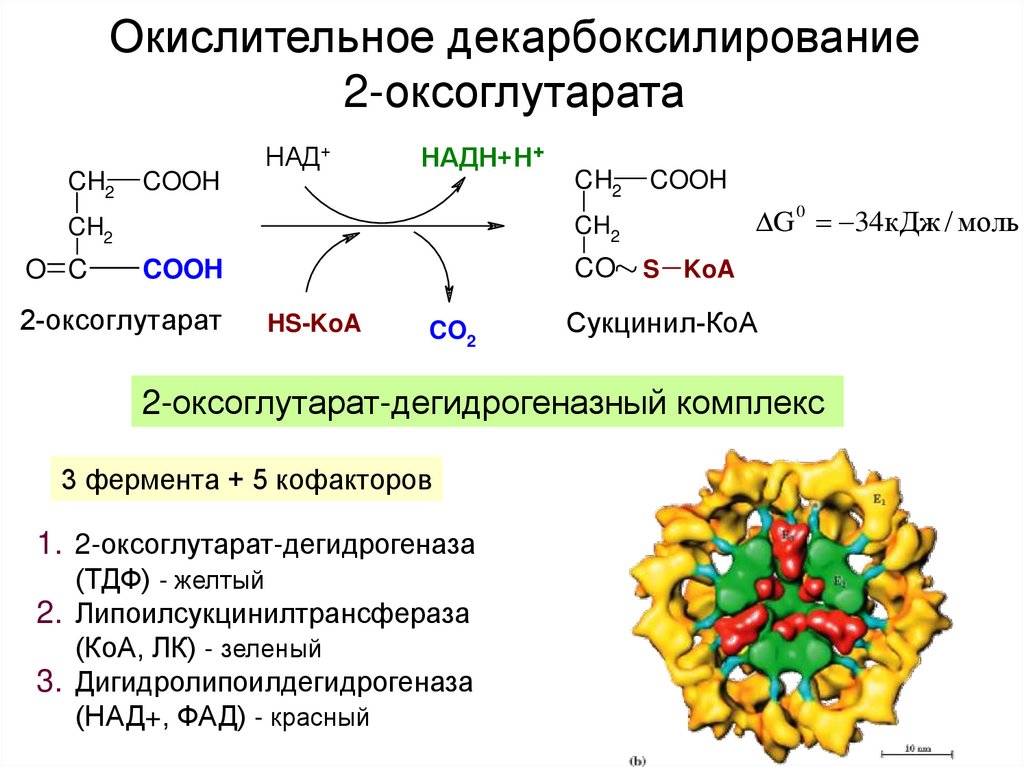
23. Окислительное декарбоксилирование 2-оксоглутарата
CH2COOH
НАД+
НАДН+Н+
COOH
G 34кДж / моль
0
CH2
CH2
O C
CH2
CO
COOH
2-оксоглутарат
HS-KoA
CO2
S KoA
Сукцинил-КоА
2-оксоглутарат-дегидрогеназный комплекс
3 фермента + 5 кофакторов
1. 2-оксоглутарат-дегидрогеназа
(ТДФ) - желтый
2. Липоилсукцинилтрансфераза
(КоА, ЛК) - зеленый
3. Дигидролипоилдегидрогеназа
(НАД+, ФАД) - красный
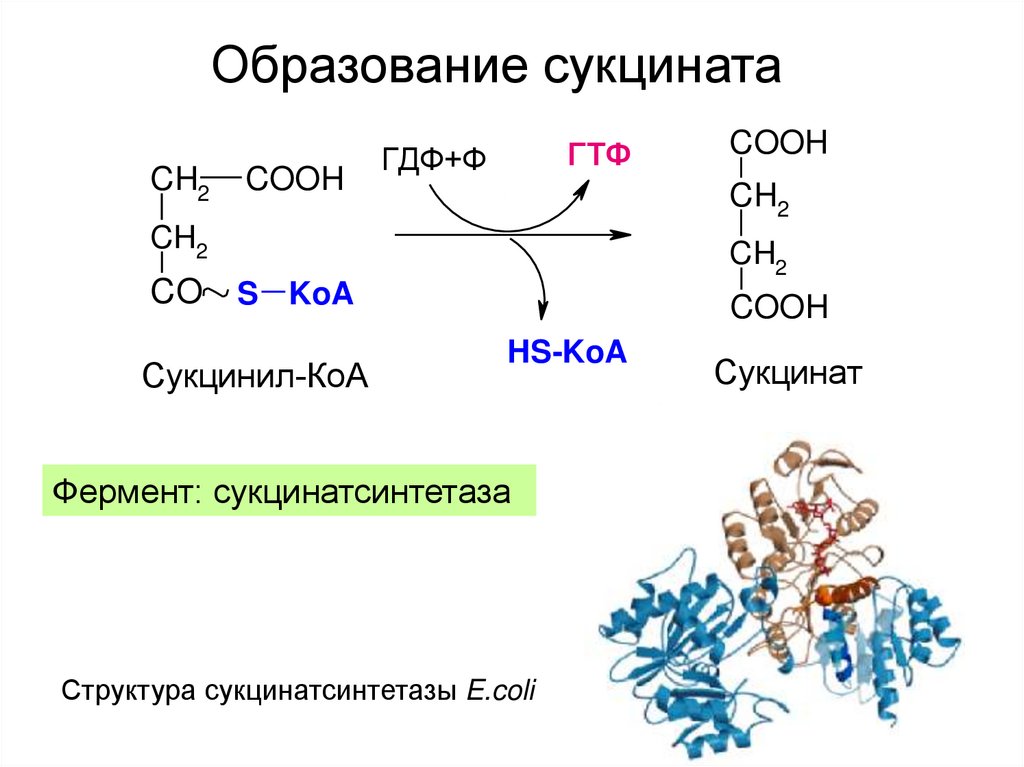
24. Образование сукцината
CH2COOH
ГТФ
ГДФ+Ф
CH2
CH2
CO
COOH
CH2
S KoA
Сукцинил-КоА
COOH
HS-KoA
Фермент: сукцинатсинтетаза
Структура сукцинатсинтетазы E.coli
Сукцинат
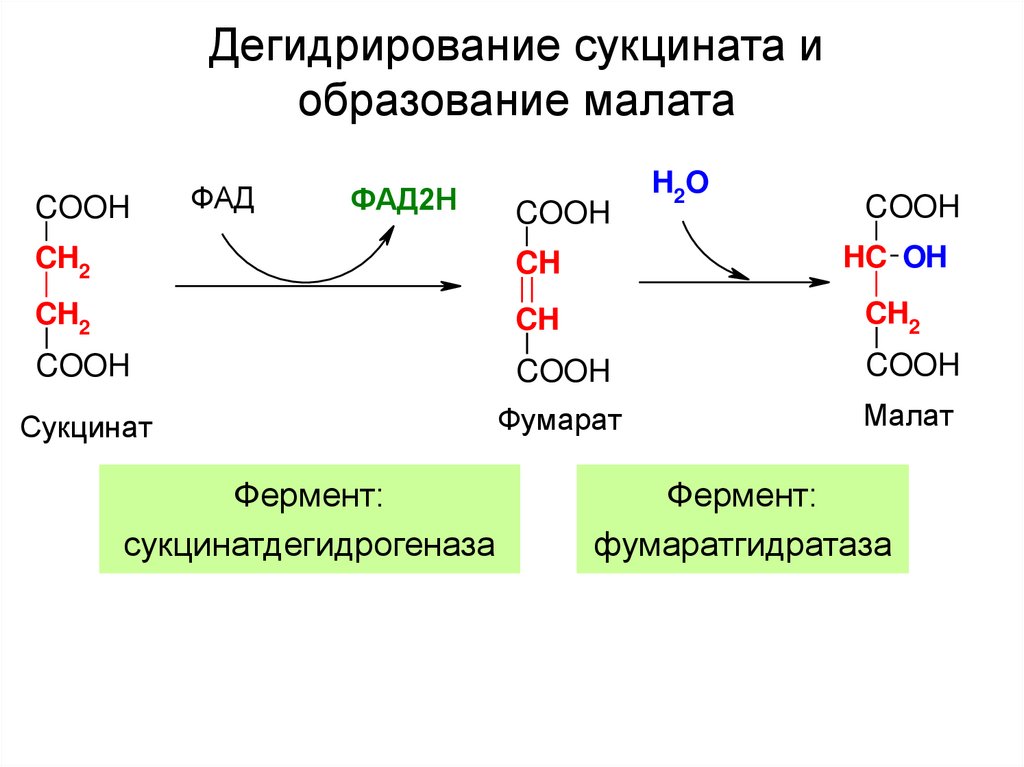
25. Дегидрирование сукцината и образование малата
COOHФАД
ФАД2Н
COOH
H2 O
COOH
CH2
CH
HC OH
CH2
CH
CH2
COOH
COOH
COOH
Сукцинат
Фумарат
Малат
Фермент:
сукцинатдегидрогеназа
Фермент:
фумаратгидратаза
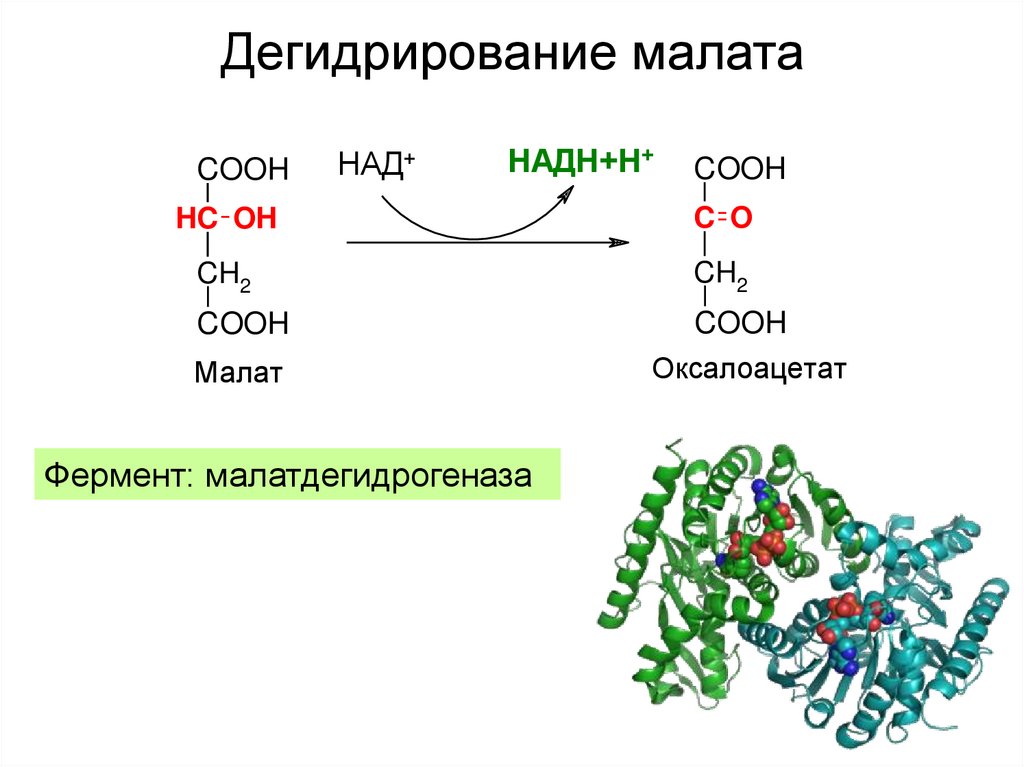
26. Дегидрирование малата
COOHНАД+
НАДН+Н+
COOH
HC OH
C O
CH2
CH2
COOH
Малат
Фермент: малатдегидрогеназа
COOH
Оксалоацетат
27.
Суммарное уравнение цикла КребсаацетилКоА 3 НАД ФАД ГДФ Н 3 PO4 2 Н 2 О
2CO2 SHKoA 3 НАДH 2 ФАДH 2 ГТФ
При окислении 1 моля ацетила выделяется 1050 кДж энегрии, из них
• 80% (840 кДж) накапливается в молекулах НАДН2, ФАДН2 и в
макроэргической связи ГТФ
• 20% (210 кДж) рассеивается в виде тепла
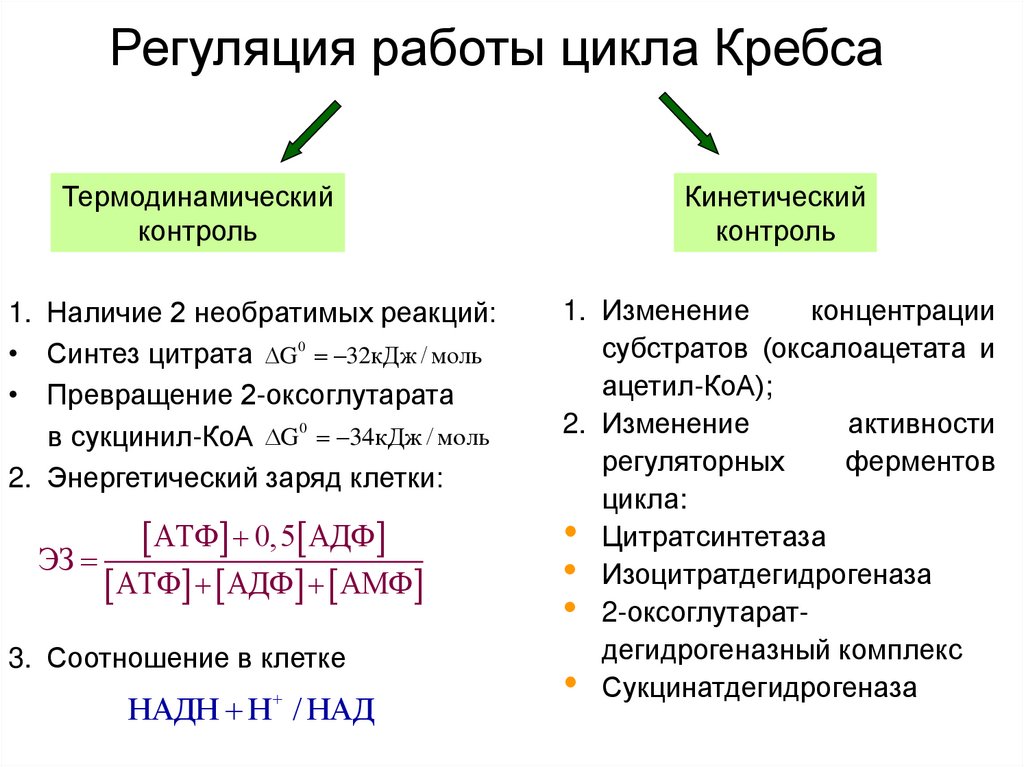
28. Регуляция работы цикла Кребса
Термодинамическийконтроль
1. Наличие 2 необратимых реакций:
• Синтез цитрата G 0 32кДж / моль
• Превращение 2-оксоглутарата
в сукцинил-КоА G 0 34кДж / моль
2. Энергетический заряд клетки:
АТФ 0,5 АДФ
ЭЗ
АТФ АДФ АМФ
3. Соотношение в клетке
НАДН Н / НАД
Кинетический
контроль
1. Изменение
концентрации
субстратов (оксалоацетата и
ацетил-КоА);
2. Изменение
активности
регуляторных
ферментов
цикла:
• Цитратсинтетаза
• Изоцитратдегидрогеназа
• 2-оксоглутаратдегидрогеназный комплекс
• Сукцинатдегидрогеназа
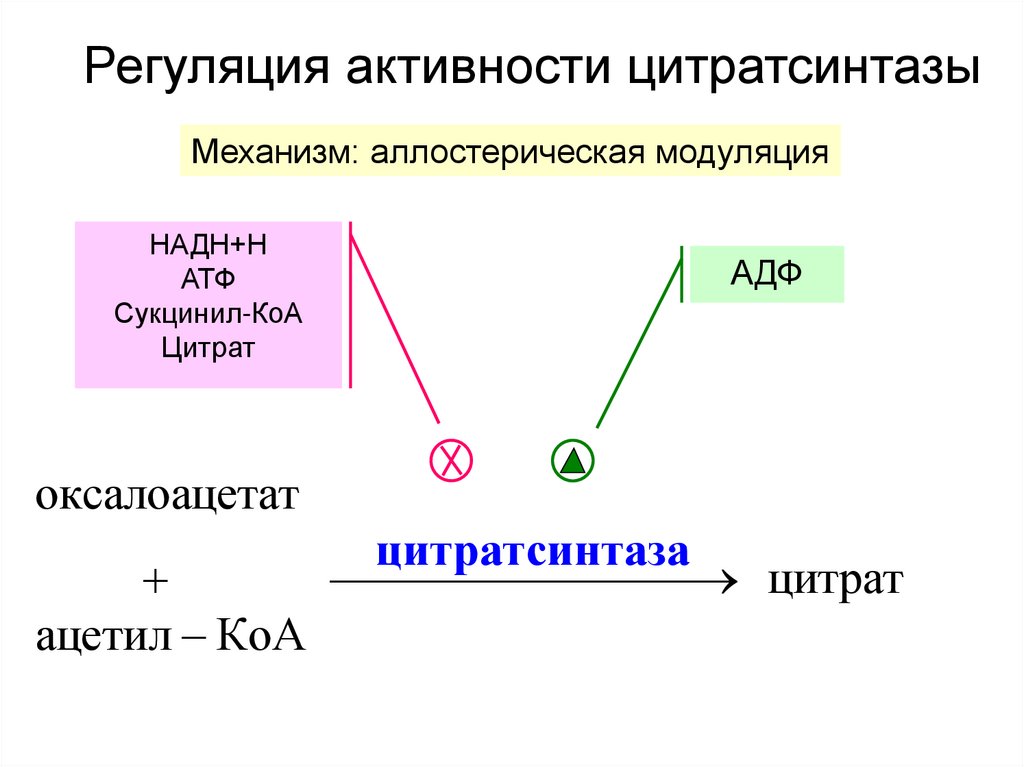
29. Регуляция активности цитратсинтазы
Механизм: аллостерическая модуляцияНАДН+Н
АТФ
Сукцинил-КоА
Цитрат
АДФ
оксалоацетат
ацетил КоА
цитратсинтаза
цитрат
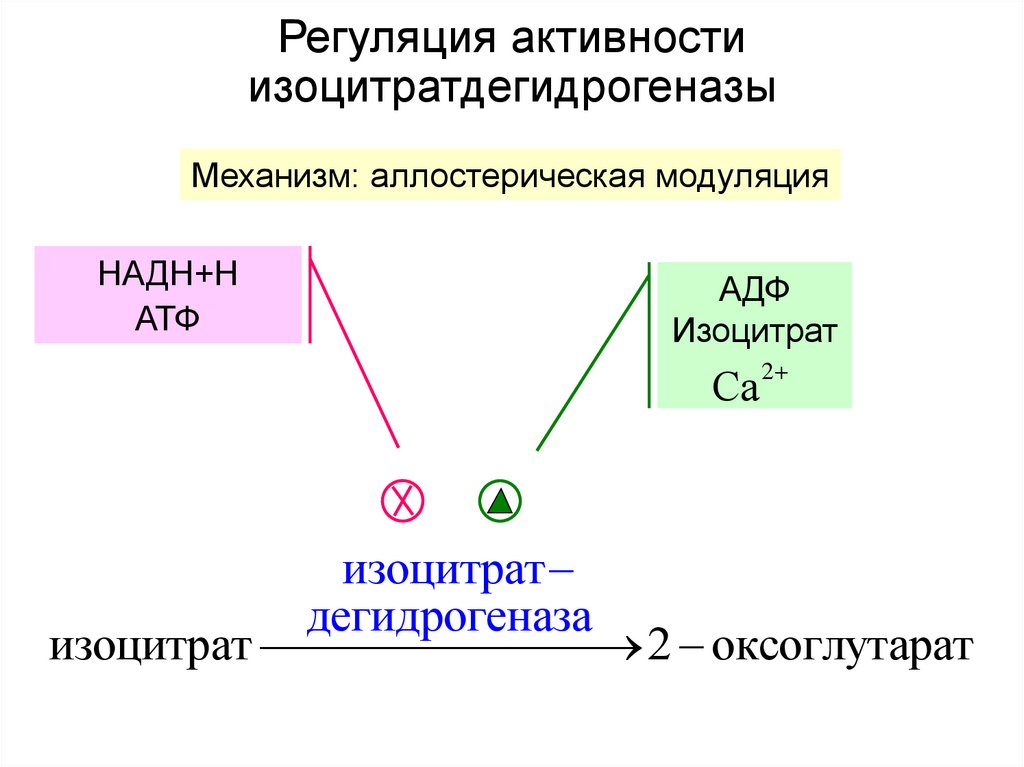
30. Регуляция активности изоцитратдегидрогеназы
Механизм: аллостерическая модуляцияНАДН+Н
АТФ
АДФ
Изоцитрат
Са
2
изоцитрат
дегидрогеназа
изоцитрат 2 оксоглутарат
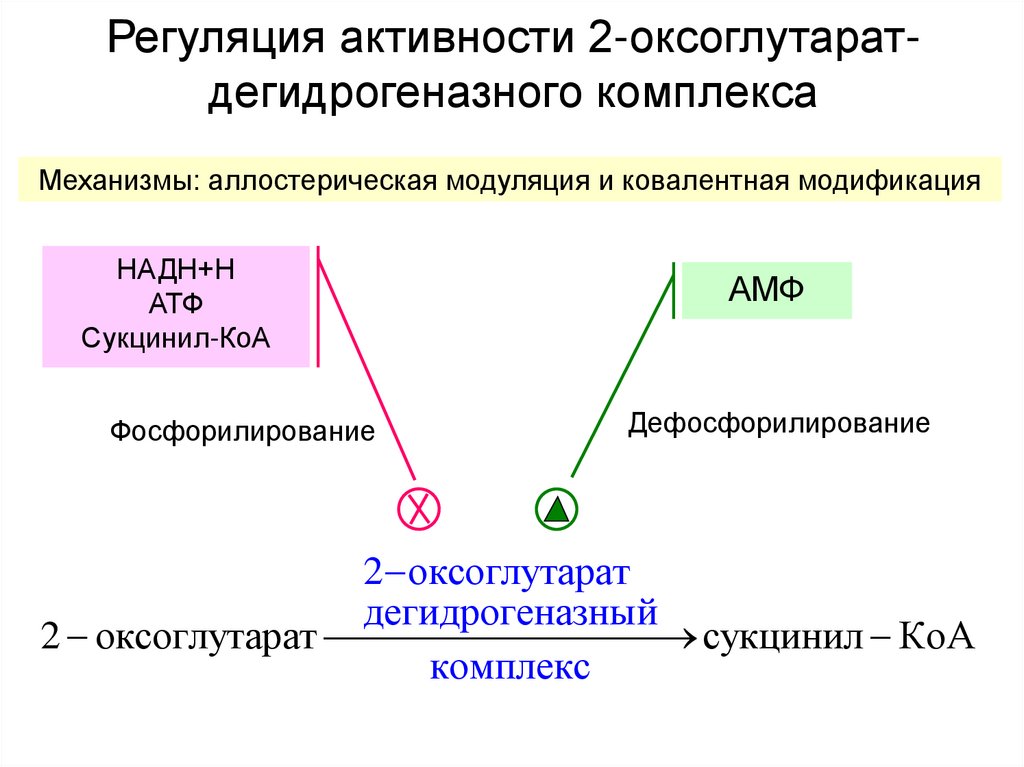
31. Регуляция активности 2-оксоглутарат-дегидрогеназного комплекса
Регуляция активности 2-оксоглутаратдегидрогеназного комплексаМеханизмы: аллостерическая модуляция и ковалентная модификация
НАДН+Н
АТФ
Сукцинил-КоА
Фосфорилирование
АМФ
Дефосфорилирование
2 оксоглутарат
дегидрогеназный
2 оксоглутарат
сукцинил КоА
комплекс
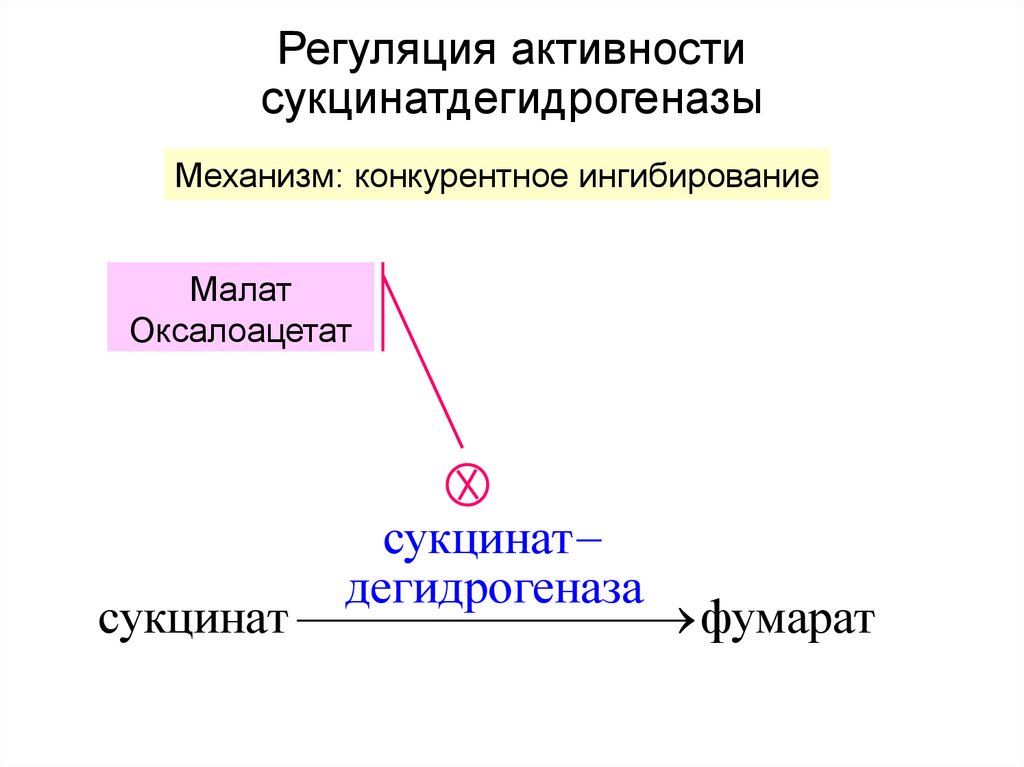
32. Регуляция активности сукцинатдегидрогеназы
Механизм: конкурентное ингибированиеМалат
Оксалоацетат
сукцинат
дегидрогеназа
сукцинат фумарат
33.
Цепь дыхательных ферментов (ЦДФ)2H
2H
2H
I НАДН2
ФМН
2e
КоQ
FeS
2e
КоQ
цитохром В
FeS
2e
цитохром С1
цитохром С
III
e
+
e
2H
цитохром С
IV
e
+
цитохромы А и А3 (Сu)
e
e
½ О2
+
e
Н2О
34.
Редуцированная ЦДФ2H
2H
сукцинат
II
III
e
ФАДН2
цитохром В
+
e
КоQ
FeS
2e
FeS
2e
цитохром С1
цитохром С
e
2H
цитохром С
IV
2H
2e
КоQ
+
цитохромы А и А3 (Сu)
e
e
½ О2
+
e
Н2О
35.
Кислородный коэффициент- является мерой интенсивности процессов аэробного
окисления в тканях и выражается в мкл О2, поглощенного
тканью за 1 час в пересчете на 1 мг сухого веса ткани.
сердце
5 мкл/час·мг
кислородный
коэффициент
почки
23 мкл/час·мг
печень
17 мкл/час·мг
надпочечники
10 мкл/час·мг
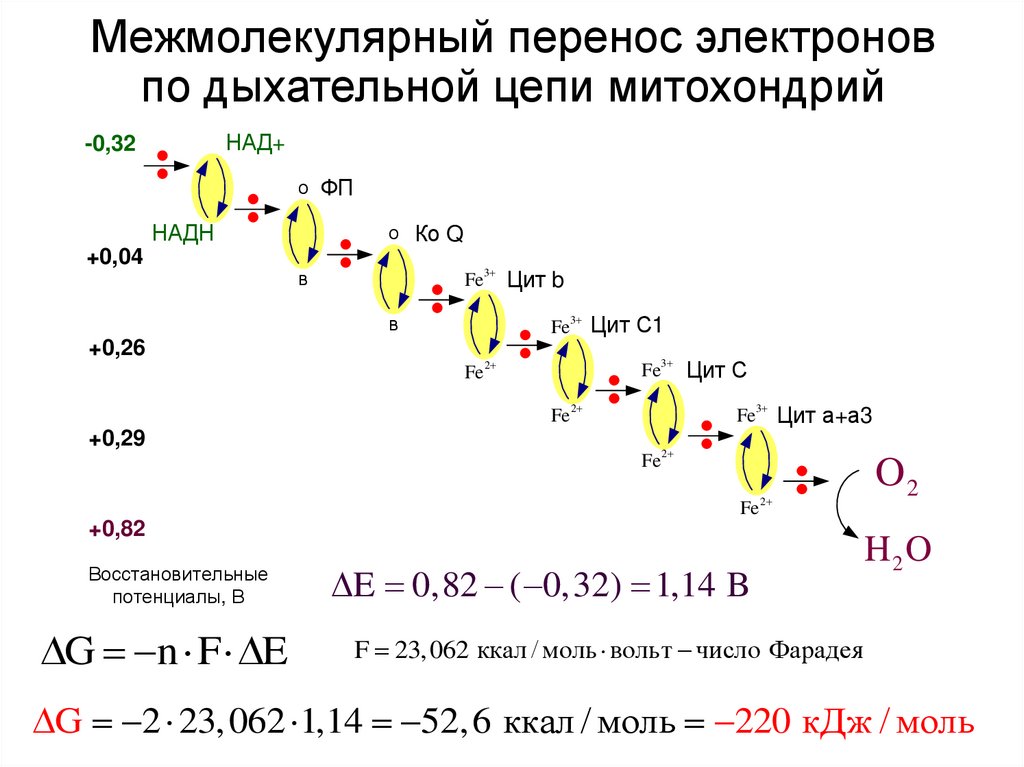
36. Межмолекулярный перенос электронов по дыхательной цепи митохондрий
НАД+-0,32
о ФП
НАДН
+0,04
о Ко Q
Fe3 Цит b
в
Fe3 Цит С1
в
+0,26
Fe3 Цит С
Fe 2
Fe 2
+0,29
Fe3 Цит а+а3
Fe 2
Fe
2
+0,82
Восстановительные
потенциалы, В
G n F E
E 0,82 ( 0,32) 1,14 B
O2
H2O
F 23, 062 ккал / моль вольт число Фарадея
G 2 23, 062 1,14 52, 6 ккал / моль 220 кДж / моль
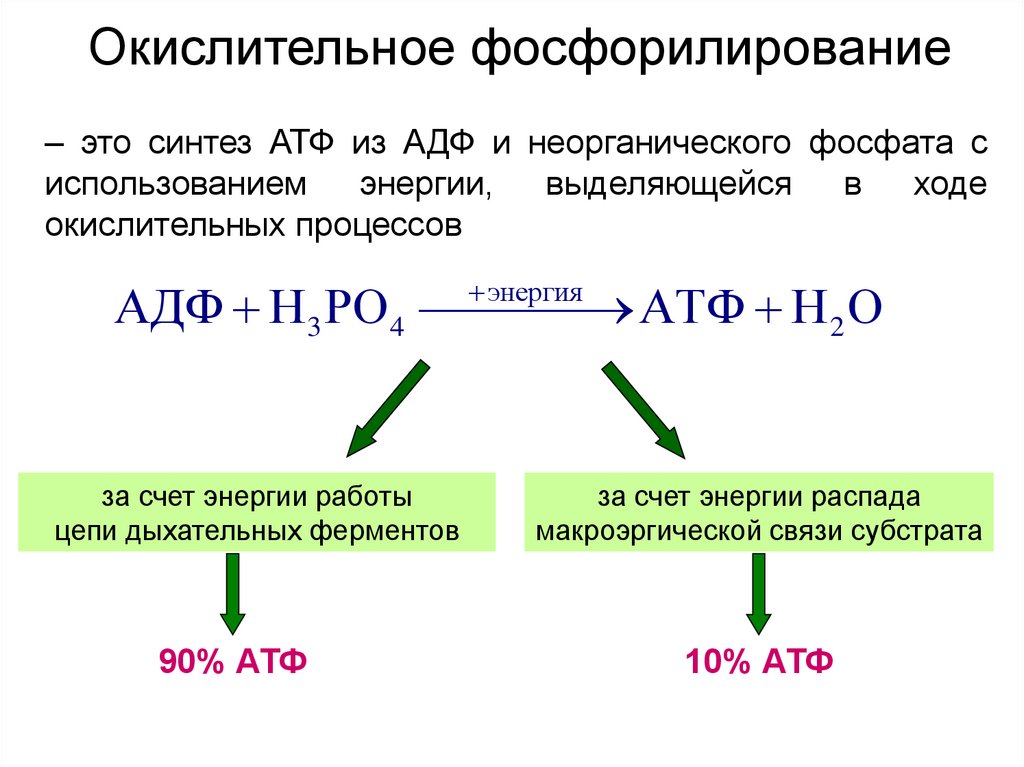
37. Окислительное фосфорилирование
– это синтез АТФ из АДФ и неорганического фосфата сиспользованием
энергии,
выделяющейся
в
ходе
окислительных процессов
энергия
АДФ Н3 РО 4
АТФ Н 2 О
за счет энергии работы
цепи дыхательных ферментов
90% АТФ
за счет энергии распада
макроэргической связи субстрата
10% АТФ
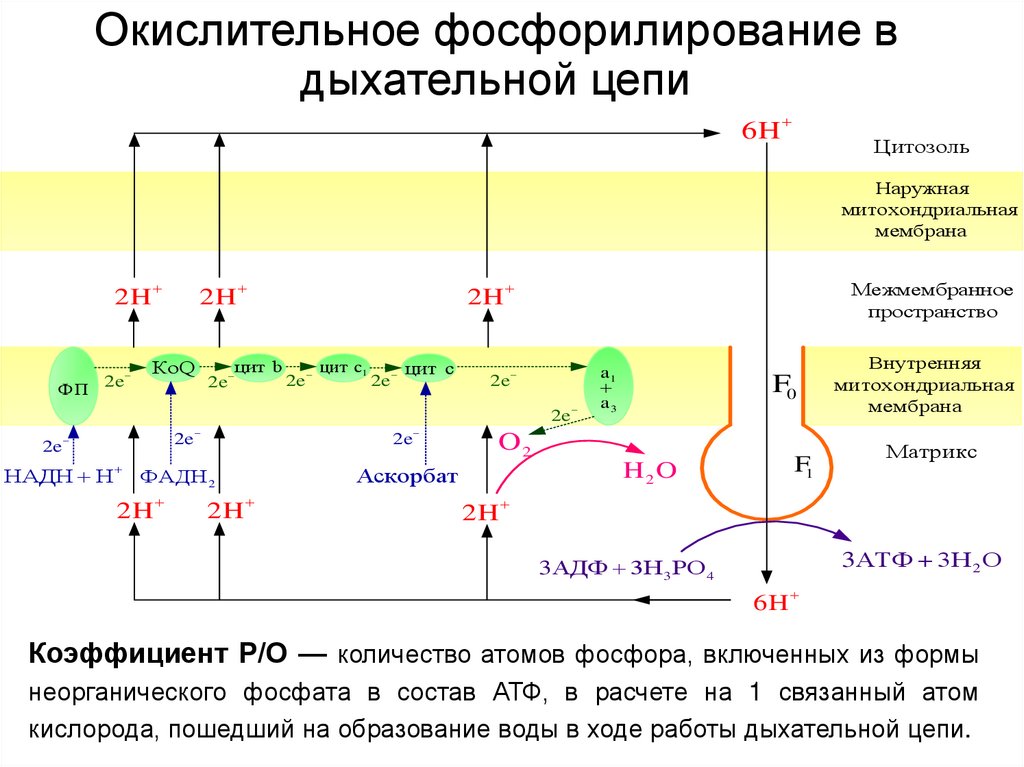
38. Окислительное фосфорилирование в дыхательной цепи
6HЦитозоль
Наружная
митохондриальная
мембрана
2H
ФП 2e
2H
КоQ
цит b
2e
2H
2e
цит c1
2e
цит c
Межмембранное
пространство
2e
2e
2e
2e
НАДH H
2e
ФАДH 2
2H
2H
a1
a3
F0
O2
H2O
Аскорбат
F1
Внутренняя
митохондриальная
мембрана
Матрикс
2H
3АТФ 3Н 2 О
3АДФ 3Н 3 РО 4
6H
Коэффициент Р/О — количество атомов фосфора, включенных из формы
неорганического фосфата в состав АТФ, в расчете на 1 связанный атом
кислорода, пошедший на образование воды в ходе работы дыхательной цепи.
39.
nH+2е
-
2е
-
+
+
+
фумарат nН
½O
2+ 2H nН H O
Н+
2
nН
nН+
НАД сукцинат
+
НАДН+Н
+
Цикл Кребса
ADP +Pi
ATP
Н Z pH
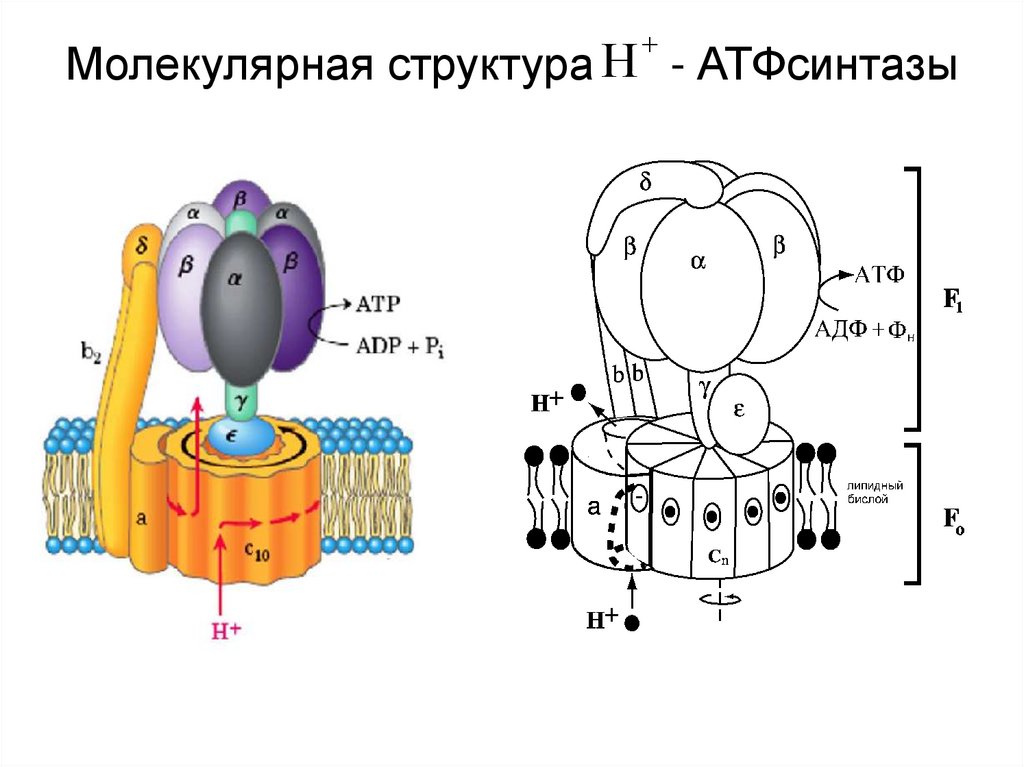
40. Молекулярная структура - АТФсинтазы
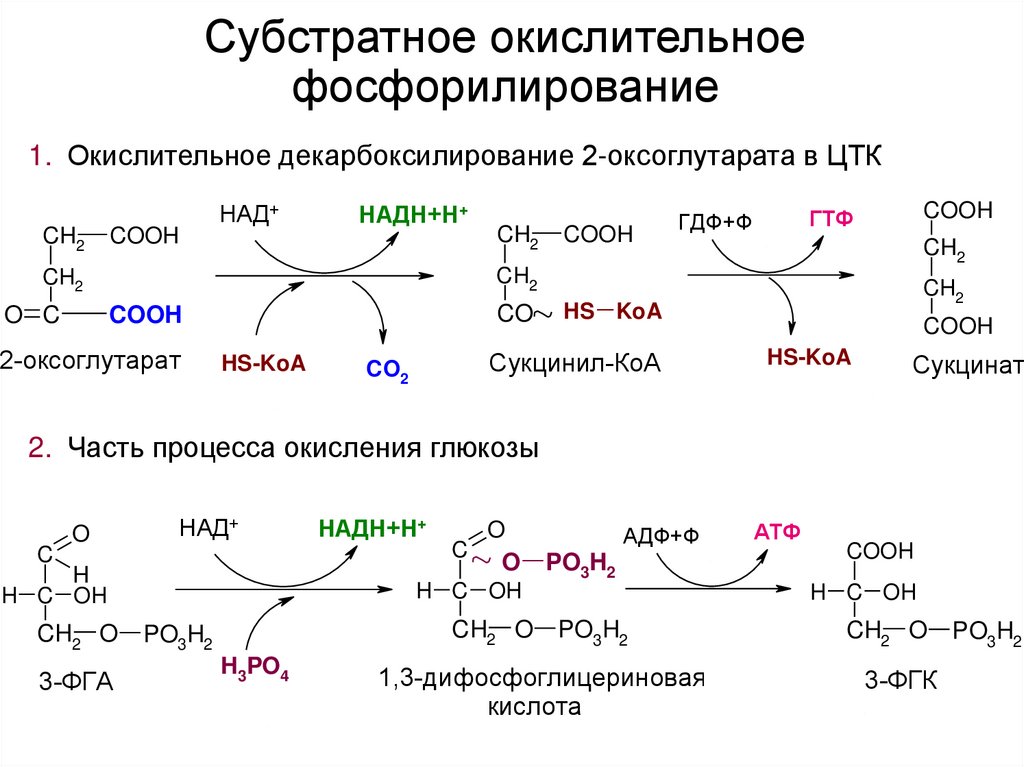
Молекулярная структура Н - АТФсинтазы41. Субстратное окислительное фосфорилирование
1. Окислительное декарбоксилирование 2-оксоглутарата в ЦТКCH2
COOH
НАД+
НАДН+Н+
COOH
CH2
CH2
CH2
CO
COOH
O C
CH2
COOH
ГТФ
ГДФ+Ф
2-оксоглутарат
HS-KoA
HS KoA
Сукцинил-КоА
CO2
CH2
COOH
HS-KoA
Сукцинат
2. Часть процесса окисления глюкозы
C
O
НАД+
H
H C OH
CH2 O
3-ФГА
НАДН+Н+
O
O
H C OH
C
CH2 O
PO3 H2
H3PO4
АДФ+Ф
PO3H2
АТФ
COOH
H C OH
PO3 H2
1,3-дифосфоглицериновая
кислота
CH2 O
3-ФГК
PO3H2
42. Действие ингибиторов цепи дыхательных ферментов
Ротенон, амитал натрияНАДН Q Цит b Цит с1 Цит с Цит а а 3 О2
карбоксин
ФАД
антимицин
НАДН Q Цит b Цит с1 Цит с Цит а а 3 О2
Цианиды, СО
НАДН Q Цит b Цит с1 Цит с Цит а а 3 О2
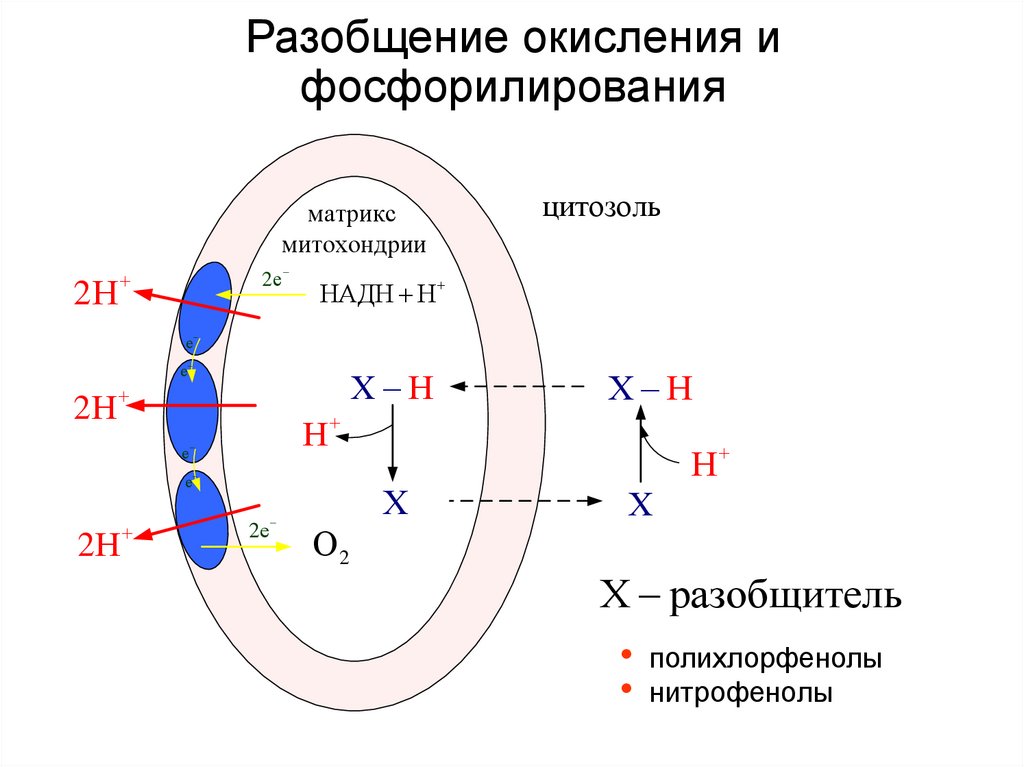
43. Разобщение окисления и фосфорилирования
матриксмитохондрии
2Н
2е
цитозоль
НАДН Н
е
е
Х Н
2Н
Н
е
е
2Н
2е
Х Н
Х
О2
Н
Х
Х разобщитель
• полихлорфенолы
• нитрофенолы
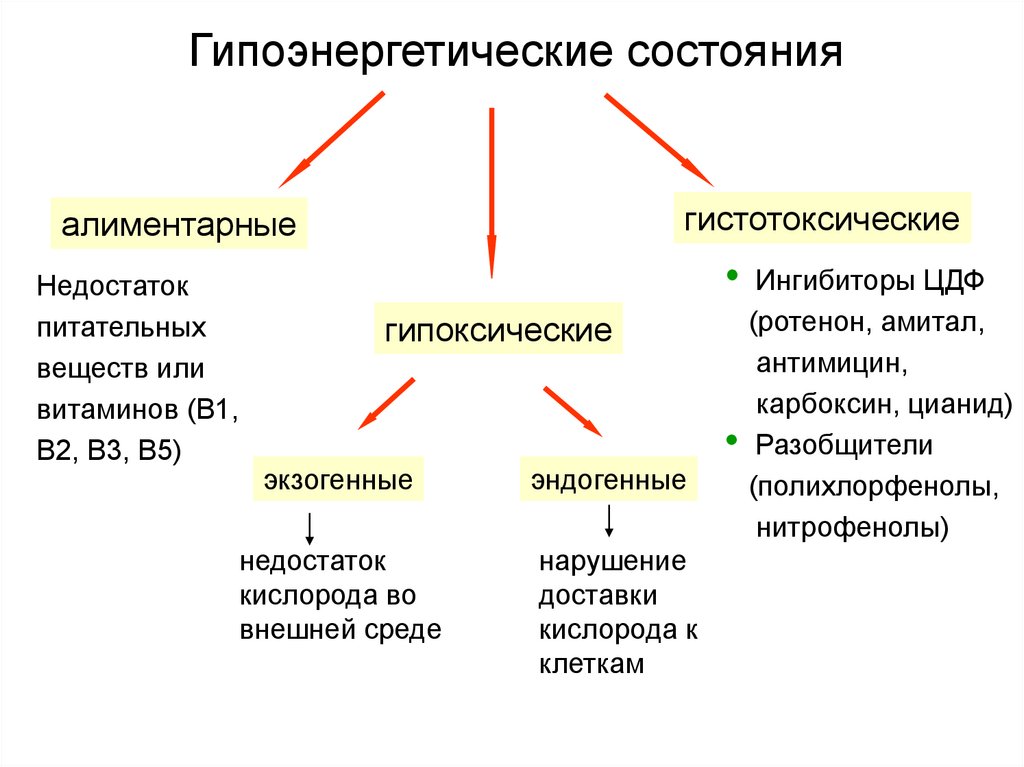
44. Гипоэнергетические состояния
гистотоксическиеалиментарные
Недостаток
питательных
веществ или
витаминов (В1,
В2, В3, В5)
гипоксические
экзогенные
недостаток
кислорода во
внешней среде
эндогенные
нарушение
доставки
кислорода к
клеткам
Ингибиторы ЦДФ
(ротенон, амитал,
антимицин,
карбоксин, цианид)
• Разобщители
(полихлорфенолы,
нитрофенолы)
45. Микросомальное окисление
Ферменты:1. Монооксигеназы (гидроксилазы)
2. Диоксигеназы
3. Цитохромы ( Цит b5 и Цит P450 )
Функции:
1. Расщепление метаболитов (триптофан).
2. Синтез соединений (оксипролин, оксилизин).
3. Детоксикация веществ (биотрансформация).
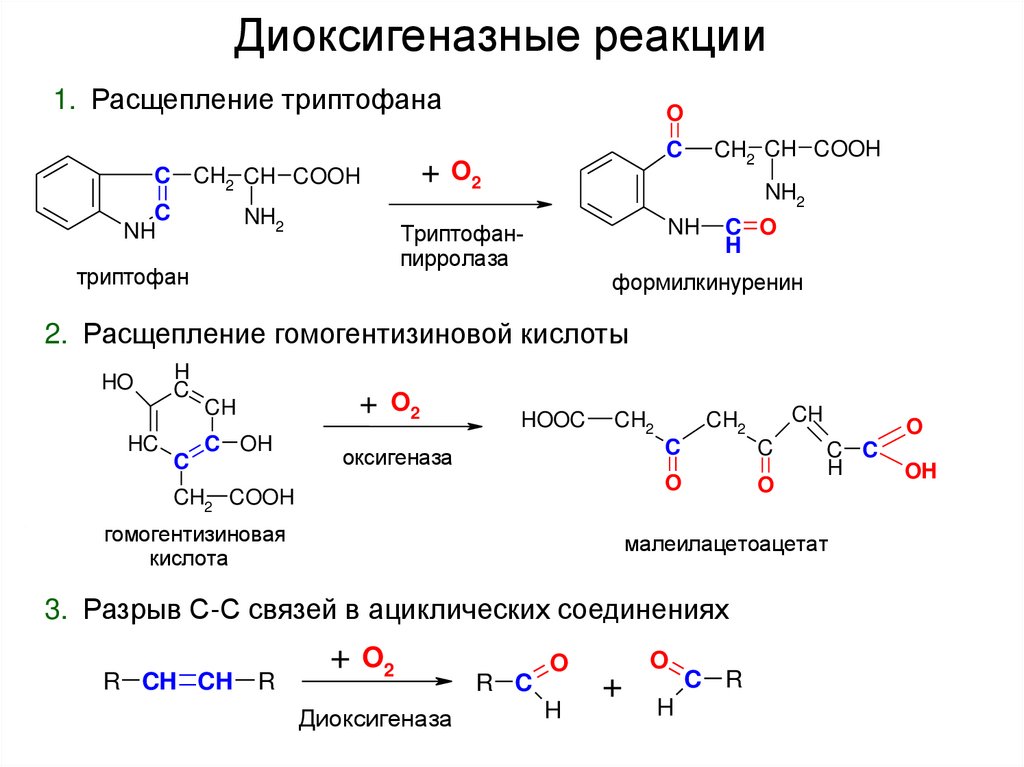
46. Диоксигеназные реакции
1. Расщепление триптофанаC
+
CH2 CH COOH
C
NH
NH2
O
O2
NH2
NH
Триптофанпирролаза
триптофан
CH2 CH COOH
C
C O
H
формилкинуренин
2. Расщепление гомогентизиновой кислоты
HO
HC
H
C
C
+
CH
C OH
O2
HOOC
CH2
оксигеназа
CH2 COOH
гомогентизиновая
кислота
C
C
O
O
R
O
C C
H
малеилацетоацетат
3. Разрыв С-С связей в ациклических соединениях
R CH CH
CH
CH2
+
O2
Диоксигеназа
R C
O
H
+
O
H
C R
OH
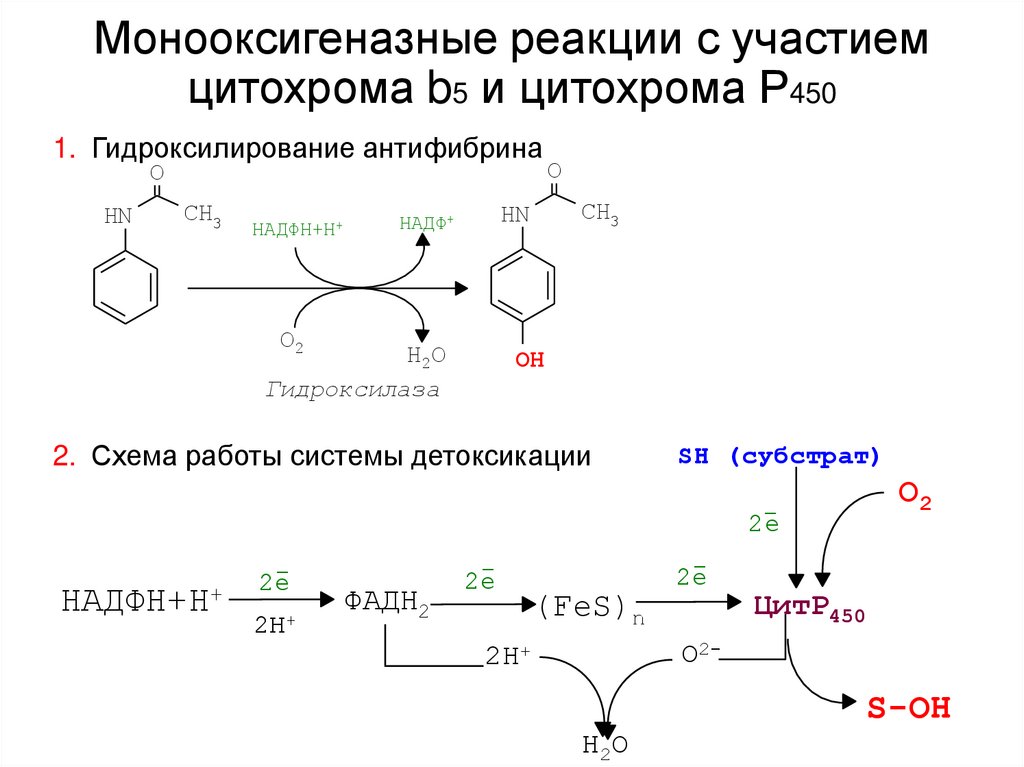
47. Монооксигеназные реакции с участием цитохрома b5 и цитохрома Р450
1. Гидроксилирование антифибринаO
HN
CH3
НАДФН+Н+
CH3
HN
НАДФ+
О2
Н2О
Гидроксилаза
O
OH
2. Схема работы системы детоксикации
SH (субстрат)
O2
2e
НАДФН+Н+
2e
2H+
ФАДН2
2e
(FeS)n
2e
ЦитP450
O2-
2H+
S-OH
H2O
48. Образование активных форм кислорода
Oсупероксидный анион-радикал
2
2
3
Hb(Fe ) O2 MetHb(Fe ) O2
1. Превращение Hb в MetHb:
2. Одноэлектронное окисление KoQH2: KoQH2 O2 KoQH O2 H
3. Микросомальное окисление с участием цит P450
4. Одноэлектронное окисление флавина во флавиновых дегидрогеназах.
O
2
2 пероксидный анион
1. Обезвреживание супероксидного анион-радикала
2. Работа аэробных дегидрогеназ
HO
1.
гидроксильный радикал
2
H2 O2 O HO HO O2
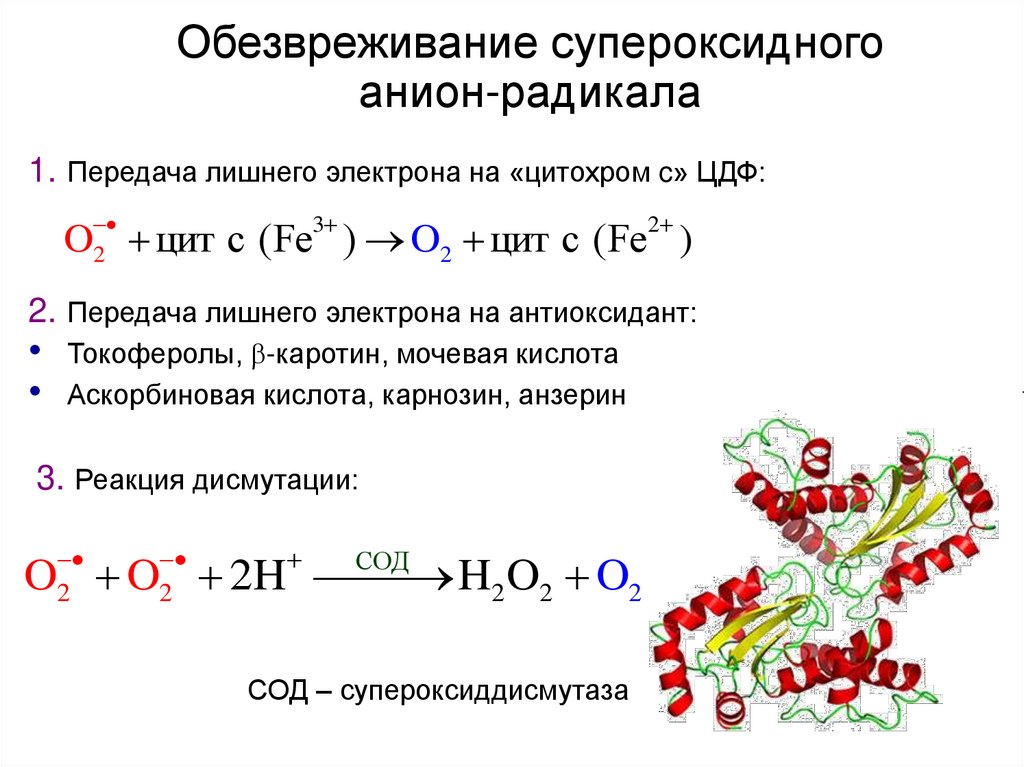
49. Обезвреживание супероксидного анион-радикала
1. Передача лишнего электрона на «цитохром c» ЦДФ:2
3
2
O цит с (Fe ) O2 цит с (Fe )
2. Передача лишнего электрона на антиоксидант:
Токоферолы, -каротин, мочевая кислота
Аскорбиновая кислота, карнозин, анзерин
3. Реакция дисмутации:
2
2
СОД
O O 2H
H2 O2 O2
СОД – супероксиддисмутаза
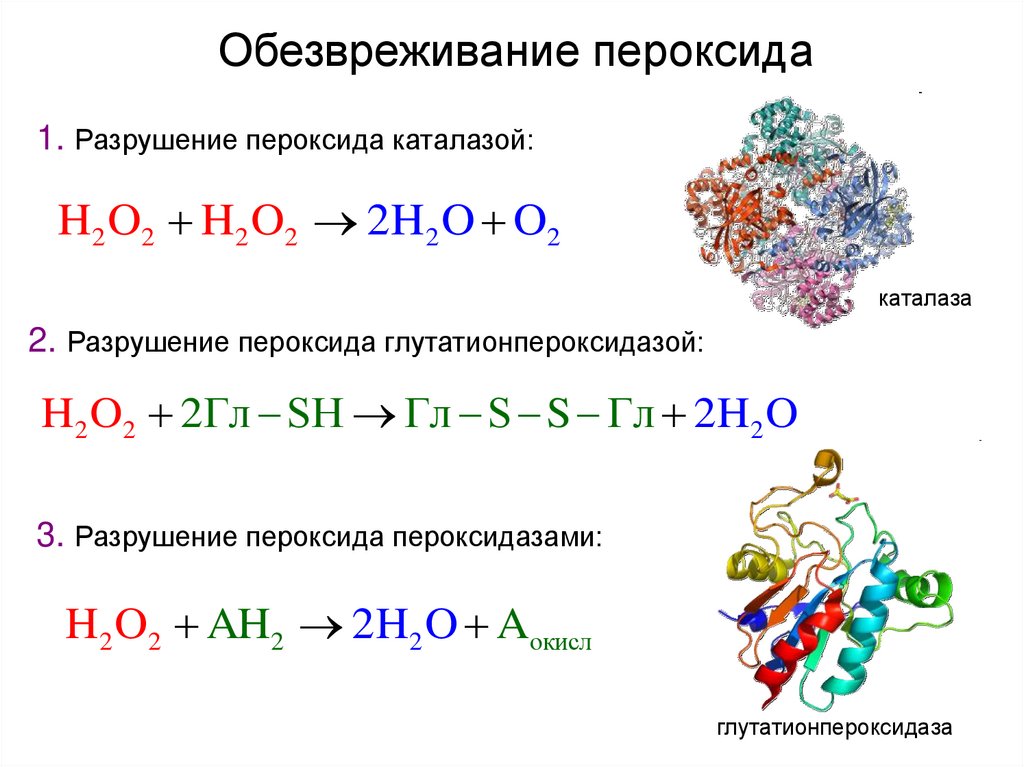
50. Обезвреживание пероксида
1. Разрушение пероксида каталазой:H 2 O 2 H 2 O2 2 H 2 O O2
каталаза
2. Разрушение пероксида глутатионпероксидазой:
H2 O2 2Гл SH Гл S S Гл 2H2 O
3. Разрушение пероксида пероксидазами:
H2 O2 AH2 2H2 O Aокисл
глутатионпероксидаза

















 Биология
Биология








