Похожие презентации:
Гидроксильные соединения и их производные
1. ГИДРОКСИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРОИЗВОДНЫЕ
Важнейшие подгруппы:СПИРТЫ И ФЕНОЛЫ
2.
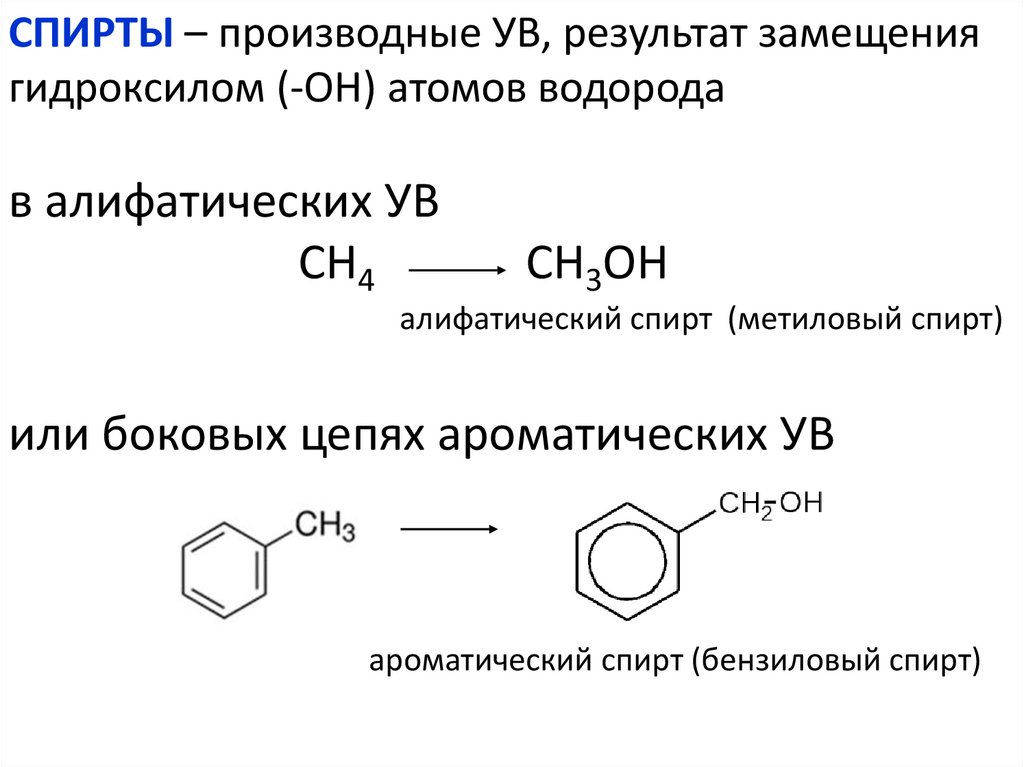
СПИРТЫ – производные УВ, результат замещениягидроксилом (-ОН) атомов водорода
в алифатических УВ
СН4
СН3ОН
алифатический спирт (метиловый спирт)
или боковых цепях ароматических УВ
ароматический спирт (бензиловый спирт)
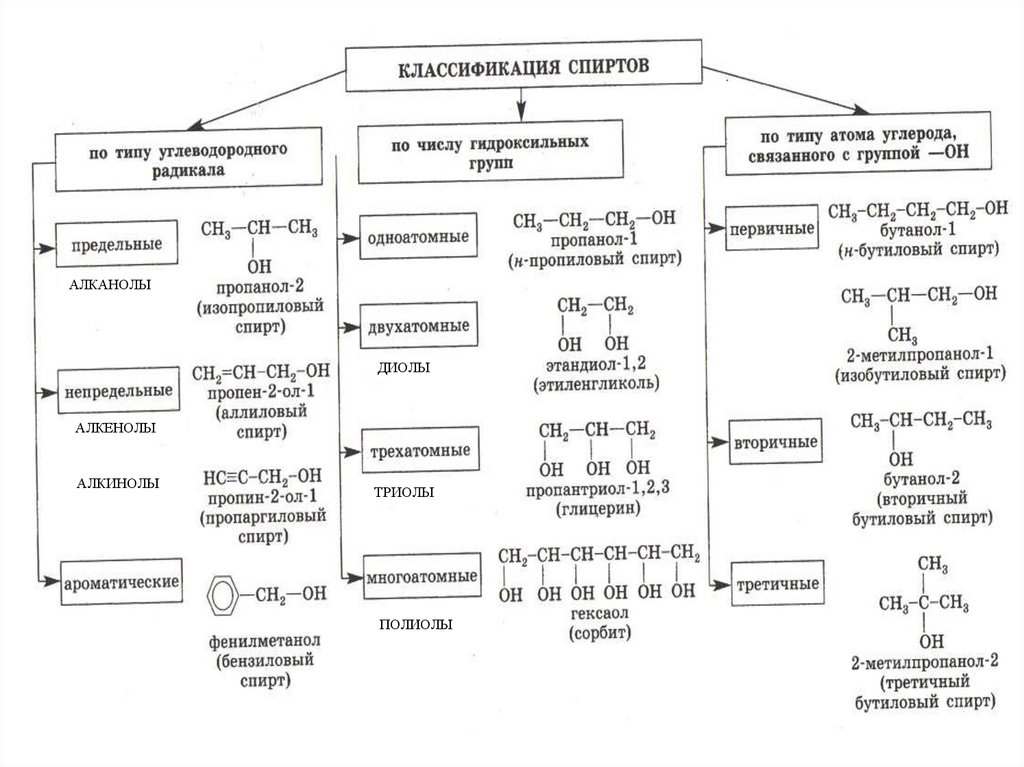
3.
АЛКАНОЛЫДИОЛЫ
АЛКЕНОЛЫ
АЛКИНОЛЫ
ТРИОЛЫ
ПОЛИОЛЫ
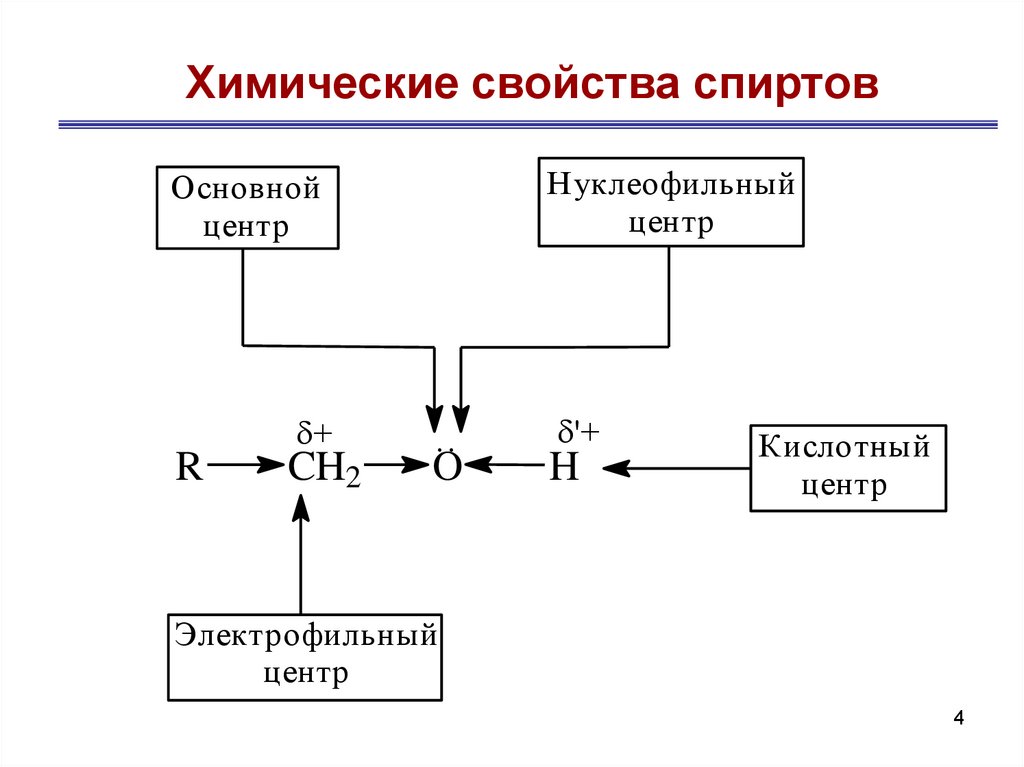
4. Химические свойства спиртов
Нуклеофильныйцентр
Основной
центр
R
+
CH2
..
O
'+
H
Кислотный
центр
Электрофильный
центр
4
5. Химические свойства одноатомных спиртов
Химические свойства спиртов связаны с наличием в ихмолекуле группы –ОН. Для спиртов характерны два типа
реакций: разрыв связи С-О и связи О-Н.
Cпирты взаимодействуют с:
1. Меакт
2. ННal
3. Карбоновыми кислотами
4. NH3
5. РCl5 и SOCl2
6. H2SO4
7. HNO3
8. Подвергаются межмолекулярной и
внутримолекулярной дегидратации
5
6.
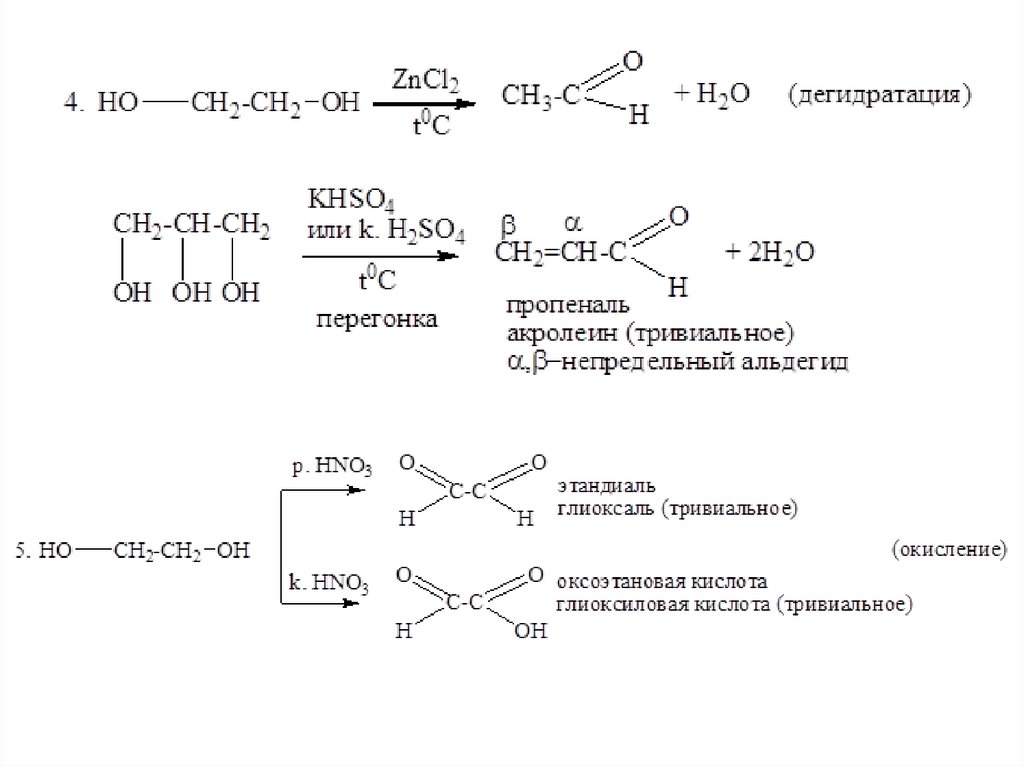
8. ОкисляютсяCu, t0C
7. а) СH3СН2OH
или окислитель
CH3-CHO
(дегидрирование, окисление первичных спиртов)
б) CH3-CH(OH)-CH3
Cu, t0C
или окислитель
CH3-CO-CH3
(дегидрирование, окисление вторичных спиртов)
в) Третичные спирты окисляются K2Cr2O7/H2SO4 при нагревании до смеси
карбоновых кислот (кетонов) через образование алкенов.
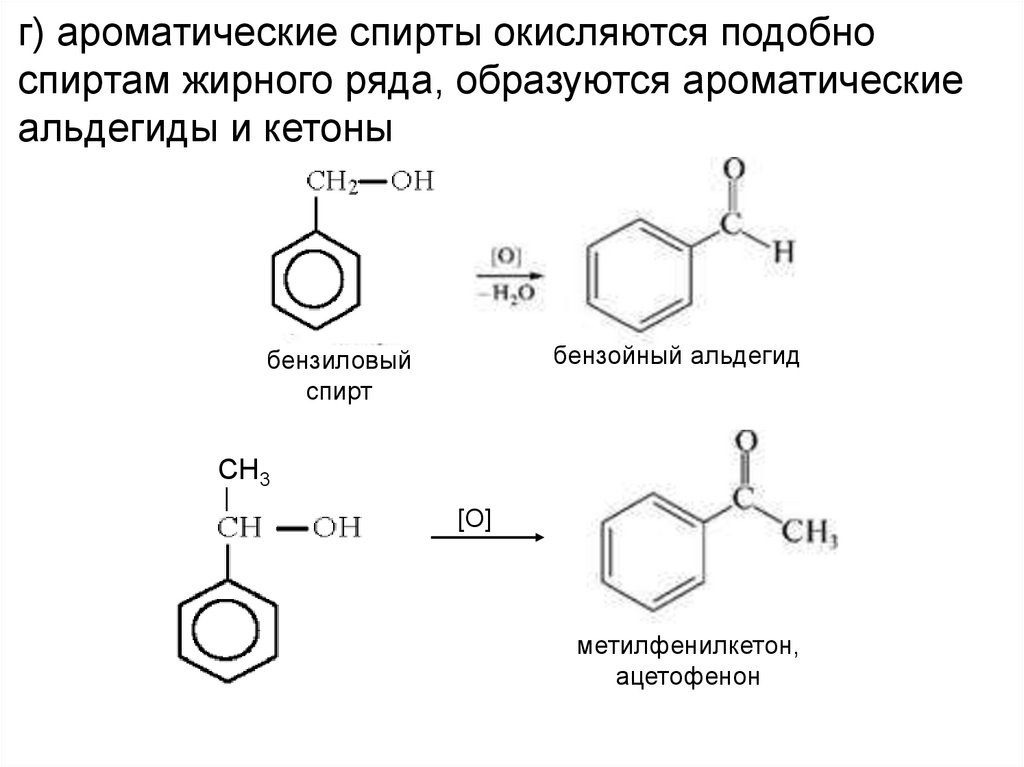
7.
г) ароматические спирты окисляются подобноспиртам жирного ряда, образуются ароматические
альдегиды и кетоны
бензойный альдегид
бензиловый
спирт
СН3
[O]
метилфенилкетон,
ацетофенон
8.
Химические свойства многоатомных спиртов1. Многоатомные спирты более сильные кислоты, чем
одноатомные спирты. Гликоли и глицерины образуют
алкоголяты, аналогично одноатомным спиртам.
Отличительным свойством является образование
соединений типа хелатов с ионами тяжелых металлов.
С Cu(ОН)2 образуется раствор ярко-синего цвета
(качественная реакция).
8
9.
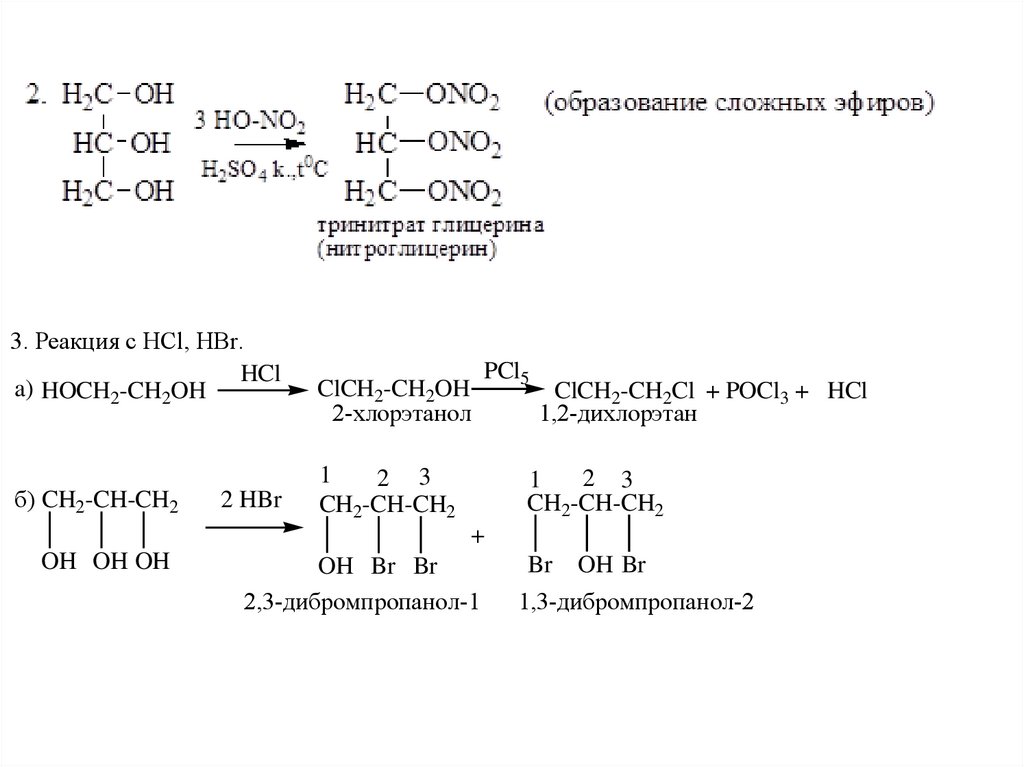
3. Реакция с HCl, HBr.HCl
a) HOCH2-CH2OH
б) CH2-CH-CH2
2 HBr
ClCH2-CH2OH
2-хлорэтанол
PCl5
1
2 3
CH2-CH-CH2
ClCH2-CH2Cl + POCl3 + HCl
1,2-дихлорэтан
2 3
1
CH2-CH-CH2
+
OH OH OH
OH Br Br
2,3-дибромпропанол-1
Br OH Br
1,3-дибромпропанол-2
10.
11.
Отдельные представителиМетанол (метиловый спирт). Принятие внутрь
вызывает опьянение и тяжелое отравление,
потерю зрения и часто смерть.
Этанол (этиловый спирт). Обеззараживающее
средство. В небольших дозах действует
опьяняюще, при больших количествах
вызывает состояние близкое к наркозу, иногда
заканчивающееся смертью.
12.
Авертин, или нарколан (трибромэтанол).Средством для ректального наркоза.
Позволяет усыплять больного в палате и
уменьшать психическую травму.
Диэтиловый эфир
Обладает общеанастезирующим действием.
В хирургии - ингаляционный наркоз, в
стоматологии - для обработки кариозных
полостей и корневых каналов зуба при
подготовке к пломбированию.
13.
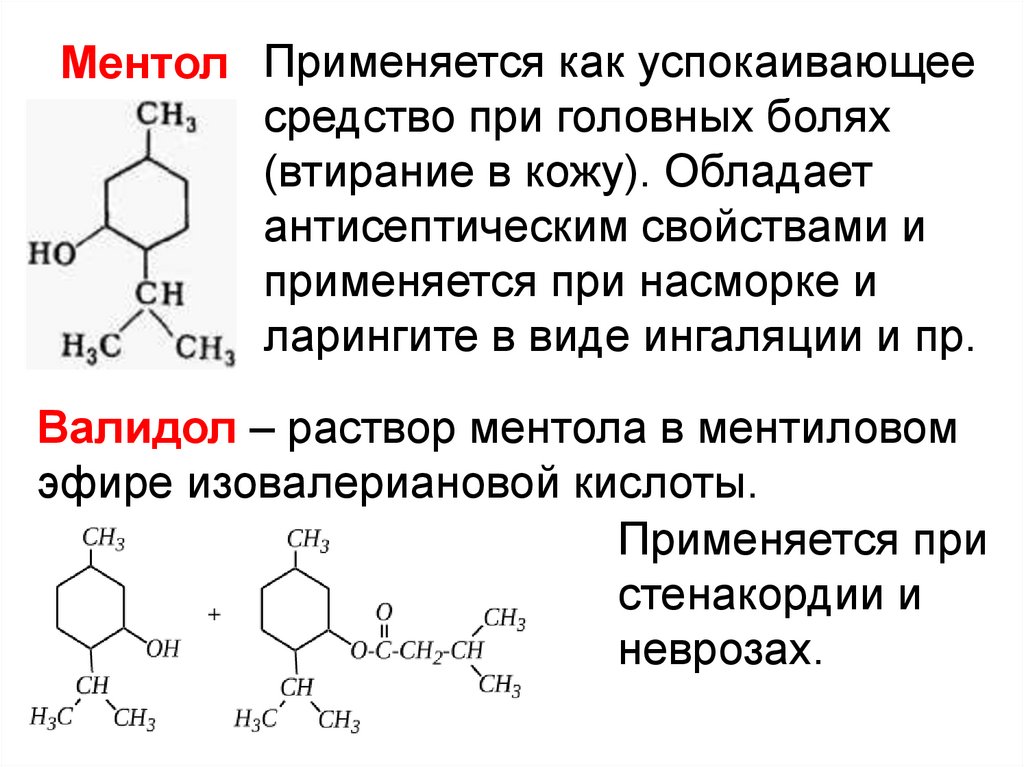
Ментол Применяется как успокаивающеесредство при головных болях
(втирание в кожу). Обладает
антисептическим свойствами и
применяется при насморке и
ларингите в виде ингаляции и пр.
Валидол – раствор ментола в ментиловом
эфире изовалериановой кислоты.
Применяется при
стенакордии и
неврозах.
14.
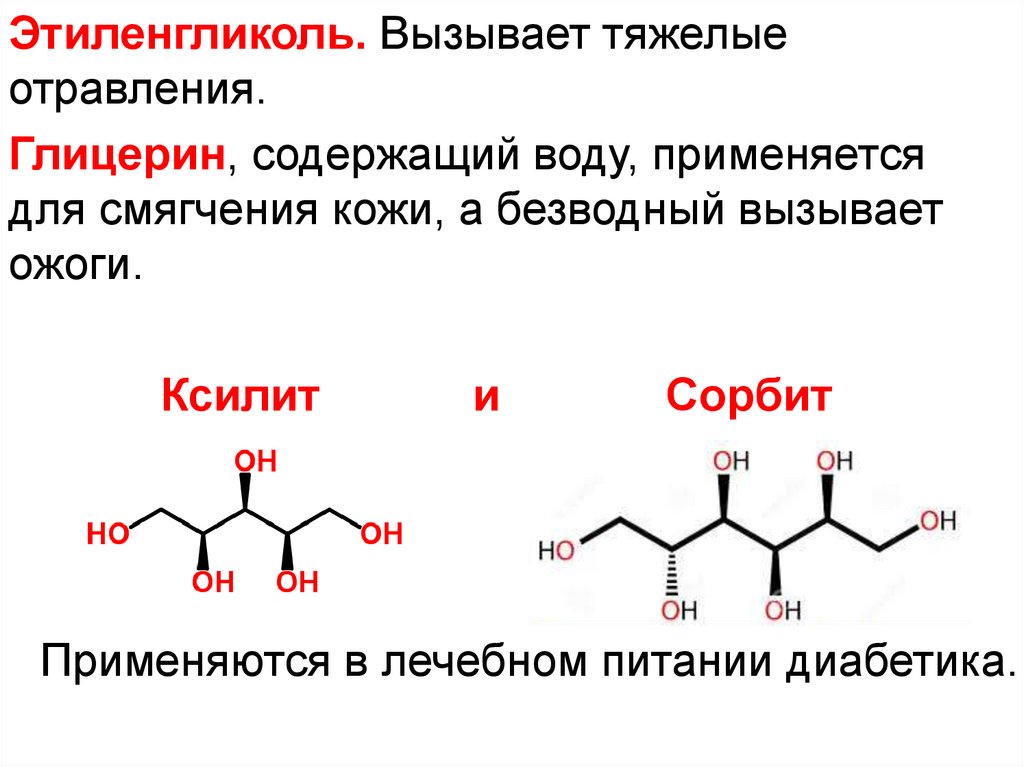
Этиленгликоль. Вызывает тяжелыеотравления.
Глицерин, содержащий воду, применяется
для смягчения кожи, а безводный вызывает
ожоги.
Ксилит
и
Сорбит
Применяются в лечебном питании диабетика.
15. ОКСИСОЕДИНЕНИЯ
ФЕНОЛЫ16.
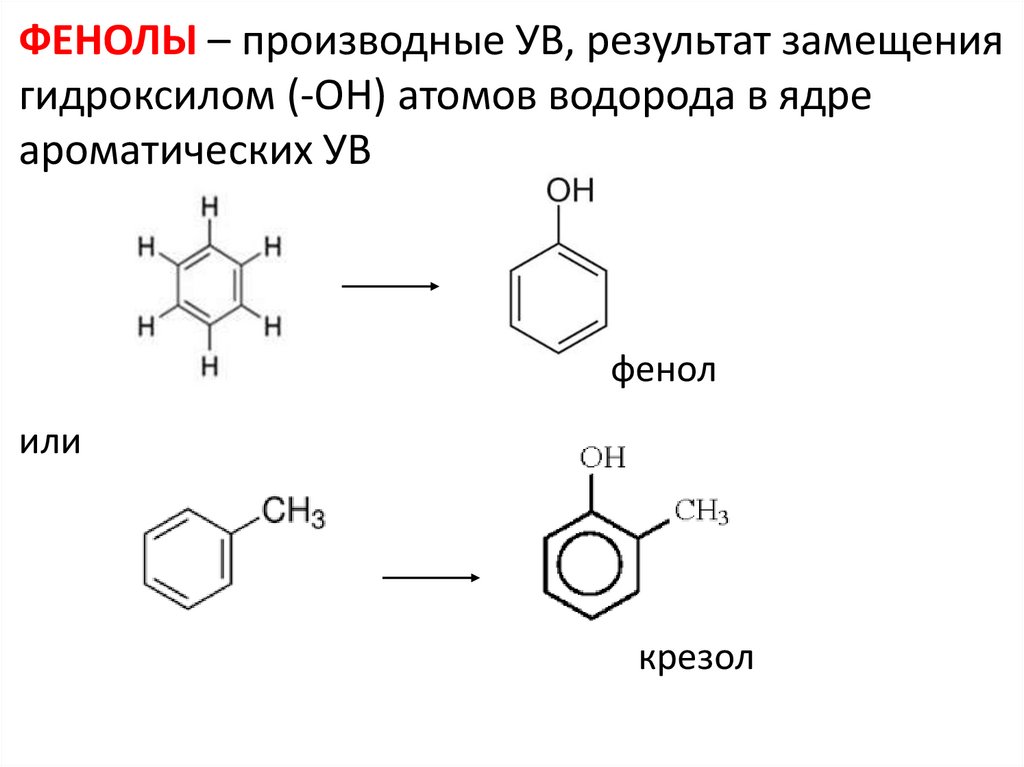
ФЕНОЛЫ – производные УВ, результат замещениягидроксилом (-ОН) атомов водорода в ядре
ароматических УВ
фенол
или
крезол
17.
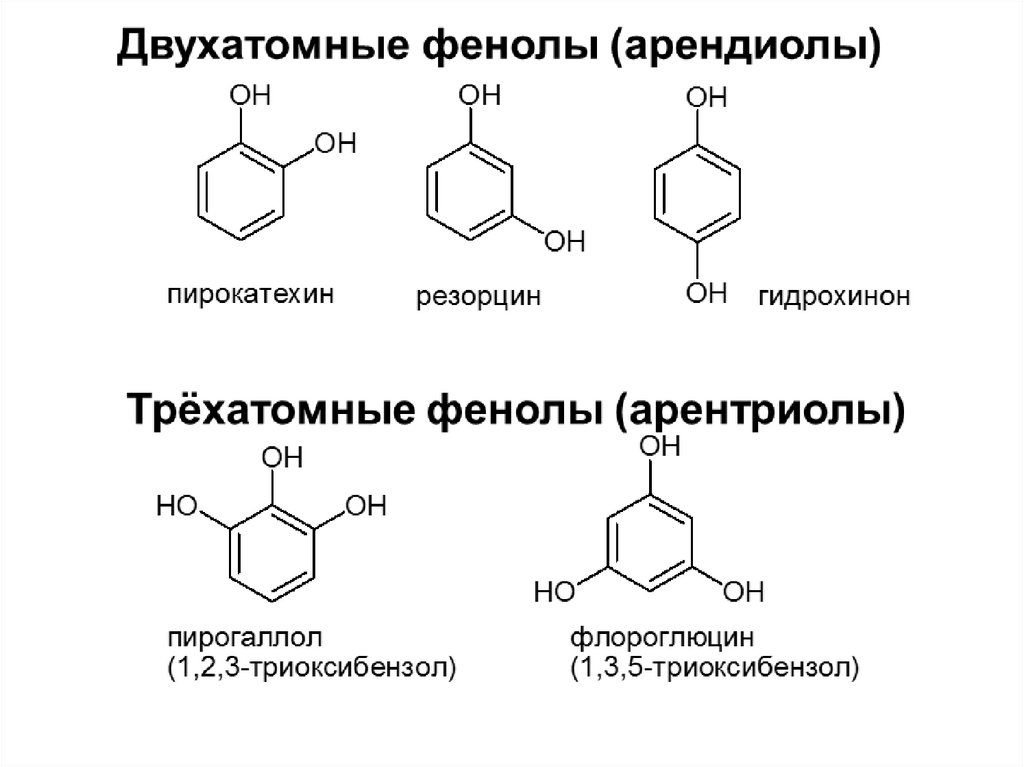
Одноатомные фенолы (аренолы)OH
фенол
гидроксибензол, устар. карболовая кислот
(5 % раствор в воде — антисептик; основа
лекарственных веществ, красителей)
18.
19.
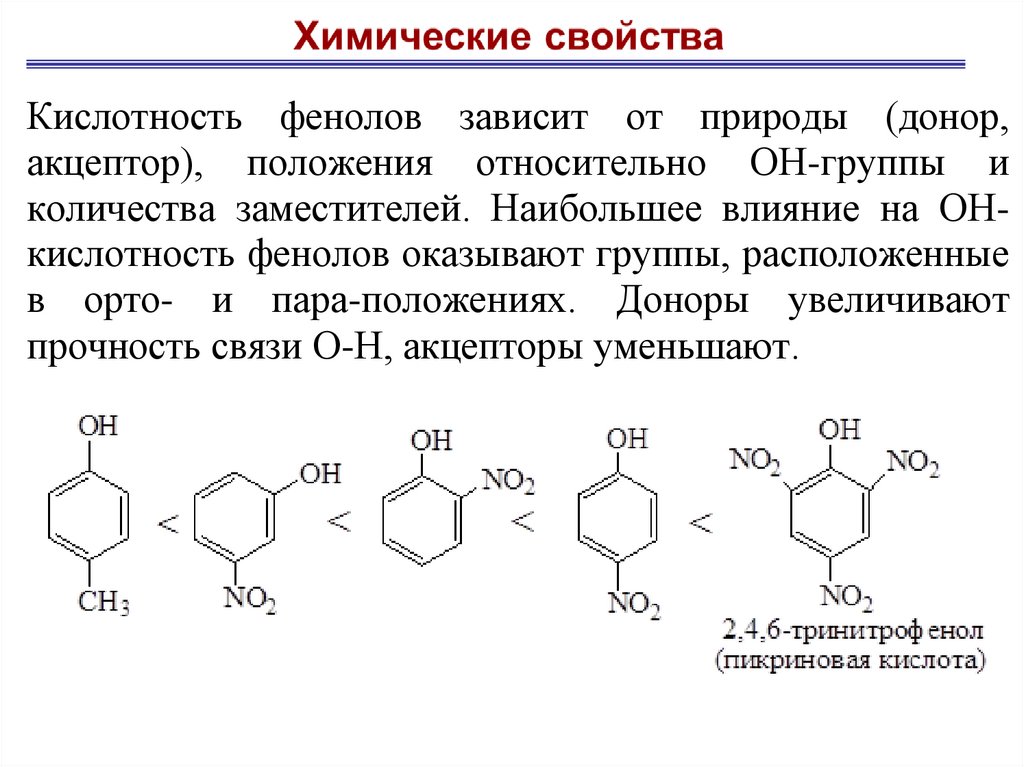
Кислотность фенолов зависит от природы (донор,акцептор), положения относительно ОН-группы и
количества заместителей. Наибольшее влияние на ОНкислотность фенолов оказывают группы, расположенные
в орто- и пара-положениях. Доноры увеличивают
прочность связи О-Н, акцепторы уменьшают.
20.
Гидроксильная группа – ориентант I рода, облегчаетреакции по бензольному кольцу, направляя атаку
электрофильного реагента в орто-, пара-положения.
OH
Br
OH
3 Br2, 20
Br
OH
OH
NO2
+
HNO3
- 3HBr
Br
OCH3 CH Br
3
ацилирования
ONa
CH 3COCl
NaOH, -H2O
[O]
анизол
фенолят
Na, -1/2 H2
Н2
NaOH
хинон
[O]
циклогексанол
O
C
O
CH3
NO2
фенилацетат
НСООН
-Н2О
фенолформальдегидная
смола
гидрохинон
20
21.
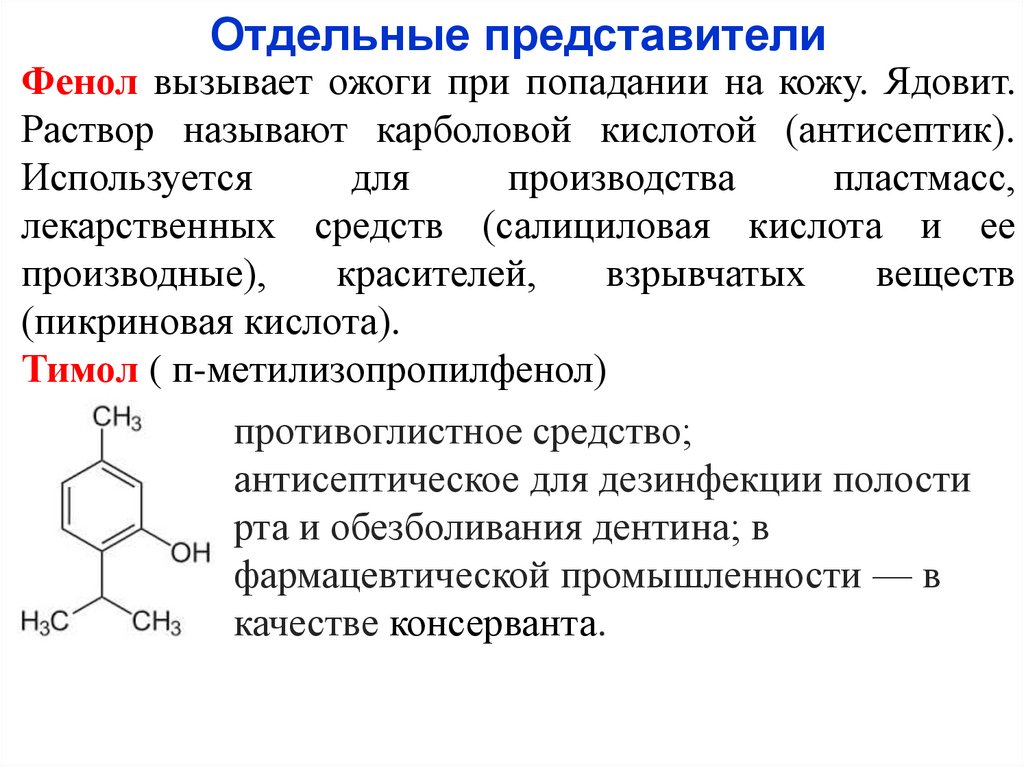
Отдельные представителиФенол вызывает ожоги при попадании на кожу. Ядовит.
Раствор называют карболовой кислотой (антисептик).
Используется
для
производства
пластмасс,
лекарственных средств (салициловая кислота и ее
производные),
красителей,
взрывчатых
веществ
(пикриновая кислота).
Тимол ( п-метилизопропилфенол)
противоглистное средство;
антисептическое для дезинфекции полости
рта и обезболивания дентина; в
фармацевтической промышленности — в
качестве консерванта.
22.
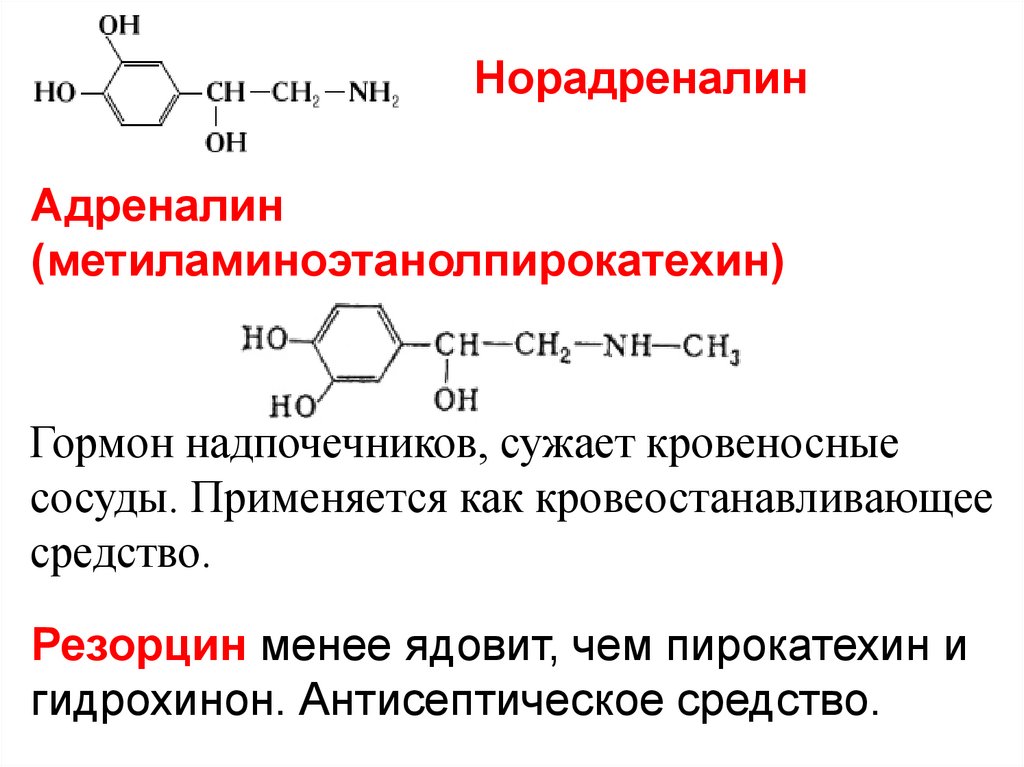
НорадреналинАдреналин
(метиламиноэтанолпирокатехин)
Гормон надпочечников, сужает кровеносные
сосуды. Применяется как кровеостанавливающее
средство.
Резорцин менее ядовит, чем пирокатехин и
гидрохинон. Антисептическое средство.
23.
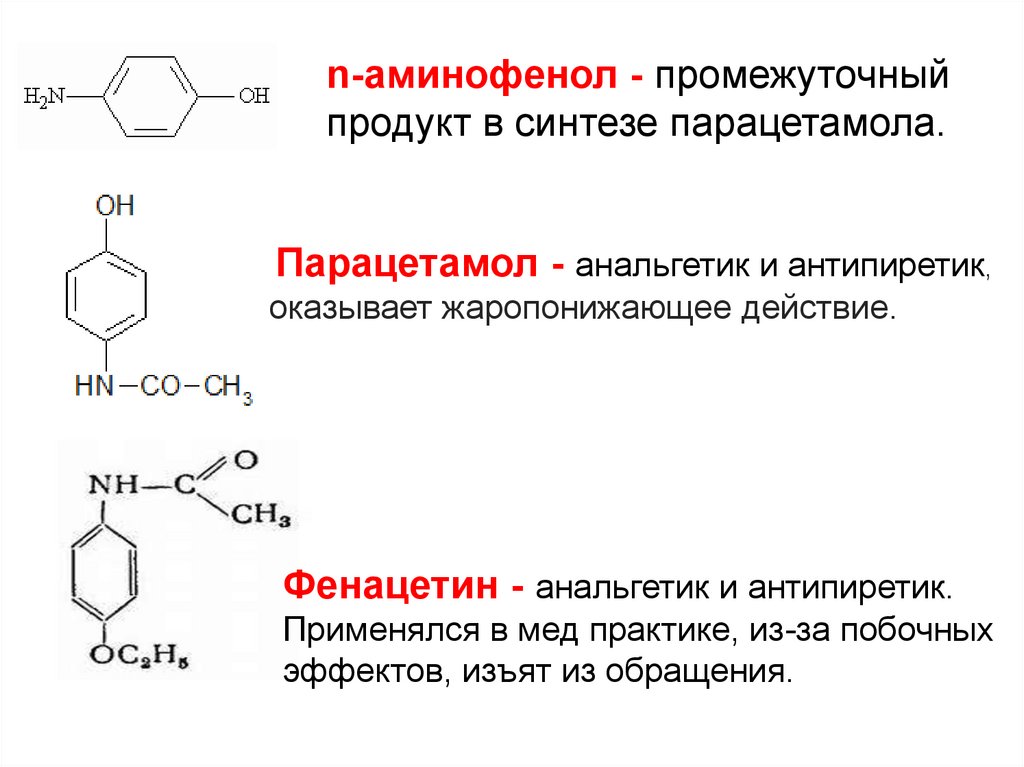
n-аминофенол - промежуточныйпродукт в синтезе парацетамола.
Парацетамол - анальгетик и антипиретик,
оказывает жаропонижающее действие.
Фенацетин - анальгетик и антипиретик.
Применялся в мед практике, из-за побочных
эффектов, изъят из обращения.
24. ТИОЛЫ
25. ХИМИЧЕСКИЕ СВОЙСТВА
ТИОЛЫ (меркаптаны) R – SH - сернистыеаналоги спиртов (производные сероводорода).
ХИМИЧЕСКИЕ СВОЙСТВА
Тиолы проявляют слабые кислотные свойства (на
5-6 порядков больше, чем у спиртов)
1. 2С2Н5SH + 2Na = 2C2H5SNa + H2
этантиол
этантиолят натрия
(этилмеркаптан)
2. С2Н5SH + NaOH = C2H5SNa + H2O
3. 2С2Н5SH + HgO = (C2H5S)2Hg + H2O
этантиолят ртути (II)
4. С2Н5SH + HgCl2 = (C2H5S)2Hg + 2HCl
26.
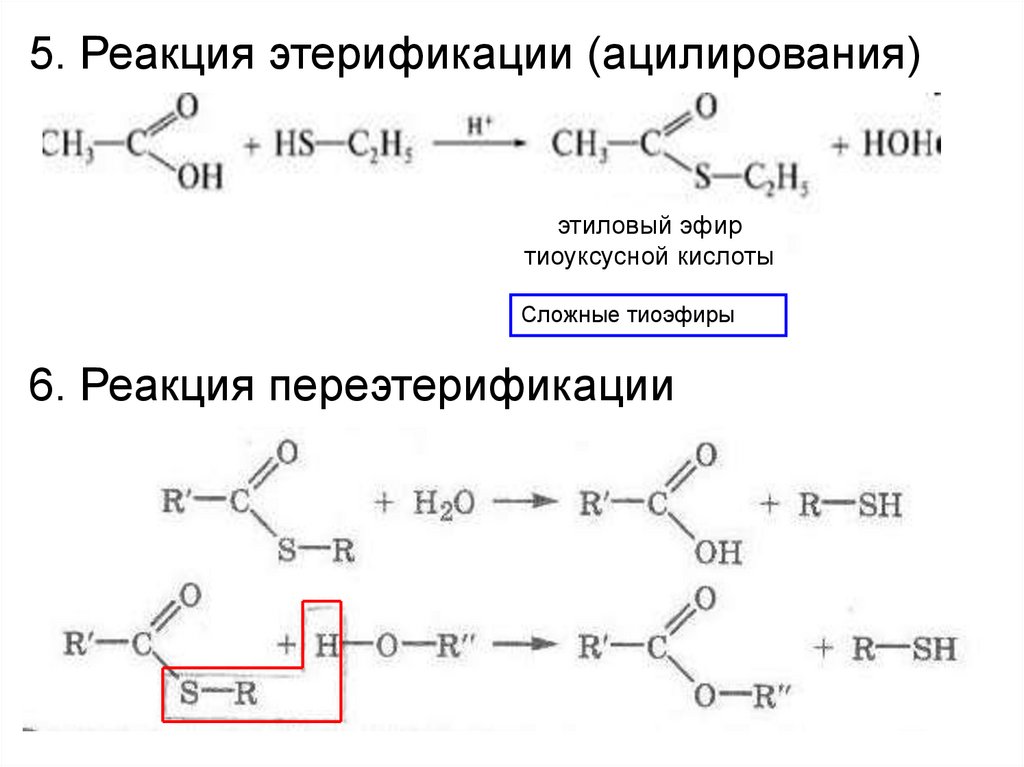
5. Реакция этерификации (ацилирования)этиловый эфир
тиоуксусной кислоты
Сложные тиоэфиры
6. Реакция переэтерификации
27.
В организме кофермент А участвует в обменевеществ: активируя карбоновые кислоты,
превращает их в реакционноспособные сложные
тиоэфиры (ацилкофермент А).
28.
7. Окислительно-восстановительные реакции.Тиолы сильные восстановители.
окисление
2RSH
R – S – S –R + 2H+
восстановление
Тиол
Дисульфид
Тиол-дисульфидная система – сопряженная
окислительно-восстановительная пара.
Используется для поддержания Ox/Red гомеозтата
в организме и в работе антиоксидантной буферной
системы.
29.
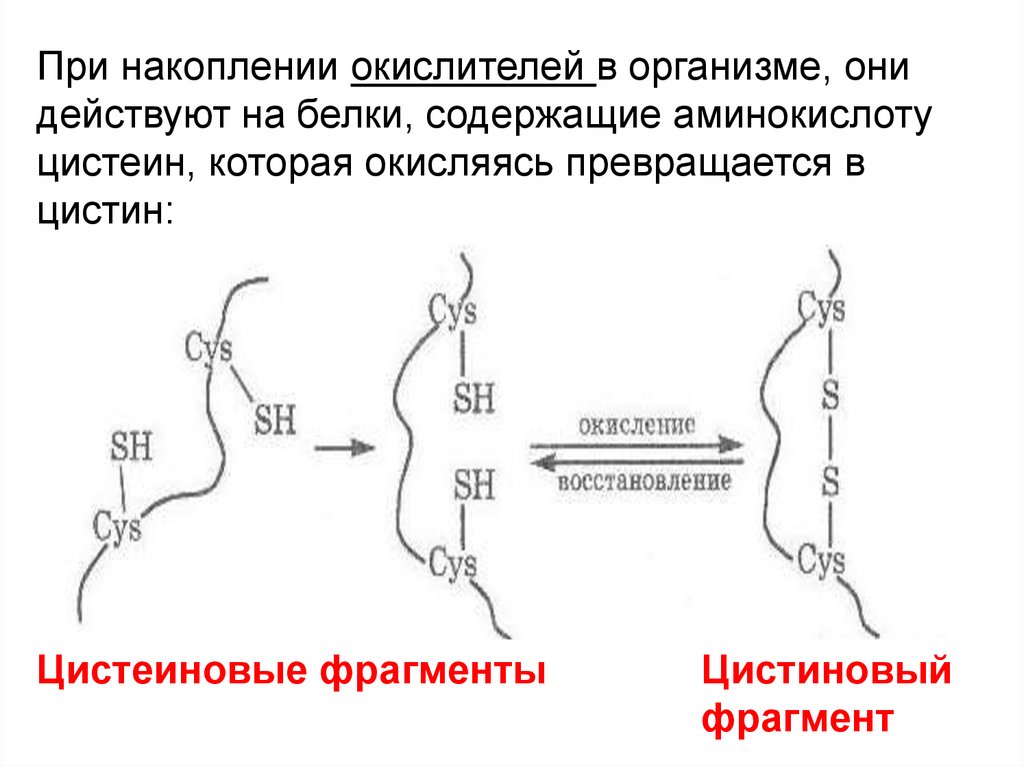
При накоплении окислителей в организме, онидействуют на белки, содержащие аминокислоту
цистеин, которая окисляясь превращается в
цистин:
Цистеиновые фрагменты
Цистиновый
фрагмент
30.
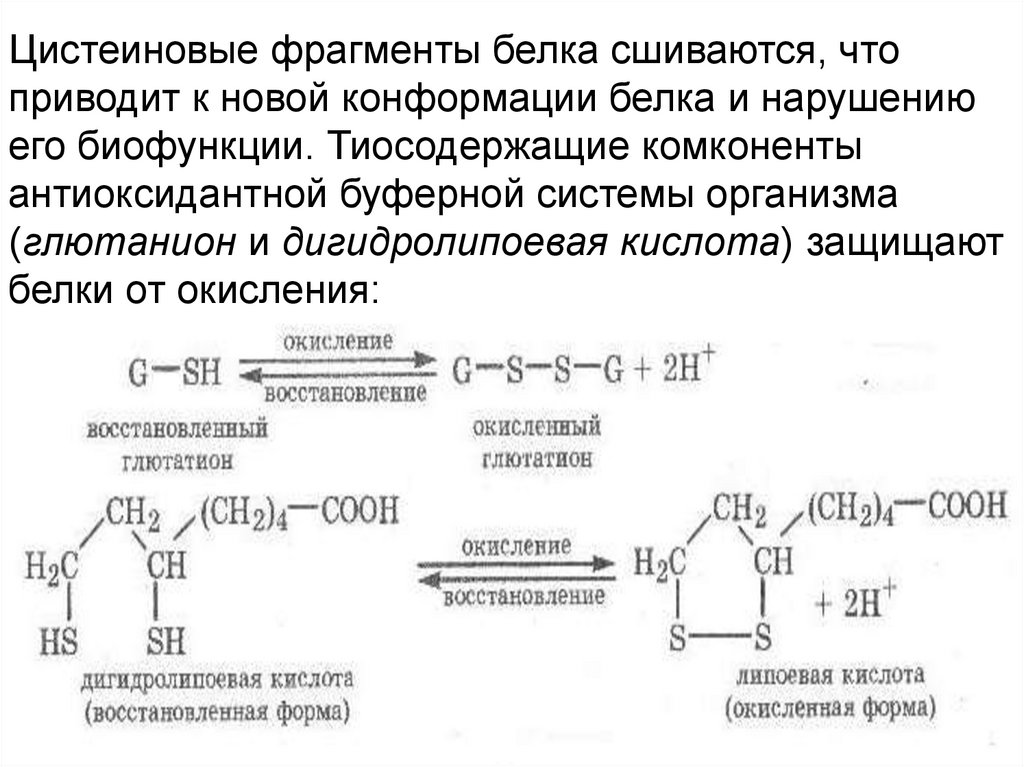
Цистеиновые фрагменты белка сшиваются, чтоприводит к новой конформации белка и нарушению
его биофункции. Тиосодержащие комконенты
антиоксидантной буферной системы организма
(глютанион и дигидролипоевая кислота) защищают
белки от окисления:
31.
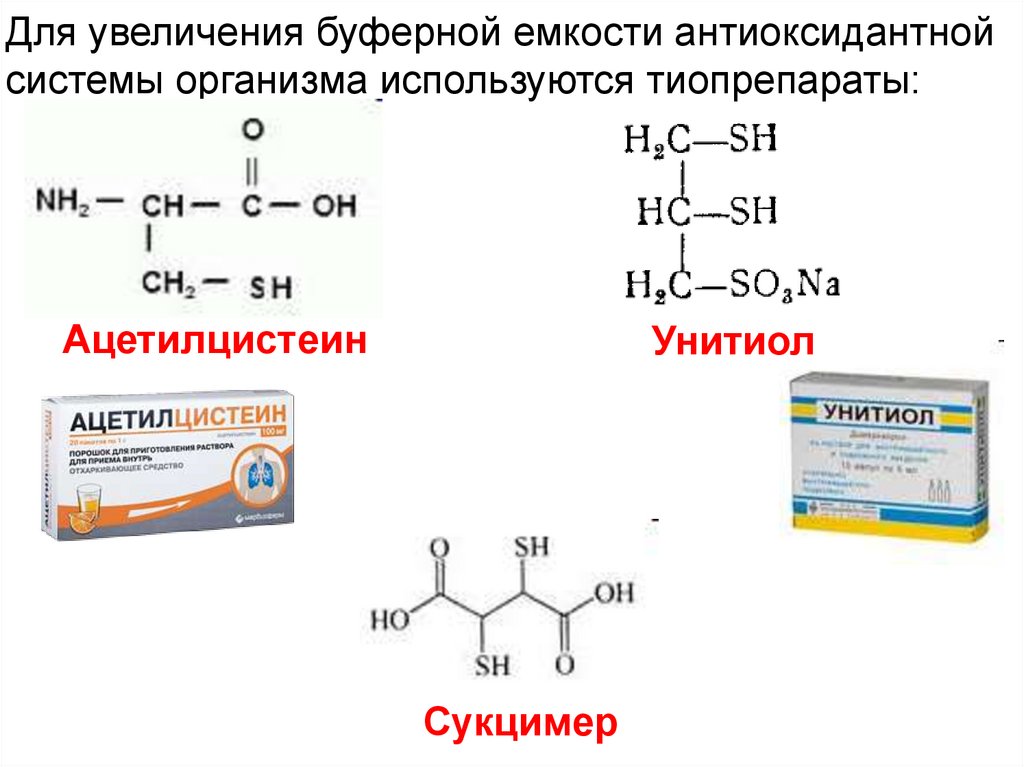
Для увеличения буферной емкости антиоксидантнойсистемы организма используются тиопрепараты:
Ацетилцистеин
Унитиол
Сукцимер
32.
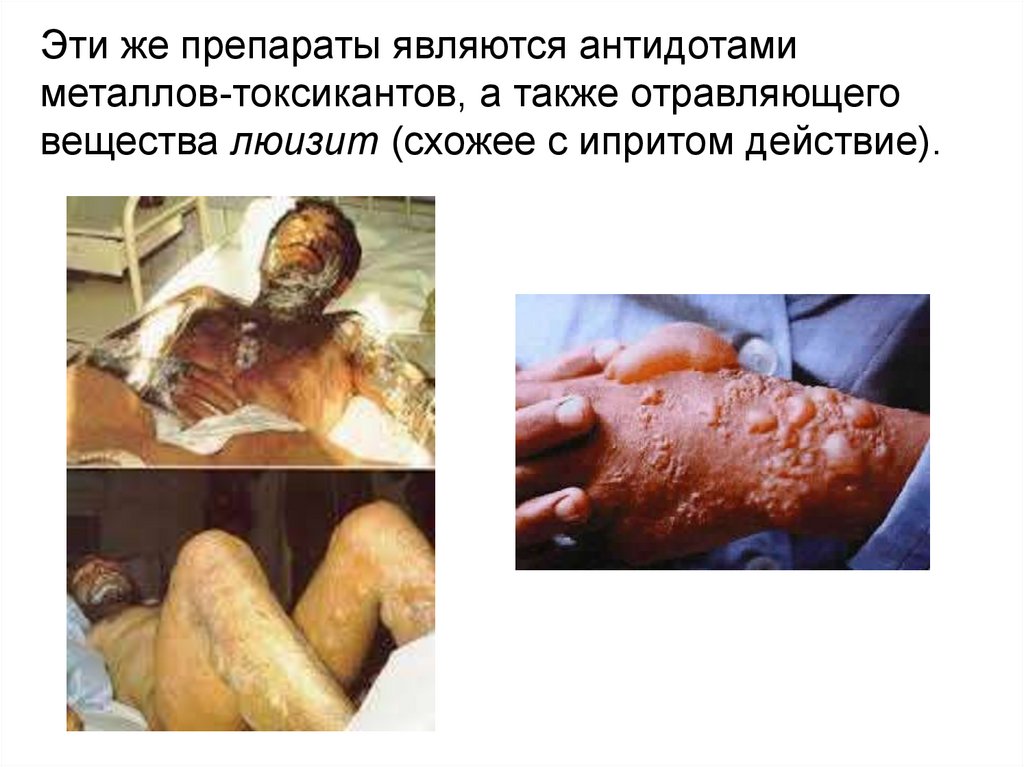
Эти же препараты являются антидотамиметаллов-токсикантов, а также отравляющего
вещества люизит (схожее с ипритом действие).
33.
Нарушение окислительно-восстановительногогомеостаза наблюдается при радиоактивном
облучении.
Для предотвращения тяжелых последствий
используют радиопротекторы (вещества,
смягчающие последствия радиации), например
меркамин (аминотиол)
меркамин
цистамин
34.
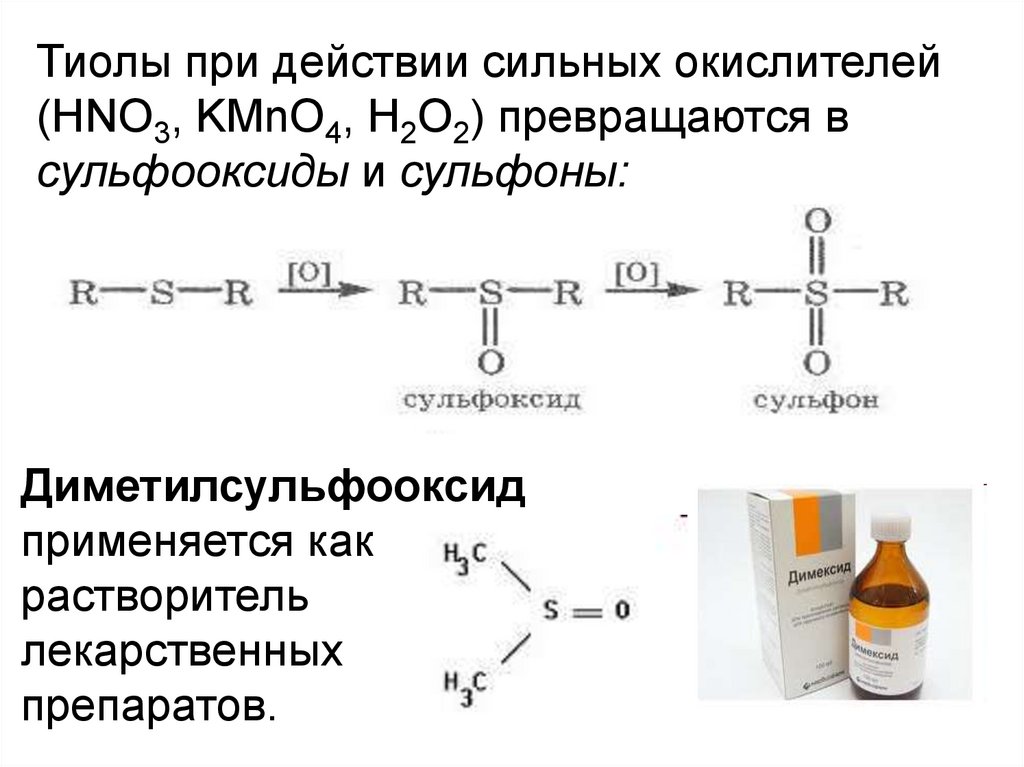
Тиолы при действии сильных окислителей(HNO3, KMnO4, H2O2) превращаются в
сульфооксиды и сульфоны:
Диметилсульфооксид
применяется как
растворитель
лекарственных
препаратов.













 Химия
Химия








