Похожие презентации:
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
1. Кислородсодержащие производные углеводородов
2.
К кислорородсодержащим производнымуглеводородов относятся:
• спирты (R-OH),
• фенолы (Ar-OH),
• простые эфиры (R-O-R’),
• альдегиды (R-CHO),
• кетоны (R-CO-R’),
• карбоновые кислоты (R-COOH)
и их функциональные производные и др.
3. Гидроксилсодержащие производные углеводородов
-такиепроизводные, у
которых один или
несколько Н-атомов
замещены на
гидроксильную группу –
ОН
-Спирты, енолы, фенолы
4. СПИРТЫ
Общееназвание – алканолы.
Это производные
углеводородов, у которых
гидроксильная группa связана
с sp3 гибридным атомом С.
5.
RПРЕДЕЛЬНЫЕ
НЕПРЕДЕЛЬНЫЕ
CH3CH2OH
этанол
CH2 CHCH2OH
аллиловый спирт
АЛИЦИКЛИЧЕСКИЕ
OH
циклогексанол
АРОМАТИЧЕСКИЕ
CH2OH
бензиловый спирт
6.
• В зависимости от типа атома С,соединенного с группой ОН, спирты
бывают
R
H2
H
R C OH
R C OH
R C OH
R
R
первичный вторичный третичный
спирт
спирт
спирт
7.
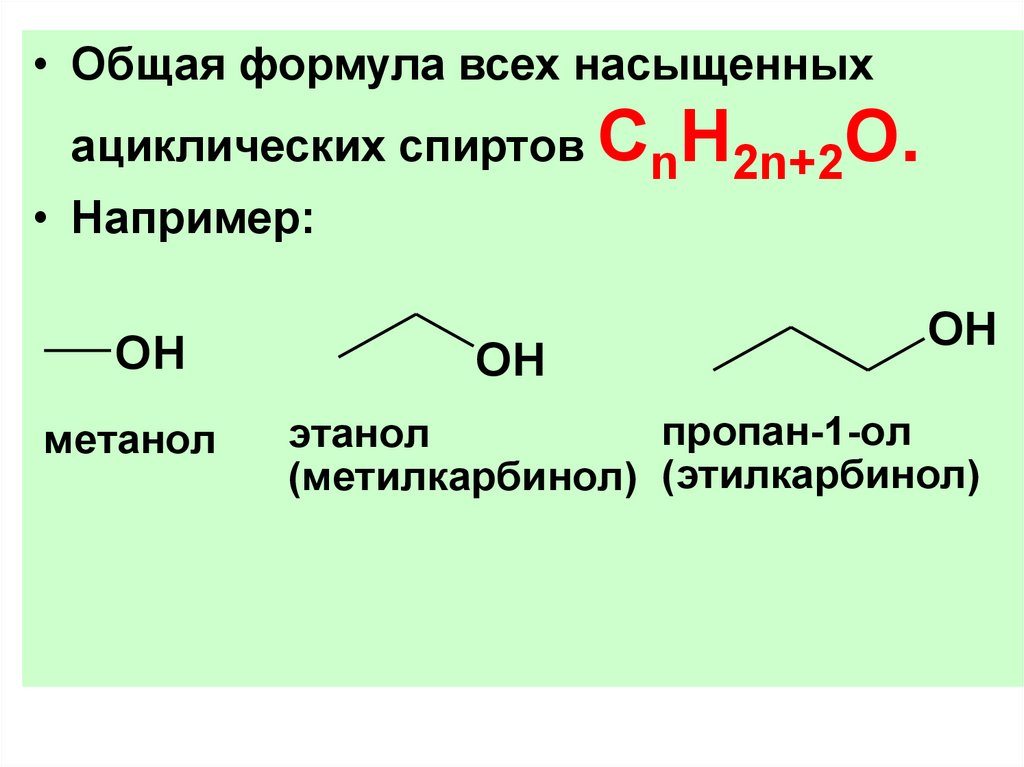
• Общая формула всех насыщенныхациклических спиртов СnH2n+2O.
• Например:
OH
метанол
OH
OH
пропан-1-ол
этанол
(метилкарбинол) (этилкарбинол)
8.
OHOH
пропан-2-ол
(диметилкарбинол)
проп-2-ен-1-ол
(аллиловый спирт,
винилкарбинол)
9.
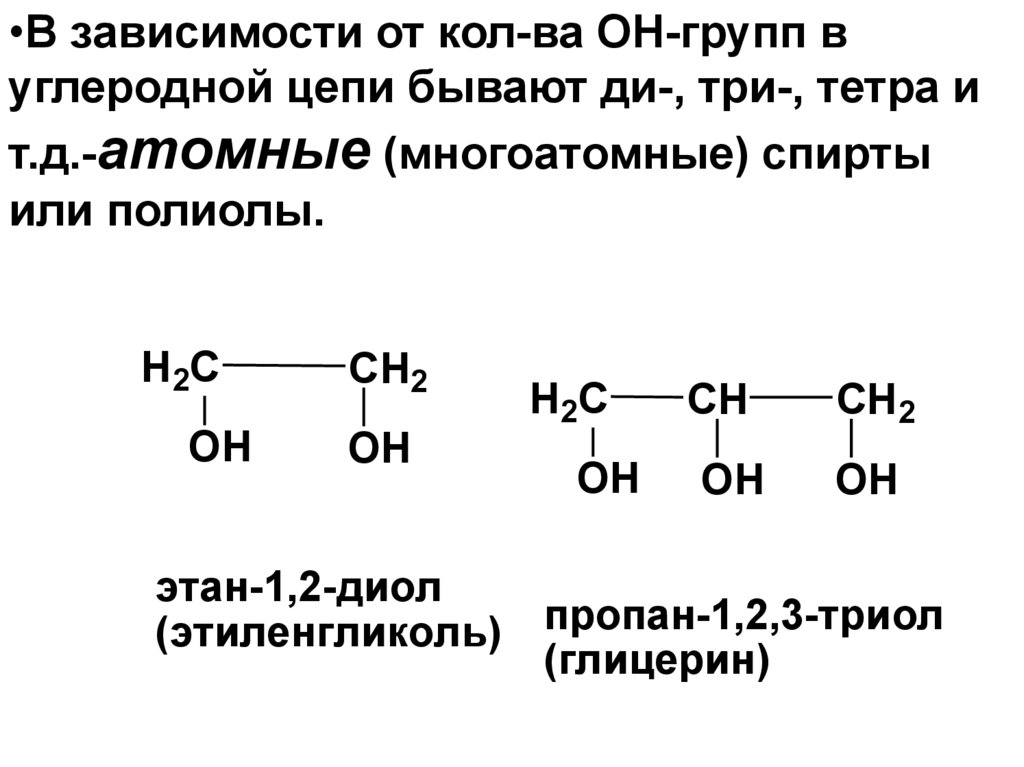
•В зависимости от кол-ва ОН-групп вуглеродной цепи бывают ди-, три-, тетра и
т.д.-атомные (многоатомные) спирты
или полиолы.
H2C
OH
CH2
OH
H2C
OH
CH
OH
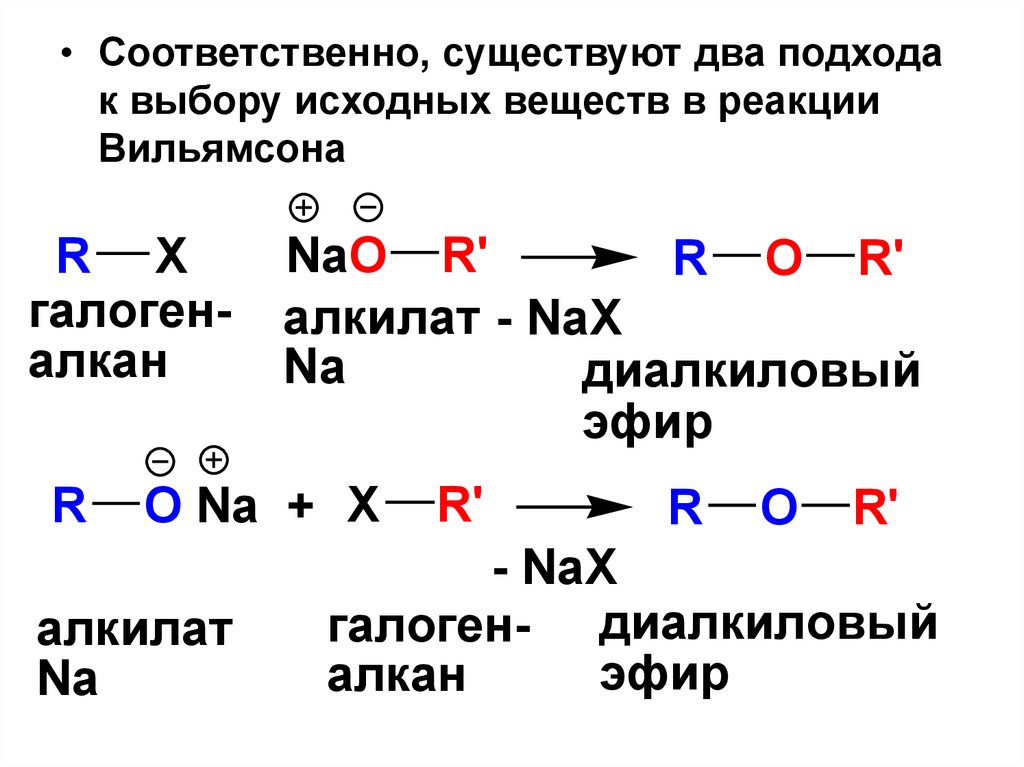
CH2
OH
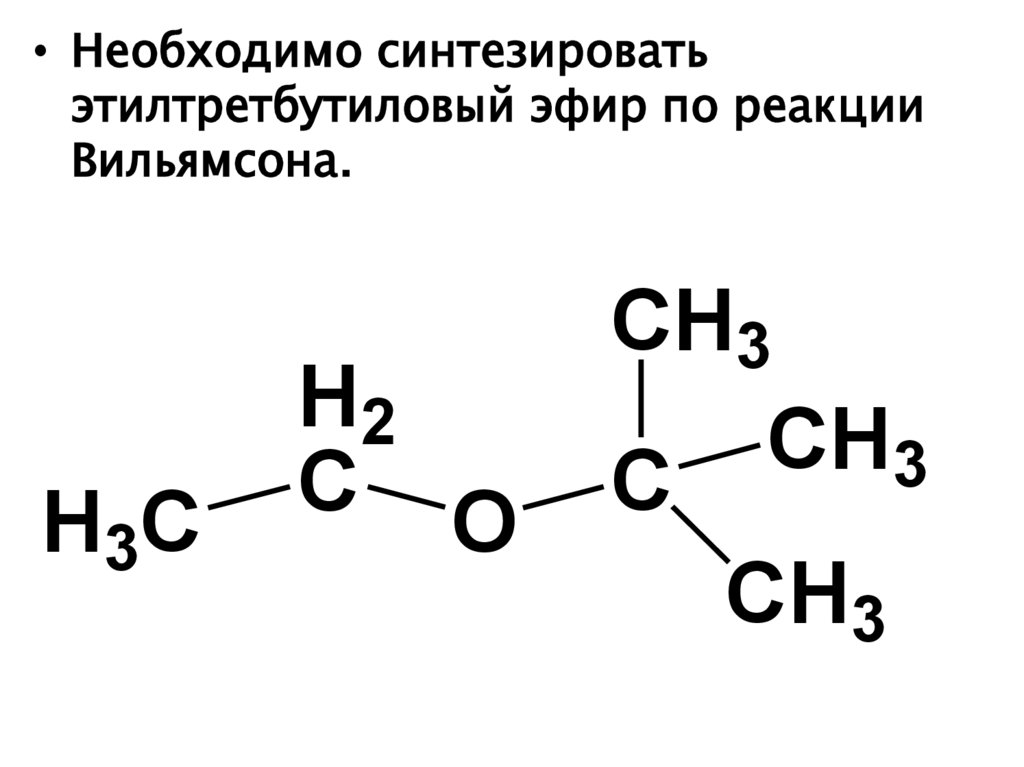
этан-1,2-диол
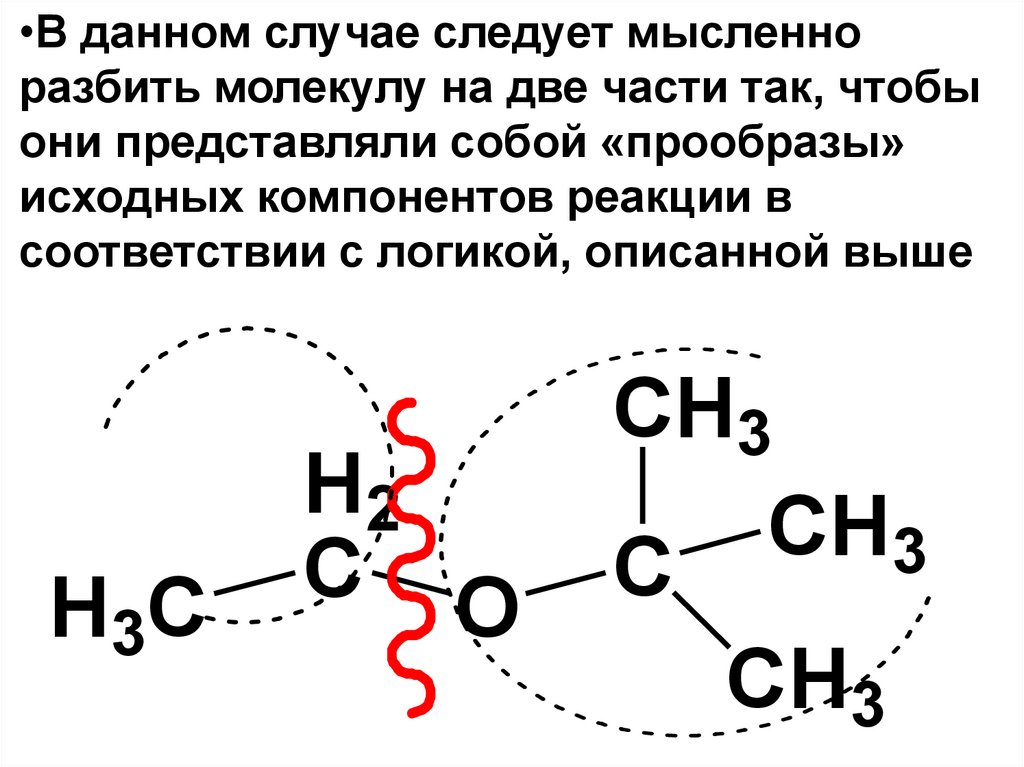
(этиленгликоль) пропан-1,2,3-триол
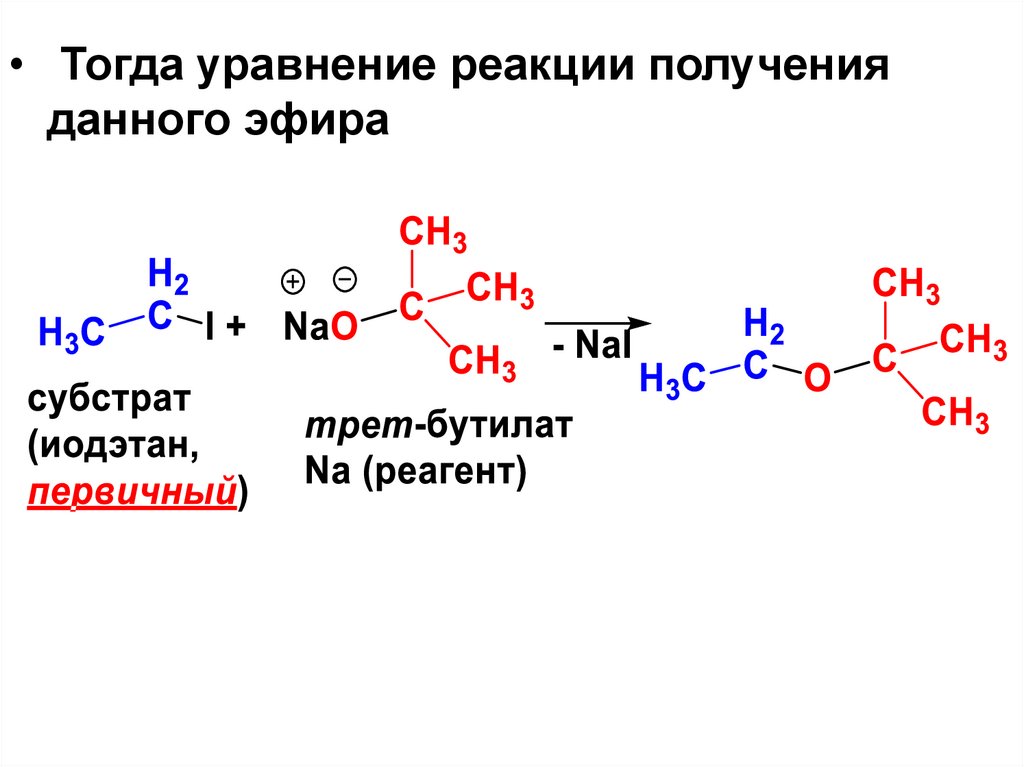
(глицерин)
10.
НоменклатураИЮПАК
• Гидроксильная группа спиртов
указывается при помощи суффикса
ОЛ
• Если в соединении присутствуют
более старшие группы (СО, СНО,
СООН, SO3H), гидроксильная группа
OH указывается с помощью
префикса
• ГИДРОКСИ
11.
CH3H
C
COOH
OH
2-гидроксипропановая кислота
12. ИЗОМЕРИЯ
1. C- скелета;2. Положения ОН-гр.;
3. Оптическая изомерия.
13.
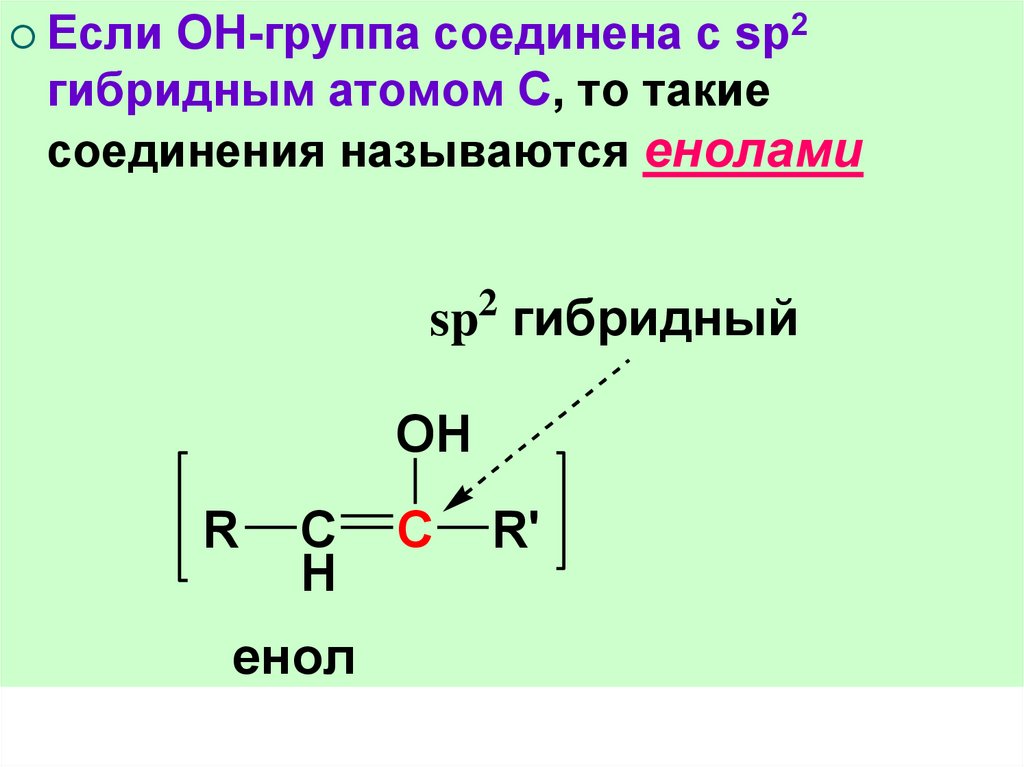
ЕслиОН-группа соединена с sp2
гибридным атомом С, то такие
соединения называются енолами
2
sp гибридный
OH
R
C
H
енол
C
R'
14.
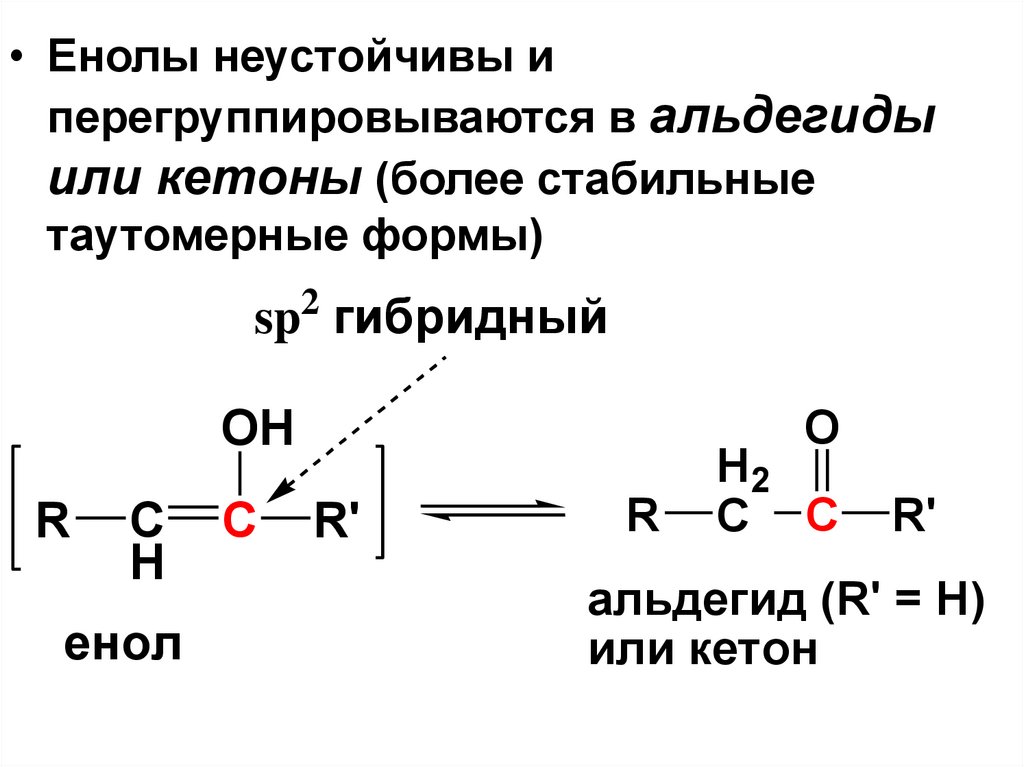
• Енолы неустойчивы иперегруппировываются в альдегиды
или кетоны (более стабильные
таутомерные формы)
sp2 гибридный
O
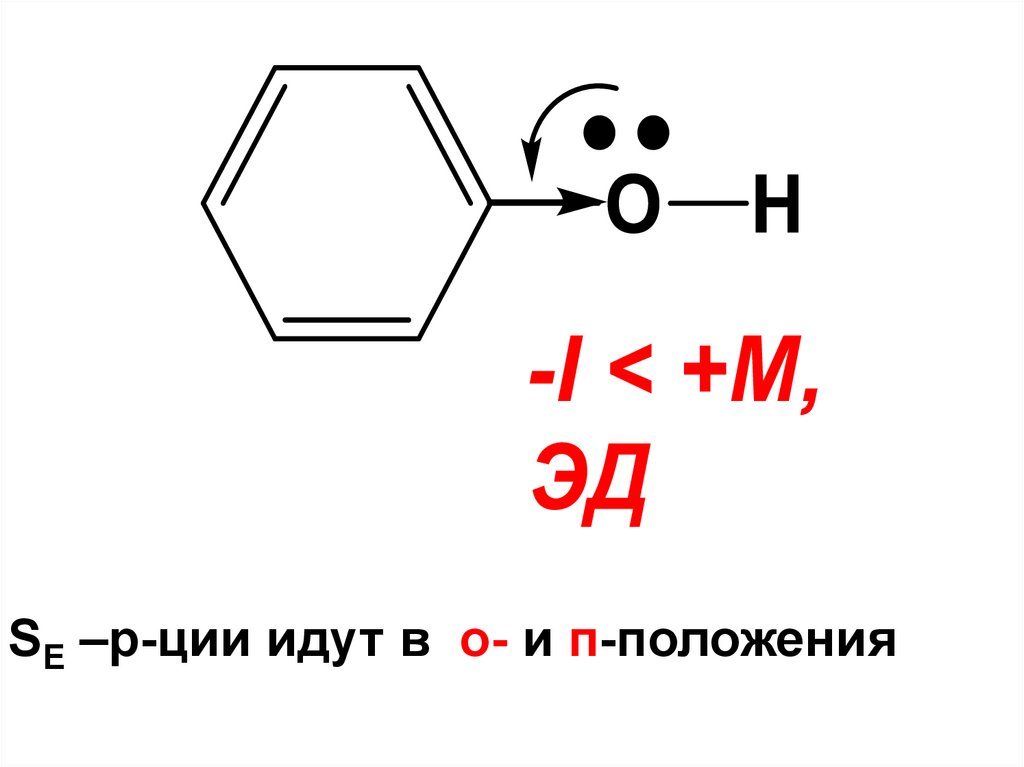
OH
R
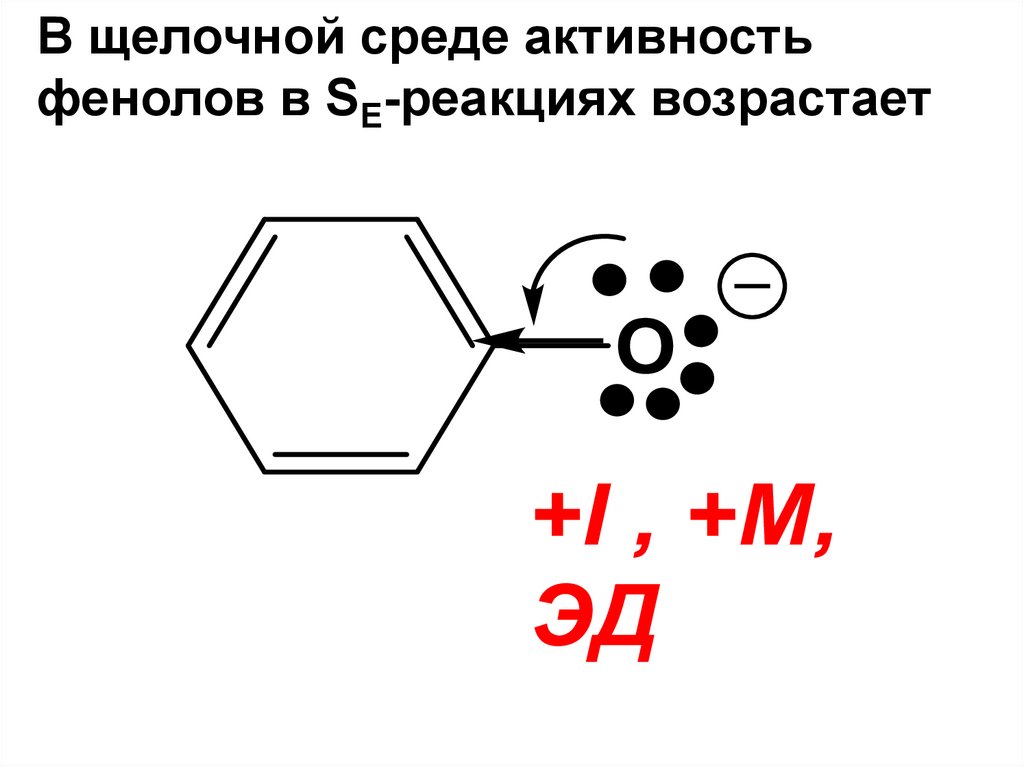
C
H
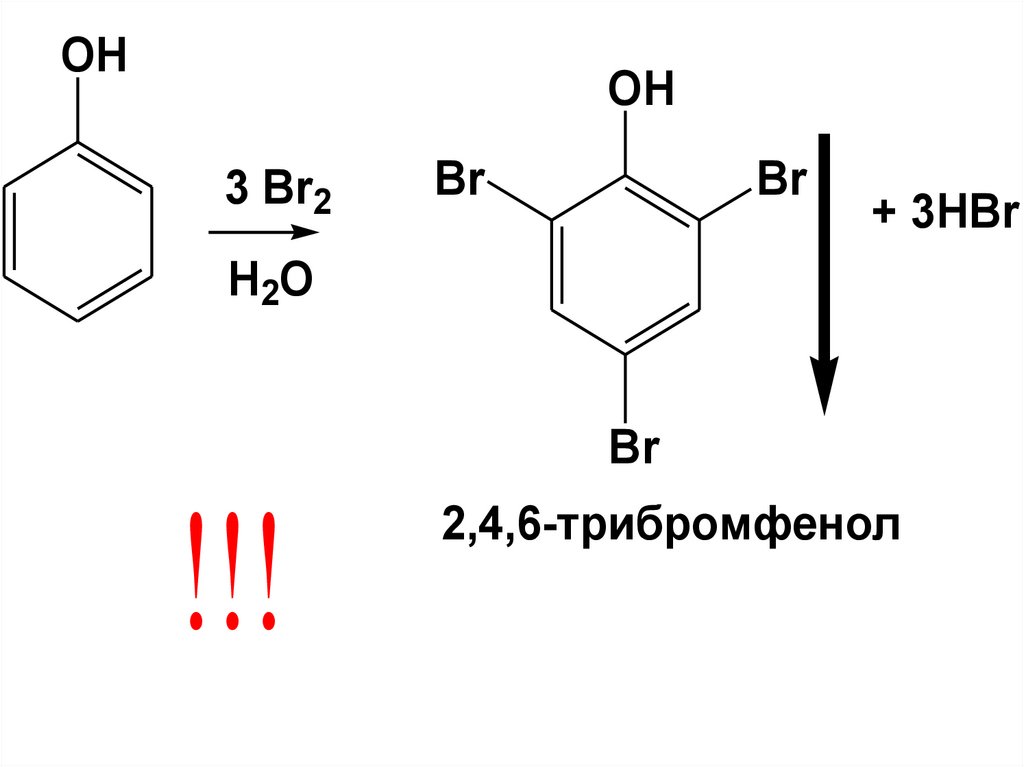
енол
C
R'
R
H2
C C
R'
альдегид (R' = H)
или кетон
15. ФЕНОЛЫ
Фенолыэто производные
ароматических углеводородов,
в молекулах которых группа OH
непосредственно связана
с sp2-гибридным атомом С
ароматичесого цикла.
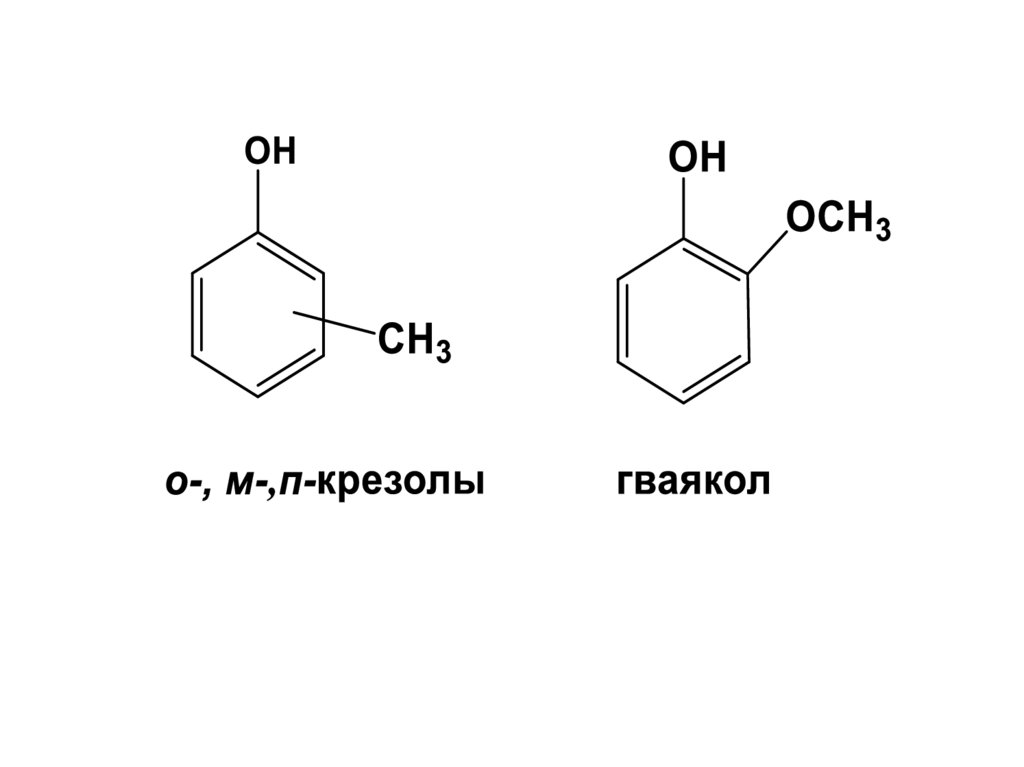
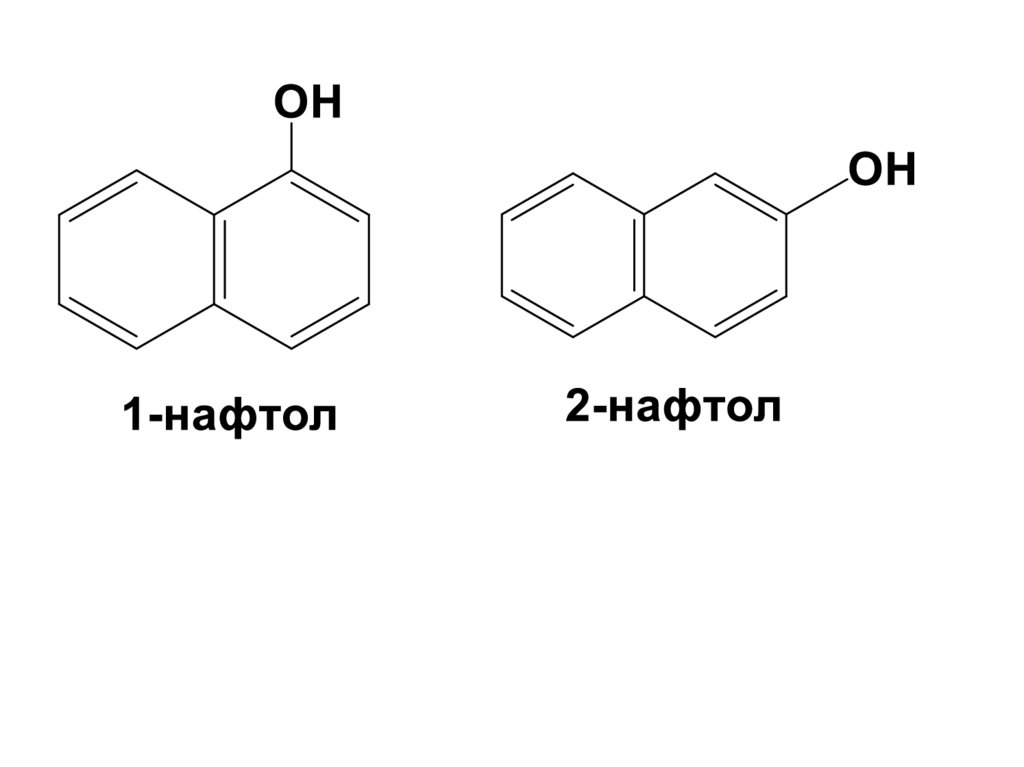
16.
Общая формула Ar-OHПримеры фенолов
17.
18.
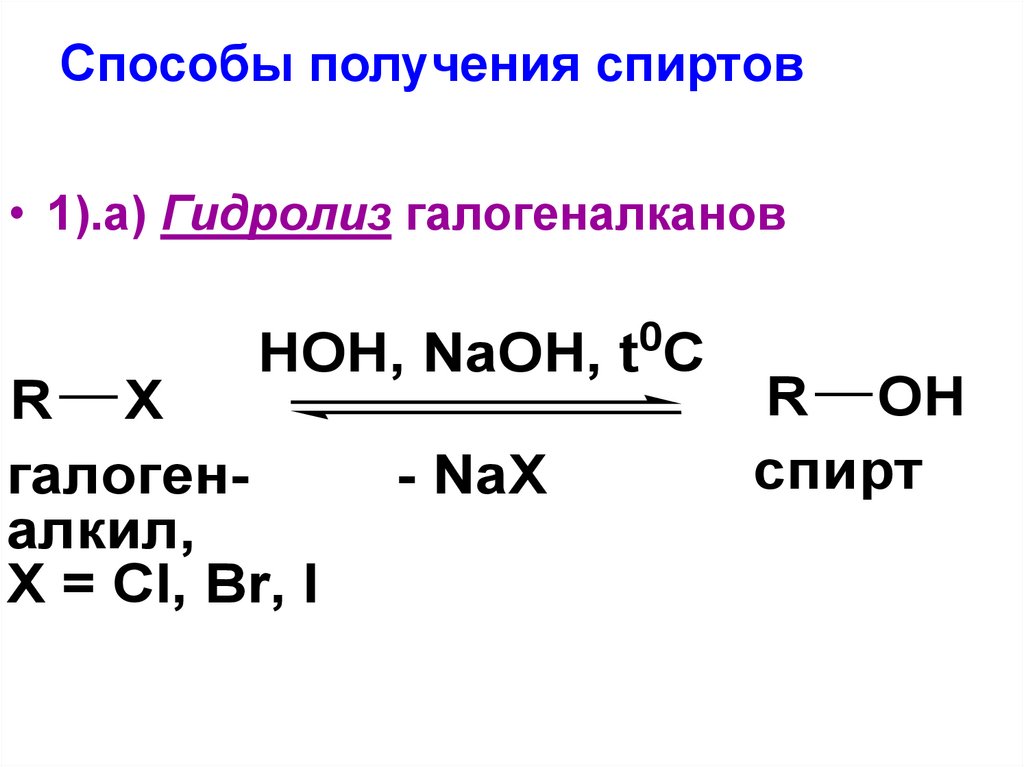
19. Способы получения спиртов
• 1).а) Гидролиз галогеналканов0
HOH, NaOH, t C
R X
галогеналкил,
X = Cl, Br, I
- NaX
R OH
спирт
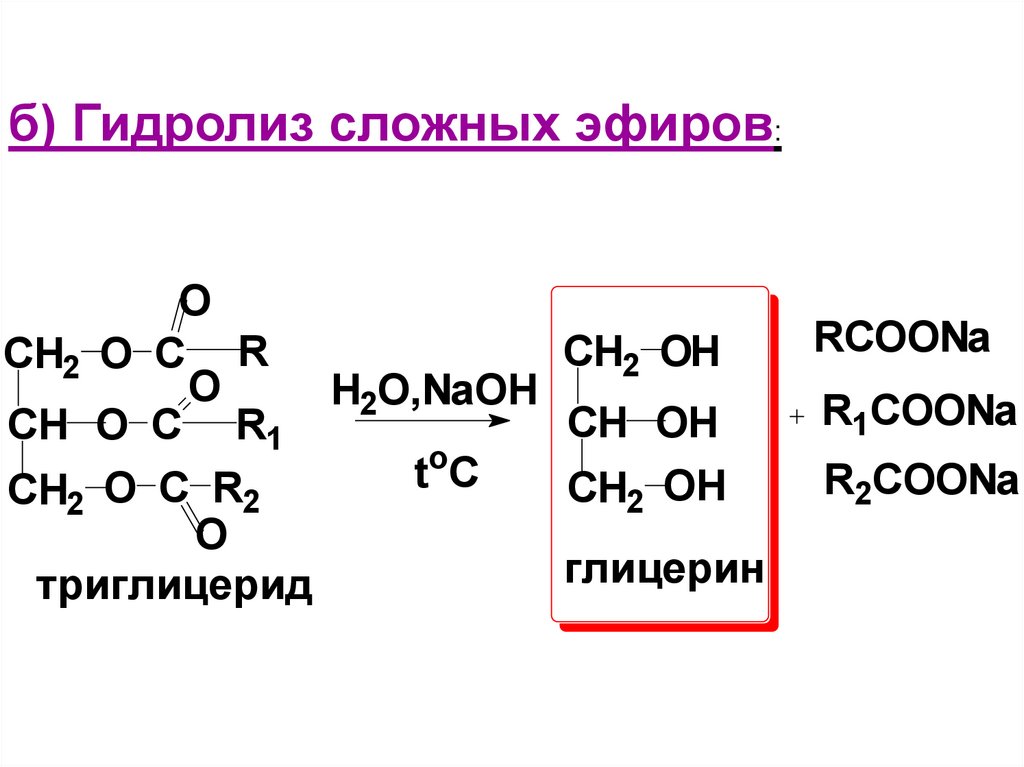
20. б) Гидролиз сложных эфиров:
OCH2 O C R
O
H2O,NaOH
CH O C R1
o
t
C
CH2 O C R2
O
триглицерид
CH2 OH
RCOONa
CH OH
CH2 OH
R1COONa
глицерин
R2COONa
21.
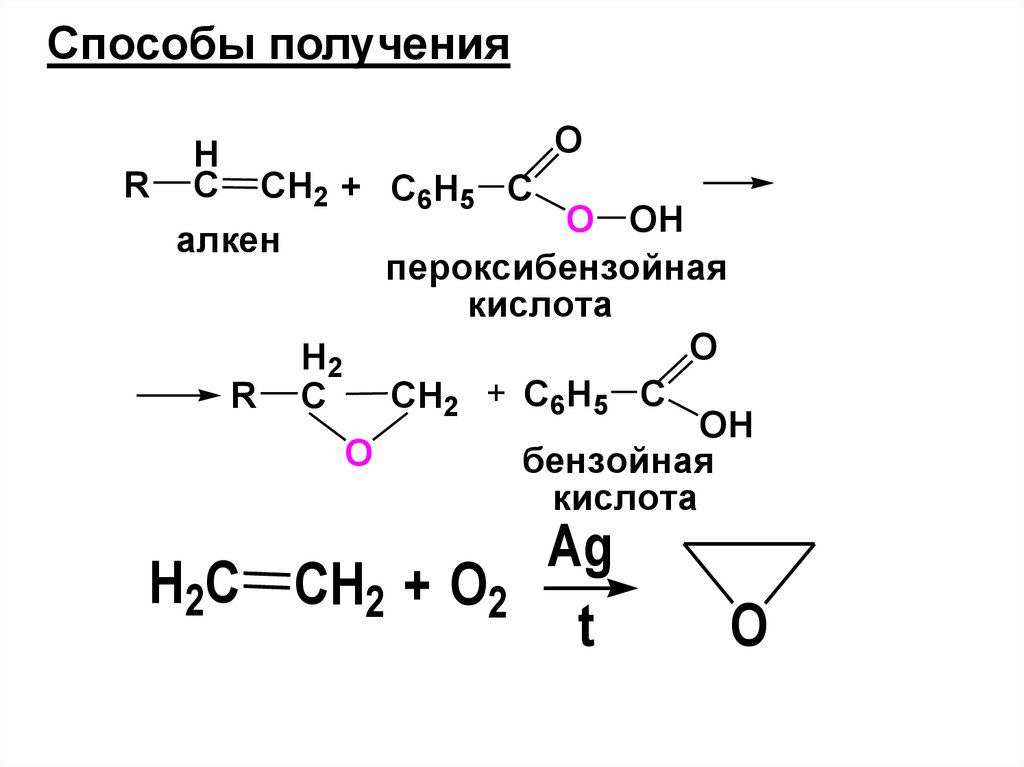
• 2) Гидратация алкенов(присоединение воды)
H2O, H
R
C
H
CH2
алкен
Присоединение
R
H
C
CH3
OH
спирт
воды в присутствии
сильных кислот (H2SO4, H3PO4, HCl) идет
в соответствии с правилом
МАРКОВНИКОВА.
22.
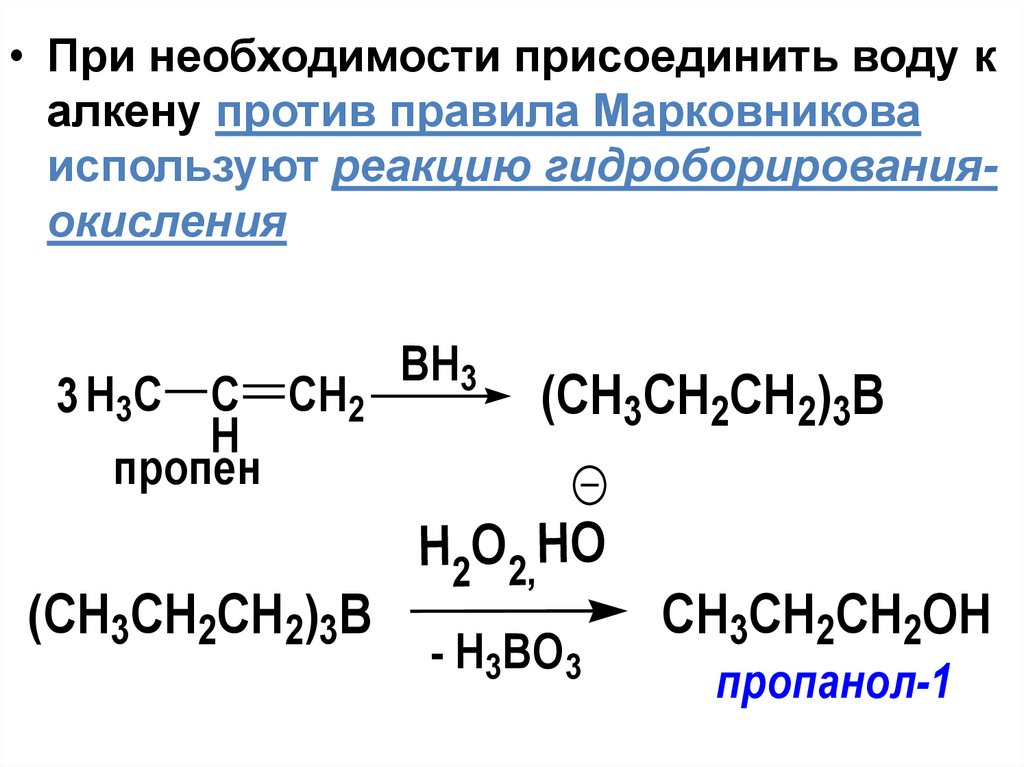
• При необходимости присоединить воду калкену против правила Марковникова
используют реакцию гидроборированияокисления
3 H3C C CH2
H
пропен
(CH3CH2CH2)3B
BH3
(CH3CH2CH2)3B
H2O2,HO
- H3BO3
CH3CH2CH2OH
пропанол-1
23.
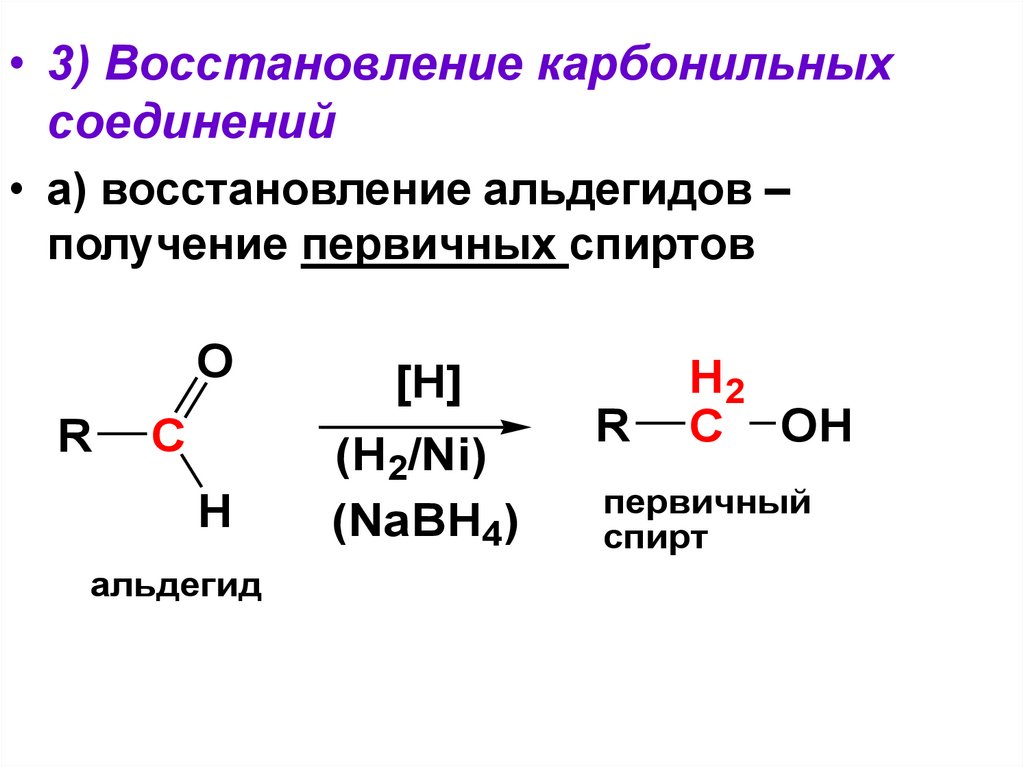
• 3) Восстановление карбонильныхсоединений
• а) восстановление альдегидов –
получение первичных спиртов
O
R
C
H
альдегид
[H]
(H2/Ni)
(NaBH4)
R
H2
C OH
первичный
спирт
24.
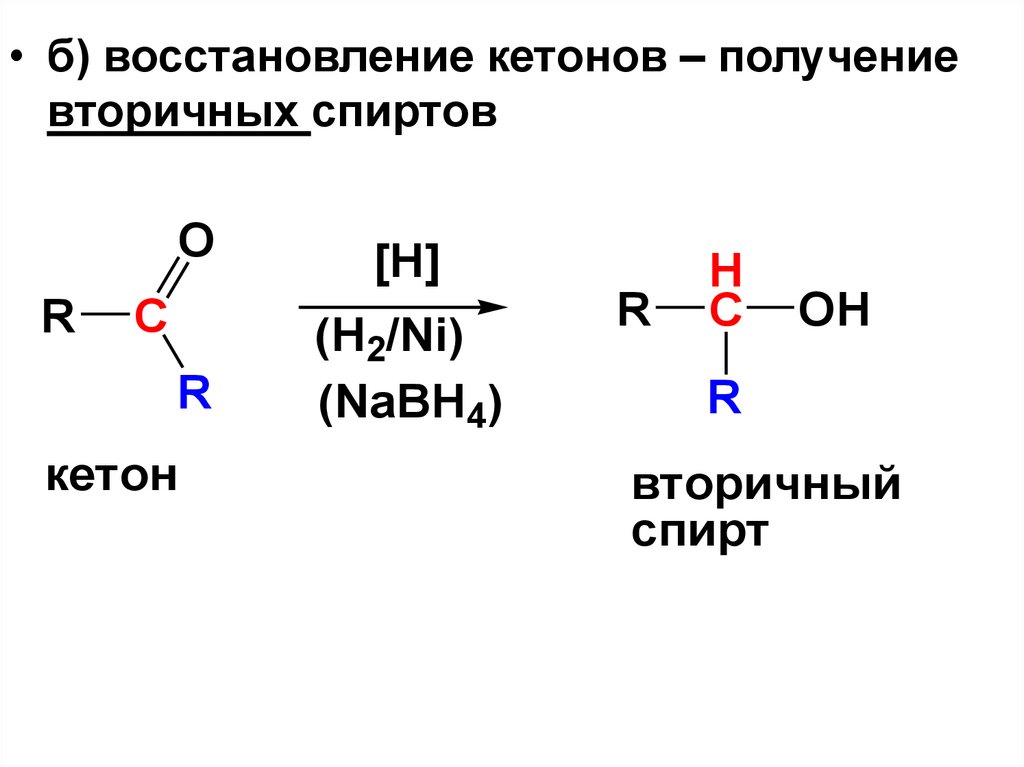
• б) восстановление кетонов – получениевторичных спиртов
O
R
C
R
кетон
[H]
(H2/Ni)
(NaBH4)
R
H
C
OH
R
вторичный
спирт
25.
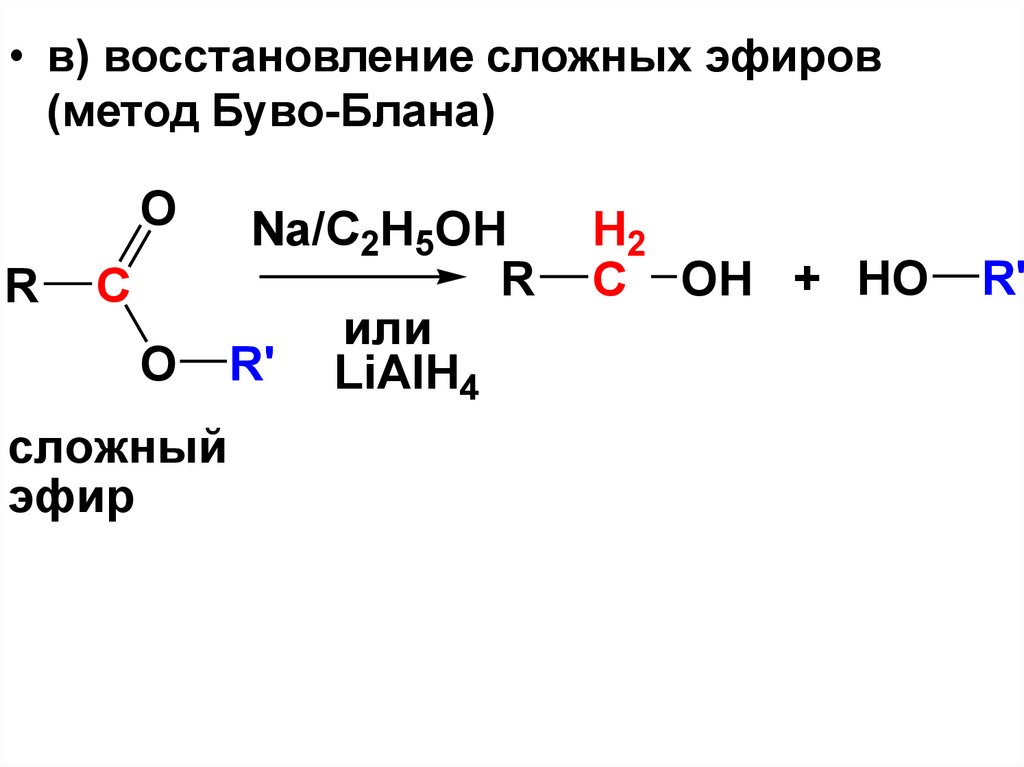
• в) восстановление сложных эфиров(метод Буво-Блана)
O
R
C
O
сложный
эфир
Na/C2H5OH
R
или
R' LiAlH4
H2
C OH + HO
R'
26.
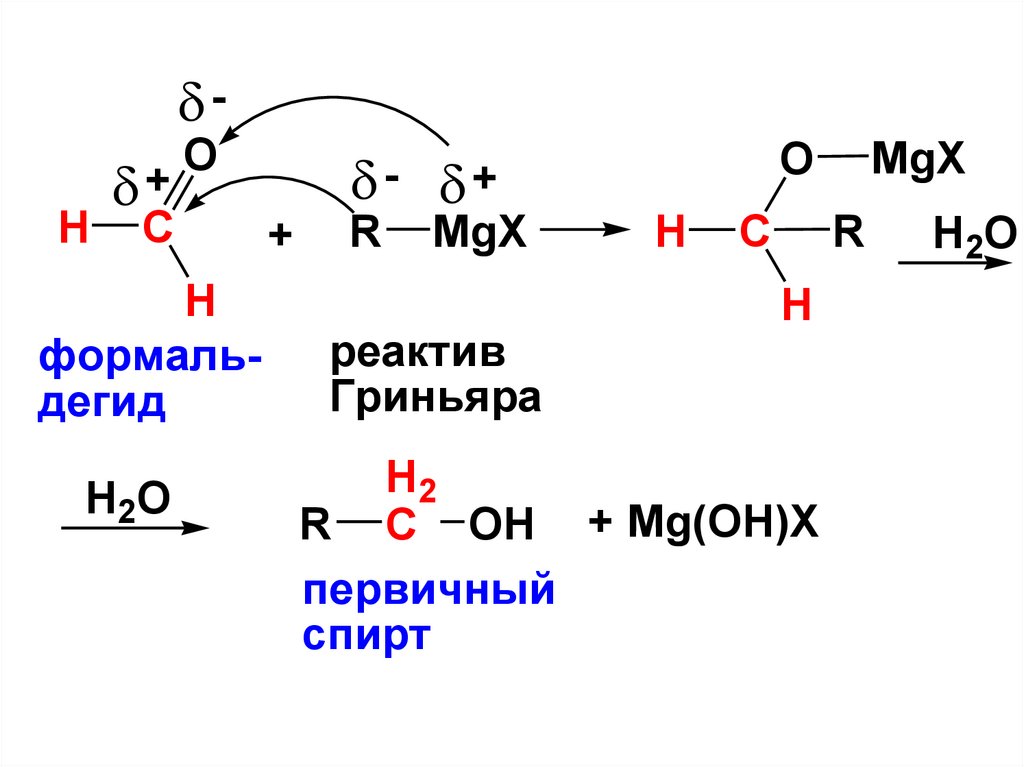
• 4. Получение спиртов изкарбонильных соединений с помощью
реактивов Гриньяра:
• а) получение первичных спиртов. Для
этого используется формальдегид
27.
H+
O
C
H
формальдегид
H2 O
+
- +
R MgX
реактив
Гриньяра
MgX
O
H
C
R
H
H2
R C OH + Mg(OH)X
первичный
спирт
H2 O
28.
Взаимодействие с эпоксидами приводит кобразованию перв. Спиртов, содержащих на
2 С-атома больше
OMgBr
СH2 CH2
O
R MgBr
H C CH2R
H
H2O
OH
CH2 CH2 R
первичный спирт
Mg(OH)Br
29.
• б) получение вторичных спиртов. Дляэтого используются альдегиды
R
+
O
C
H
альдегид
H2O
- +
R MgX
+
реактив
Гриньяра
R
H
C
OH
R
вторичный
спирт
MgX
O
R
C
R
H
+ Mg(OH)X
H2O
30.
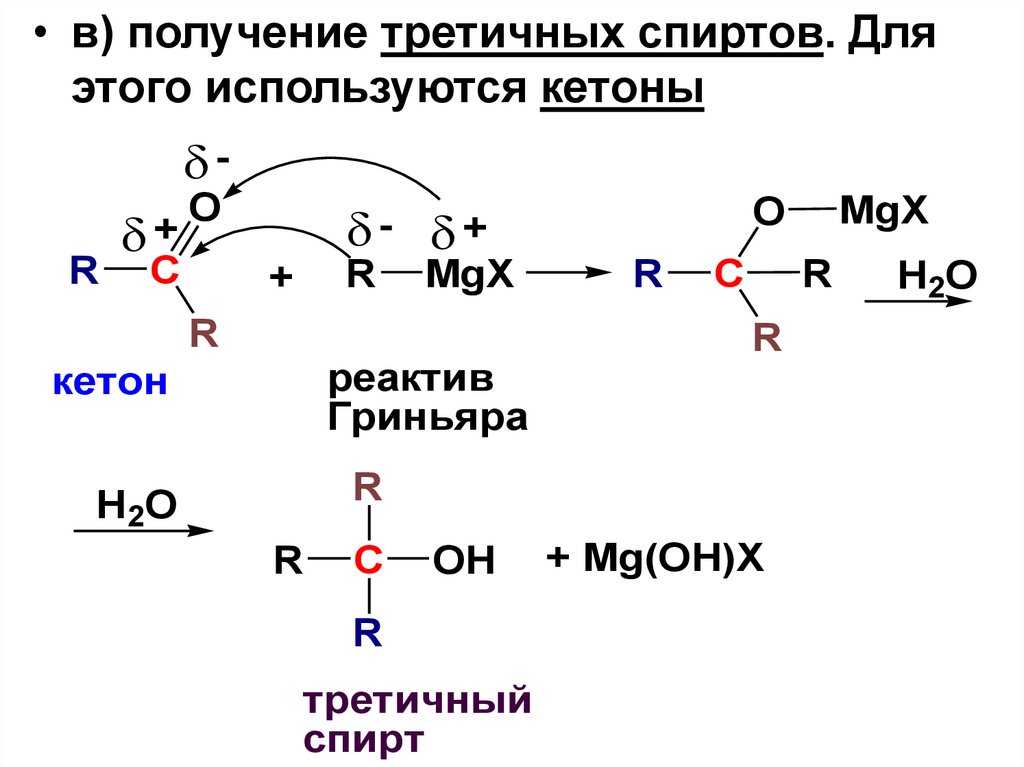
• в) получение третичных спиртов. Дляэтого используются кетоны
+
R C
O
- +
R MgX
+
R
реактив
Гриньяра
кетон
R
C
R
R
R
H2 O
R
C
OH
R
третичный
спирт
MgX
O
+ Mg(OH)X
H2O
31.
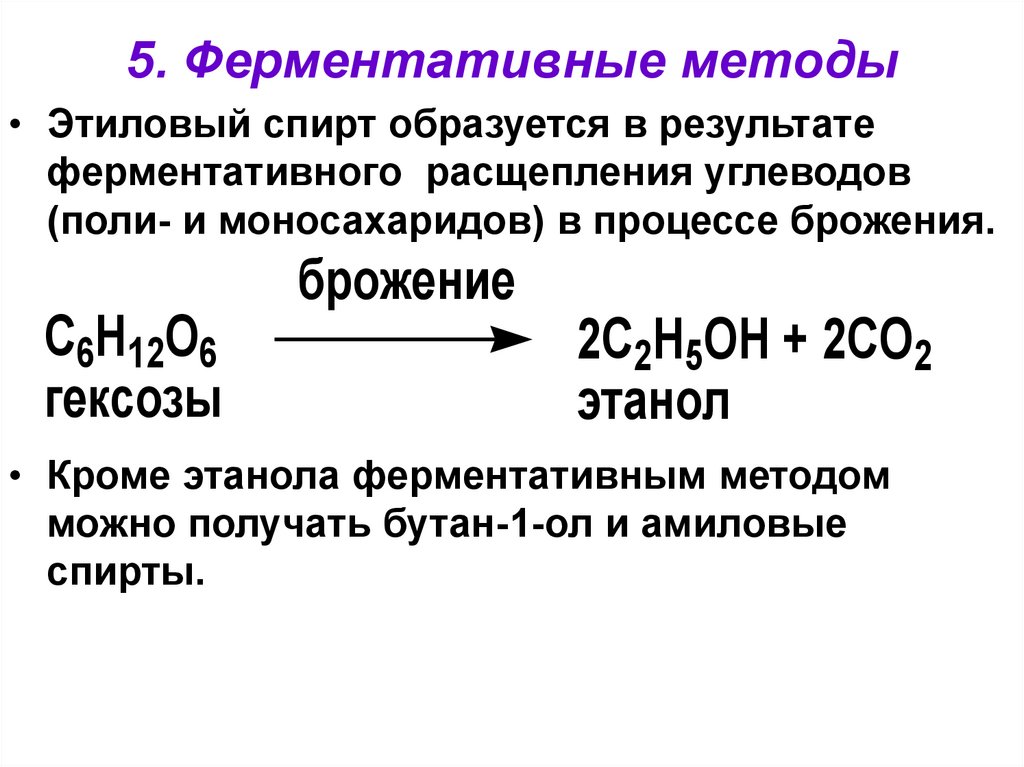
5. Ферментативные методы• Этиловый спирт образуется в результате
ферментативного расщепления углеводов
(поли- и моносахаридов) в процессе брожения.
брожение
C6H12O6
гексозы
2C2H5OH + 2CO2
этанол
• Кроме этанола ферментативным методом
можно получать бутан-1-ол и амиловые
спирты.
32.
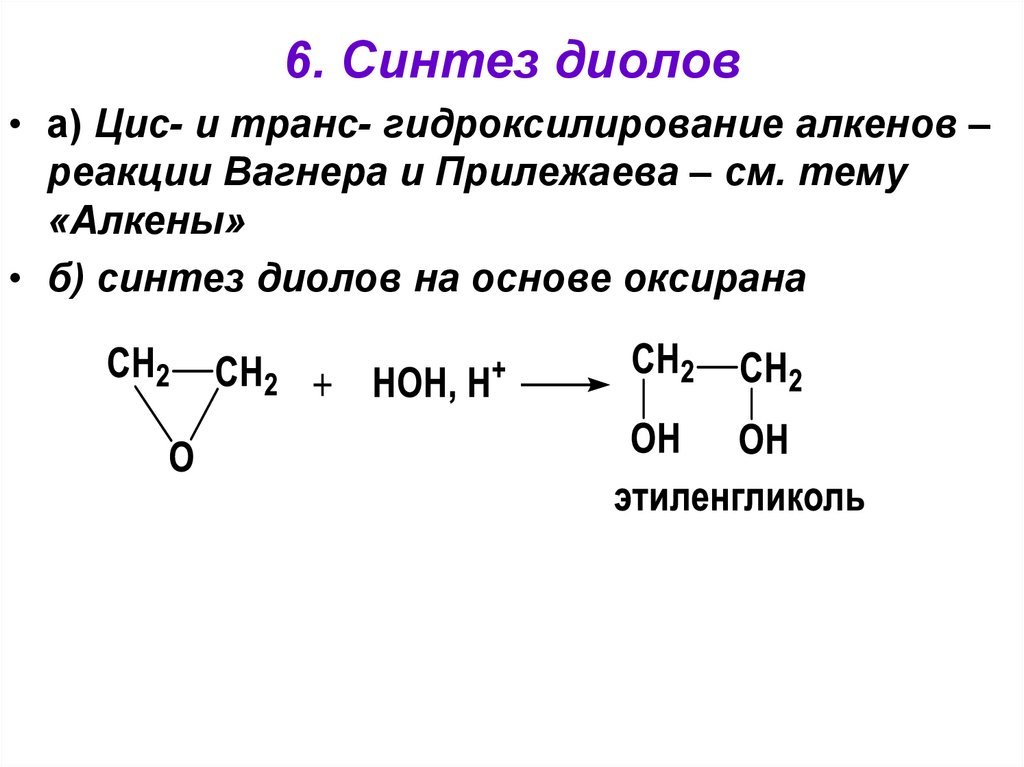
6. Синтез диолов• а) Цис- и транс- гидроксилирование алкенов –
реакции Вагнера и Прилежаева – см. тему
«Алкены»
• б) синтез диолов на основе оксирана
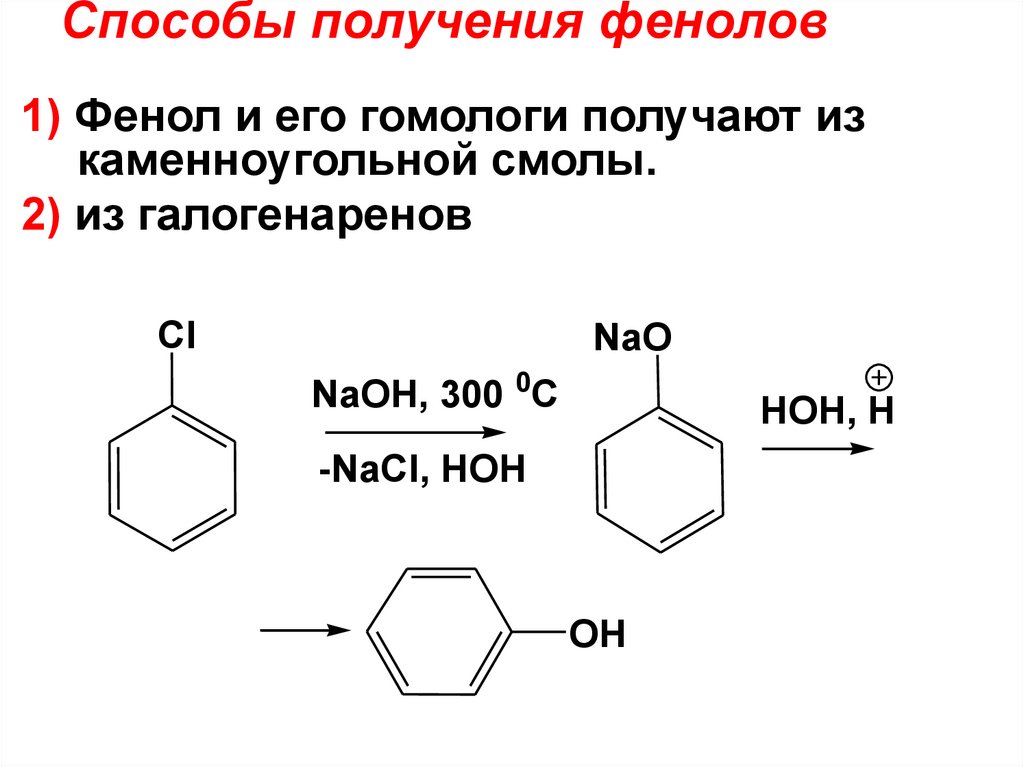
33. Способы получения фенолов
1) Фенол и его гомологи получают изкаменноугольной смолы.
2) из галогенаренов
Cl
NaO
NaOH, 300 0C
HOH, H
-NaCl, HOH
OH
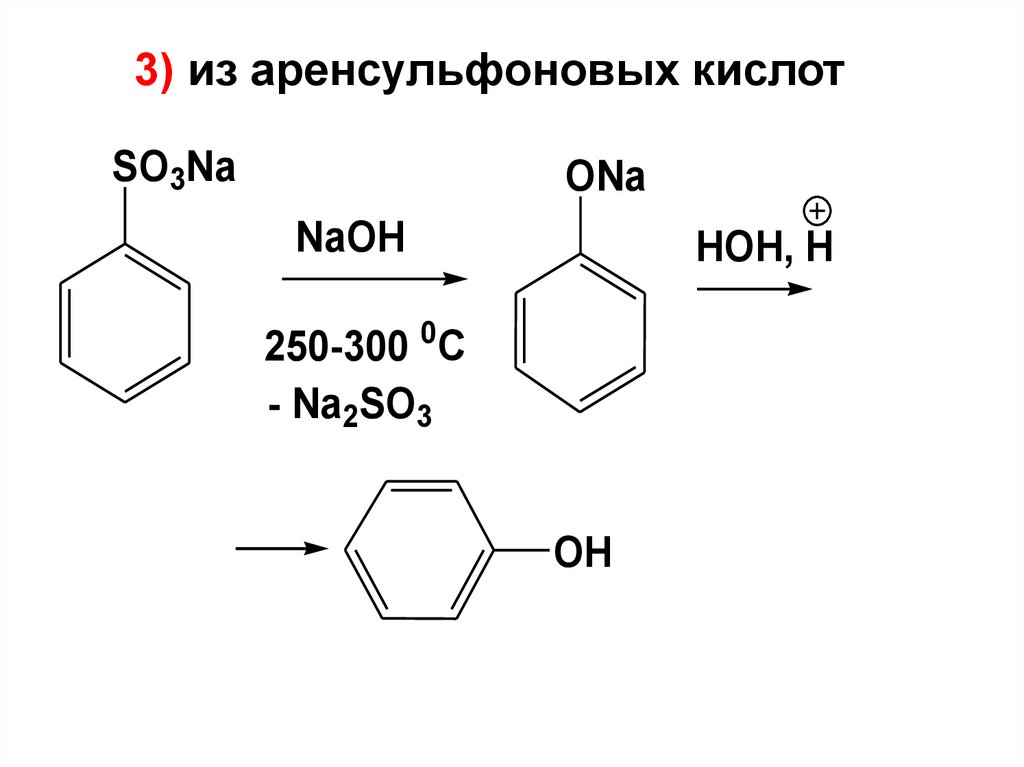
34.
3) из аренсульфоновых кислотSO3Na
ONa
NaOH
HOH, H
250-300 0C
- Na2SO3
OH
35.
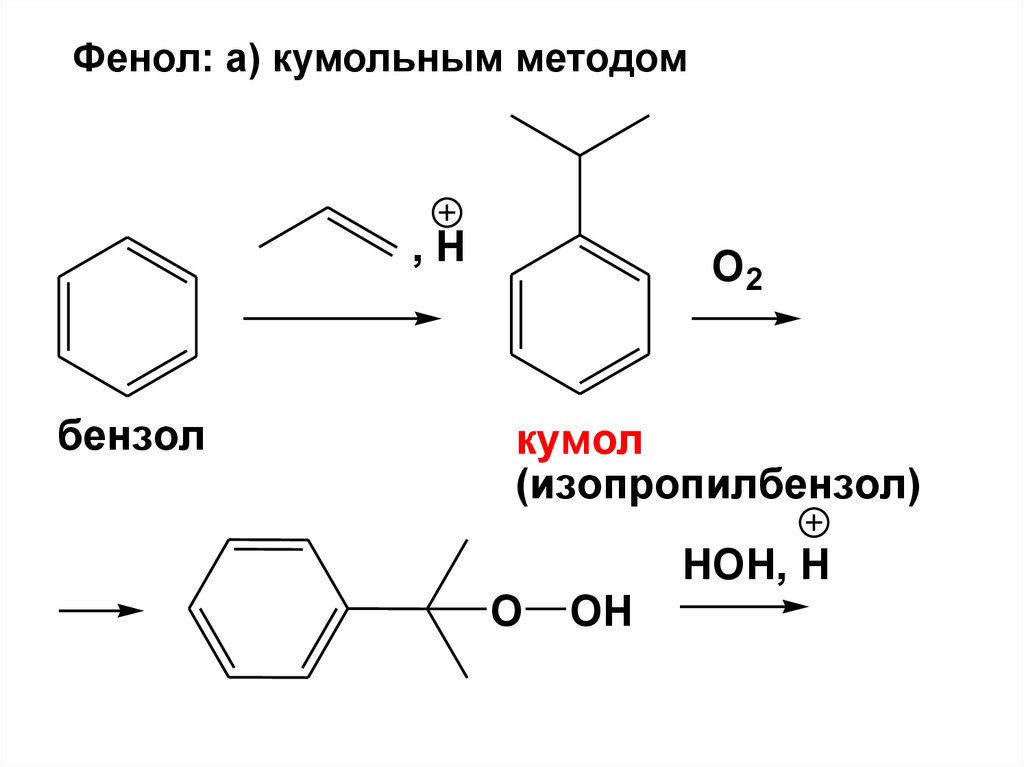
4) из солей диазония36.
Фенол: а) кумольным методом,H
бензол
O2
кумол
(изопропилбензол)
HOH, H
O
OH
37.
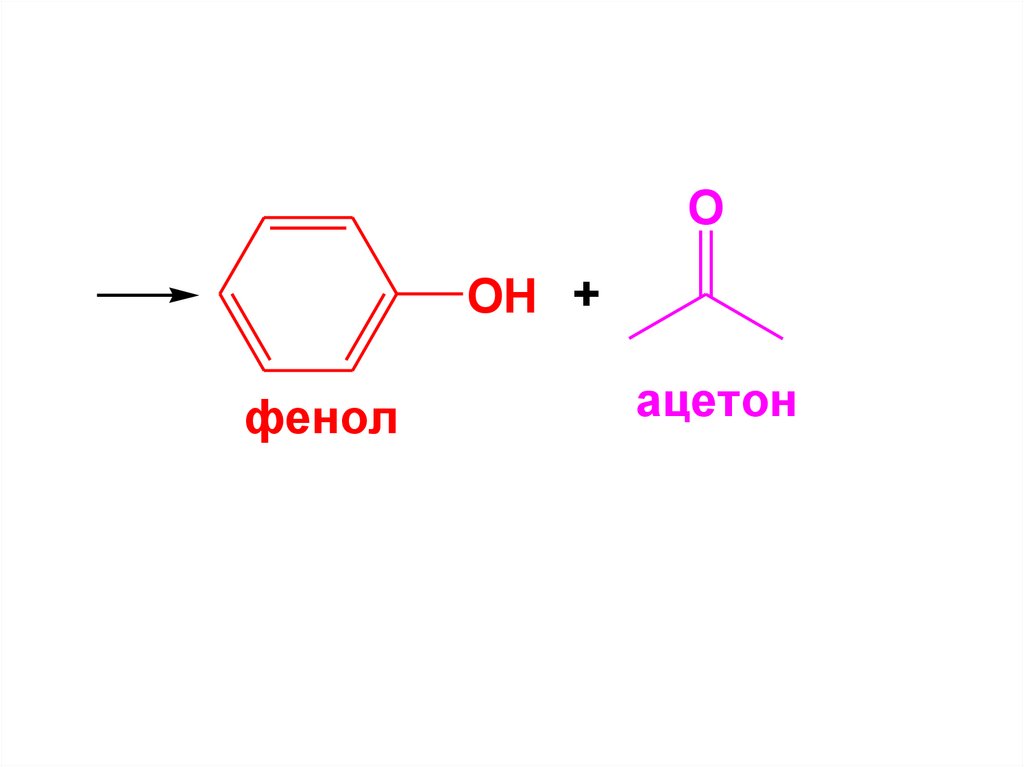
OOH +
фенол
ацетон
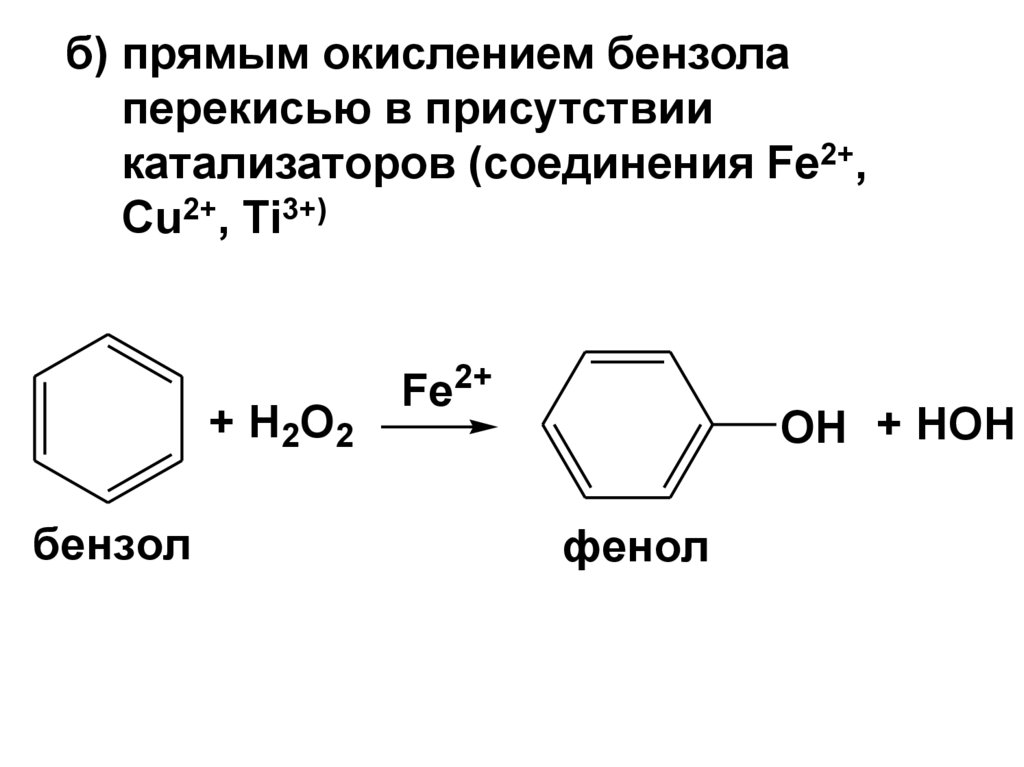
38.
б) прямым окислением бензолаперекисью в присутствии
катализаторов (соединения Fe2+,
Cu2+, Ti3+)
+ H2O2
бензол
Fe2+
OH + HOH
фенол
39. Строение и физические свойства спиртов
•Спирты представляют собой ж. или тв.в-ва со своеобразным запахом. Низшие
спирты имеют приятный запах, С4-С6 –
раздражающий, высшие – ароматный.
40.
• Длины связей и угол связиС–О–Н
4
4
,1
0
R
м
н
O
H
C
H2
0,09
7н
м
R
O
C
H
H2
0
106
41.
• В молекулах спиртов присутствуют двеполярные связи - О–Н и О–С
O
'
R
C
H2
H
42.
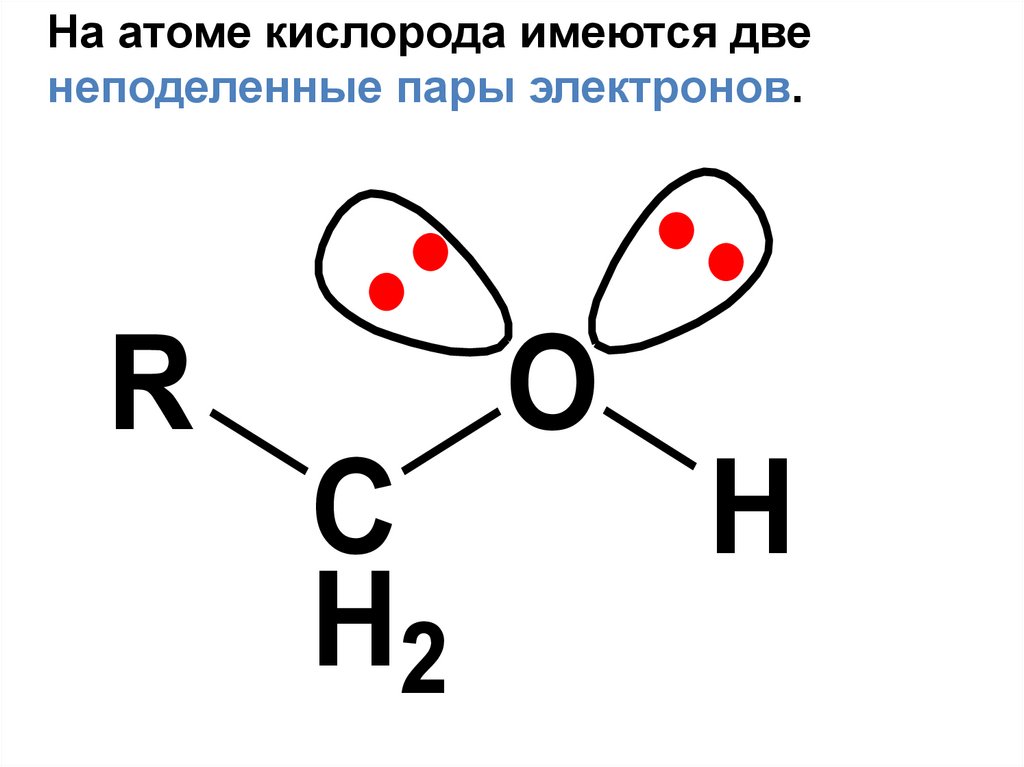
На атоме кислорода имеются двенеподеленные пары электронов.
O
R
C
H2
H
43.
• Ткип. спиртов сравнительно выше, чемТкип. соответствующих алканов или
галогенопроизводных алканов.
Соединени Ткип.
0С
е
CH4
CH3Cl
CH3CH3
-162
-24
-89
CH3CH2Cl
12
Спирт
CH3OH
Ткип.
0С
65
CH3CH2OH 78
44.
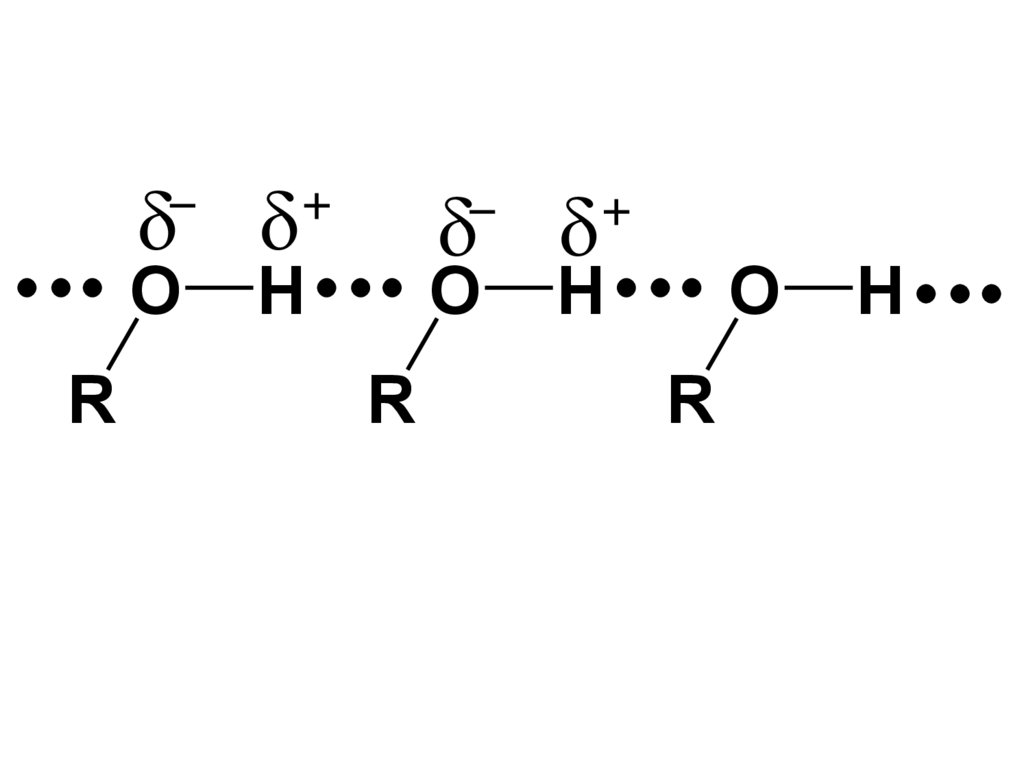
•Это связано со значительной ассоциацией молекул спиртов за счет образования межмолекулярных водородныхсвязей, которые возникают в результате
взаимодействия атома О одной молекулы
и атома Н другой. Эти атомы несут
частичные отрицательные и
положительные заряды вследствие чего
связь О–Н явл-ся сильно полярной. Так
полярность связи О–Н > полярности
связи О–С (1,5 D и 0,5 D соответственно)
•Энергия водородной связи спиртов
•25-26 кДж/моль.
45.
OR
H
O
R
H
O
R
H
46.
Строение и физическиесвойства фенолов
Фенолы, как правило тв. в-ва.
Сам фенол крист. бесц. в-во,
розовеющее на воздухе.
Фенолы имеют сильный запах.
Обладают дезинфицирующим
действием.
47.
Строение феноловОН-группа фенолов находится в
сопряжении с ароматическим циклом
O OH
H
-I < +M,
ЭД
48. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ И ФЕНОЛОВ
49.
• Определяются наличиемполярных связей О–Н, О–С и
неподеленных электронных пар
на О-атоме
- реакции по связи О–Н;
- реакции по связи О–С;
- реакции с участием
углеводородного радикала.
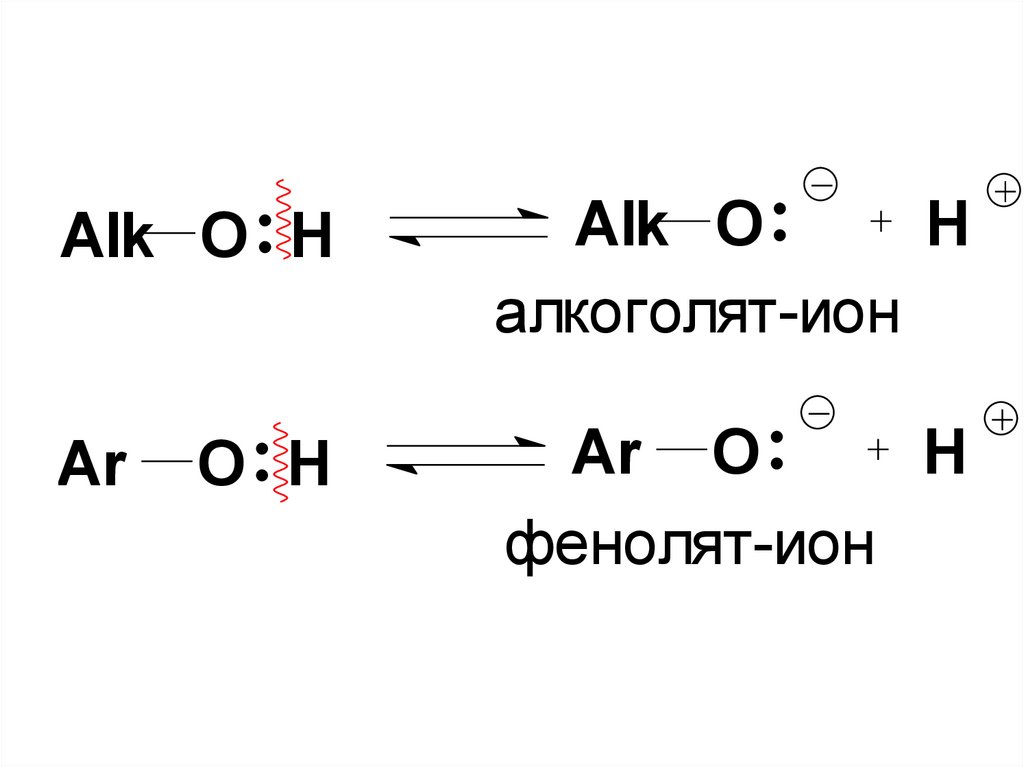
50. I. Кислотность и основность.
• а) Кислотные свойства –образование алкоголятов и
фенолятов.
• Очевидно, что ОН-содержащие в
соответствии с протолитической теорией
способны проявлять кислотные св-ва
вследствие высокой полярности связи
О–Н.
• Вспомним: кислоты – доноры протона.
51.
Alk O HAlk O
H
алкоголят-ион
Ar
Ar O
H
фенолят-ион
O H
52.
• Кислотные св-ва соединенияопределяются
• - полярностью связи ;
• - стабильностью аниона,
образующегося в результате отдачи
протона (в данном случае это
алкоголят-анион или фенолят-ион).
53.
• Поэтому природа углеводородногоостатка влияет на кислотные св-ва,
сила кислоты тем больше:
• чем выше полярность связи О–Н;
• чем ниже ЕD связи О–Н, т. е. чем
стабильнее анион, образующийся
при отдаче протона.
54.
• ЭА заместители в углеводородномрадикале увеличивают полярность
связи и способствуют стабилизации
аниона, благодаря чему кислотность
увеличивается (ЭА←О ←Н, ЭА←О− ).
• ЭД заместители напротив снижают
кислотность (ЭД→О →Н, ЭД → О−).
55.
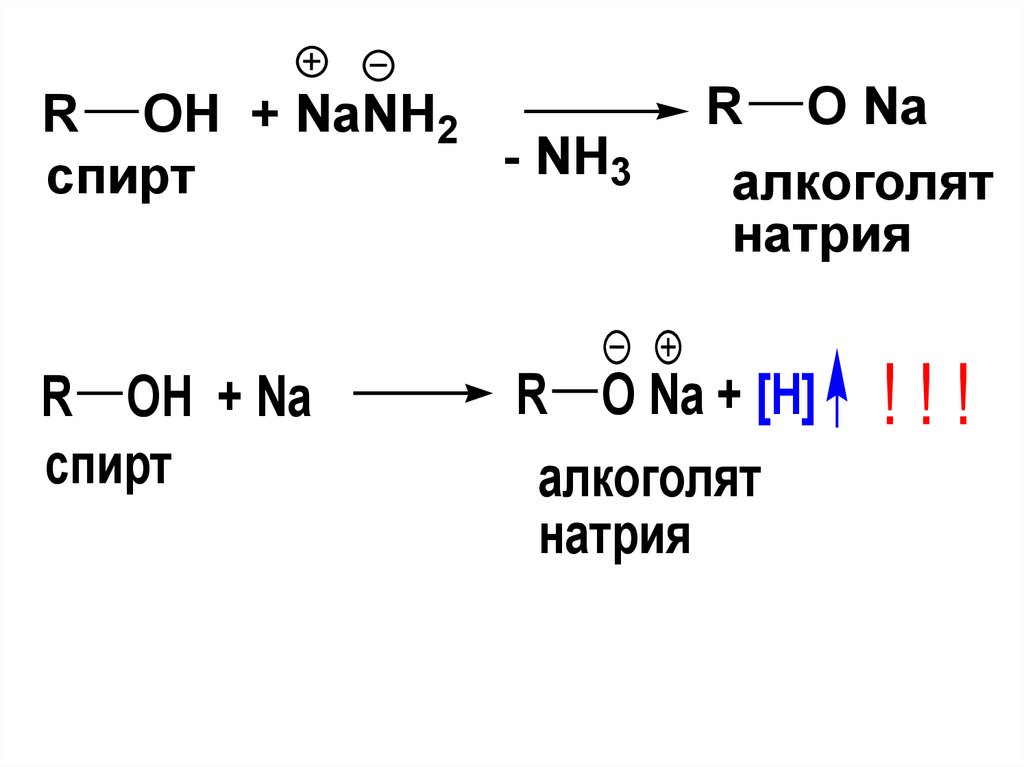
Поэтому спирты, в молекулах которых сОН-группой связан алкильный R,
обладающий +I –эффектом, явл-ся
слабыми кислотами, вступают в реакции
только с сильными основаниями и
щелочными металлами с образованием
солей, которые называются
АЛКОГОЛЯТЫ.
56.
R OH + NaNH2NH
3
спирт
R OH + Na
спирт
R O Na
алкоголят
натрия
R O Na + [H]
алкоголят
натрия
!!!
57.
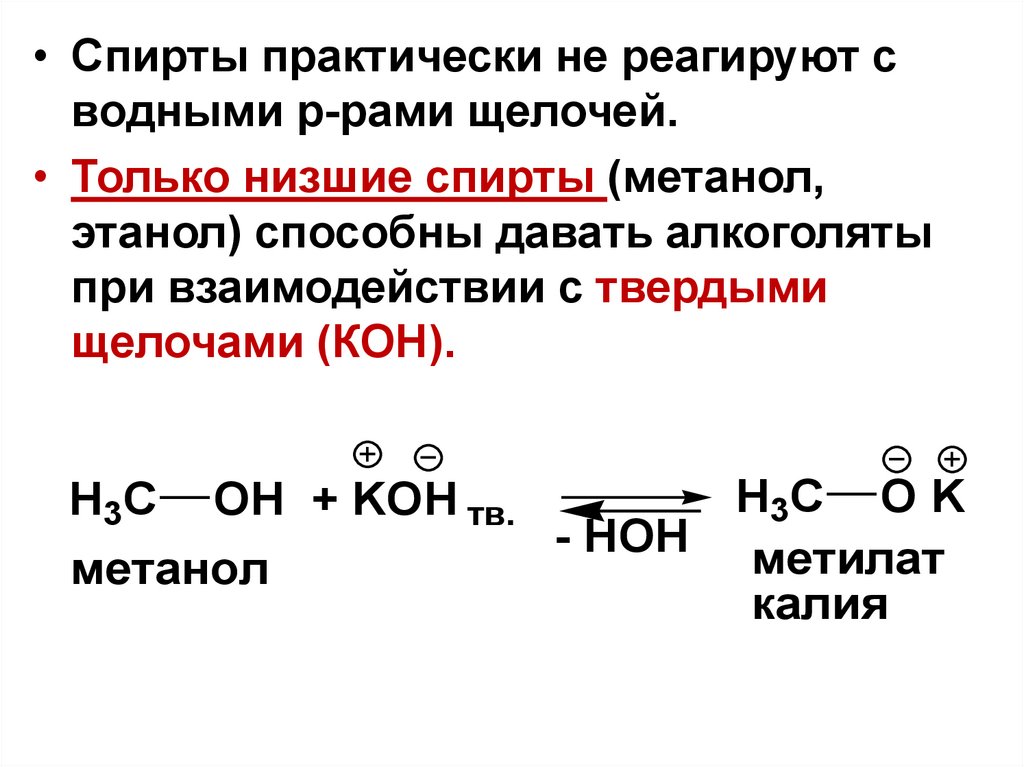
• Спирты практически не реагируют сводными р-рами щелочей.
• Только низшие спирты (метанол,
этанол) способны давать алкоголяты
при взаимодействии с твердыми
щелочами (КОН).
H3C
OH + KOH тв.
метанол
- HOH
H3C O K
метилат
калия
58.
• Спирты являются слабыми кислотами,а алкоголят-анионы
(R–О−) напротив представляют собой
очень сильные основания. (вспомним, напр.
их роль в конкуренции реакций нуклеофильного
замещения и элиминирования).
59.
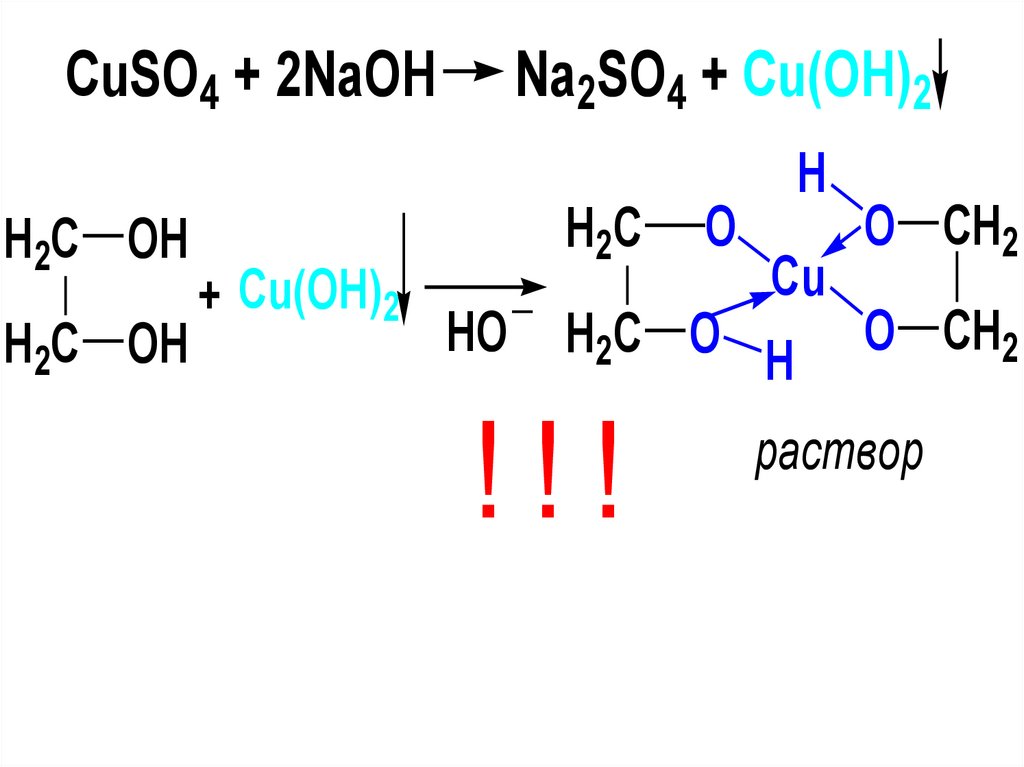
• Кислотность многоатомныхспиртов возрастает, особенно в
случае виц-расположения ОН-групп.
Поэтому 1,2-диолы (α-гликоли)
реагируют с гидроксидами тяжелых
металлов.
С гидроксидом меди в щелочной
среде они образуют растворимые в
воде комплексные соли, окрашенные
в синий цвет.
60.
CuSO4 + 2NaOHNa2SO4 + Cu(OH)2
H
H2C OH
H2C OH
+ Cu(OH)2
HO
_
H2C
O
Cu
H2C O H
!!!
O CH2
O CH2
раствор
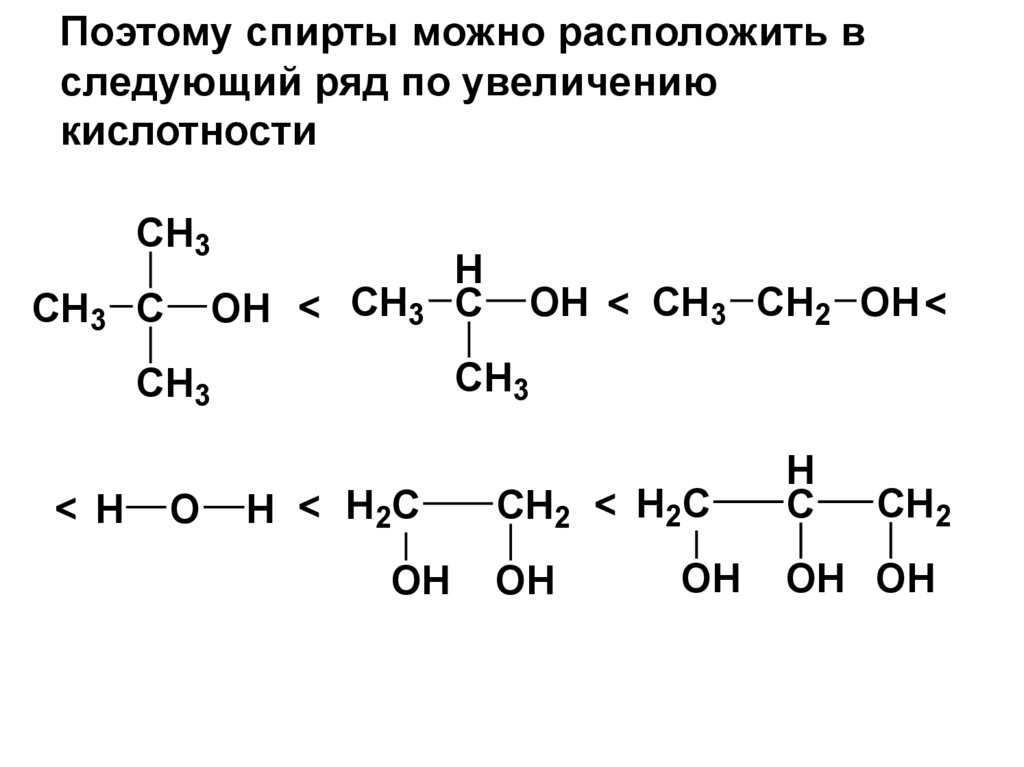
61. Поэтому спирты можно расположить в следующий ряд по увеличению кислотности
CH3OH < CH3
CH3 C
O
OH < CH3 CH2 OH <
CH3
CH3
< H
H
C
H < H2C
OH
CH2 < H2C
OH
OH
H
C
CH2
OH OH
62.
По сравнению со спиртамифенолы являются более
сильными кислотами т.к.
63.
- связь О-Н у фенолов более полярная(способствует сопряжение НЭП кислорода
с ароматическим циклом);
- фенолят-анион, образующийся в
результате отщепления протона от
молекулы фенола, явл-ся более
стабильным, чем алкоголят анион, т.к.
представляет собой сопряженный анион
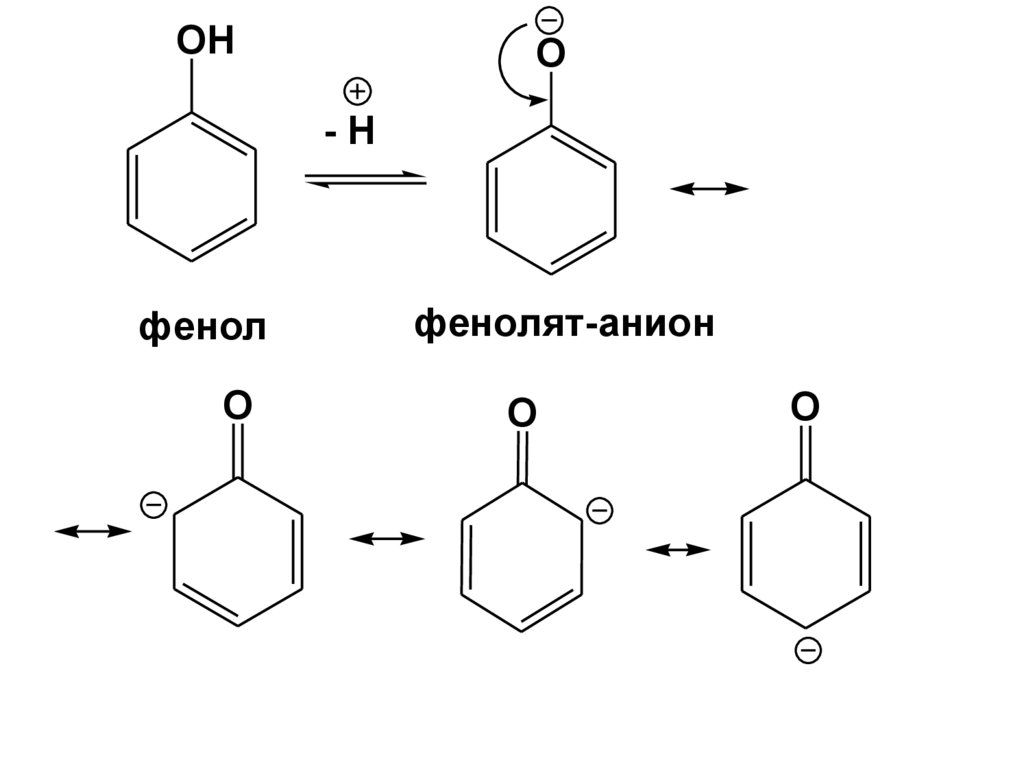
64.
OHO
-H
фенол
O
фенолят-анион
O
O
65.
Наличие ЭА заместителей вароматическом кольце фенолов
повышает их кислотность.
Если в ароматическом кольце
присутствует ЭД заместители то,
благодаря своим донорным
свойствам, они способствуют
снижению кислотности фенолов
66.
HO
H
H
O
O
ЭД
фенол
ЭА
67.
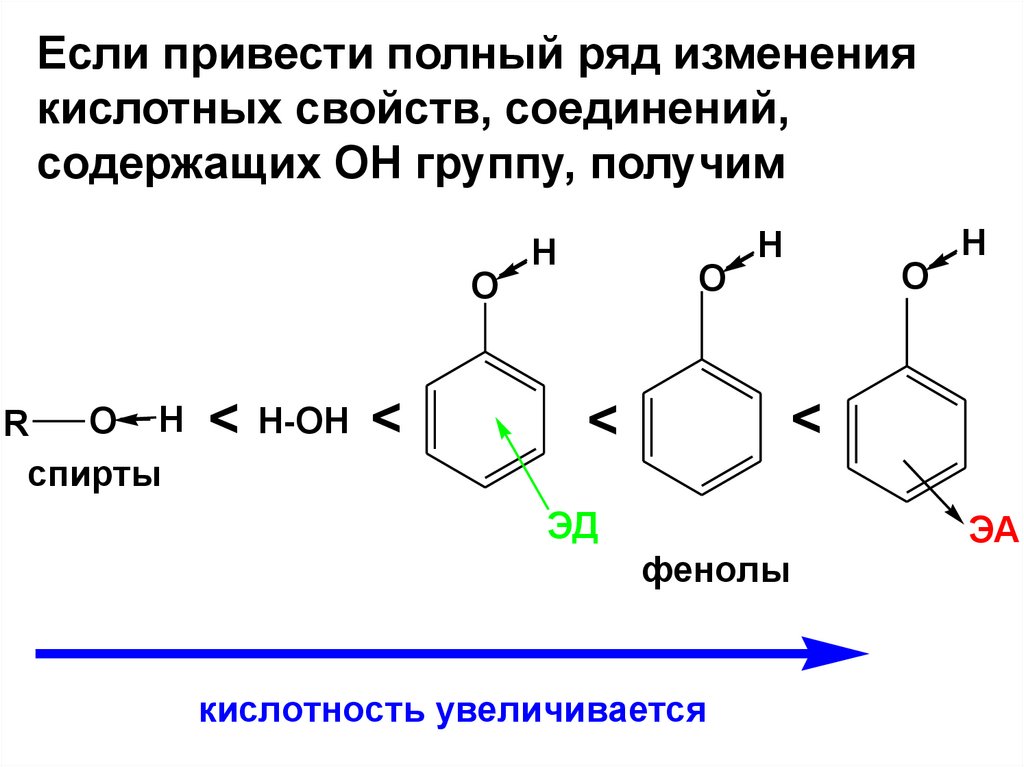
Если привести полный ряд изменениякислотных свойств, соединений,
содержащих ОН группу, получим
<
H-OH
<
O
O
O
O H
R
спирты
H
H
H
<
<
ЭД
фенолы
кислотность увеличивается
ЭА
68.
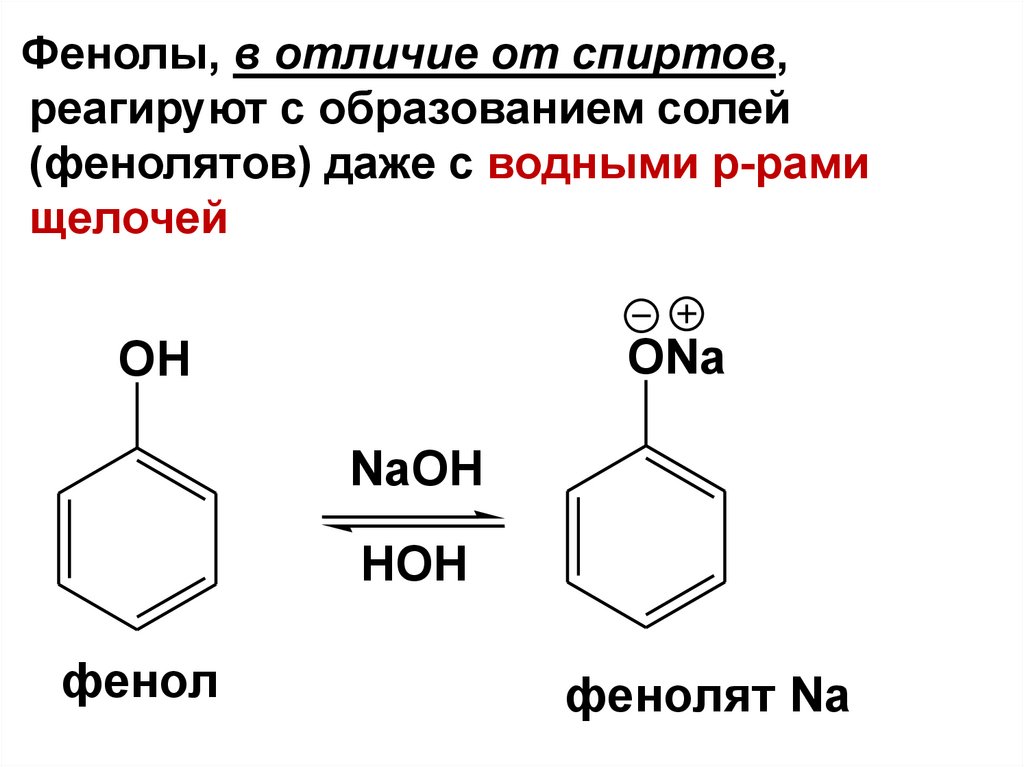
Фенолы, в отличие от спиртов,реагируют с образованием солей
(фенолятов) даже с водными р-рами
щелочей
ONa
OH
NaOH
HOH
фенол
фенолят Na
69.
Обладая кислотными свойствами фенолырастворяются в водных растворах
щелочей.
Эта реакция может быть использована
для разделения фенолов и спиртов.
Благодаря выраженным кислотным
свойствам фенолов и наличию в их
молекулах ароматических фрагментов,
фенолы образуют с солями Fe+3
окрашенные комплексные соединения
(качественная реакция на фенолы)
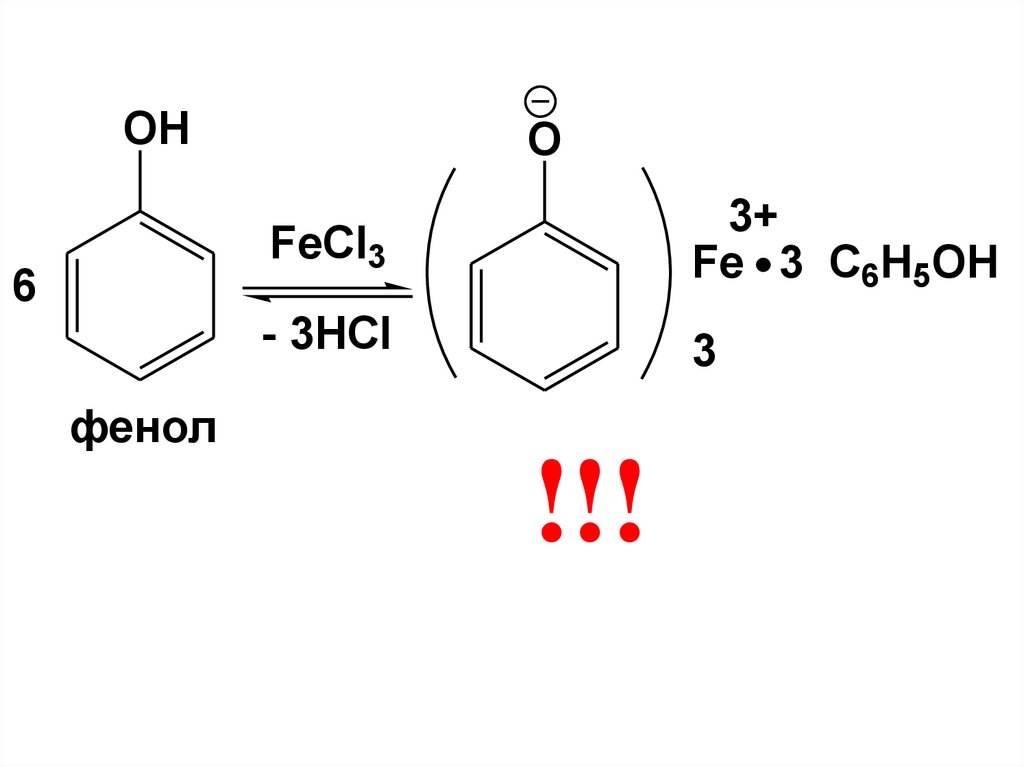
70.
OH6
O
FeCl3
3+
Fe 3 C6H5OH
- 3HCl
3
фенол
!!!
71.
б) Основные свойства спиртов –образование алкилоксониевых солей
Благодаря наличию на атоме кислорода,
неподеленных электронных пар, они
способны взаимодействовать с
протонными кислотами (присоединять
протон) и кислотами Льюиса.
Спирты достаточно слабые основания.
Основность возрастает от первичных к
третичным спиртам.
72.
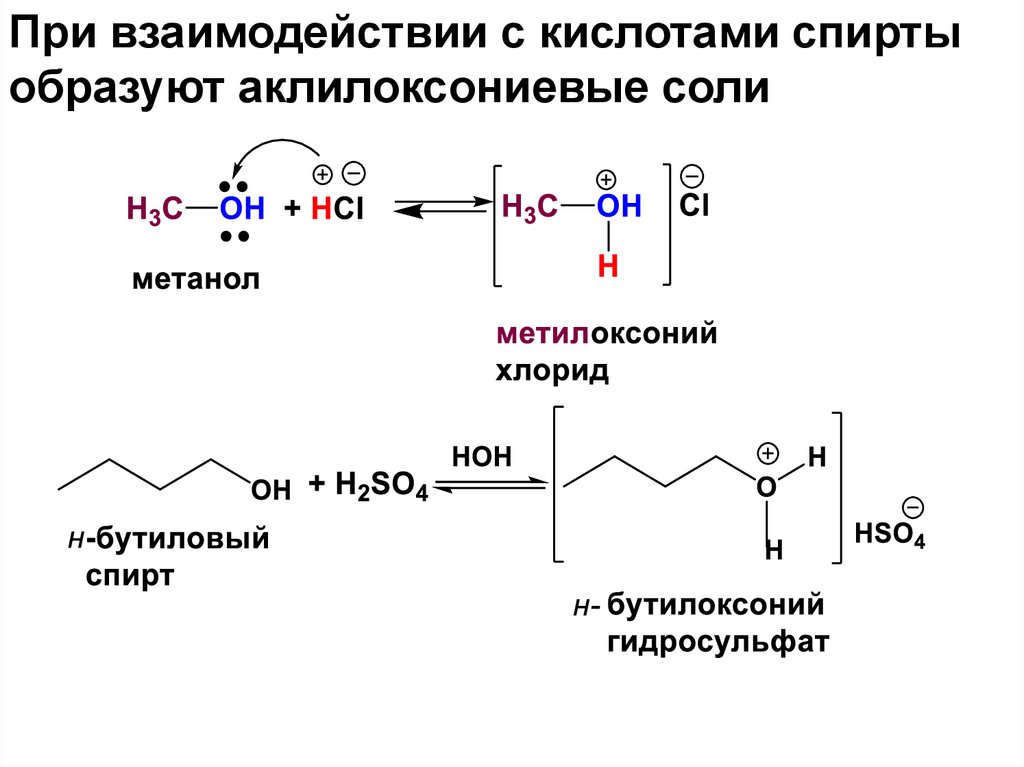
При взаимодействии с кислотами спиртыобразуют аклилоксониевые соли
73.
74.
Основность фенолов понижена из-запонижения электронной плотности
на О-атоме вследствие М-эффекта:
с кислотами оксониевых солей не
образуют.
75.
II.Спирты и фенолы, какнуклеофильные реагенты
• Благодаря наличию е-пары на О-атоме
ОН- производные явл-ся нуклеофилами.
Вследствие невысокой поляризуемости
е-облака нуклеофилы слабые (фенолы
более слабые, чем спирты). Алкоголяты и
феноляты, явл-ся более сильными
нуклеофилами и сильными основаниями.
76.
а) Алкилирование - образованиепростых эфиров (реакция
Вильямсона)
• Вследствие низкой нуклеофильности
непосредственное алкилирование спиртов
и фенолов обычно не производят.
Алкилируют как правило алкоголяты и
феноляты.
R O Na
нуклеофил
+
X R'
R O R'
+ NaX
простой эфир
субстрат
алкилирующее
средство
77.
Ряд алкилирующих средств:R-OSO2O-R > R-I > R-Br > R-Cl
78.
• Следует отметить, что простыедиалкиловые эфиры образуются также в
р-ции межмолекулярной дегидратации,
которая будет рассмотрена ниже.
• Фениловые эфиры не могут быть
получены р-ей межмолекулярной
дегидратации фенолов аналогично
спиртам, т.к. она не идет!.
79.
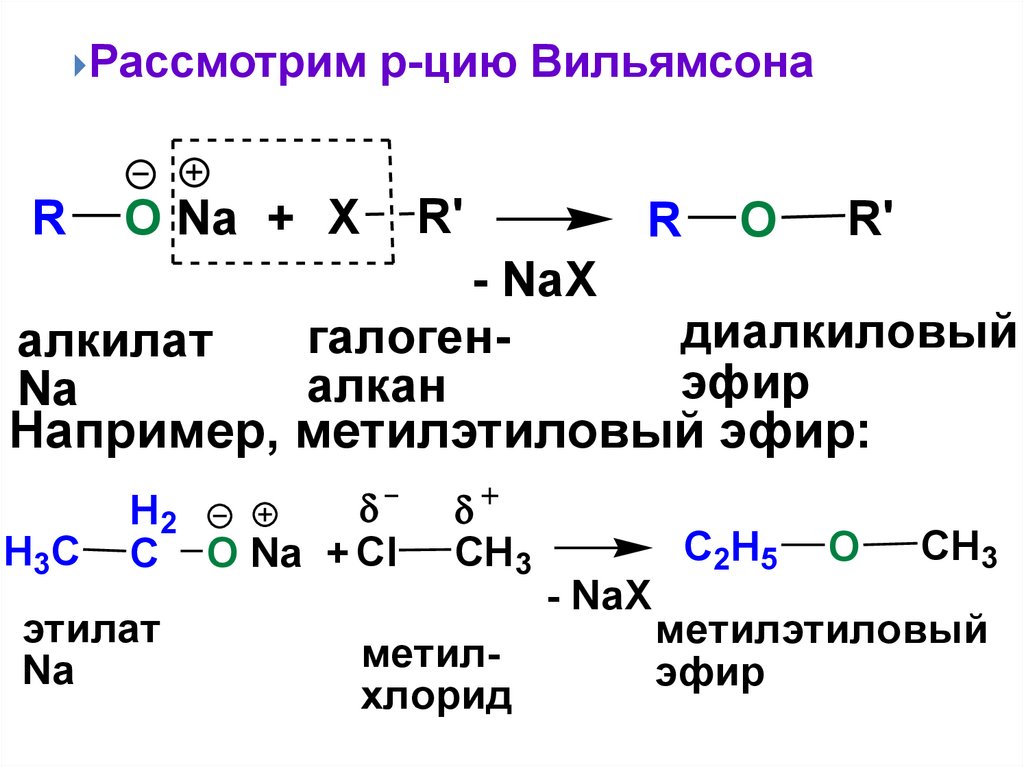
РассмотримR
р-цию Вильямсона
R'
O Na + X
алкилат
Na
R
- NaX
галогеналкан
O
R'
диалкиловый
эфир
Например, метилэтиловый эфир:
H3C
H2
C O Na + Cl
этилат
Na
CH3
метилхлорид
C2H5
- NaX
O
CH3
метилэтиловый
эфир
80.
• Очевидно, что данная реакция являетсятипичной реакцией нуклеофильного
замещения SN (SN2 или SN1).
• Поэтому необходимо учитывать, что
такие реакции всегда сопровождаются
реакциями элиминирования (отщепления
HX) и образования алкенов.
• В данном случае вероятность протекания
реакции элиминирования особенно
высока, т.к. алкоголят-анионы
(R–O-) – очень сильные основания.
81.
• Значит для получения простых эфировреакцией Вильямсона следует
правильно выбрать исходные
вещества (алкоголят и галогеналкан),
чтобы исключить или свести к
минимуму возможность получения
алкена.
• Для этого следует рассмотреть
строение простого эфира, который
необходимо синтезировать.
82.
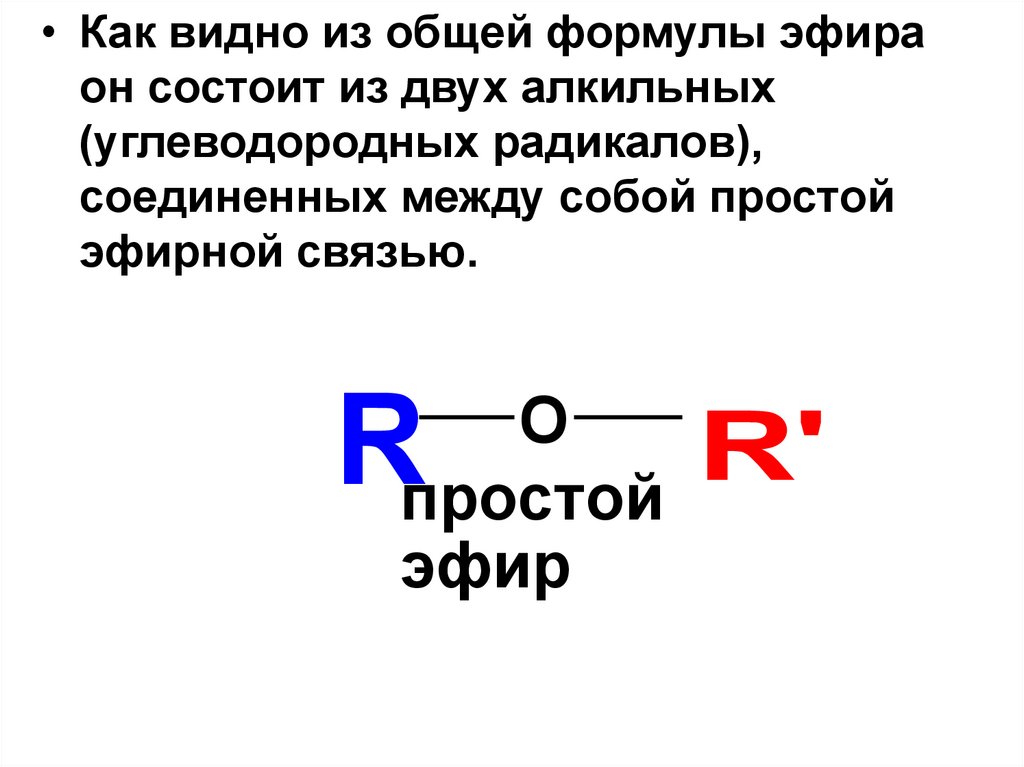
• Как видно из общей формулы эфираон состоит из двух алкильных
(углеводородных радикалов),
соединенных между собой простой
эфирной связью.
R
O
простой
эфир
R'
83.
• Соответственно, существуют два подходак выбору исходных веществ в реакции
Вильямсона
R X
галогеналкан
R
NaO R'
R O R'
алкилат - NaX
Na
диалкиловый
эфир
O Na + X
алкилат
Na
R'
R
O
R'
- NaX
галоген- диалкиловый
эфир
алкан
84.
• Чтобы минимизировать возможностьобразования алкена следует, по
возможности, использовать
в
реакции первичный
галогеналкан, который менее
склонен к реакциям элиминирования.
• Например:
85.
• Необходимо синтезироватьэтилтретбутиловый эфир по реакции
Вильямсона.
H3 C
H2
C O
CH3
CH
3
C
CH3
86.
•В данном случае следует мысленноразбить молекулу на две части так, чтобы
они представляли собой «прообразы»
исходных компонентов реакции в
соответствии с логикой, описанной выше
H3 C
H2
C O
CH3
CH
3
C
CH3
87.
• Тогда уравнение реакции полученияданного эфира
88.
Получение простых фениловыхэфиров
Алкилирование фенолятов щелочных
металлов галогенопроизводными
углеводородов (реакция SN)
Алкилирование фенолов
диметилсульфатом в шелочной среде
(реакция SN)
89.
ONaR
X +
O
R
-NaX
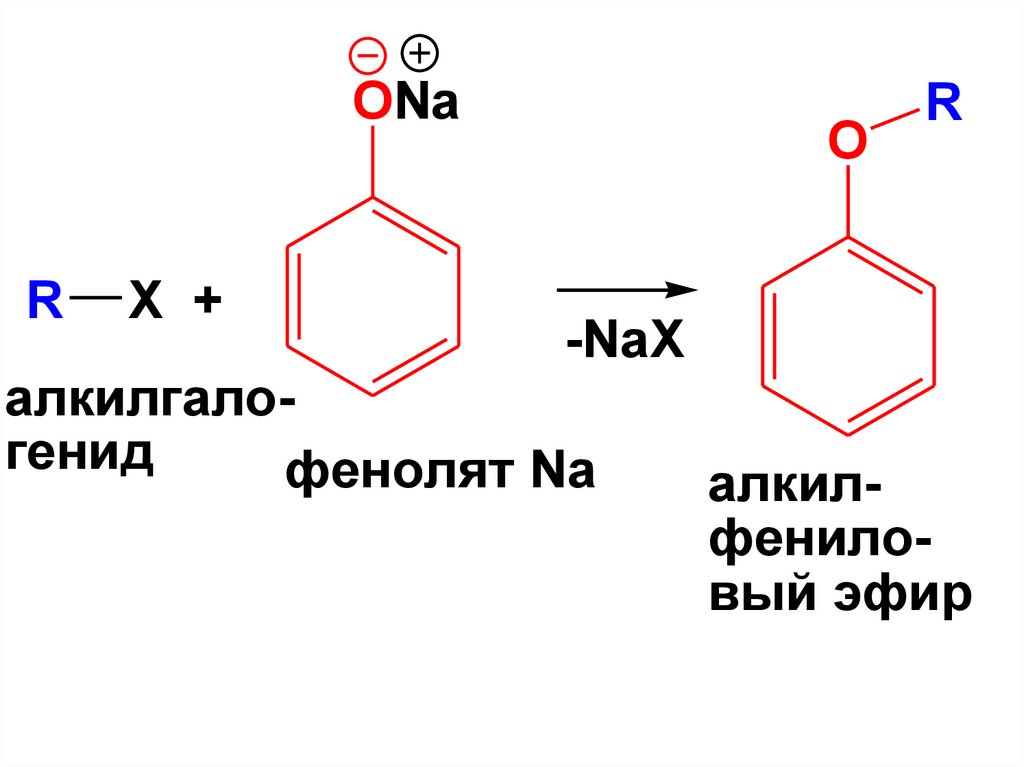
алкилгалогенид
фенолят Na
алкилфениловый эфир
90.
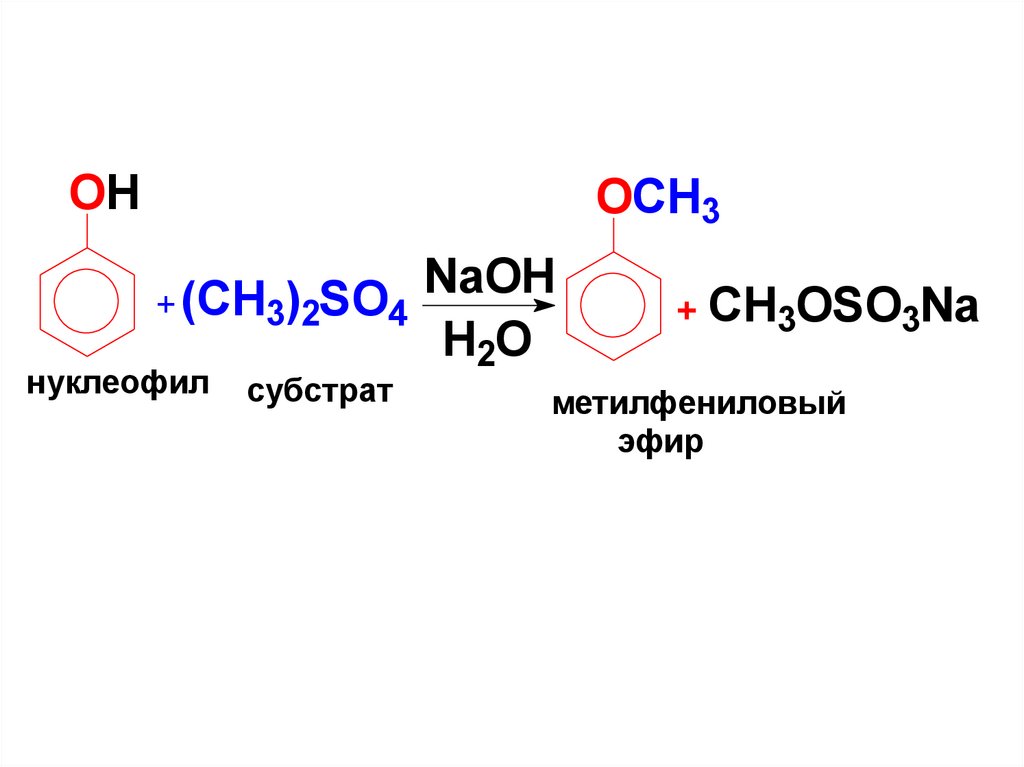
OHOCH3
NaOH
+ (CH3)2SO4
H2O
нуклеофил
субстрат
+ CH3OSO3Na
метилфениловый
эфир
91.
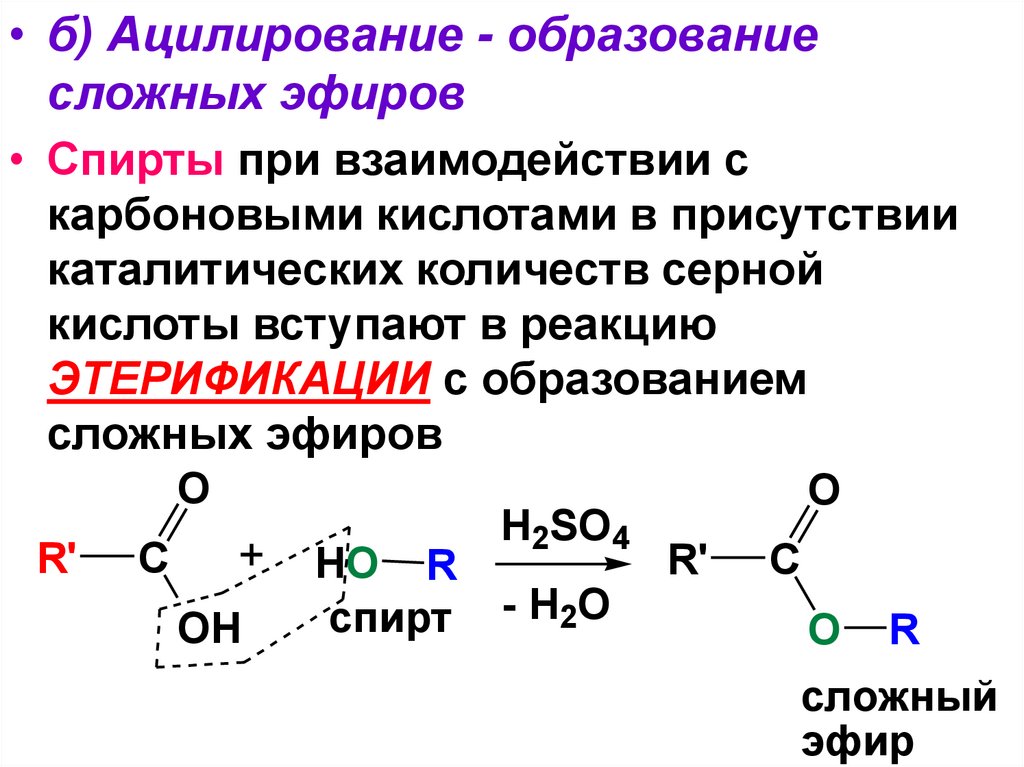
• б) Ацилирование - образованиесложных эфиров
• Спирты при взаимодействии с
карбоновыми кислотами в присутствии
каталитических количеств серной
кислоты вступают в реакцию
ЭТЕРИФИКАЦИИ с образованием
сложных эфиров
O
R'
C
+
OH
HO R
спирт
H2SO4
- H2O
O
R'
C
O
R
сложный
эфир
92.
• Для получения сложных эфировможно использовать реакцию
ацилирования спиртов или
алкоголятов щелочных металлов
ангидридами или
галогенангидридами карбоновых
кислот
93.
Фенолы – слабые нуклеофилы,не вступают в реакцию
этерификации!
Сложные эфиры фенолов
получают взаимодействием
ацилирующих агентов (ангидридов и
галогенангидридов карбоновых кислот) с
фенолами в щелочной среде (или с
фенолятами щелочных металлов).
94.
ONaO
O
R
R
C
X
-NaX
C
O
галогенангидрид фенолят Na фениловый эфир
карбоновой
кислоты
кислоты
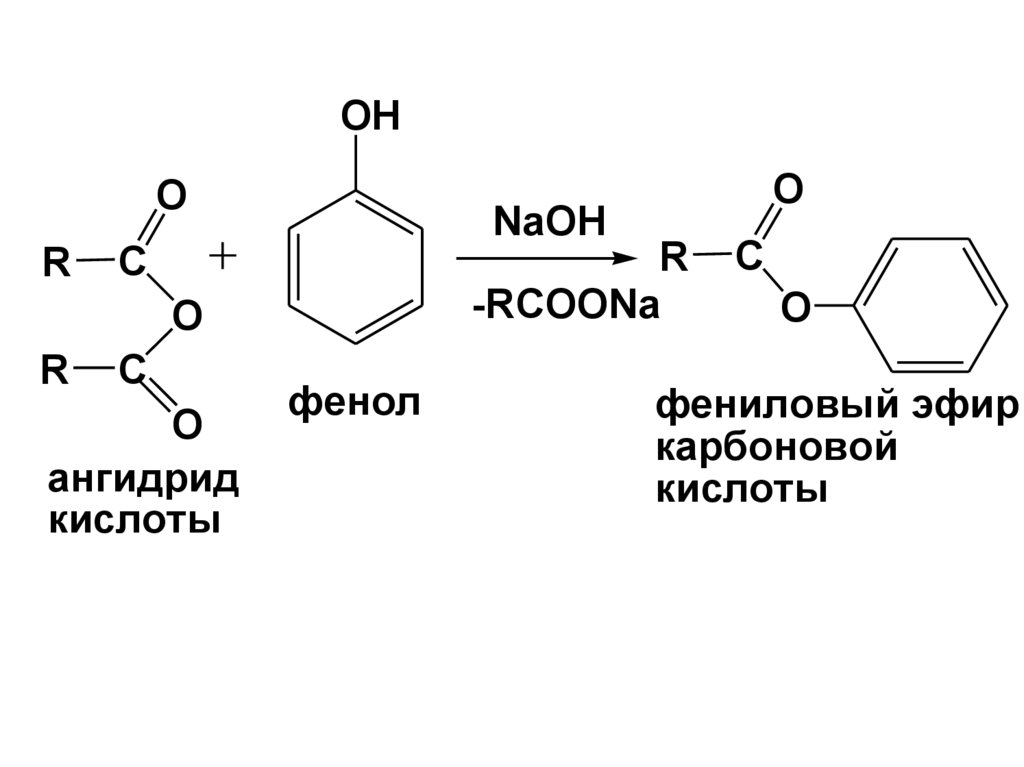
95.
OHO
R
NaOH
R
-RCOONa
C
O
R
C
O
ангидрид
кислоты
O
фенол
C
O
фениловый эфир
карбоновой
кислоты
96.
III. Реакции, протекающие с разрывомсвязи С–О (отщепление ОН-группы)
В результате этих реакций образуются
производные алканов или алкены.
• а) Нуклеофильное замещение ОН-группы на
галоген.
• Взаимодействие спиртов с
галогенводородными кислотами
(Взаимодействие спиртов с
галогеноводородными кислотами при
нагревании ведет к получению
галогеналкилов (R-X)
97.
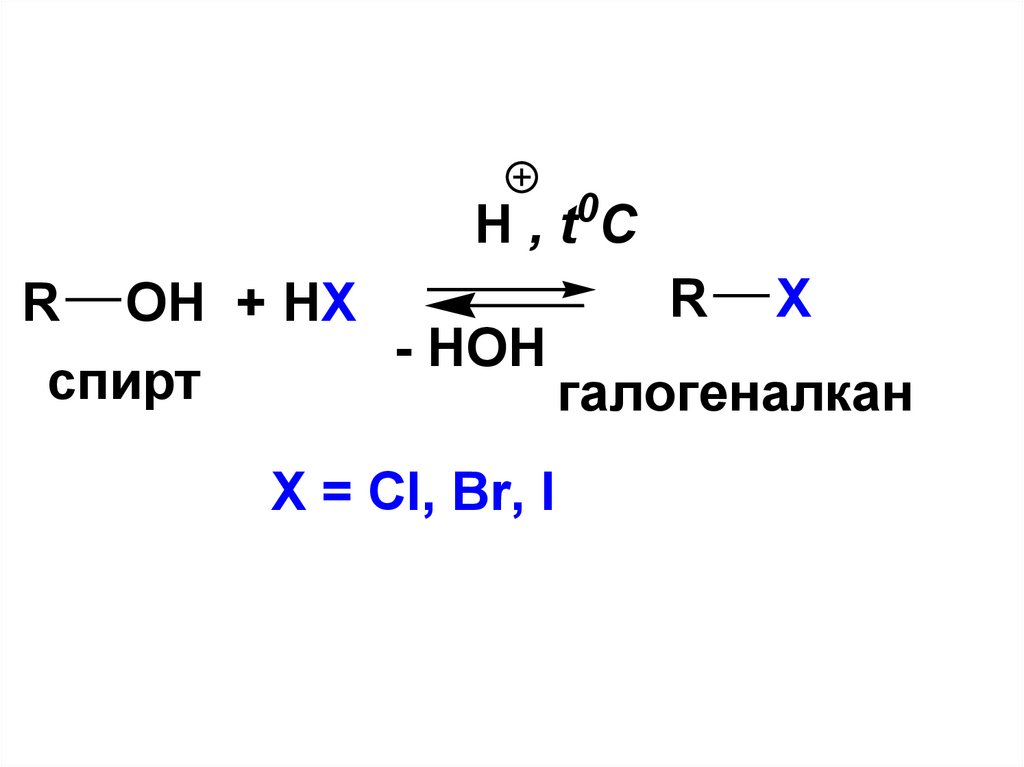
H , t0CR Х
R OH + HХ
- HOH
спирт
галогеналкан
Х = Cl, Br, I
98.
Гидроксид-анион (ОН-) является оченьэнергетически невыгодной уходящей
группой. Р-ция в отсутствие кислоты (Н+)
практически не идет.
Роль кислоты (донора Н+) заключается в
том, что происходит протонирование ОНгруппы и образование новой
энергетически выгодной уходящей
группы – бедной энергией молекулы
воды.
99.
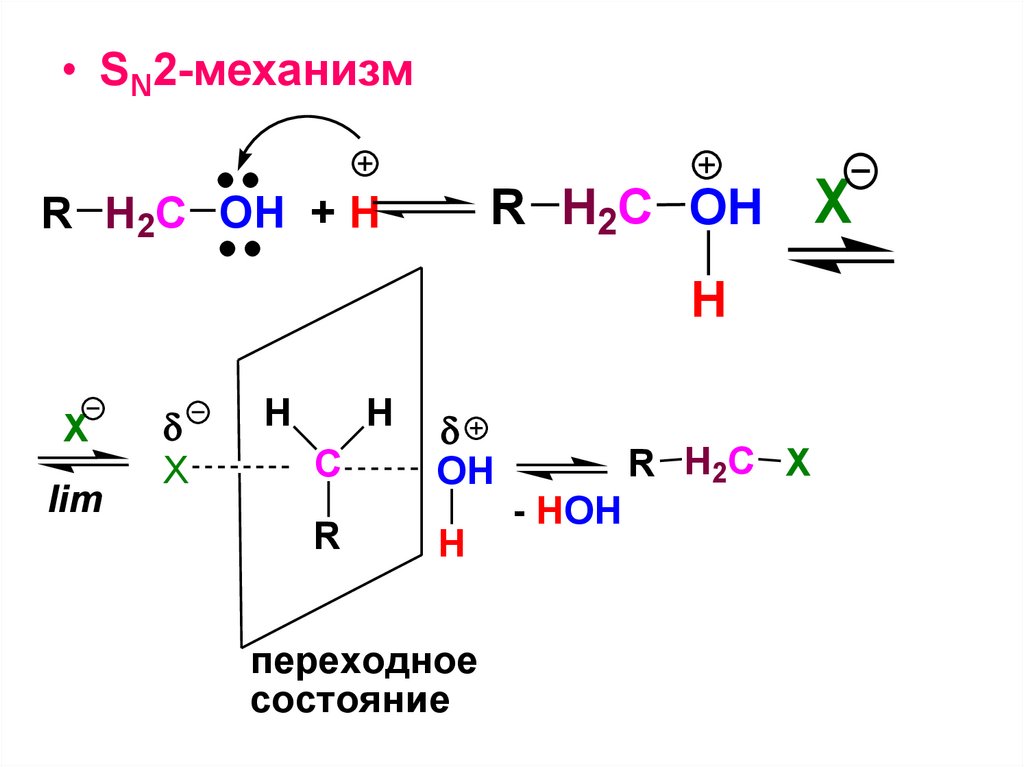
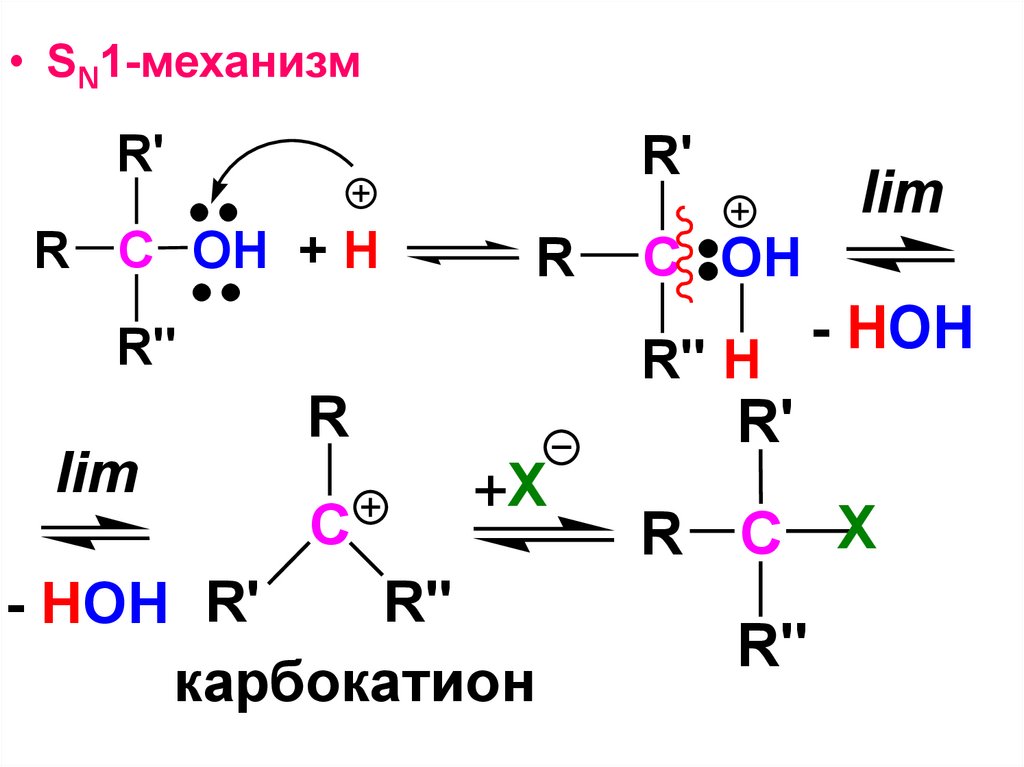
Дальнейшее превращение являетсянуклеофильным замещением протонированной
OH- гр., протекающее
либо по SN1 либо по SN2 механизму.
SN1
R
Х
Х
R
OH + H
спирт
R
OH
H
- HOH
SN2
протонированная
R
форма спирта алкилоксоний катион
Х
100.
Mеханизм р-ции определяется впервую очередь cтроением
углеводородного радикала
Для первичных спиртов
реализуется SN2 механизм, для
третичных - SN1.
Для вторичных, аллильных и
бензильных - SN1 или SN2
(протонный или апротонный
растворитель)
101.
• SN2-механизмR H2C OH
R H2C OH + H
H
Х
lim
X
H
H
C
R
OH
H
переходное
состояние
R H2C X
- HOH
Х
102.
• SN1-механизмR'
R'
R C OH + H
R
R''
R
lim
C
+Х
R''
- HOH R'
карбокатион
lim
C OH
HOH
R'' H
R'
R C X
R''
103.
В качестве источника НХ часто используют солиNaX в присутствии сильной минеральной к-ты
(серной)
NaBr + H2SO4
NaHSO4 + HBr
Образование галогеналкилов можно
осуществлять при взаимодействии спиртов с
галогенангидридами неорганических кислот
(PBr3, PBr5, PCl3, PCl5, SOCl2).
Особенный интерес представляет р-ция с
SOCl2
104.
ROH + PX3
R OH + PX5
R OH + SOCl2
R X + H3PO3
R X + POX3 + HCl
R Cl + HCl + SO2
105.
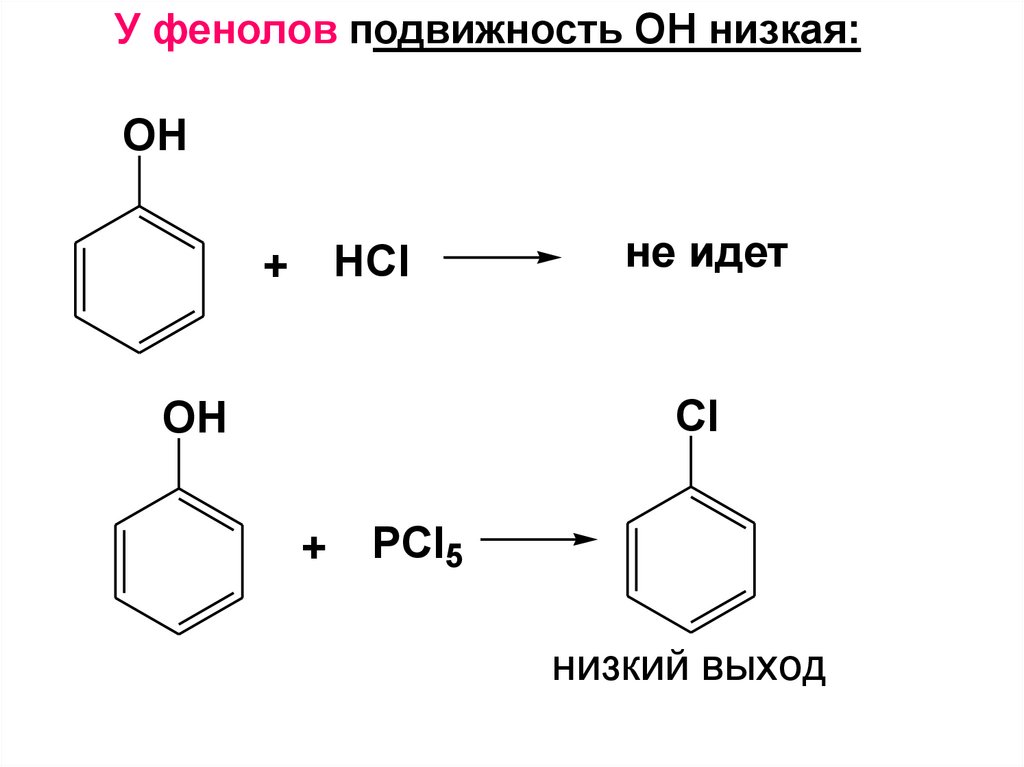
У фенолов подвижность ОН низкая:OH
HCl
+
не идет
Cl
OH
+
РCl5
низкий выход
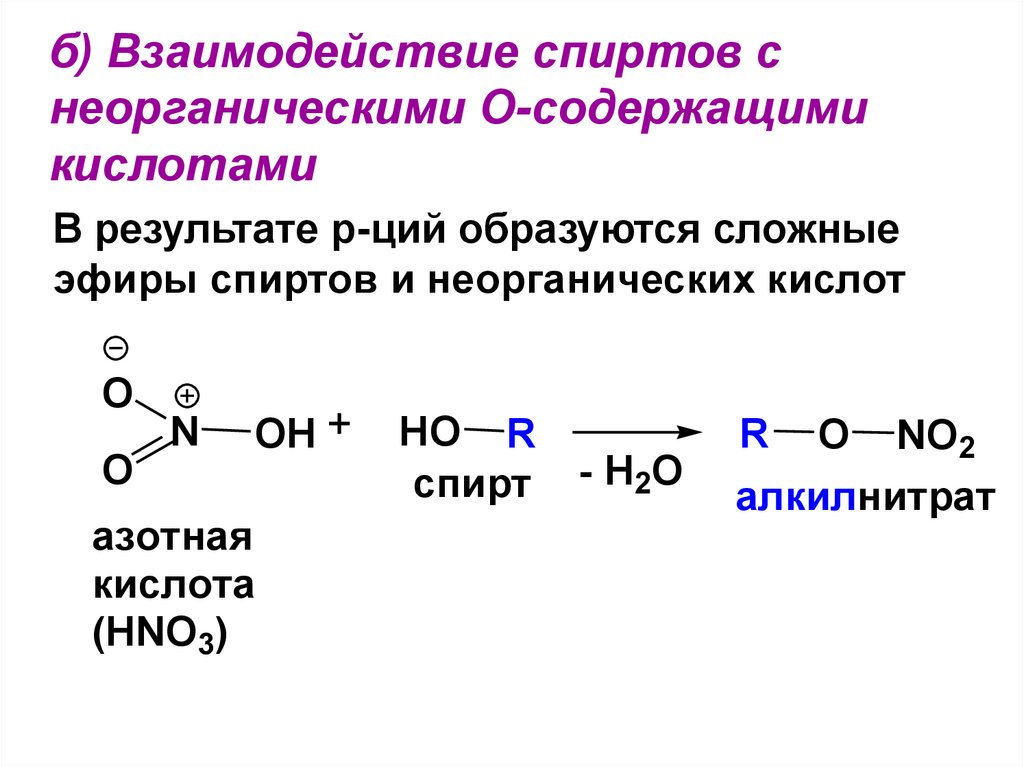
106. б) Взаимодействие спиртов с неорганическими О-содержащими кислотами
В результате р-ций образуются сложныеэфиры спиртов и неорганических кислот
O
N
O
OH +
азотная
кислота
(HNO3)
HO R
спирт
- H2O
R
O
NO2
алкилнитрат
107.
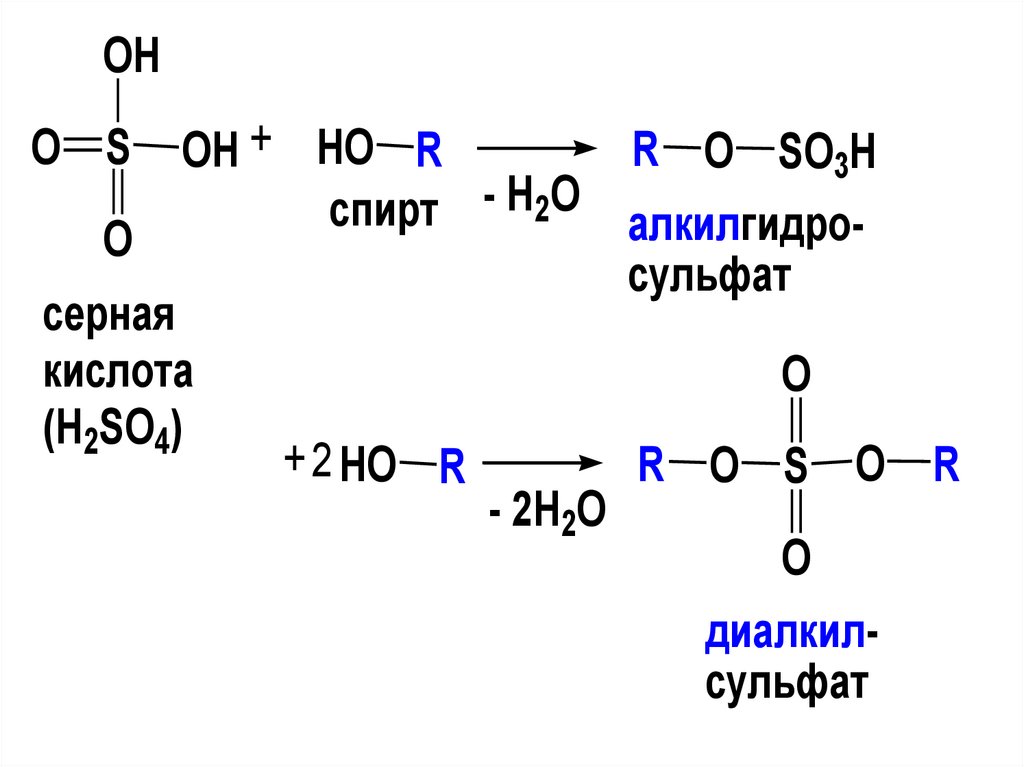
OHO S
O
R O SO3H
OH + HO R
спирт - H2O алкилгидросульфат
серная
кислота
(H2SO4)
O
+ 2 HO R
- 2H2O
R O S O R
O
диалкилсульфат
108.
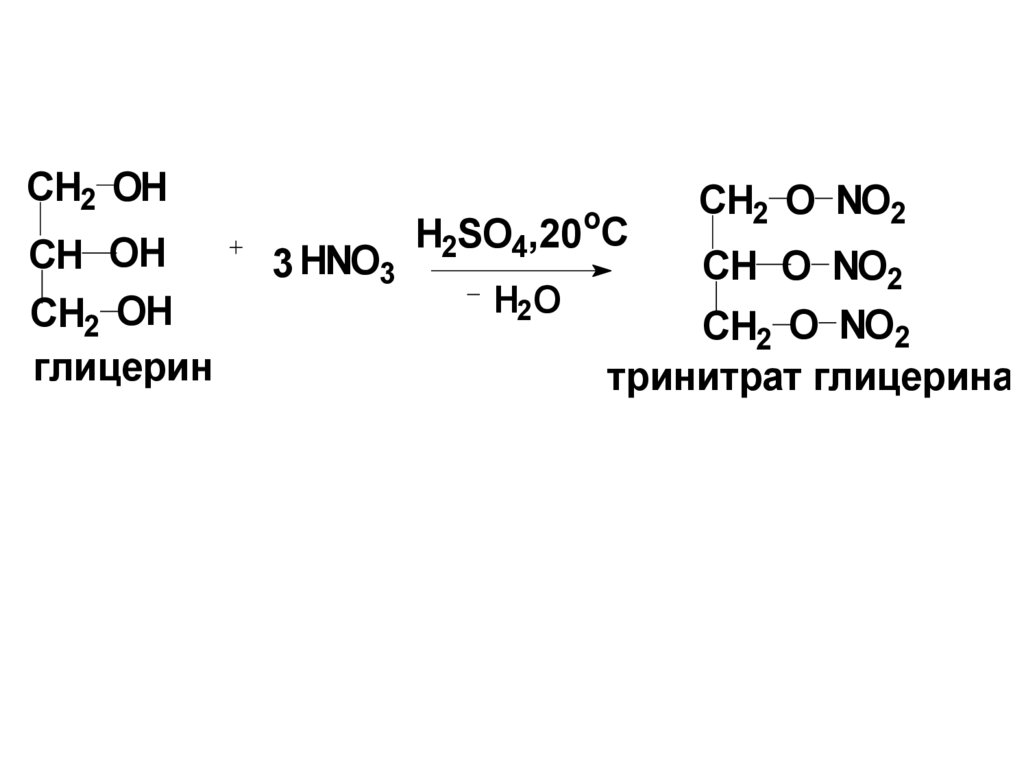
CH2 OHCH OH
CH2 OH
глицерин
o
3 HNO3
H2SO4,20 C
H2 O
CH2 O NO2
CH O NO2
CH2 O NO2
тринитрат глицерина
109.
в) Межмолекулярная дегидратацияспиртов – образование простых
эфиров
Внутримолекулярная дегидратация
спиртов – способ получения алкенов
(у фенолов этих р-ций нет)
110.
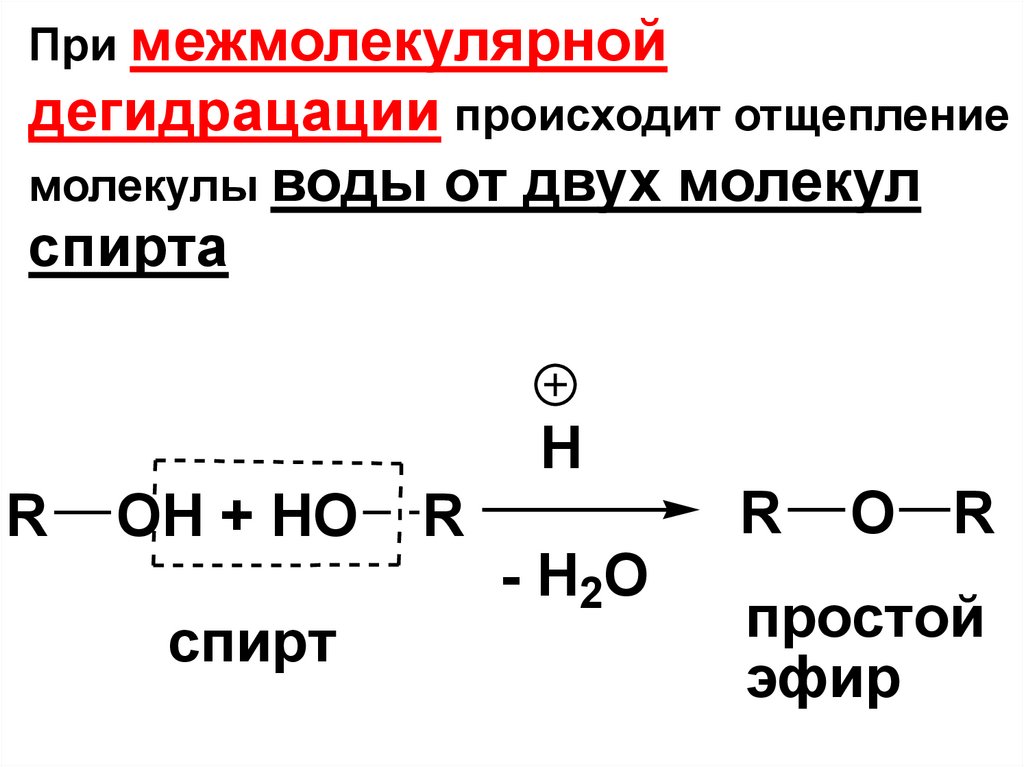
При межмолекулярнойдегидрацации происходит отщепление
молекулы воды от двух молекул
спирта
H
R
OH + HO
спирт
R
R
- H2O
O R
простой
эфир
111.
Для р-ции требуется кислотный катализ(обычно H2SO4) и сравнительно
невысокие т-ры (~130oC)
Лучше всего реакция идет для первичных
спиртов
(по SN2-механизму)
Вторичные и третичные (по SN1), при
этом высока доля р-ции
элиминирования (внутримолекулярной
дегидратации), выход простого эфира
низкий,в основном получаются алкены.
112.
Механизм реакции – нуклеофильноезамещение протонированной
ОН-группы (1 молекула – субстрат,
другая – нуклеофил)
Активация первичного спирта (субстрата)
осуществляется за счет быстрого
образования алкилгидросульфата,
который затем реагирует со второй
молекулой спирта (нуклеофилом) по SN2механизму.
113.
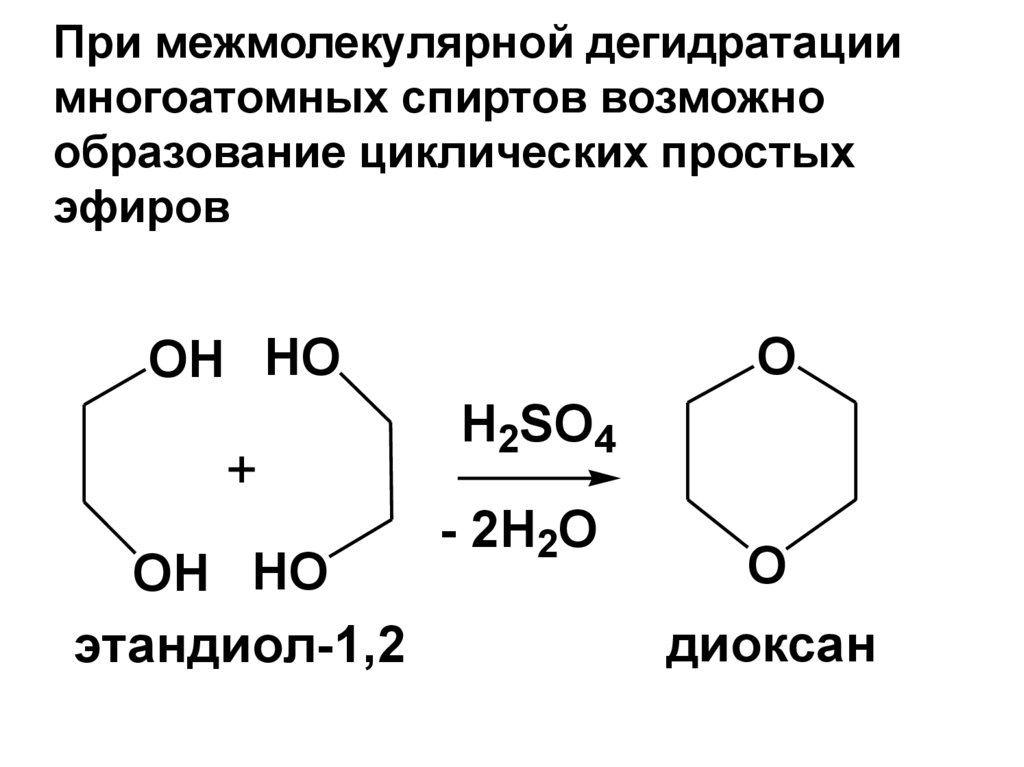
114. При межмолекулярной дегидратации многоатомных спиртов возможно образование циклических простых эфиров
OOH HO
+
OH HO
этандиол-1,2
H2SO4
- 2H2O
O
диоксан
115.
Внутримолекулярная дегидратация– получение алкенов
Протекает как в жидкой так и в паровой
фазе. При этом используются такие
водоотнимающие средства как H2SO4,
H3PO4, Al2O3.
Р-ция внутримолекулярной дегидратации
подчиняется
правилу Зайцева.
116.
OHH
CH
H2SO4конц.,
0
H 150-170 С
CH
CH3
спирт
C
H2
- H2O
H
C
H3C
C
H
CH3
алкен
В этой реакции вода отщепляется
от одной молекулы спирта.
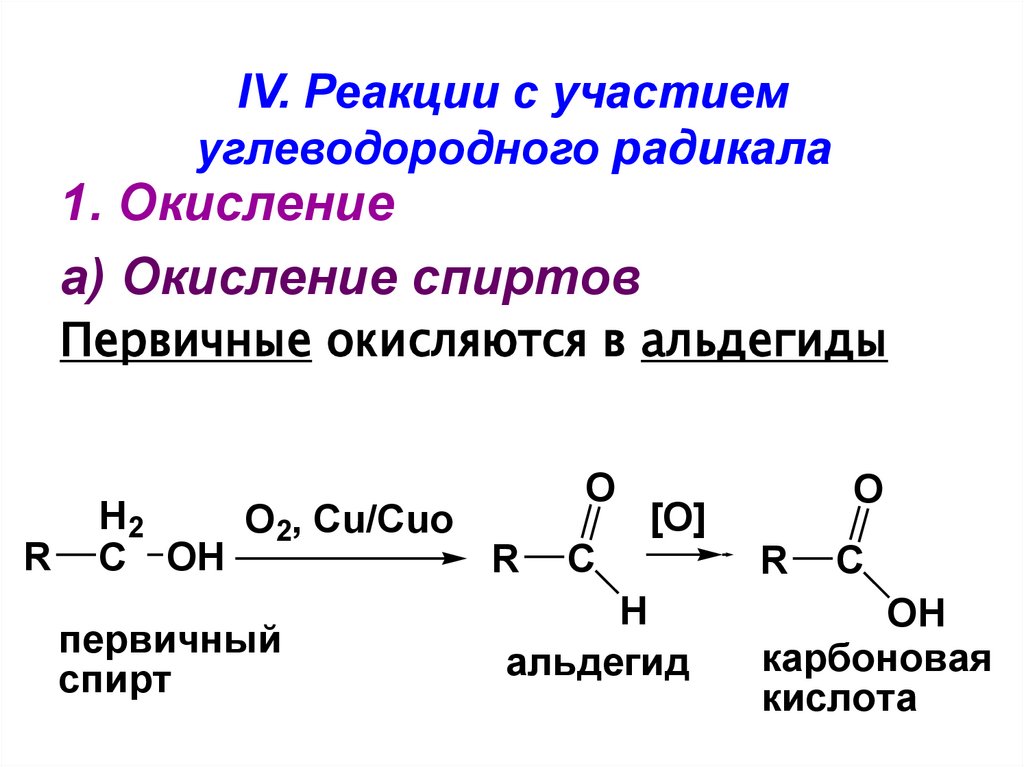
117. IV. Реакции с участием углеводородного радикала
1. Окислениеа) Окисление спиртов
Первичные окисляются в альдегиды
R
H2
O2, Cu/Cuo
C OH
R
первичный
спирт
O
O
[O]
C
H
альдегид
R
C
OH
карбоновая
кислота
118.
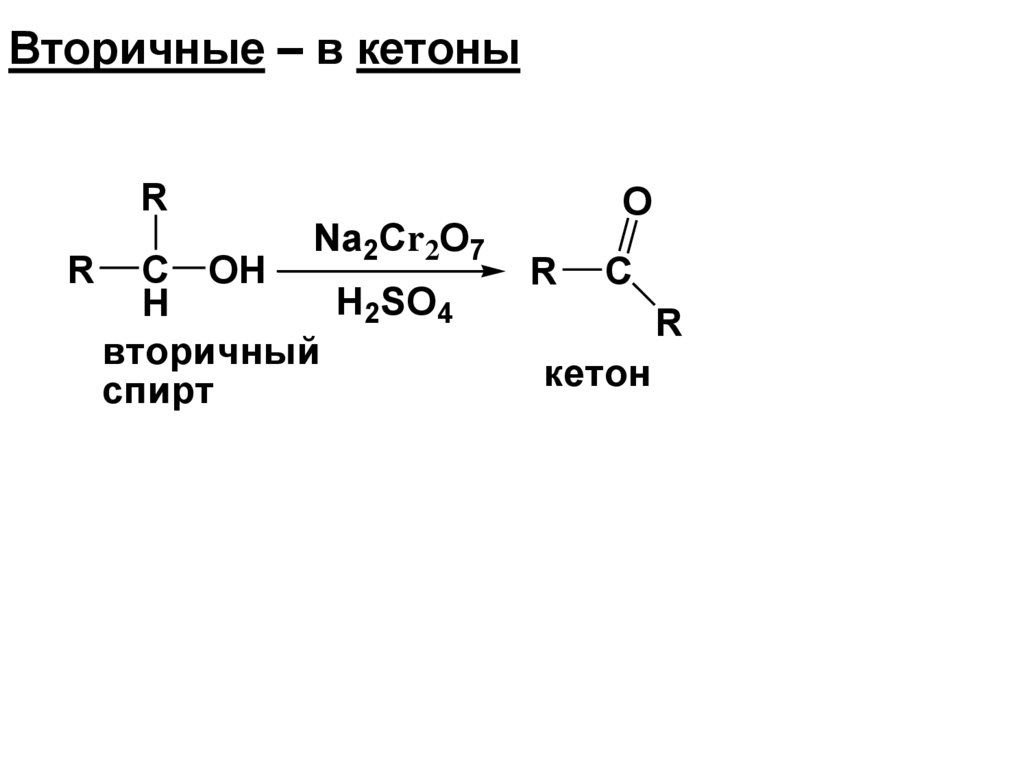
Вторичные – в кетоныR
R
O
Na2Cr2O7
C OH
H2SO4
H
вторичный
спирт
R
C
R
кетон
119.
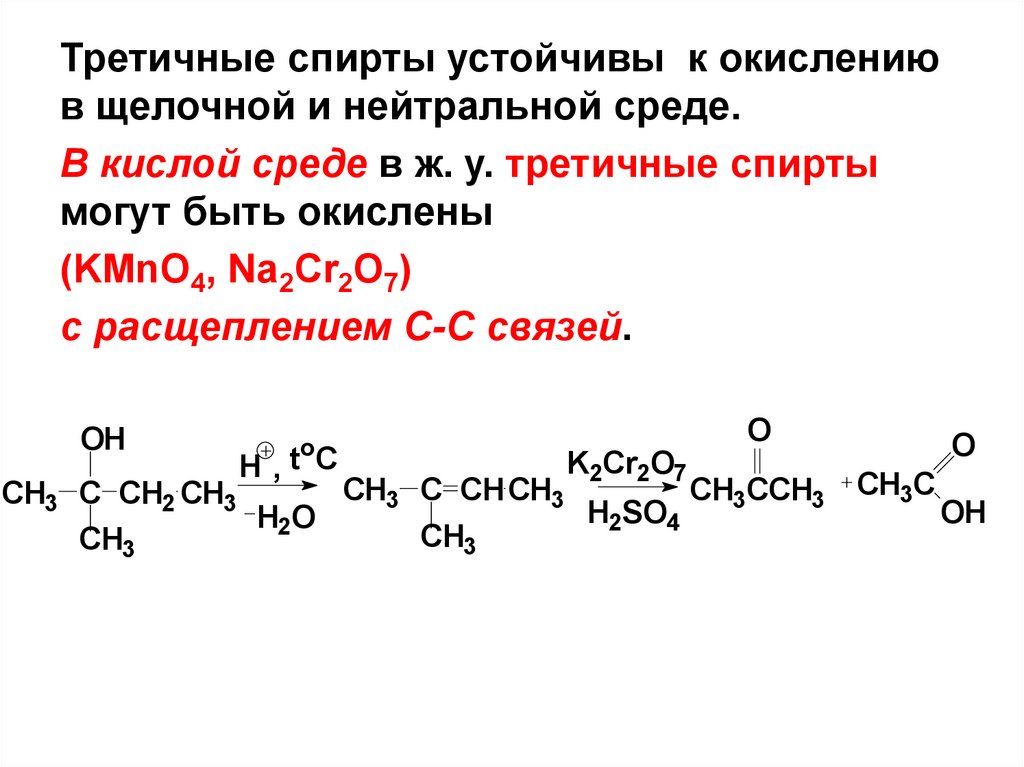
Третичные спирты устойчивы к окислениюв щелочной и нейтральной среде.
В кислой среде в ж. у. третичные спирты
могут быть окислены
(KMnO4, Na2Cr2O7)
с расщеплением С-С связей.
OH
o
H,t C
K2Cr2O7
O
O
CH3 C CHCH3
CH3CCH3 CH3C
CH3 C CH2 CH3
OH
H2SO4
H2O
CH3
CH3
120.
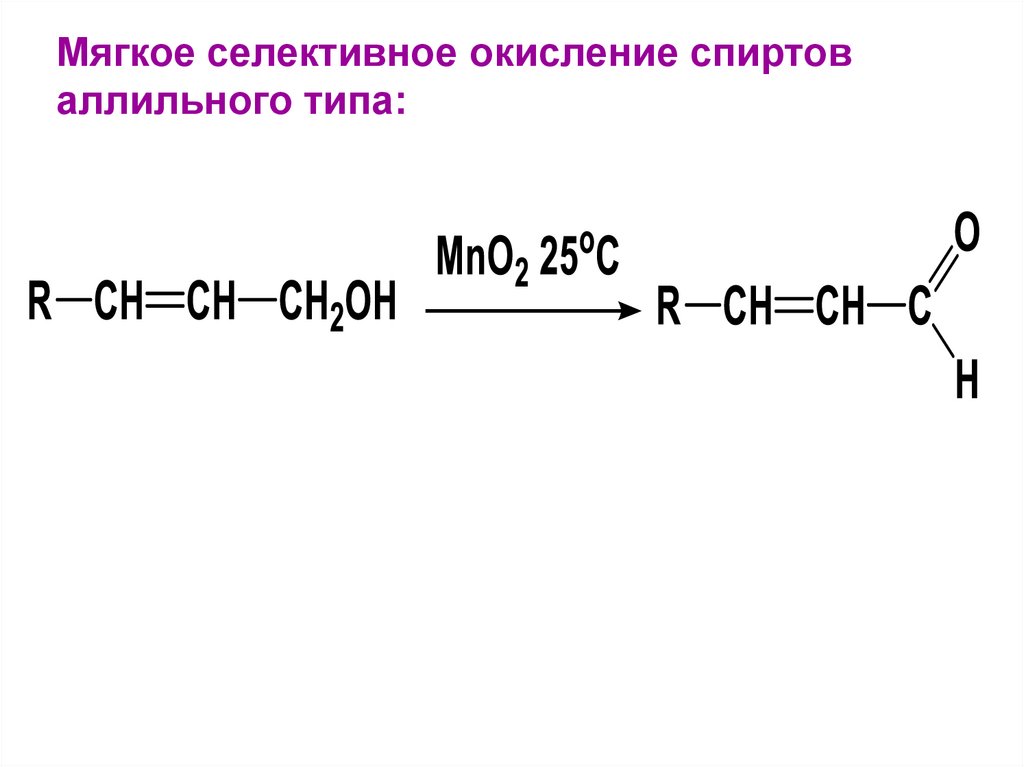
Мягкое селективное окисление спиртоваллильного типа:
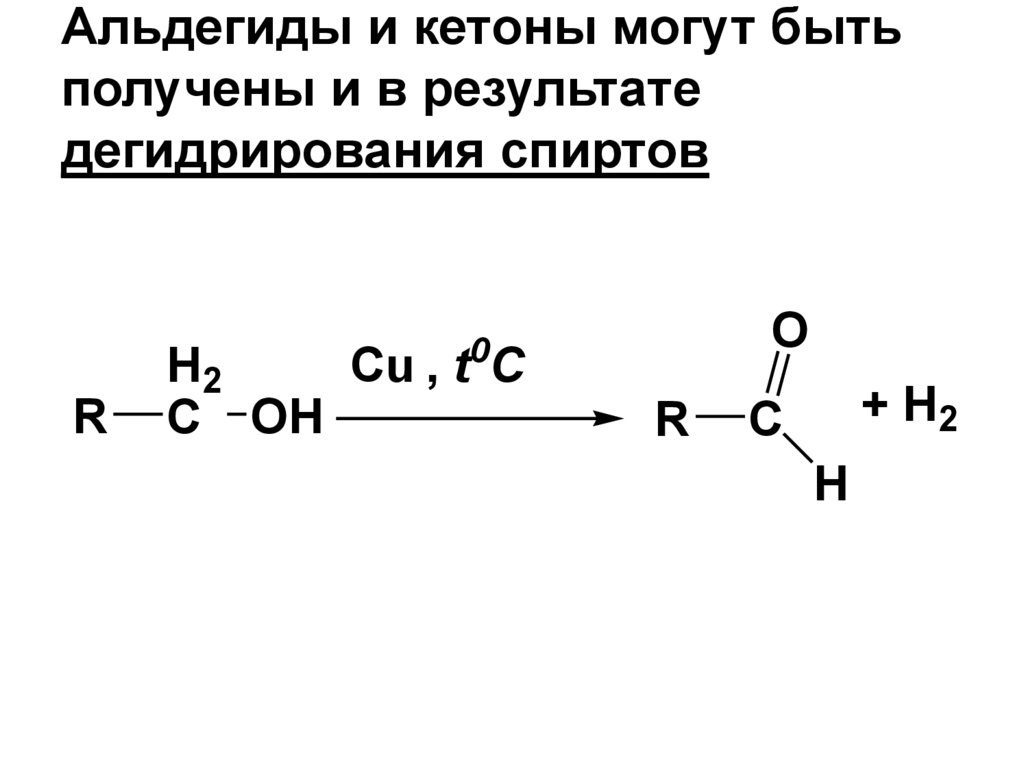
121. Альдегиды и кетоны могут быть получены и в результате дегидрирования спиртов
O0
R
Cu , t C
H2
C OH
R
+ H2
C
H
122.
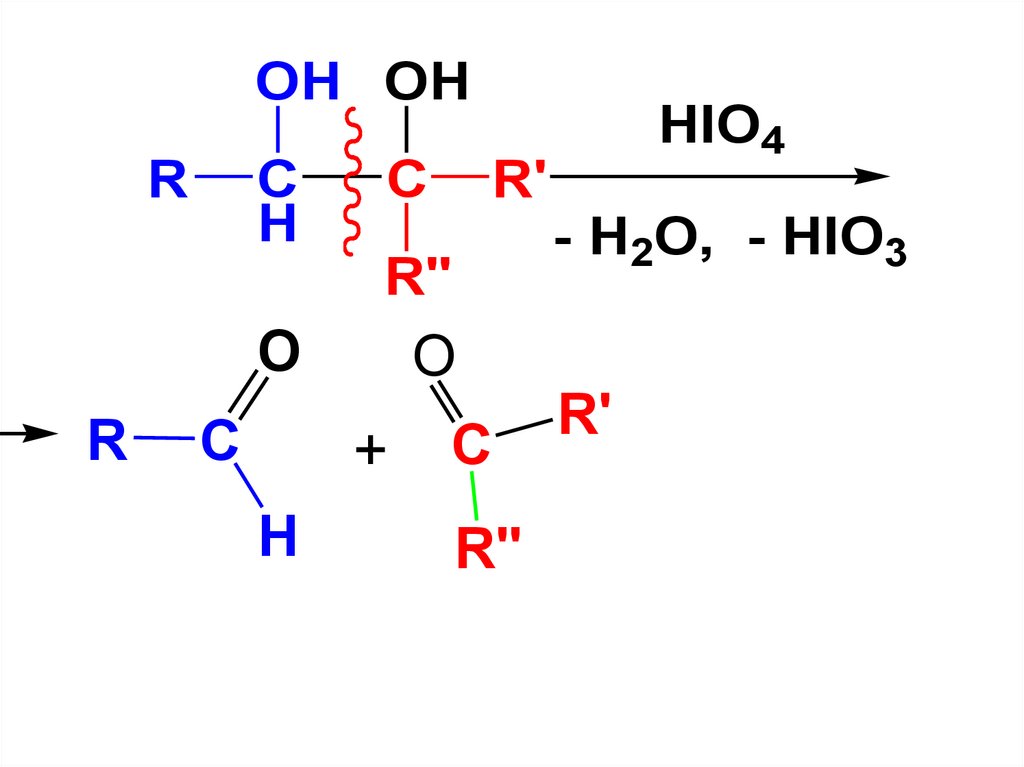
С увеличением числа ОН-групплегкость окисления возрастает
Так, 1,2-диолы (α-гликоли) подвергаются
окислению иодной кислотой.
Реакция используется для установления
строения α-гликолей, т.к. в результате
окисления разрывается С-С-связь
гликолевой группировки и образуется
смесь альдегидов и кетонов.
123.
OH OHR
C
H
C
R'
- H2O, - HIO3
R''
O
R
C
O
+
H
HIO4
C
R''
R'
124.
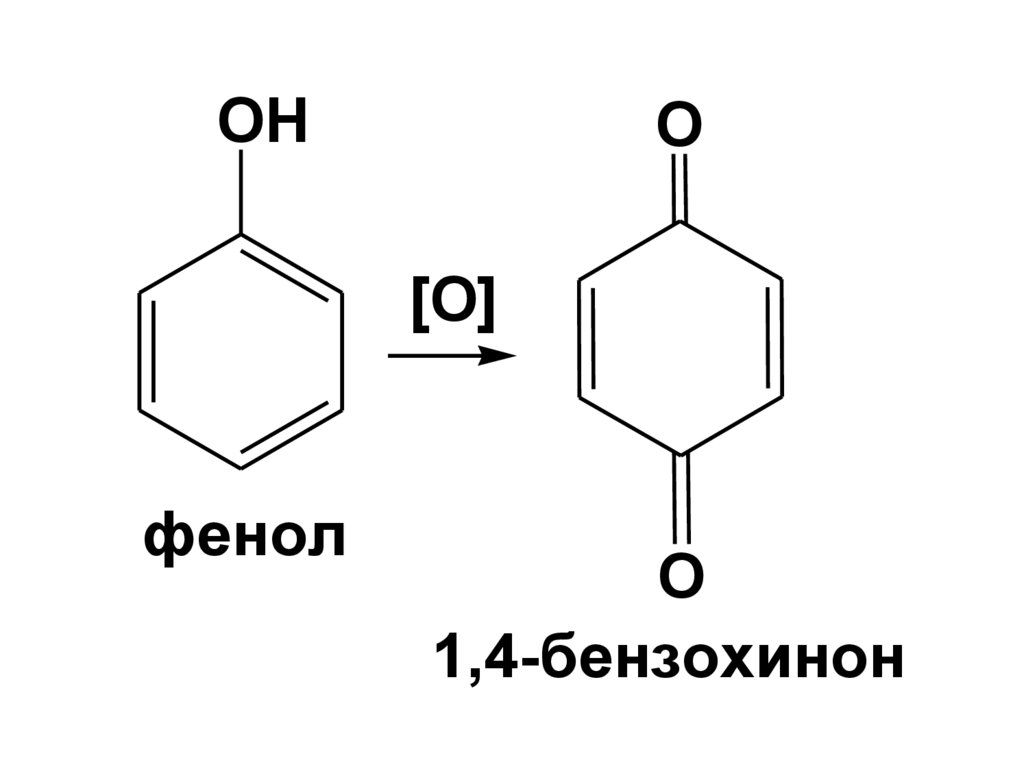
б) Окисление феноловФенолы сильно подвержены окислению.
Первоначально образуется
феноксильный радикал.
Продуктами окисления фенолов
являются хиноны.
125.
OHO
[O]
фенол
O
1,4-бензохинон
126.
Фенолы, содержащие в ароматическомцикле объемные заместители,
представляют собой ловушки свободных
R и используются в качестве
стабилизаторов полимерных материалов,
каучуков и т.д.
127.
2. SE –реакции бензольногокольца фенолов
ОН-группа сильно активирует
кольцо фенолов в реакциях SE,
благодаря
+М > –I
электронным эффектам
128.
SE –р-ции идут в о- и п-положения129.
В щелочной среде активностьфенолов в SE-реакциях возрастает
130.
Характерны реакции:-галогенирования;
- нитрования;
- сульфирования;
- ацилирования;
- алкилирования;
- нитрозирования;
- азосочетания;
-формиилирования;
- гидроксиметилирования;
-карбоксилирования и др.
131.
а) ГалогенированиеПротекает очень легко и не требует
катализатора.
Бромирование фенола в водных
р-рах дает белый осадок 2,4,6трибромфенола.
Другие фенолы также легко реагируют с
бромной водой, приводя к
обесцвечиванию р-ра брома
(качественная реакция на фенолы)
132.
OHOH
3 Br2
Br
Br
+ 3HBr
H2O
Br
!!!
2,4,6-трибромфенол
133.
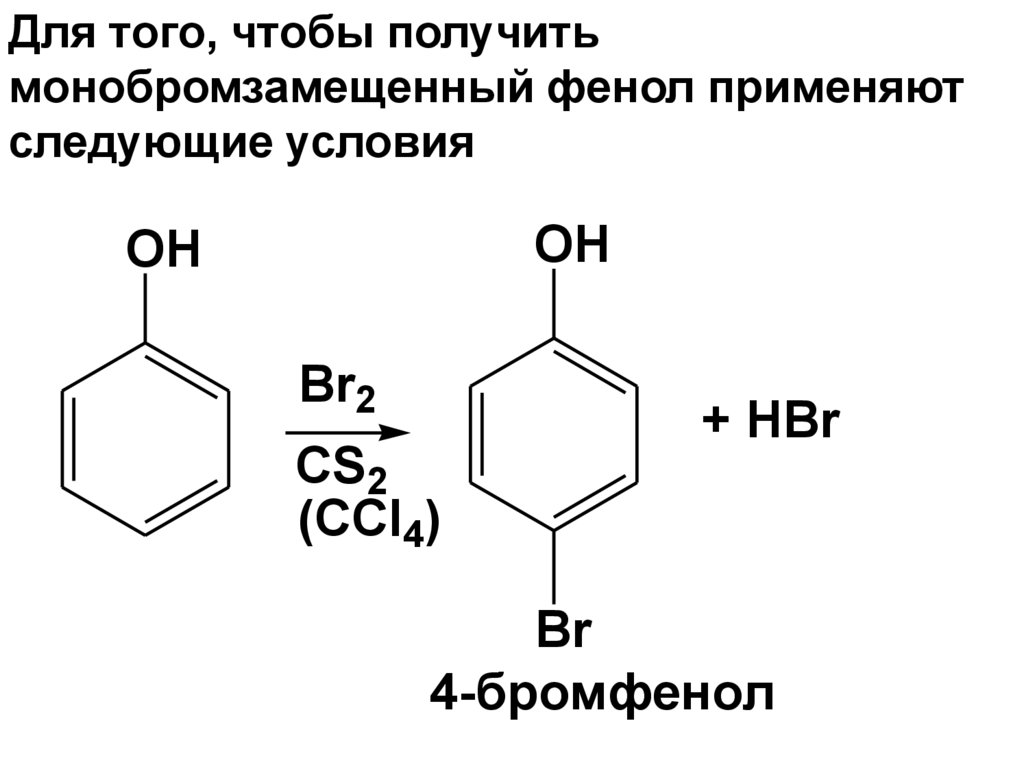
Для того, чтобы получитьмонобромзамещенный фенол применяют
следующие условия
OH
OH
Br2
CS2
(CCl4)
+ HBr
Br
4-бромфенол
134.
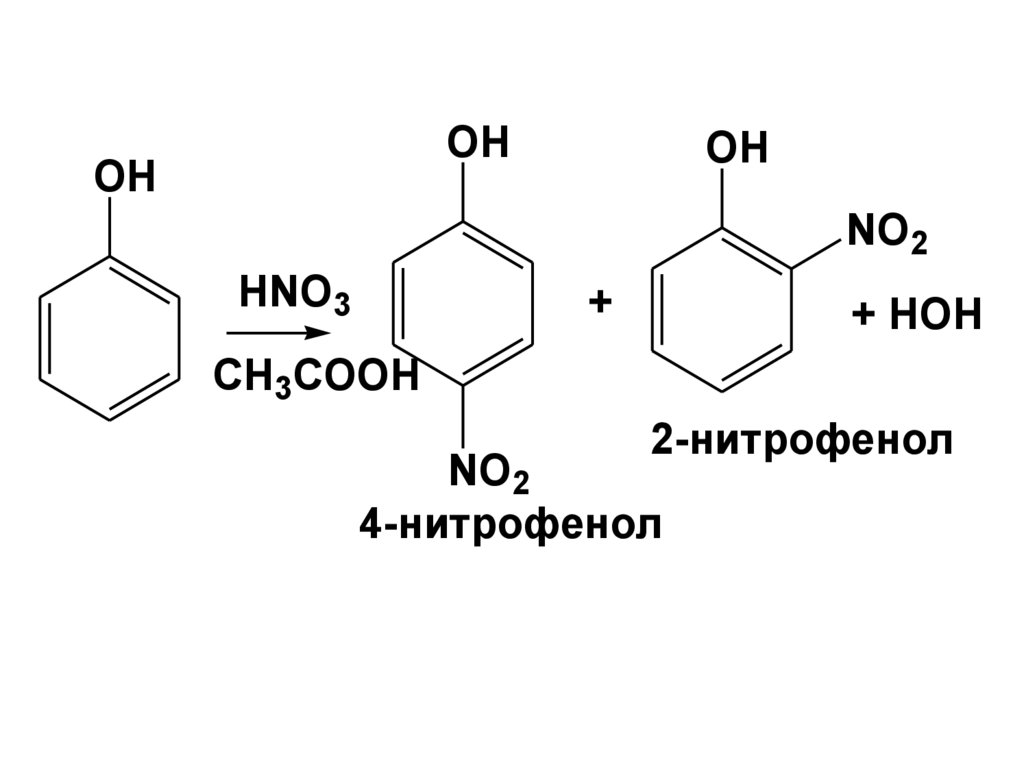
б) НитрованиеПротекает легко.
Не требуется H2SO4. Для нитрования
применяют либо разб. (~ 20%) водный
р-р HNO3 либо р-р HNO3 в уксусной к-те
при комнатной т-ре.
135.
OHOH
OH
NO2
HNO3
+
+ HOH
CH3COOH
2-нитрофенол
NO2
4-нитрофенол
136.
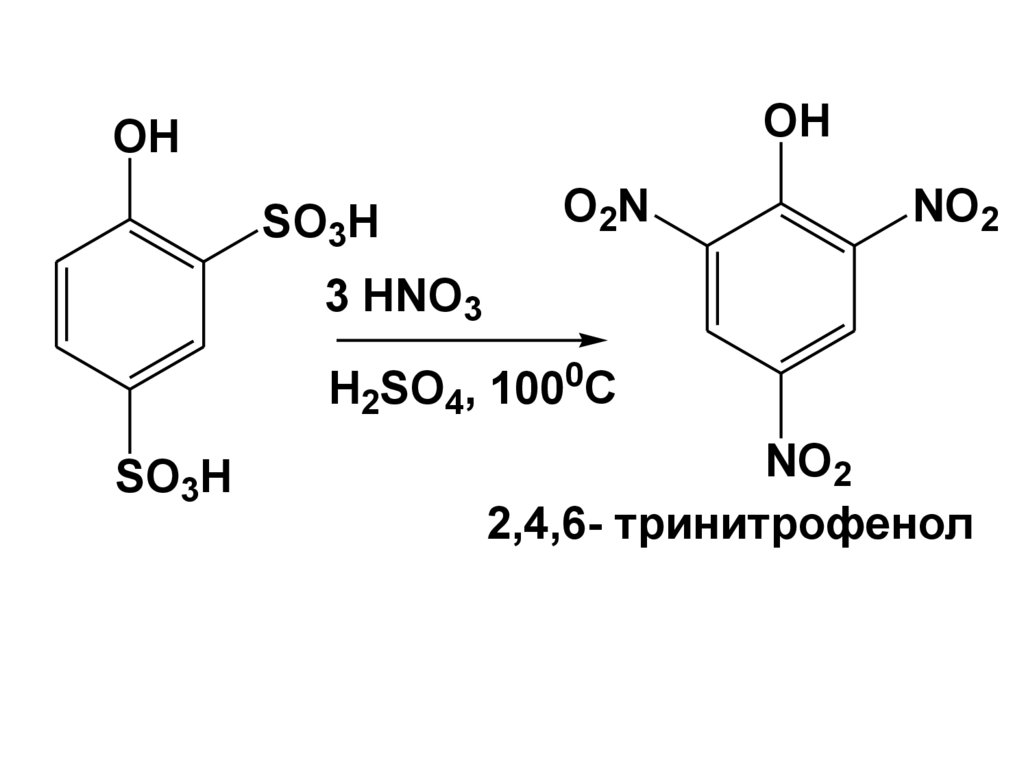
Конечным продуктом нитрованияфенола является 2,4,6-тринитрофенол
(пикриновая кислота).
Однако прямым нитрованием фенола её
не получают, т.к. нитрование фенола
осложняется протеканием
р-ций окисления и нитрозирования .
137.
Поэтому фенол сначала сульфируют,что повышает его устойчивость к
окислению и SE –реакциям. Затем
осуществляют нитрование с
одновременным замещением
сульфогрупп
138.
OHOH
SO3H
O2N
NO2
3 HNO3
0
H2SO4, 100 C
SO3H
NO2
2,4,6- тринитрофенол
139.
в) СульфированиеПриводит к образованию о- и пфенолсульфоновых кислот.
Соотношение изомеров определяется
температурой проведения
сульфирования фенола
140.
OHH2SO4,
OH
SO3H
0
t < 100 C
H2SO4,
t > 1000C
- H2O
,
4
SO 00 C
H 2 10
t>
OH
о-гидроксибензосульфоновая
кислота
п-гидроксибензосульфоновая
кислота
SO3H
141.
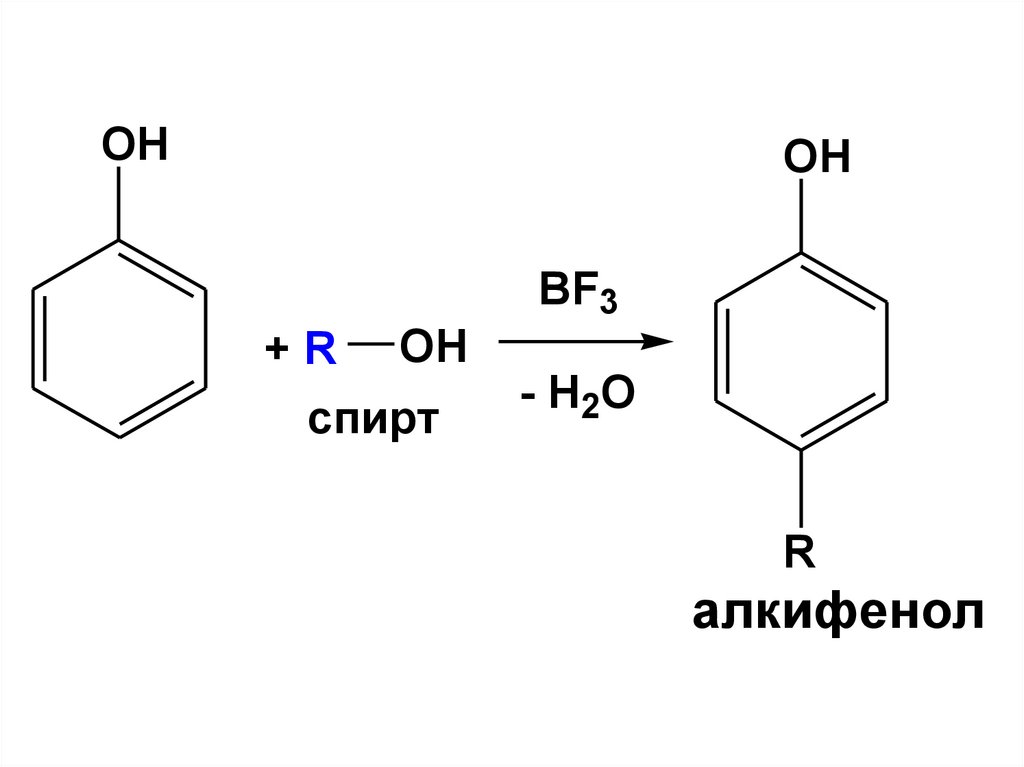
г) Алкилирование феноловДля проведения р-ции
по бензольному кольцу в качестве
алкилирующих средств используются
спирты или алкены в присутствии
катализаторов – H2SO4, H3PO4 или BF3.
142.
OHOH
BF3
+ R OH
спирт
- H2O
R
алкифенол
143.
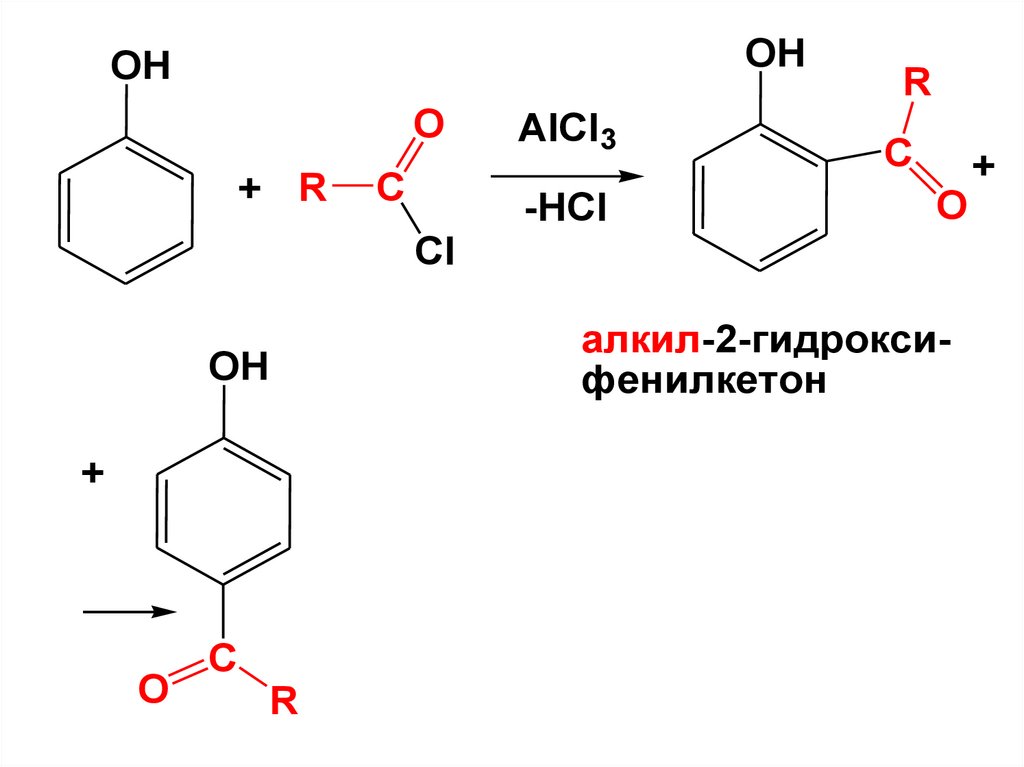
д) Ацилирование (поароматическому кольцу)
Взаимодействие фенолов С
ангидридами и
галогенангидридами карбоновых
кислот в присутствии кислот
Льюиса приводит к получению о- и пацильных производных фенолов.
144.
OHOH
O
+ R
C
AlCl3
-HCl
R
C
+
O
Cl
алкил-2-гидроксифенилкетон
OH
+
O
C
R
145. О-Замещенные ацильные проиводные фенолов способны в присутствии AlCl3 перегруппировываться в о- и п-ацилфенолы (перегруппировка
Фриса)O
O
OH
OH
C
R
AlCl3
R
C
+
O
O
C
R
146.
е) НитрозированиеОсуществляют азотистой кислотой HNO2
(NaNO2/HX)
OH
OH
HNO2
- H2O
N
O
п-нитрозофенол
147.
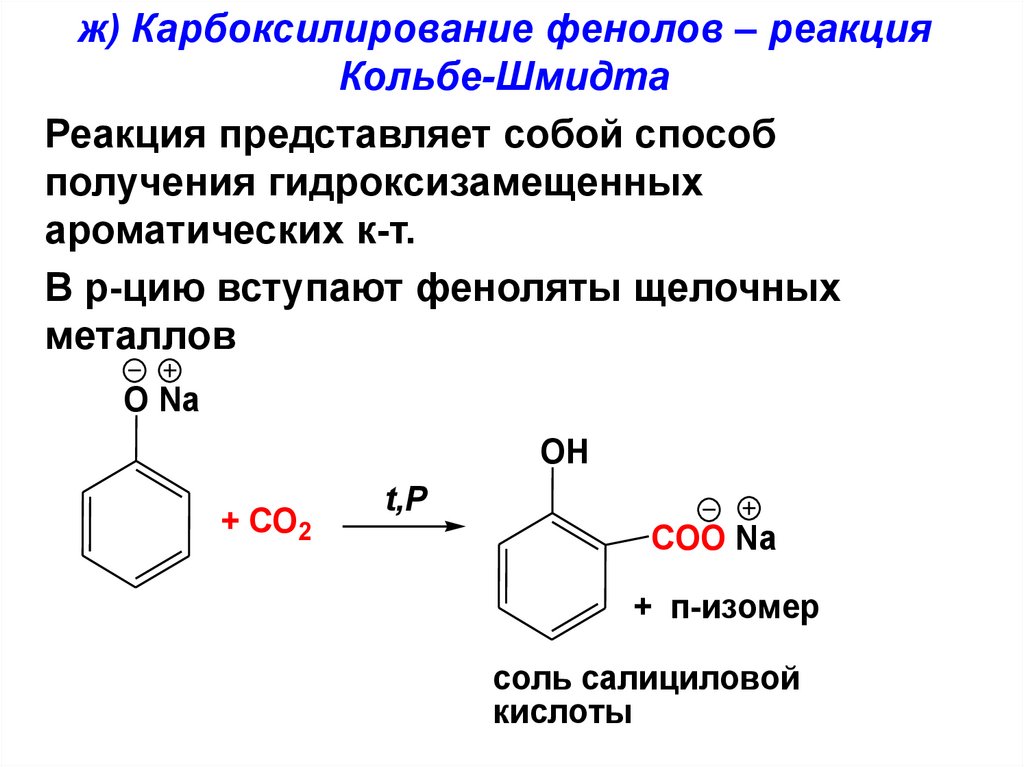
ж) Карбоксилирование фенолов – реакцияКольбе-Шмидта
Реакция представляет собой способ
получения гидроксизамещенных
ароматических к-т.
В р-цию вступают феноляты щелочных
металлов
O Na
OH
+ CO2
t,P
COO Na
+ п-изомер
соль салициловой
кислоты
148.
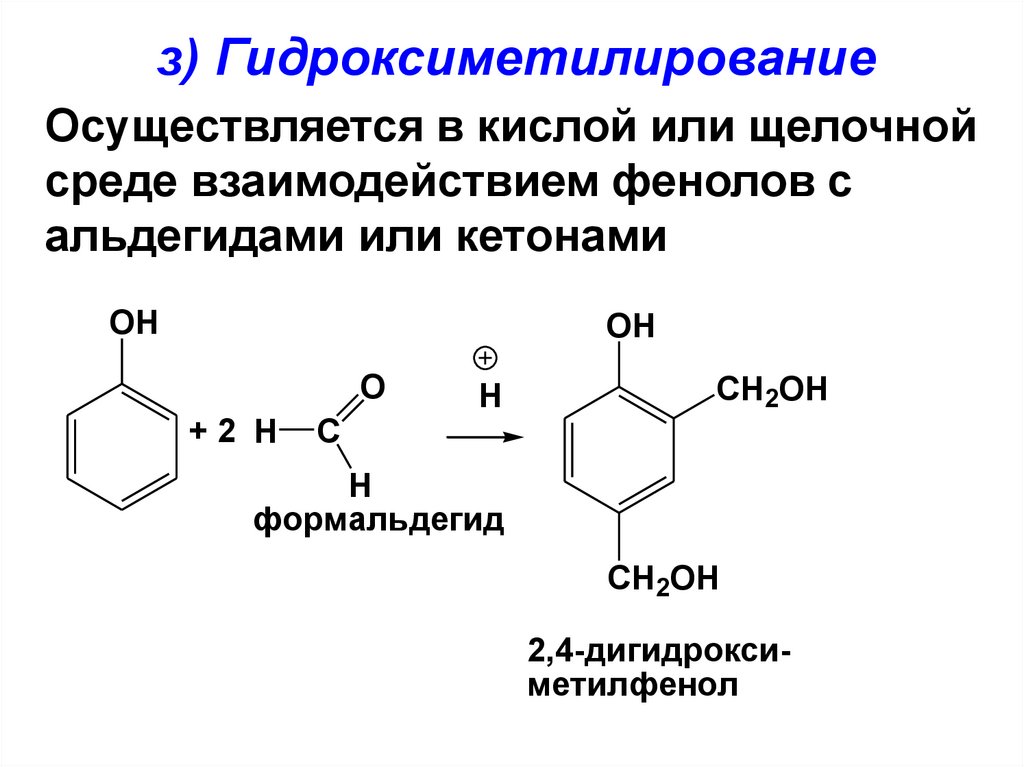
з) ГидроксиметилированиеОсуществляется в кислой или щелочной
среде взаимодействием фенолов с
альдегидами или кетонами
OH
OH
O
+2 H
H
CH2OH
C
H
формальдегид
CH2OH
2,4-дигидроксиметилфенол
149.
электрофильной частицейявляется гидроксиметилкатион
O
H
C
OH
H
H
H
C
H
150.
Гидроксиметилфенолы сами могут выступать вкачестве алкилирующих агентов, что приводит
к конденсации молекул фенола и
гидроксиметилфенола
OH
OH
H
+
- HOH
CH2OH
HO
H2
C
OH
151.
В более жестких условиях фенол иформальдегид образуют
фенолоформальдегидные смолы
OH
OH
OH
новолак
регулярная цепь
резол и др.
OH
OH
HO
нерегулярная цепь
152.
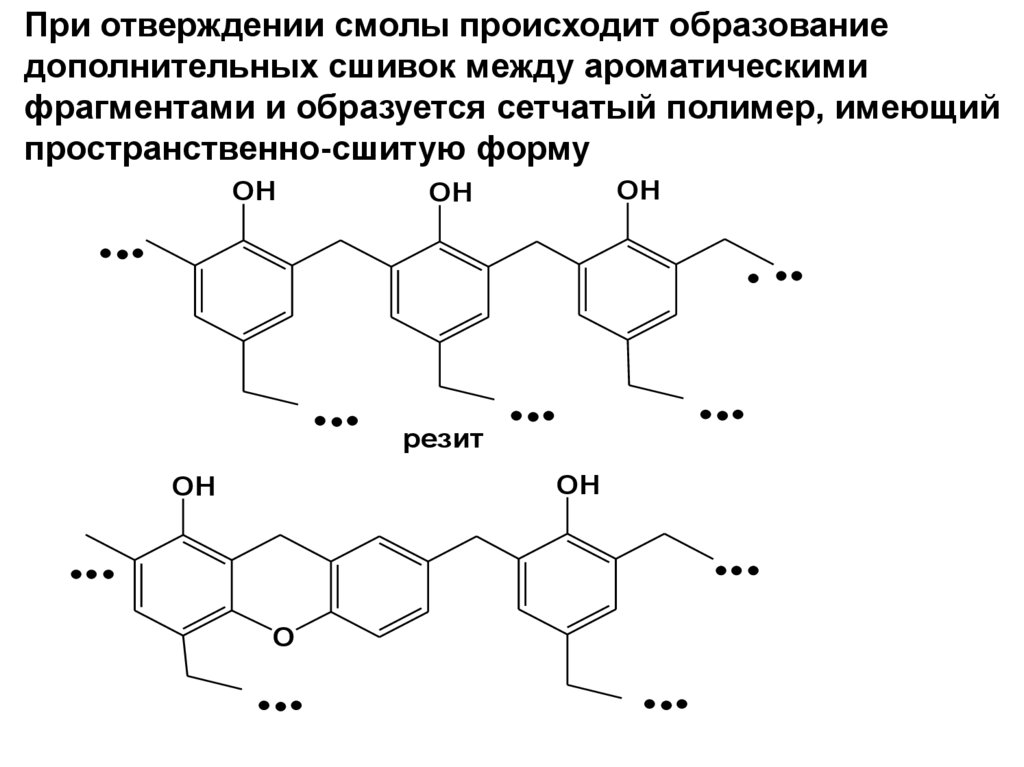
При отверждении смолы происходит образованиедополнительных сшивок между ароматическими
фрагментами и образуется сетчатый полимер, имеющий
пространственно-сшитую форму
OH
OH
OH
резит
OH
OH
O
153.
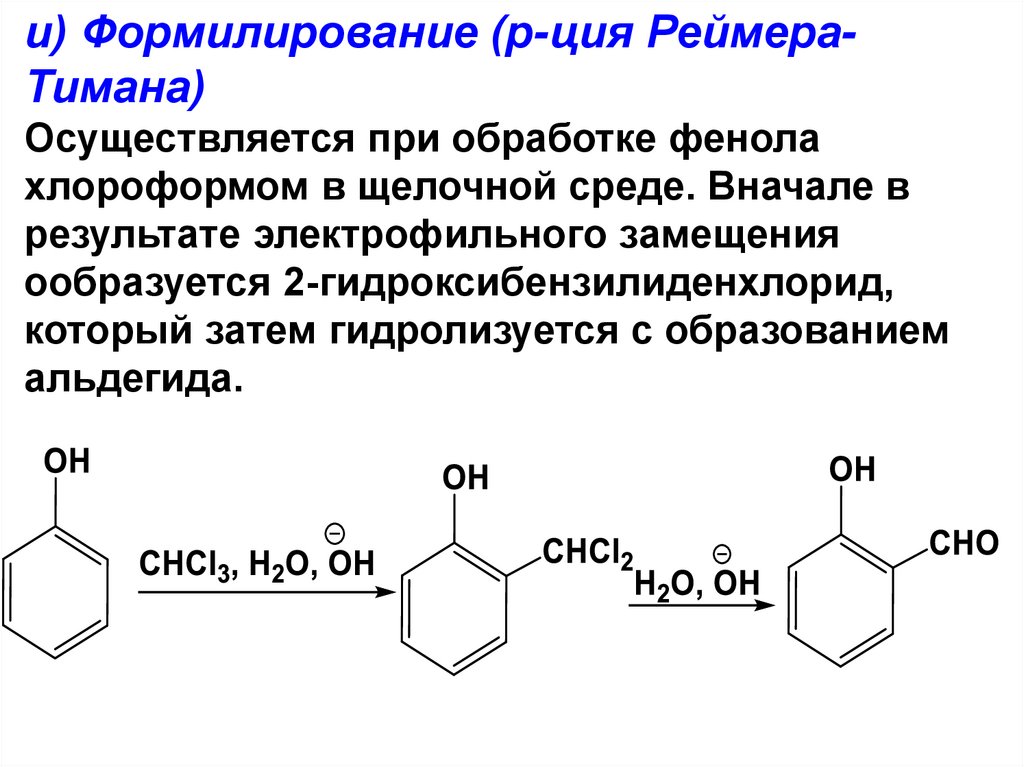
и) Формилирование (р-ция РеймераТимана)Осуществляется при обработке фенола
хлороформом в щелочной среде. Вначале в
результате электрофильного замещения
ообразуется 2-гидроксибензилиденхлорид,
который затем гидролизуется с образованием
альдегида.
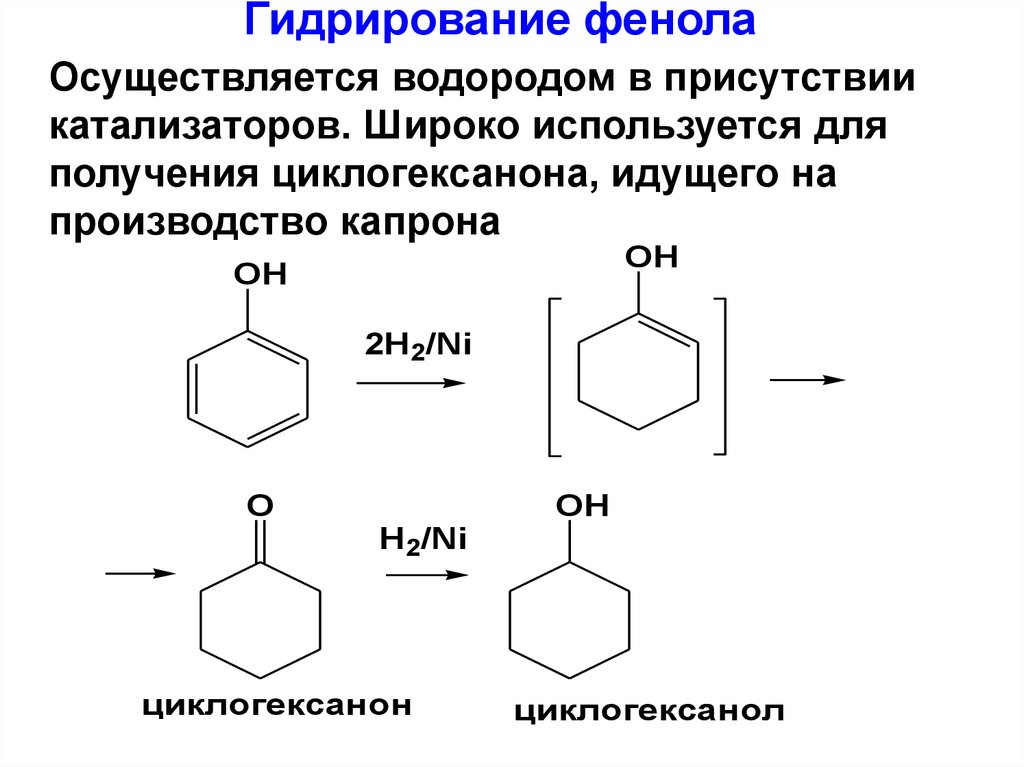
154. Гидрирование фенола
Осуществляется водородом в присутствиикатализаторов. Широко используется для
получения циклогексанона, идущего на
производство капрона
OH
OH
2H2/Ni
O
OH
H2/Ni
циклогексанон
циклогексанол
155.
Важнейшие представителиспиртов и фенолов
Метанол - древесный спирт –
Растворитель, в орг.синтезе
Этанол – древнейший м-д получения –
сбраживание сахаров.
Использование – растворитель, для
изготовления косметических продуктов,
медикаментов, в синтезе бутадиена и т.д.
156.
Аллиловый спирт – в пр-ве глицеринаБензиловый спирт – в парфюмерии и
лакокрасочной пром-сти.
Циклогексанол - растворитель, - в прве адипиновой к-ты, циклогексанона,
ε-капролактама.
157.
Этиленгликоль –→диэтиленгликоль,диоксан, простые эфиры, целлофан,
полиуретаны.
Глицерин -– в пр-ве взрывчатых в-в,
алкидных смол, полиуретанов,
акролеина, в косметической пром-ти.
Фенол- Медпрепараты, мощие
средства, стабилизаторы.
158.
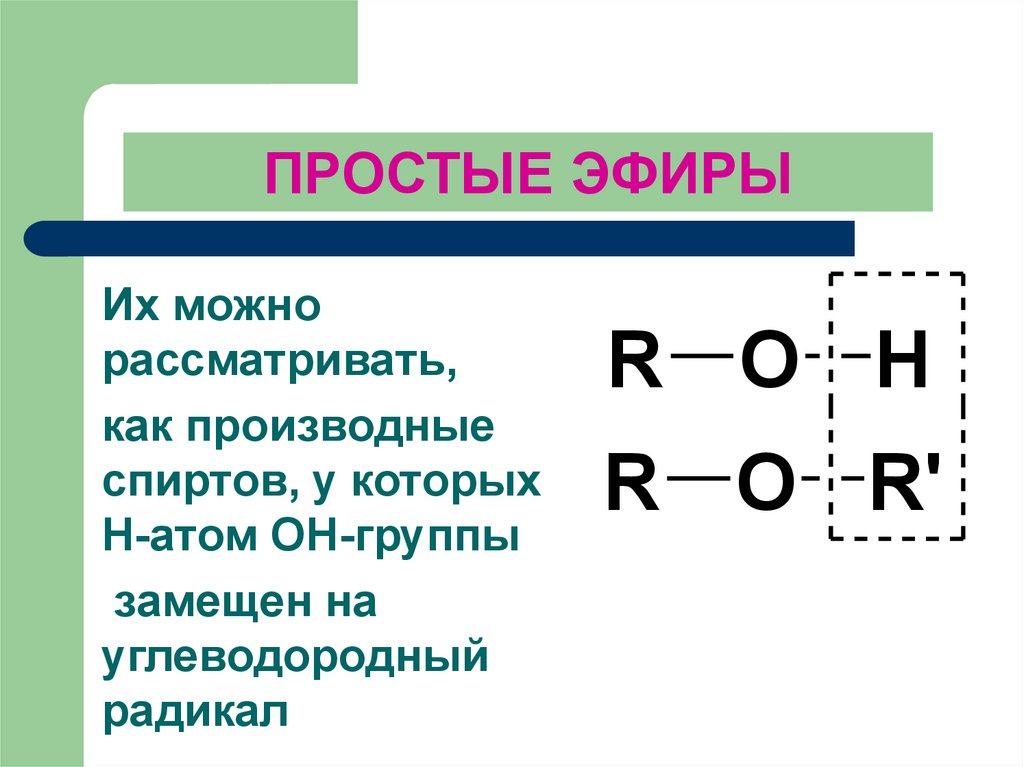
ПРОСТЫЕ ЭФИРЫИх можно
рассматривать,
как производные
спиртов, у которых
Н-атом OH-группы
замещен на
углеводородный
радикал
R O H
R O R'
159.
Номенклатура• Названия низших простых эфиров
образуют из названия радикалов.
C2H5
O C2H5
диэтиловый эфир (симметричный)
H3C O C2H5
H2C C O C2H5
H
метилэтиловый эфир винилэтиловый эфир
несимметричные
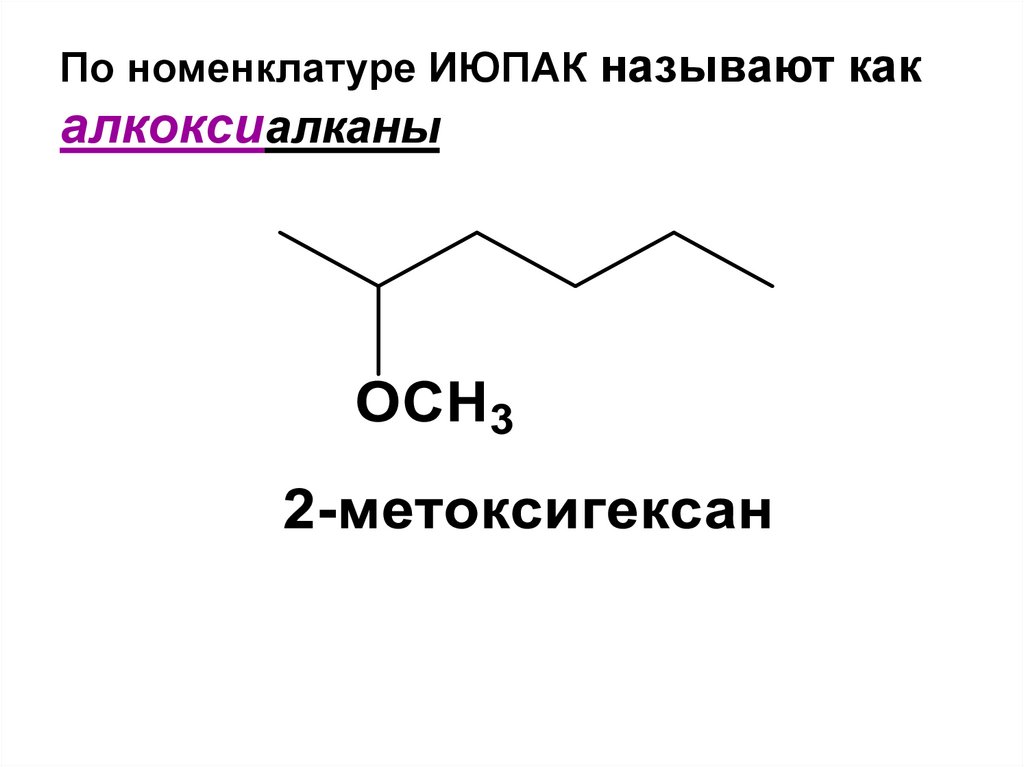
160. По номенклатуре ИЮПАК называют как алкоксиалканы
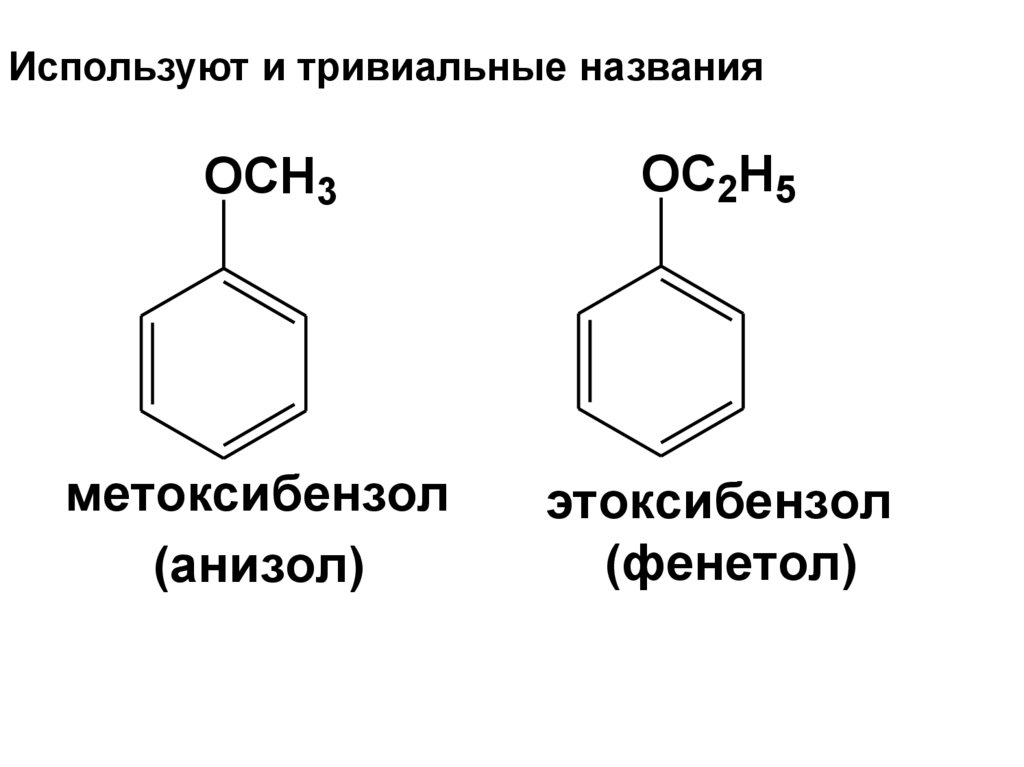
161. Используют и тривиальные названия
OCH3OC2H5
метоксибензол
(анизол)
этоксибензол
(фенетол)
162. Способы получения
• 1). Синтез Вильямсона.• 2) Алкилалкиловые – р-цией
межмолекулярной дегидратации.
• 3) Виниловые – присоединением
спиртов к алкинам.
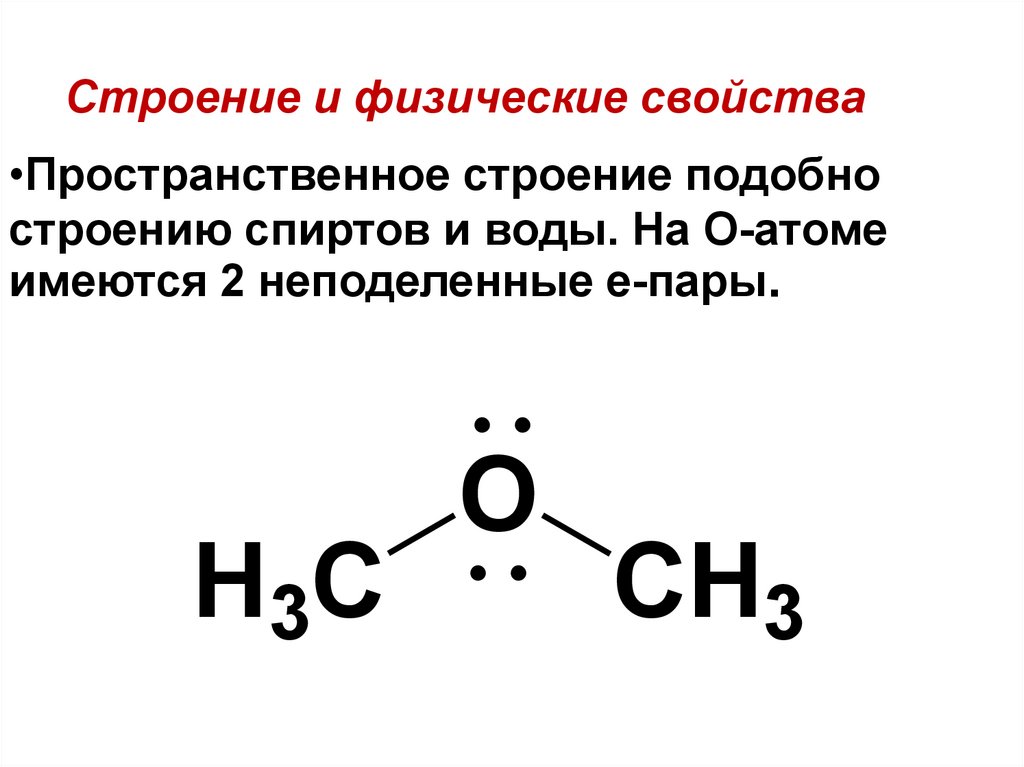
163. Строение и физические свойства
•Пространственное строение подобностроению спиртов и воды. На О-атоме
имеются 2 неподеленные е-пары.
H3C
..
O
..
CH3
164.
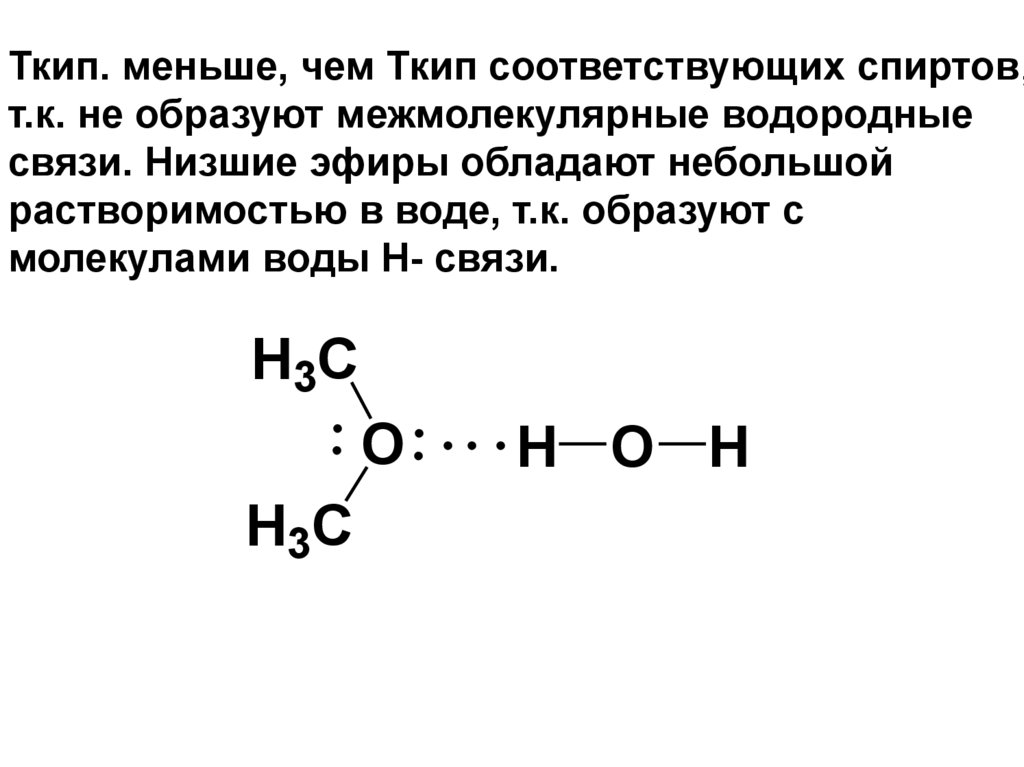
Ткип. меньше, чем Ткип соответствующих спиртов,т.к. не образуют межмолекулярные водородные
связи. Низшие эфиры обладают небольшой
растворимостью в воде, т.к. образуют с
молекулами воды Н- связи.
H3C
..
...
..
O
H3C
H O H
165. Химические свойства
Простые эфиры довольно инертны.Простая эфирная связь устойчива к
действию оснований, окислителей,
разбавленных кислот.
1) Благодаря наличию электронной пары
на О-атоме обладают основностью.
Основания слабые – образуют соли
только с сильными кислотами в
отсутствие воды.
Арилариловые эфиры
оксониевых солей не образуют.
166.
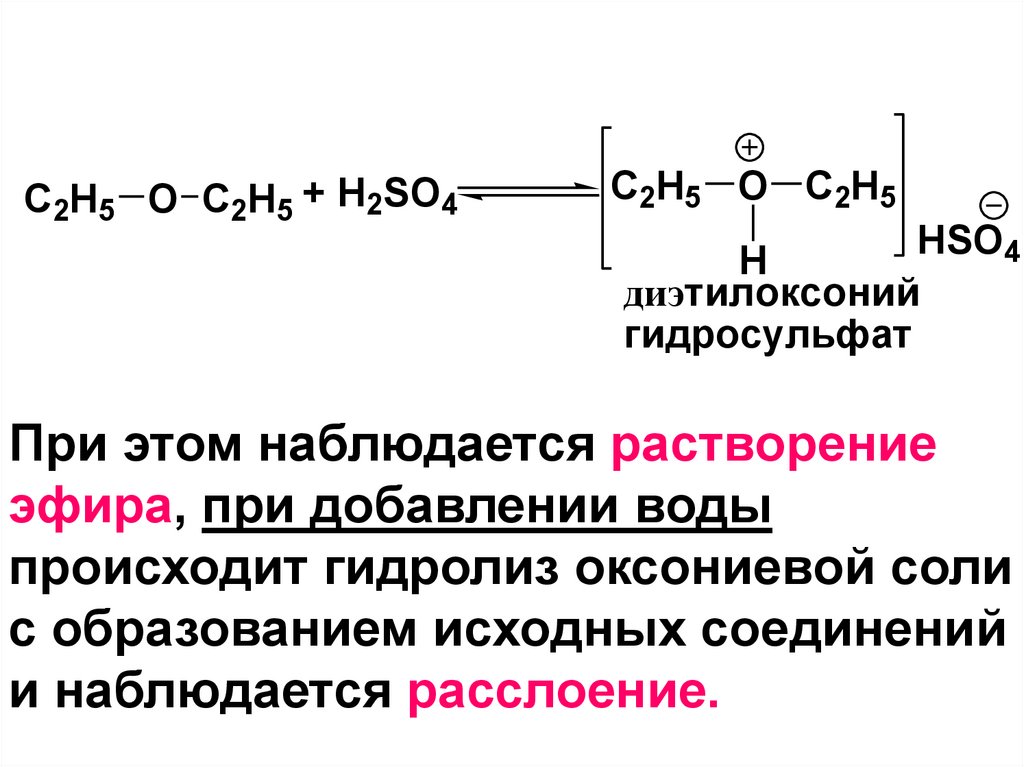
C2H5 O C2H5 + H2SO4C2H5 O C2H5
HSO4
H
диэтилоксоний
гидросульфат
При этом наблюдается растворение
эфира, при добавлении воды
происходит гидролиз оксониевой соли
с образованием исходных соединений
и наблюдается расслоение.
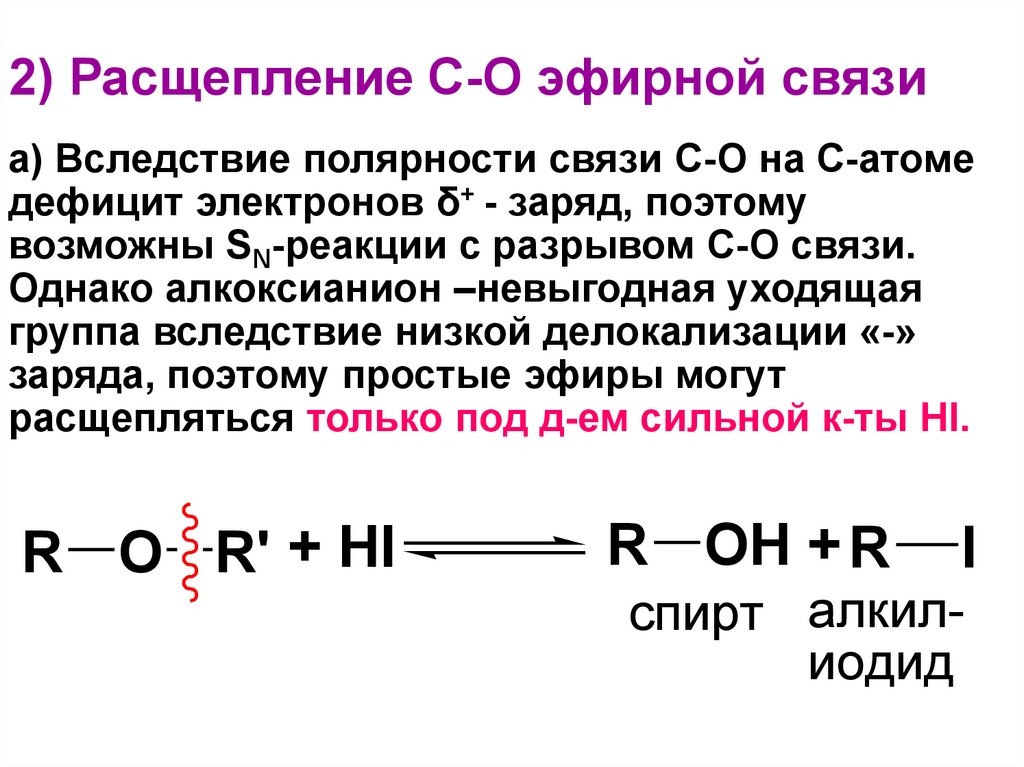
167. 2) Расщепление С-О эфирной связи
а) Вследствие полярности связи С-О на С-атомедефицит электронов δ+ - заряд, поэтому
возможны SN-реакции с разрывом С-О связи.
Однако алкоксианион –невыгодная уходящая
группа вследствие низкой делокализации «-»
заряда, поэтому простые эфиры могут
расщепляться только под д-ем сильной к-ты НI.
R O R' + HI
R OH + R
I
спирт алкилиодид
168.
• Механизм реакции SN1 или SN2 послепредварительного протонирования
(подобно спиртам). Протонирование
приводит к увеличению полярности
связи С-О и превращению
невыгодной уходящей группы
алкоксианиона в более выгодную
уходящую группу молекулу спирта.
• Направление и механизм
расщепления простой эфирной связи
зависит от строения радикалов.
169.
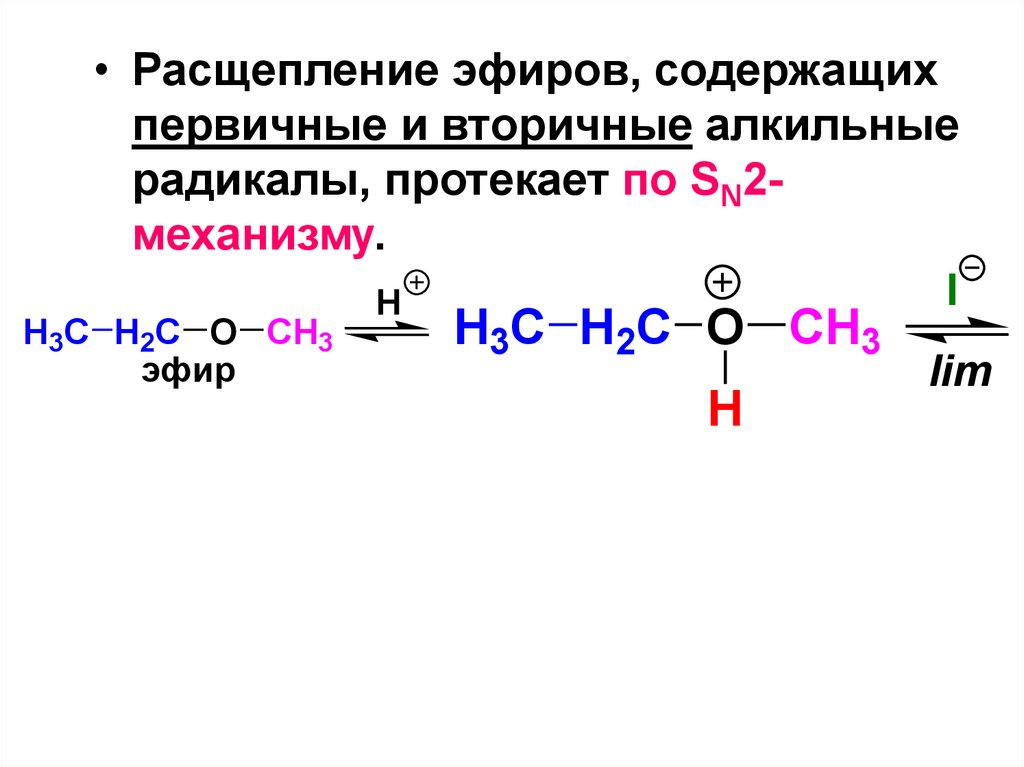
• Расщепление эфиров, содержащихпервичные и вторичные алкильные
радикалы, протекает по SN2механизму.
I
H
H3C H2C O CH3
эфир
H3C H2C O CH3
H
lim
170.
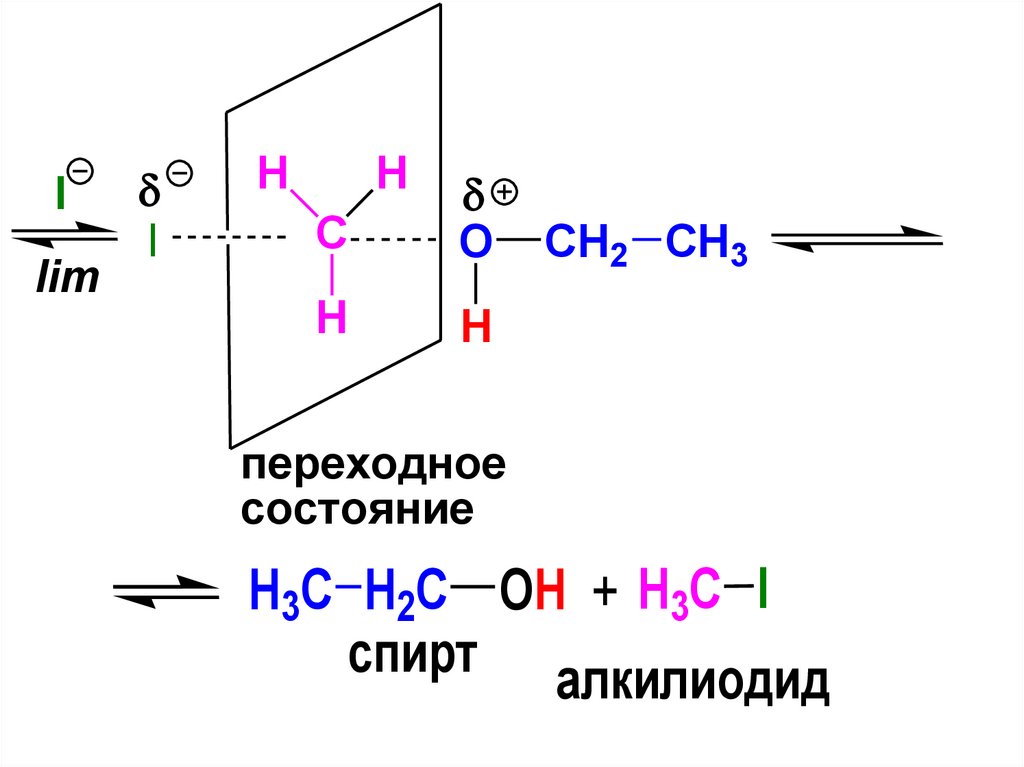
Ilim
I
H
H
C
O
H
H
CH2 CH3
переходное
состояние
H3C H2C OH + H3C I
спирт алкилиодид
171.
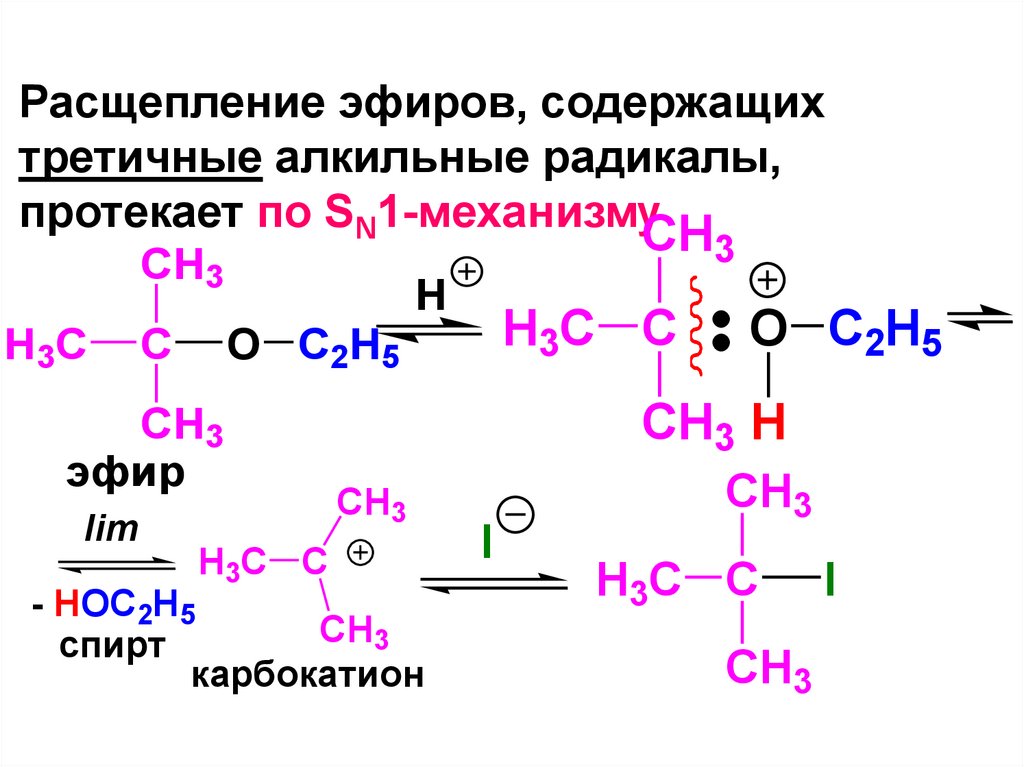
Расщепление эфиров, содержащихтретичные алкильные радикалы,
протекает по SN1-механизму
СH3
СH3
H3C
C
H
CH3
эфир
lim
H3C C
O C2H5
O C2H5
CH3 H
СH3
H3C C
- HOC2H5
CH3
спирт
карбокатион
I
СH3
H3C C
CH3
I
172.
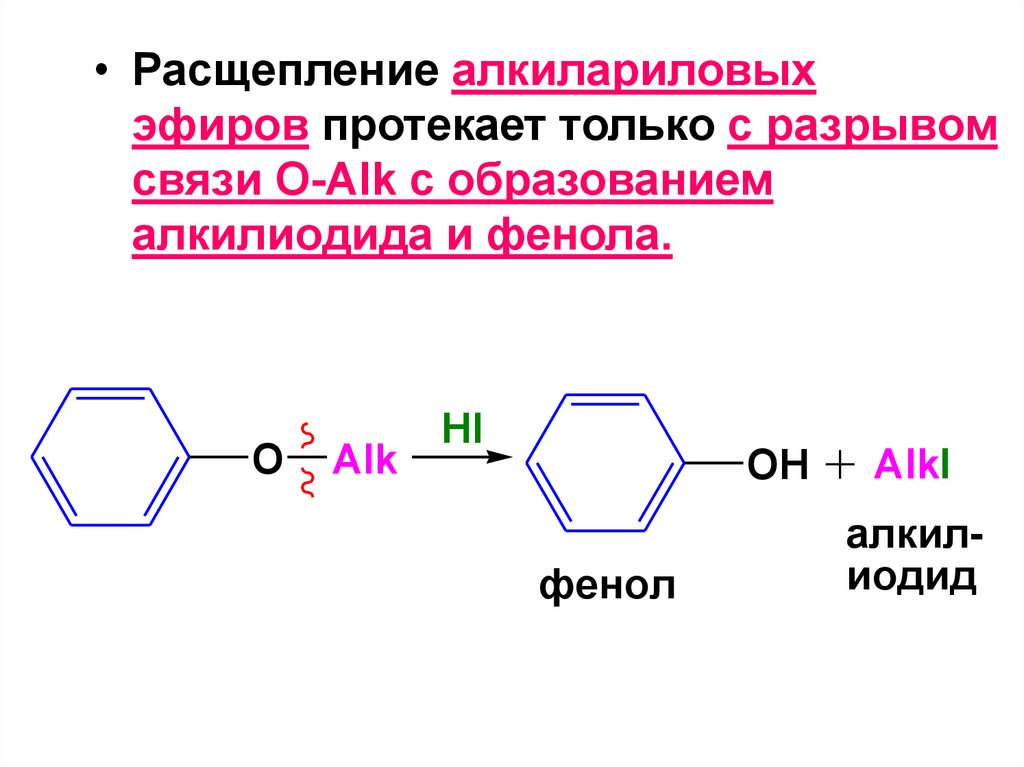
• Расщепление алкилариловыхэфиров протекает только с разрывом
связи О-Alk с образованием
алкилиодида и фенола.
O
Alk
HI
OH
фенол
AlkI
алкилиодид
173.
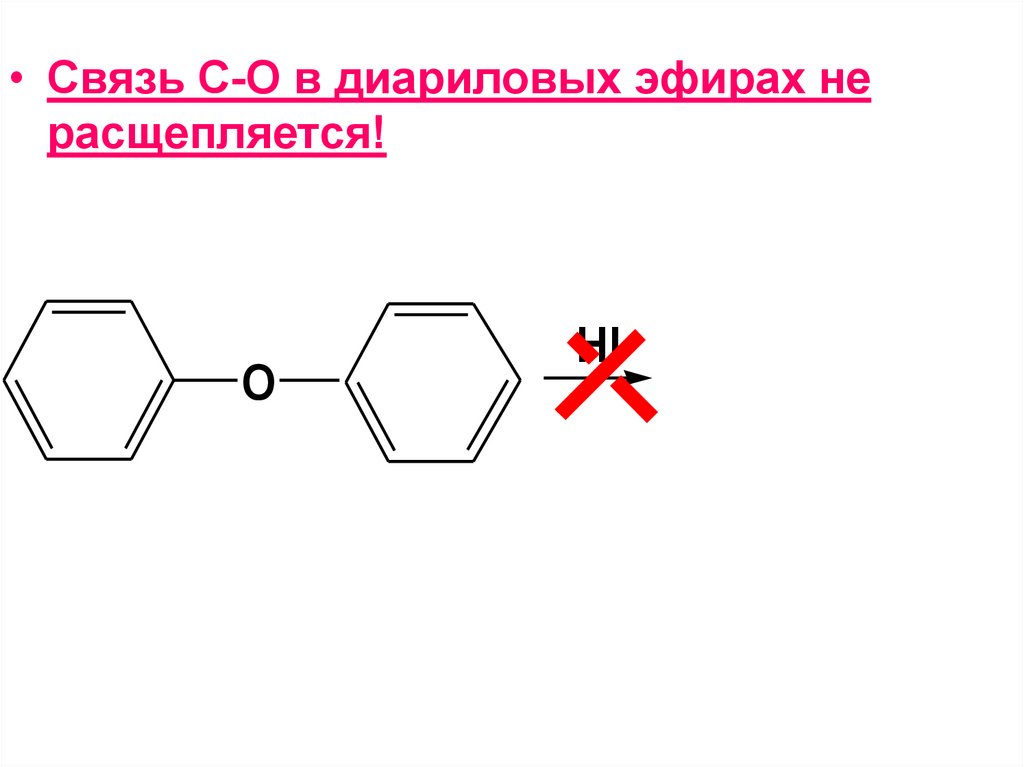
• Связь С-О в диариловых эфирах нерасщепляется!
O
HI
174.
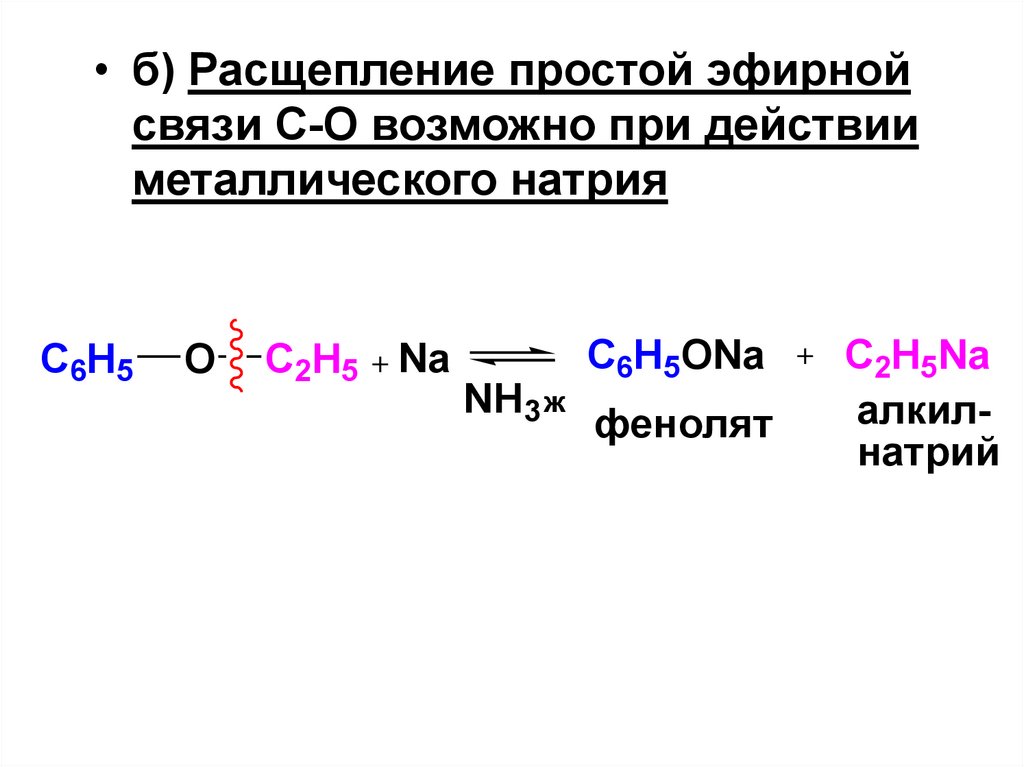
• б) Расщепление простой эфирнойсвязи С-О возможно при действии
металлического натрия
C6H5
O
C2H5 + Na
NH3 ж
C6H5ONa
фенолят
+
C2H5Na
алкилнатрий
175.
Бензиловые эфиры, содержащиеэлектронодонорные заместители в п-положении
способны гидролизоваться в мягких условиях
(разб. кислоты, умеренные температуры)
176.
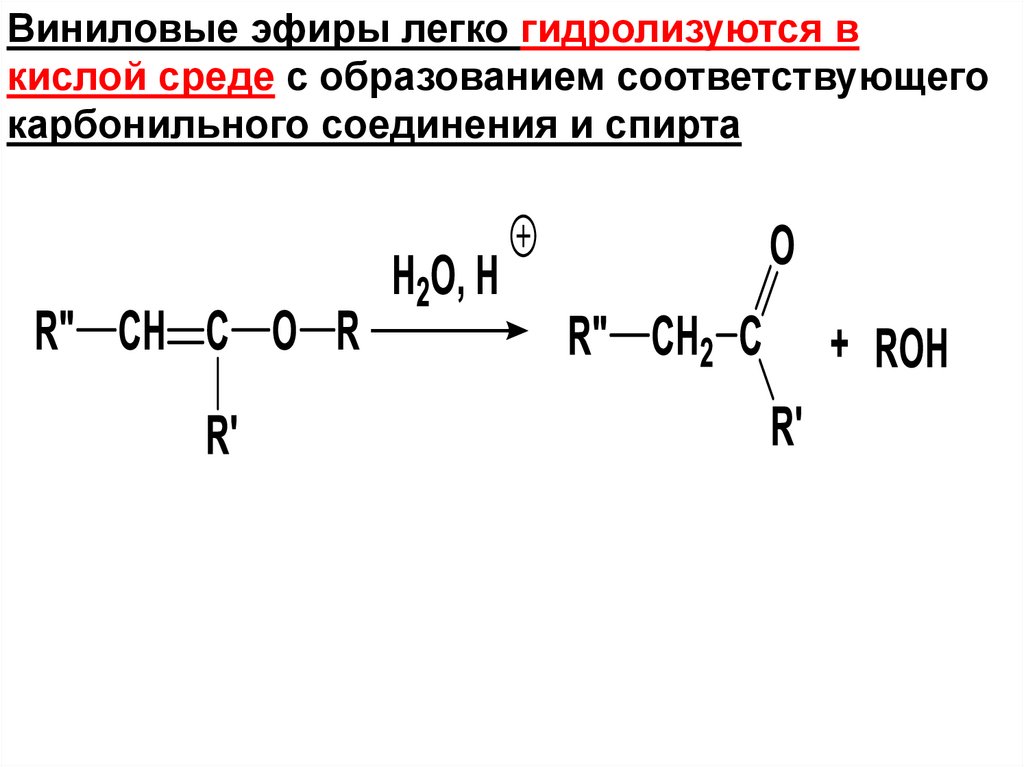
Виниловые эфиры легко гидролизуются вкислой среде с образованием соответствующего
карбонильного соединения и спирта
177.
3. АвтоокислениеБольшим недостатком алифатических
простых эфиров является их
автоокисление - под действием света и
воздуха происходит их окисление с
образованием взрывоопасных
перекисных соединений, что затрудняет
работу с ними.
178.
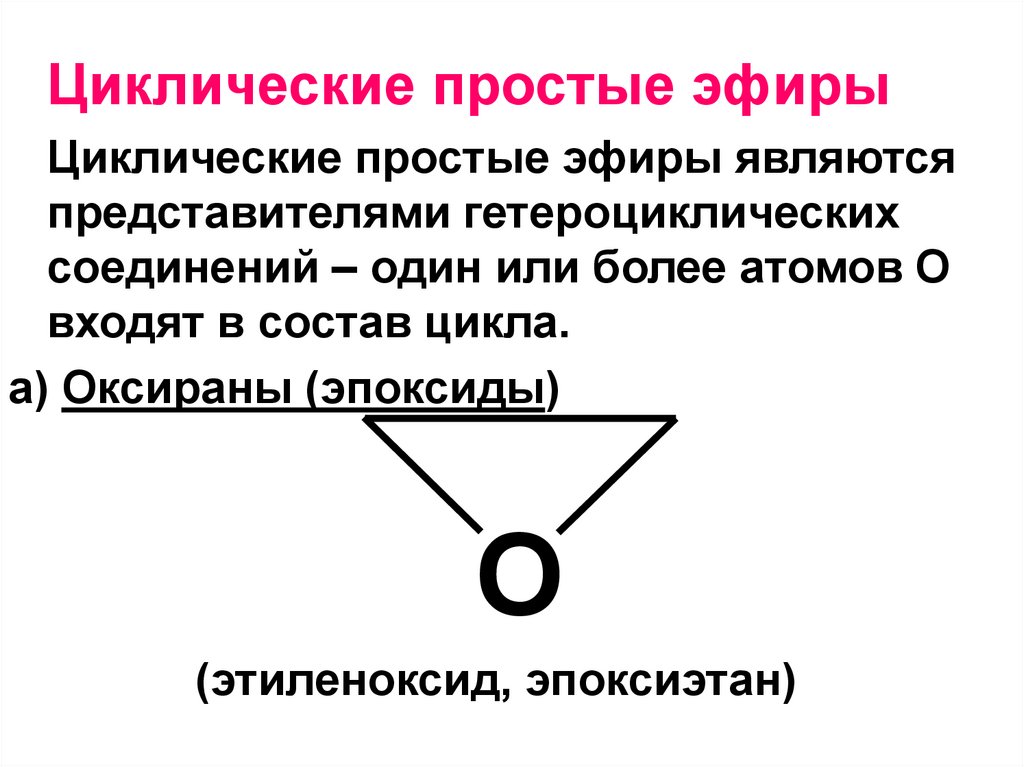
Циклические простые эфирыЦиклические простые эфиры являются
представителями гетероциклических
соединений – один или более атомов О
входят в состав цикла.
а) Оксираны (эпоксиды)
O
(этиленоксид, эпоксиэтан)
179.
Способы полученияO
H
R C CH2 + C6H5 C
O OH
алкен
пероксибензойная
кислота
O
H2
R C
CH2 + C6H5 C
OH
O
бензойная
кислота
H2C CH2 + O2
Ag
t
O
180.
РеакцииЭпоксиды – трехчленные циклы,
неустойчивы, обладают высокой
реакционной способностью. Под
действием нуклеофильных реагентов
вступают в различные р-ции с
раскрытием цикла. Продукты имеют
большое практическое значение.
181.
H2O HO CH CH OH2
2
H
O
C2H5OH HO CH CH OC H
2
2
2 5
моноэтиловый эфир
H
этиленгликоля
HOCH2CH2OH
NH3
HOCH2CH2OCH2CH2OH
диэтиленгликоль
HO CH2 CH2 NH2
этаноламин
182.
б) тетрагидрофуранТетрагидрофуран. Применяется как
растворитель природных и
синтетических смол, эфиров
целлюлозы.
O
183.
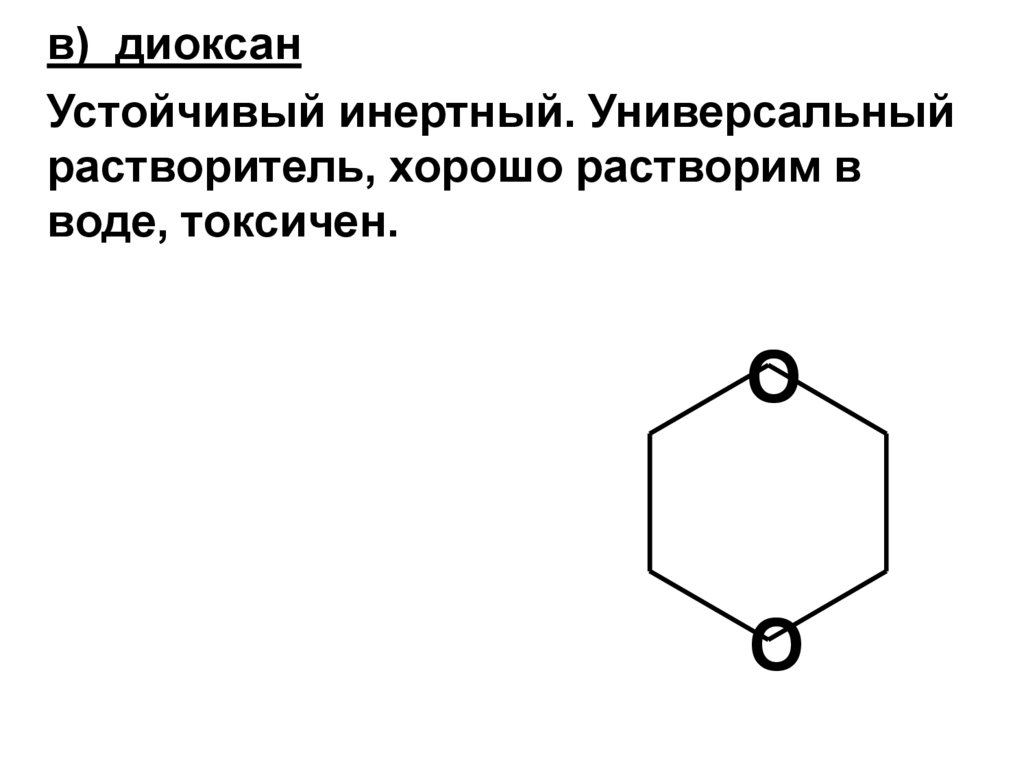
в) диоксанУстойчивый инертный. Универсальный
растворитель, хорошо растворим в
воде, токсичен.
O
O
184.
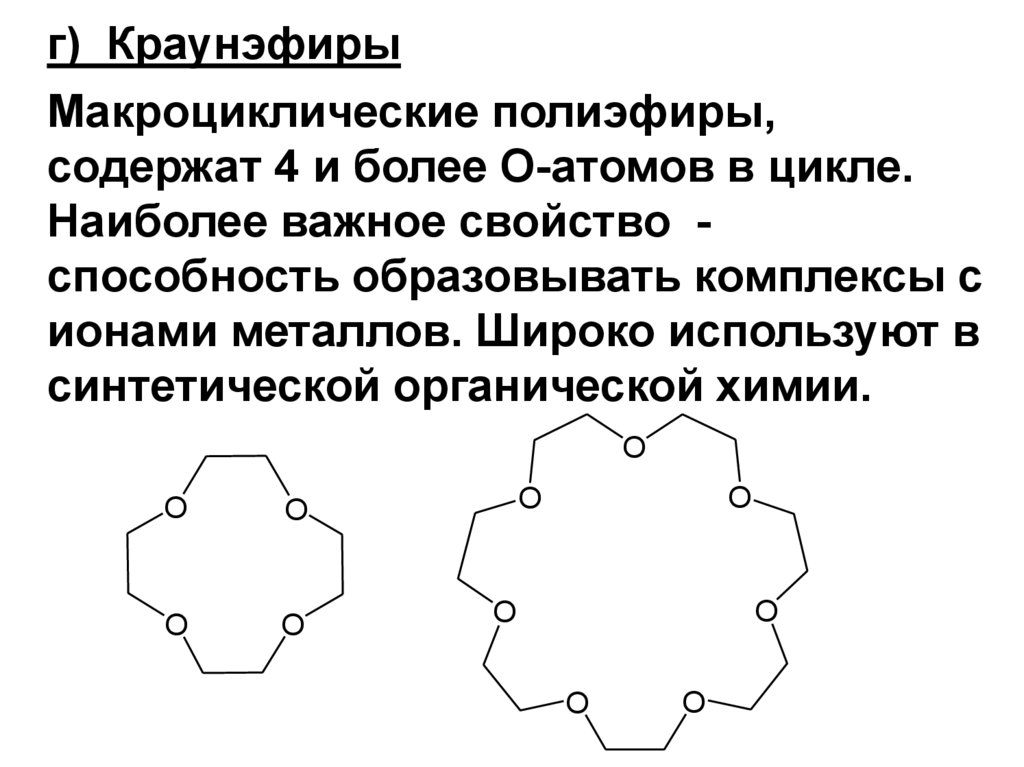
г) КраунэфирыМакроциклические полиэфиры,
содержат 4 и более О-атомов в цикле.
Наиболее важное свойство способность образовывать комплексы с
ионами металлов. Широко используют в
синтетической органической химии.
O
O
O
O
O
O
O
O
O
O
O







































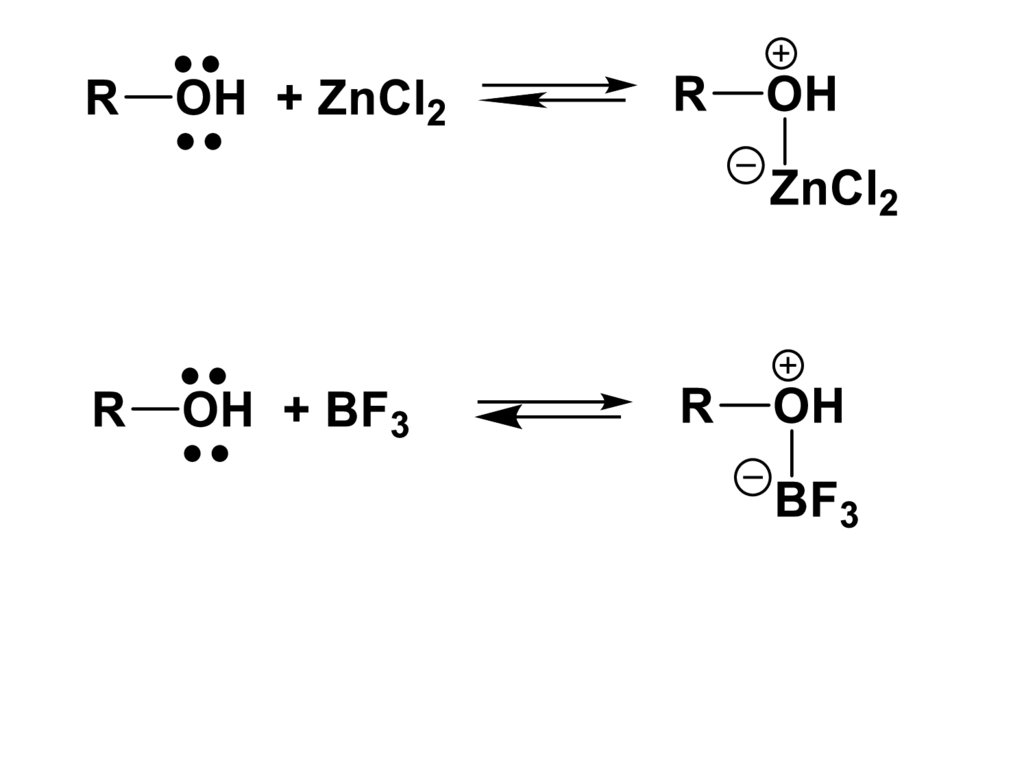






















































 Химия
Химия








