Похожие презентации:
Процесс регенерации
1.
Кафедра патологической анатомии и судебной медициныЗапорожского государственного медицинского университета
РЕГЕНЕРАЦИЯ
Лекция
профессора Туманского Валерия Алексеевича
2.
Регенерация – процесс восстановленияструктурных элементов тканей и органов
взамен утраченных
Постоянно протекает на 4-х уровнях:
молекулярно-мембранном
субклеточном
клеточном
тканево-органном
Физиологическая регенерация – самообновление биоструктур,
исчерпавших жизненный ресурс.
Репаративная регенерация – восстановление разрушенных
или повреждённых биоструктур путём образования
аналогичных структур.
Нарушение регенерации – дисрегенерация
3.
Физиологическое самообновление специализированных клетокпроисходит в соответствии с заложенной в генах клетокродителей программой поддержания популяции
специализированных клеток
При микроскопии наблюдается:
1. Митотическое деление клеток.
2. Апоптоз дефектных клеток и клеток, исчерпавших
жизненный цикл
3. Незрелые клетки на разных этапах дифференцировки.
Ритм митотического деления клеток контролируется и
постоянно поддерживается:
• гормонами,
• ростовыми факторами и цитокинами, секретируемыми
окружающими клетками в межклеточный матрикс.
4.
1. Митотическое деление клетокинициируют ростовые факторы, которые при контакте с
рецепторами клетки активируют их внутриклеточный
домен - тирозин-киназу.
Это запускает каскад фосфорилирования цитоплазматических
белков, конечные продукты которых через транскрипционные
факторы ядра, активируют
рост-регулирующие гены (протоонкогены).
Клетка из интерфазы переходит в G-1 (пресинтетическую) фазу,
в которой протоонкогены запускают биосинтез необходимых
для митоза белков, ферментов и РНК.
В следующей S-фазе клеточного цикла в клетке
развертываются хроматиды и цепи ДНК, с копий цепей ДНК
в цитоплазме синтезируются копии нуклеотидов, т.е.
происходит
5.
Для точной передачи генетической информации в S-фазе и вследующей премитотической G-2 фазе дочерние цепи ДНК
досматриваются и дефекты копирования в них быстро
исправляются репаративными ферментами. Для этого
антионкогены останавливают митоз клетки на время, нужное
для полной репарации дефектов копирования ДНК.
Только после восстановления дефектов в дочерних цепях ДНК
протоонкогены и активный комплекс Cdc-2 киназа с циклином
В инициируют транскрипцию ДНК и деление клетки
(М-фазу митоза).
В М-фазе митоза каждой дочерней клетке передается одна
материнская (старая) цепь ДНК и одна вновь
синтезированная
(новая) цепь ДНК. Появление при митозе мутантной дочерней
ДНК и невозможность ее восстановления активирует
проапоптотические гены, которые запускают апоптоз
6.
Далее происходит дифференцировка новых клеточныхпоколений
Гены-регуляторы дифференцировки в появившихся
клетках обеспечивают последовательное образование:
• множества новых рецепторов в плазмолемме для факторов
роста, гормонов и цитокинов,
• и сигнал-преобразующих молекул в цитоплазме,
работающих между рецепторами и генами ядра клетки
В процессе дифференцировки новая клетка последовательно
приобретает чувствительность к определенным
молекулярным сигналам ее микроокружения:
она мигрирует в нужный орган (или локус органа)
и обучается выполнять определенные функции
–т.е. клетка «созревает» и специализируется в сократимую,
секреторную, транспортную клетку.
7.
Репаративная регенерация – это восстановление разрушенныхили повреждённых биоструктур путём образования
аналогичных структур
Репарация – это восстановление разрушенных или
повреждённых тканей и органов путём замещения
аналогичными или другими тканями.
По особенностям репаративной (и физиологической)
регенерации популяции специализированных клеток
делятся на 4 основные группы.
1. Популяции клеток кроветворной и лимфоидной ткани
костного мозга, соединительной и мезенхимной ткани
(фибробласты, миобласты, адипоциты, хондроциты,
остеоциты), сперматогенный эпителий яичек восстанавливаются после повреждения путём митоза прогениторных
клеток-прародителей, а также мультипотентных стволовых
клеток костного мозга и тканей
Костномозговые стволовые клетки могут мигрировать в поврежденные
органы и в них обеспечивать репаративную регенерацию
8.
2. Клетки покровного эпителия (эпидермиса, роговицы иконьюнктивы, слизистых оболочек полости рта, ЖКТ,
придаточных пазух носа, ВДП и МВП), нейроглии и
эндокринных желез восстанавливаются путём митоза
тканевых стволовых и фиксированных камбиальных клеток
Репаративная пролиферация тканевых стволовых и
камбиальных клеток происходит в тканях поврежденного
органа.
Восстановление частично поврежденных поперечно-полосатых
мышц происходит путём дифференцировки новых поколений
клеток-сателлитов, находящихся в эндомизии под сарколеммой,
в мышечные клетки.
9.
3. Гепатоциты, эндотелий сосудов, эпителий канальцев почек,поджелудочной и слюнных желез, альвеолоциты, гладкие
мышцы после повреждения, не затрагивающего базальные
мембраны, восстанавливаются путём митоза неповреждённых
аналогичных клеток и путем внутриклеточной регенерации
органелл частично повреждённых клеток.
После повреждения, и клеток и базальных мембран, их
популяция восстанавливается путём митоза костномозговых и
фиксированных в органах стволовых клеток
4. Нейроны ЦНС и кардиомиоциты утрачивают у человека в
постнатальном периоде способность к митотическому
делению и после частичного повреждения восстанавливаются
путем внутриклеточной регенерации органелл.
10.
ДИСРЕГЕНЕРАЦИЯподразделяется на гиперрегенерацию и гипорегенерацию.
Гиперрегенерация обусловлена повышением уровня
индуктивных ростовых сигналов к делению клеток из
межклеточного матрикса, или повышением концентрации
рост-регулирующих гормонов, при отсутствии изменений
в генах делящихся клеток.
При гиперрегенерации формируются опухолеподобные
полипы в слизистых оболочках (полипы эндометрия), а также
опухолеподобные узлы и деформации (келлоидные рубцы)
кожи, имитирующие опухоль.
Гипорегенерация обусловлена чаще недостатком пластических
веществ, нужных для роста новых поколений клеток, реже, низкой концентрацией ростовых факторов в межклеточном
матриксе. Примером гипорегенерации могут быть трофические
язвы нижней конечности у больных стенозирующим
атеросклерозом артерий нижних конечностей с нарушением
11.
Запорожский государственный медицинский университетКафедра патологической анатомии и судебной медицины
12.
Восстановление повреждённых органов предусматривает2 процесса:
1. регенерацию составных компонентов поврежденного органа:
• репаративный ангиогенез,
• а также восстановление:
- популяций специализированных клеток,
- межклеточного матрикса и стромы органа,
- специализированных микроструктур органа,
- специализированных межклеточных контактов,
- эпителиального и серозного покрова органа.
2. Адаптивное ремоделирование органа
13.
РЕПАРАТИВНЫЙ АНГИОГЕНЕЗ. Ангиогенные факторыроста,
секретируемые
макрофагами
и
тромбоцитами,
индуцируют митоз эндотелиальных клеток и миграцию их
новых поколений по сохранившимся базальным мембранам в
зоны повреждения органа, где формируются «почки роста»,
сосудистые отпрыски и новые капиллярные трубки.
Восстановление межклеточного матрикса и базальных мембран
поврежденного органа. Трансформирующие факторы и
фиброгенные медиаторы макрофагов и лимфоцитов
активируют размножение фибробластов и синтез ними молекул
и волокон (коллагена, эластина) межклеточного матрикса, а
также молекул базальных мембран.
В новых клетках появляются трансмембранные адгезивные
рецепторы (кадгерины, интегрины, селектины, иммуноглобулины), внутренние домены которых связаны с локомоторным
цитоскелетом клетки, а наружные – связываются с белками
внеклеточного матрикса и обеспечивают миграцию новых
клеток в поврежденные зоны органа.
14.
Восстановлениеповрежденных
специализированных
микроструктур органа происходит при взаимодействии
клеточных адгезивных рецепторов с разветвленными
ламининами
и
фибронектинами
базальных
мембран,
имеющими сайты как для адгезивных рецепторов клеток, так и
для межклеточных молекул и волокон. Комплементарное
взаимодействие
рецепторов
клеток
с
ламининомфибронектином
базальных
мембран
и
молекулярноволокнистым
межклеточным
матриксом
обеспечивает
самосборку канальцев, альвеол и т.д.
Эти же трансмембранные клеточные адгезивные рецепторы
обеспечивают восстановление специализированных межклеточных контактов (десмосом, полудесмосом, синапсов и др.)
15.
Варианты восстановления поврежденных органов:1. Полное восстановление структуры и функции органа
(реституция). Развивается: на месте ссадины кожи, на месте
поверхностной эрозии слизистой оболочки, после мозаичного
повреждения эндотелия, эпителия канальцев, протоков,
бронхиол без повреждения базальных мембран.
2. Неполное восстановление структуры и функции органа
(субституция) и репаративное ремоделирование органа.
Развивается после: инфаркта, некроза органа; обширного
гнойно-некротического воспаления; обширного ровоизлияния;
разрушения сосудов, протоков, бронхиол, канальцев (с
базальными мембранами); мозаичной гибели нейронов и
кардиомиоцитов; глубоких язв.
В процессе ремоделирования восстановившегося после
повреждения органа изменяется объем его камер и
конфигурация: формируется гидроцефалия, гидронефроз,
гидроцеле, ретенционная киста; изменяются объемы камер и
толщина стенок желудочков сердца.
16.
Заживление поверхностных ссадин кожи происходит путемэпителизации
ссадины под струпом
(под корочкой из
свернувшейся крови).
Заживление ран кожи первичным натяжением происходит в не
инфицированных ранах с ровными краями с последующим
образованием линейного рубца.
В первые двое суток отмечается первичное очищение раны от
клеточного детрита нейтрофилами и моноцитарными
макрофагами.
В течение 3-10 суток в ране образуется грануляционная ткань (с
краёв раны навстречу друг другу растут новообразованные
сосуды, фибробласты усиливают синтез волокон
соединительной ткани). С краев раны наползает
пролиферирующий эпидермис.
Эпителизация раны и образование нежного рубца завершается
на 14-21 сутки.
17.
Заживление вторичным натяжением происходитпри инфицированных глубоких и размозженных ранах.
1. В первые 4 суток в ране вначале развивается гнойное
воспаление
2. Затем до 2-й недели рана очищается от мертвых масс
макрофагами.
3. На 2-3-й неделе появляется видимая глазом грануляционная
ткань.
4. На 4-6-й неделе доминирует пролиферация фибробластов и
синтез коллагена (фибропластическая фаза), а образование
плотного рубца завершается к концу 2-3 месяца.
18.
Запорожский государственный медицинский университетКафедра патологической анатомии
19.
Компенсаторно-приспособительные процессыПриспособление – adaptare – совокупность биологических
процессов, обеспечивающих приспособление биосистемы к
изменяющимся условиям среды
Компенсация – compensatio (возмещение) – это частный вид
приспособления, направленный на возмещение дефекта
органа или ткани
Аккомодация клеток – это микроскопически выявляемые
процессы приспособления клеток к изменившейся
внеклеточной среде
Морфология процессов аккомодации клеток
1. Пролиферация (увеличение числа митозов) и гиперплазия
(увеличение числа)
клеток (при возрастании уровня
митогенных ростовых факторов во внеклеточном матриксе)
20.
2 Рост числа апоптотически измененных клеток (привозрастании уровня апоптогенных сигналов из внеклеточного
матрикса).
3. Гипертрофия клеток:
• адаптивная гипертрофия мышц тела при регулярных
тренировках,
• регенерационная гипертрофия одиночных нейронов с
гиперплазией органелл, выживших в зоне некроза мозга).
4. Эндорепликация и полиплоидия (увеличение числа хромосом
в ядре, кратное гаплоидному (одинарному) набору непарных
хромосом). У человека все клетки (кроме гамет) диплоидны.
Образуются три-, тетра-, гексаплоидные и т. д. клетки с
повышенной функциональной активностью.
5. Амитоз (прямое деление ядра без репликации ДНК) с
образованием двух- или многоядерной клетки (клетка при
делении ядра выполняет свои функции, но далее не сможет
вступить в митоз).
21.
6. Метаплазия (призматического эпителия бронхиол в многослойный плоский эпителий у курильщиков).Метаплазия – превращение одного вида ткани/эпителия в
другой в пределах зародышевого листка. Представляет собой
изменение обычной дифференцировки новых поколений клеток
под влиянием изменившихся факторов внеклеточной среды.
22.
ГИПЕРТРОФИЯ ОРГАНА – (hyper–чрезмерно, trophe–питание) –увеличение объёма, размеров, массы и функциональной
активности органа за счёт увеличения количества или
объёма его специализированных структур (истинная
гипертрофия)
Разновидности гипертрофии органов по механизмам развития:
1. Компенсаторная (рабочая).
2. Викарная (заместительная) гипертрофия одного из парных
органов после удаления второго
3. Нейрогуморальная:
- фолликулярная гипертрофия щитовидной железы при
повышенном уровне тиреотропного гормона,
- железисто-кистозная гиперплазия эндометрия при избытке
эстрогенов,
- гинекомастия у мужчин при снижении андрогенной
активности яичек и повышении их эстрогенной активности
23.
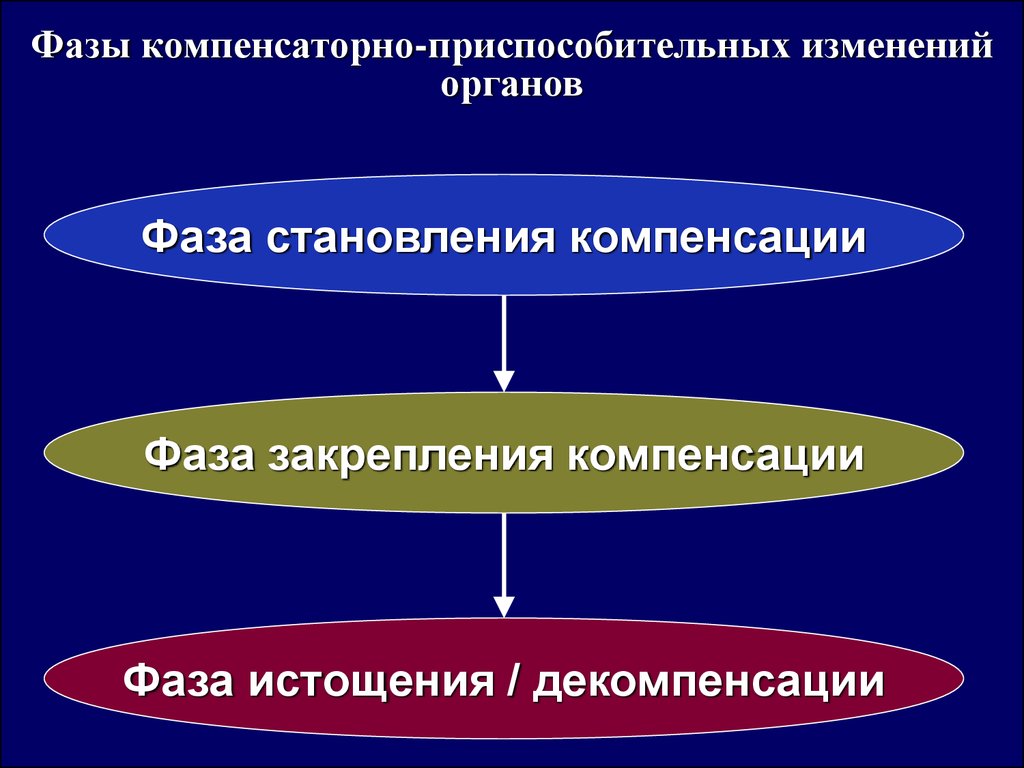
Фазы компенсаторно-приспособительных измененийорганов
Фаза становления компенсации
Фаза закрепления компенсации
Фаза истощения / декомпенсации
24.
АТРОФИЯ ОРГАНА – снижение массы, размеров и объёмаоргана
Разновидности атрофии по причине развития:
1. Дисфункциональная атрофия (от бездействия)
2. Атрофия органа от недостаточного его кровоснабжения
3. Нейротическая атрофия (мышц после их денервации)
4. Атрофия от воздействия химических и физических факторов























 Медицина
Медицина








