Похожие презентации:
Алканы и их свойства. Получение
1.
Алканы2.
• Предельные углеводороды, состоящие изатомов углерода и водорода, соединенные
между собой одинарной связью.
• Общая формула CnH2n+2
• При отрыве от молекулы алкана атома
водорода образуются одновалентные
радикалы:
метил CH3пропил C3H7этил
C2H5бутил C4H9-
3.
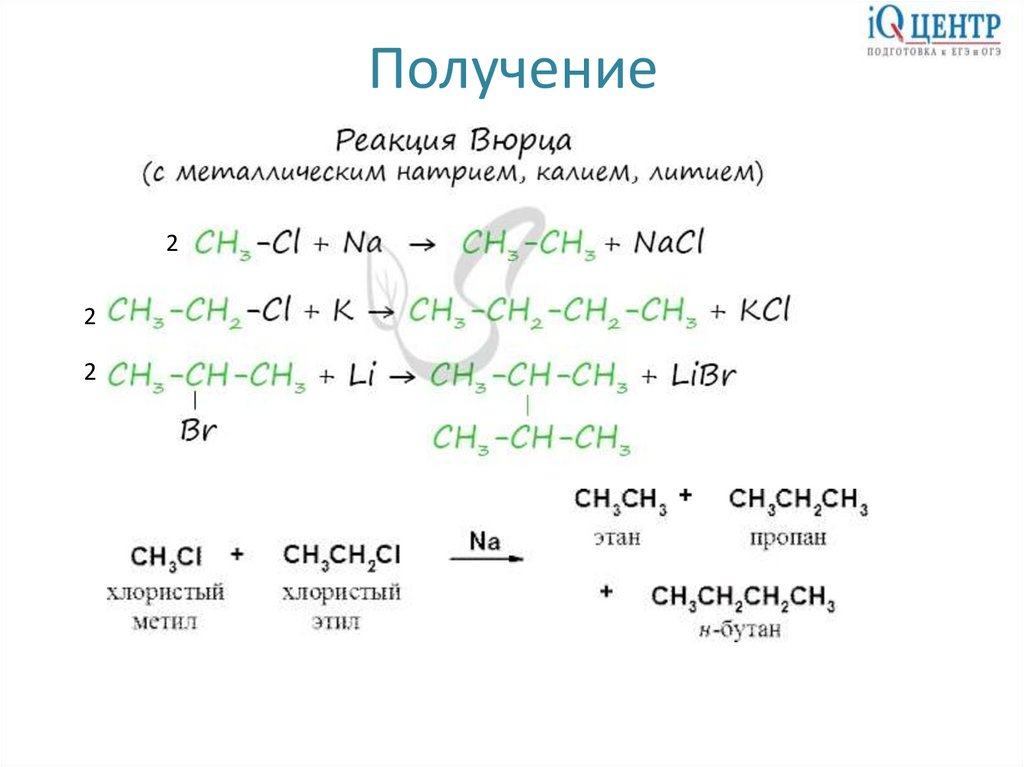
Получение2
2
2
4.
• Синтез по Кольбе, электролиз конц.водныхрастворов солей карбоновых кислот
• Реакция Дюма, декарбоксилирование
солей карбоновых кислот
5.
• Гидрирование ненасыщенных углеводородовна Pt/Ni/Pd катализаторе, t
R-СH=CH-R+H2 = R-CH2-CH2-R
• Гидрирование оксидов углерода
nCO+(2n+1)H2=CnH2n+2+nH2O (Co, t)
CO+3H2=CH4+H2O
(Ni, t)
CO2+4H2=CH4+2H2O
(Ni, t)
6.
• Из карбидов металлов(лаб)• Переработка нефти, природного газа,
попутного нефтяного газа, каменного угля
• Газификация твердого топлива
С+2H2=CH4 (Ni, p, t)
7.
Химические свойстваКачественные реакции
Не обесцвечивает р-р KMnO4 и бромную
воду
Горит голубоватым пламенем
Реакции окисления
Горение – полное окисление
CnH2n+2+(1.5n+0.5)O2=nCO2+(n+1)H2O+Q (t)
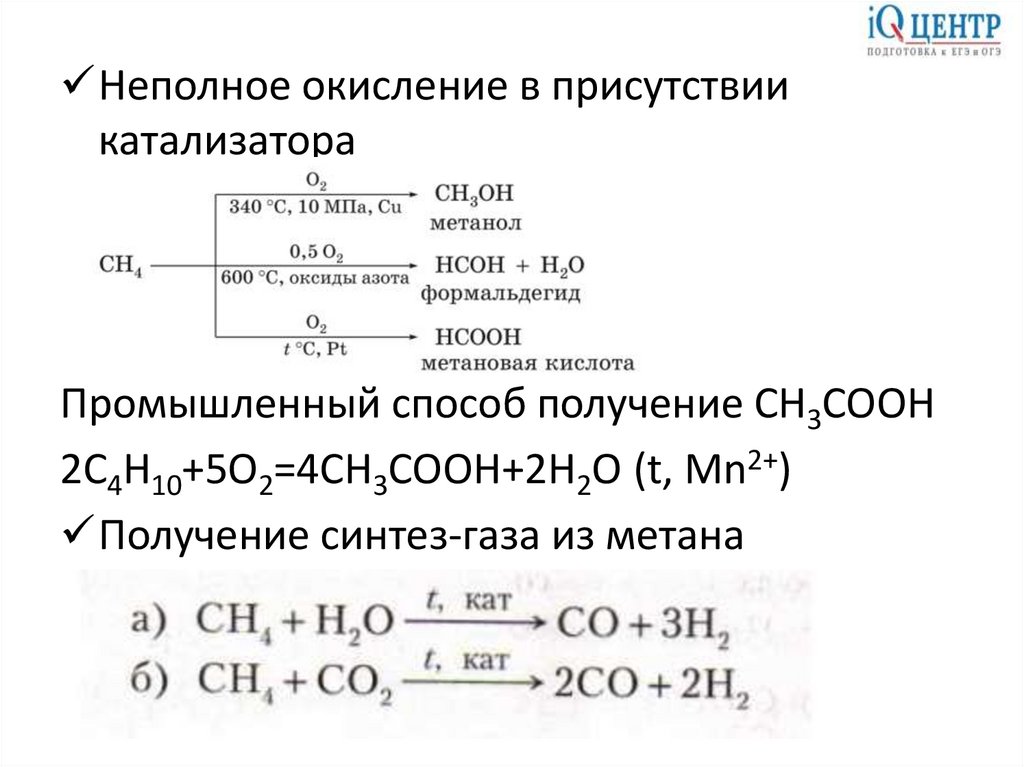
8.
Неполное окисление в присутствиикатализатора
Промышленный способ получение CH3COOH
2C4H10+5O2=4CH3COOH+2H2O (t, Mn2+)
Получение синтез-газа из метана
9.
Термолиз2CH4=C2H2+3H2(t=1500 C)
CH4=C+2H2(t>1500 C)
+риформинг
10.
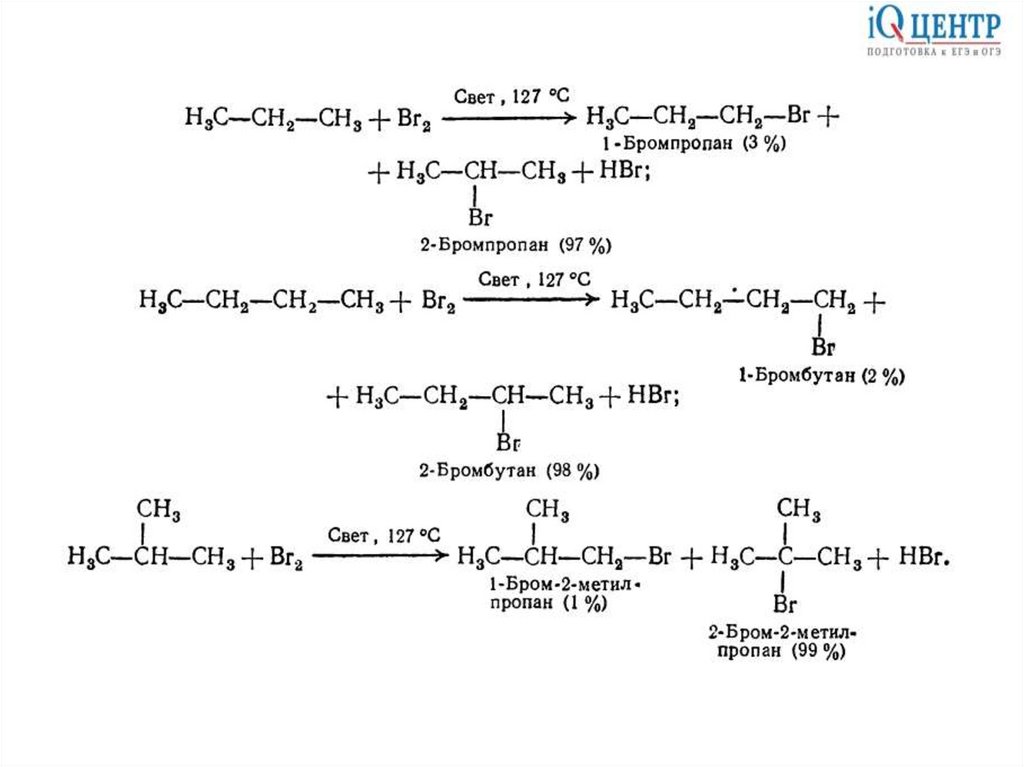
Реакции радикального замещенияГалогенирование
11.
12.
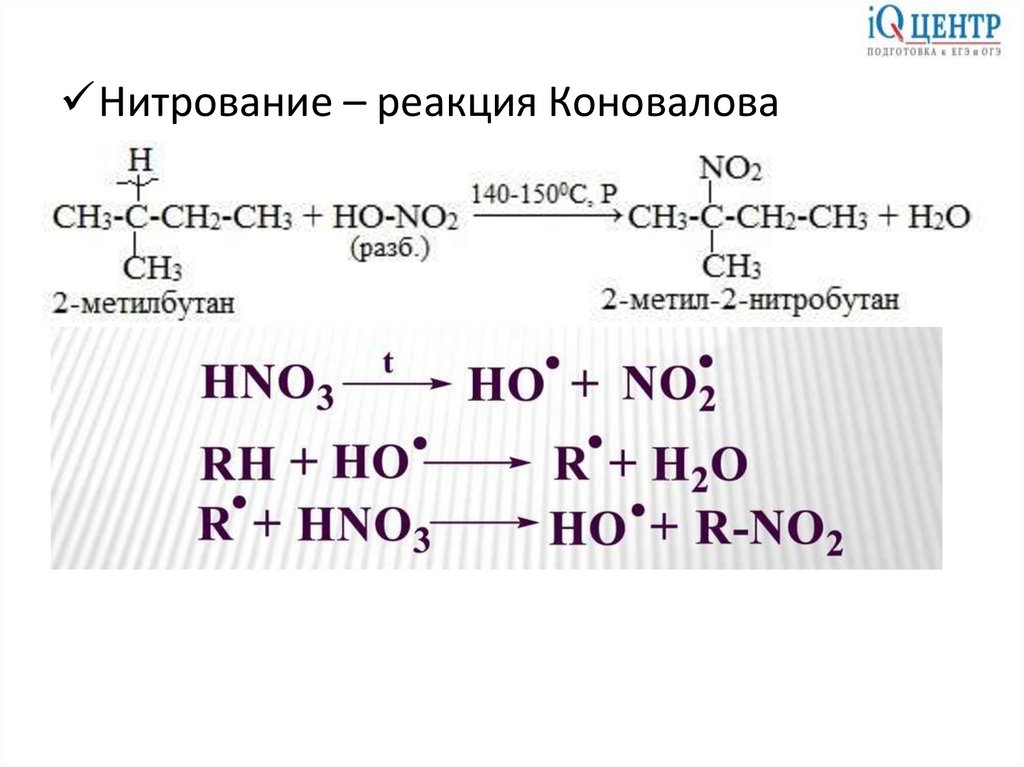
Нитрование – реакция Коновалова13.
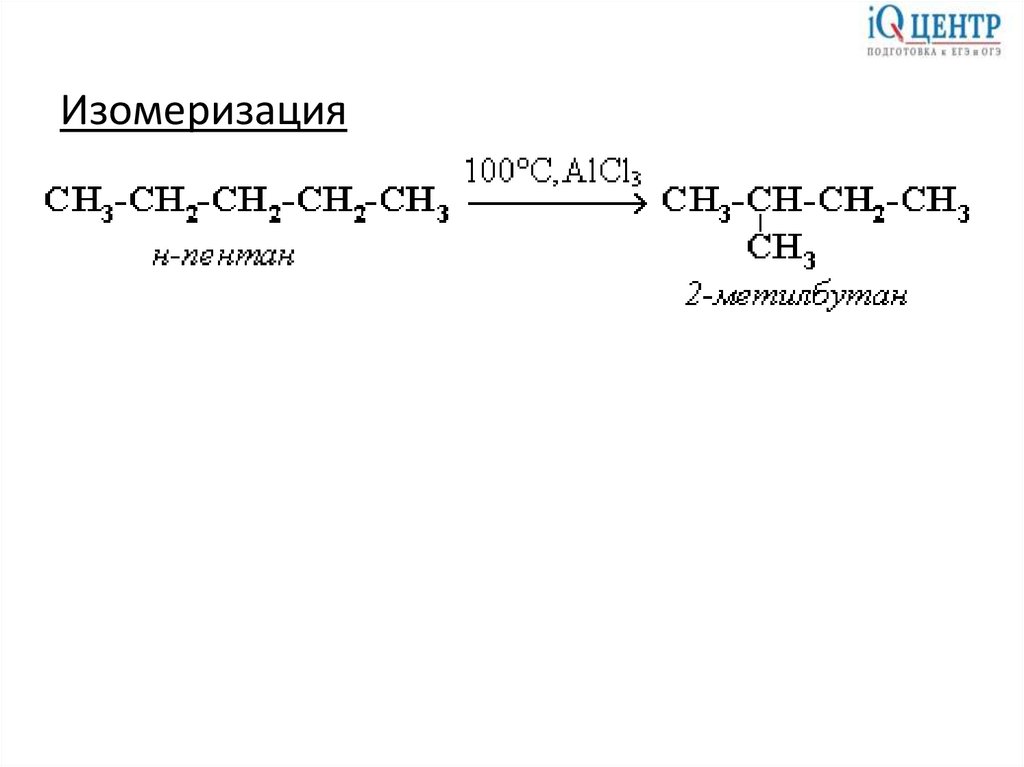
Изомеризация14.
Применение1)Топливо
2)Получение органических кислот, сажи,
непредельных углеводородов, H2
3)Получение фреонов, хлороформа(СHCl3)









 Химия
Химия








