Похожие презентации:
Органическая химия. Алканы
1. Органическая химия
Алканы2.
Алка́ны - (парафи́ны, также насы́щенные или преде́льныеуглеводород
́ ы) — ациклические углеводороды линейного или
разветвлённого строения, содержащие только простые
(одинарные) связи, все атомы находятся в состоянии sp3
гибридизация, и образующие гомологический ряд с общей
формулой CnH2n+2.
3.
Физические свойстваПри стандартных условиях, установленных
ИЮПАК (давление 105 Па, температура 0 °C), неразветвлённые
алканы с CH4 до C4H10 являются газами, с C5H12 до C15H32 —
жидкостями, а начиная с C16H34 и далее — твёрдыми веществами
Температуры плавления и кипения увеличиваются с
молекулярной массой и длиной главной углеродной цепи.
Температуры плавления и кипения понижаются от
менее разветвлённых к более разветвлённым. Так,
например, при 20 °C н-пентан — жидкость,
а неопентан — газ
Газообразные и твердые алканы не пахнут,
некоторые жидкие алканы обладают
характерным «бензиновым» запахом
Все алканы бесцветны, легче воды и
нерастворимы в ней. Алканы хорошо
растворяются в
органических растворителях, жидкие
алканы (пентан, гексан) используются как
растворители.
4.
Номенклатура алканов1. Выбираем самую длинную углеродную цепь
2. Нумеруем главную цепь с того конца, к которому ближе всего находится
акильный заместитель,
*(если заместители на равном удалении от концов – то с того края где их
больше )
*(если заместители на равном удалении от концов и они разные – то со того
края у которого старший
3. В начале название перечисляют заместители в алфавитном порядке с
указанием номеров атомов углерода, с которыми они связаны. Если в
молекуле имеется несколько одинаковых заместителей, то цифрой
указывают нахождение каждого из них в главной цепи и перед их
названием соответственно ставят частицы ди-, три-, тетра- и т.д
4.Основой названия служит наименование предельного
углеводорода с тем же количеством атомов углерода, что и в
главной цепи
5.
ИзомерияДля алканов возможна изомерия только
углеродного скелета
Возможна она начиная с
бутана – у него всего два
изомера
А у пентана возможно
уже пять изомеров
6.
Методы полученияАлканы входят в состав природного газа: метан 80-97%, этан 0.5-4%,
пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
1.Выделение из природного газа (в промышленности).
2. Ректификация нефти(в промышленности)
7.
3.Синтез Фишера — Тропша (из синтез газа)nCO + (2n+1)H2 → CnH2n+2 + nH2O
Пример: 21H₂ + 10CO → C₁₀H₂₂ + 10H₂O
4.Декарбоксилирование солей карбоновых кислот – реакция Дюма
(сплавление с щёлочью)
RCOONa + NaOH → RH + Na2CO3 (t°)
2H3С –СН2 – СООNа + 2Н2О → H3С–СН2–СН2–СН3 + 2NаOH + 2СО2 +H2
5.Реакция Вюрца(В настоящее время реакция Вюрца практически не
используется)
2R-X + 2Na → R-R + 2NaX
Пример: 2H5С2–Br + 2Na → H5C2–C2H5 + 2NaBr
6.Электролиз водных растворов солей карбоновых кислот – синтез
Кольбе
RCOONa эл→ток R-R + CO2 + …(продукты элетролиза метлла)
Анод: удвоенный радикал и углекислый газ
Катод: продукты элетролиза метлла
Пример:2H3С –СН2 – СООNа + 2Н2О → H3С–СН2–СН2–СН3 + 2NаOH + 2СО2 +H2
8.
5. Гидрирование непредельных углеводородов в присутствиикатализаторов(Ni; Pt; Pd)
СnН2n + Н2 → СnН2n+2
СnН2n-2 + 2Н2 → СnН2n+2
6.Синтез Гриньяра
H3C-Cl + Mg → H3C-Mg-Cl (.Синтез реактива Гриньяра)
H3C-Mg-Cl + H3C-Cl → H3C-CH3 + MgCl2
Специфические реакции получения метана
1.Гидролиз карбида алюминия
Аl4С3 + 12Н2О → 3СН4 + 4Аl(ОН)3
Аl4С3 + 12HCl → 3СН4 + 4АlCl3
2.взаимодействием простых веществ(400°C,P,kat)
С + 2H2 → CH4
3.Восстановление оксидов углерода(t°,Ni; Pt; Pd;)
СO + H2 → CH4 + H2O
СO2 + H2 → CH4 + H2O
9.
Химические свойства алканов(для алканов свойственны радикалные реакции замещения)
1. Галогенирование(хлорирование или бромирование)(на свету!)
CH4 + Cl2 → CH3Cl + HCl,
CH3Cl + Cl2→ CH2Cl2 + HCl,
CH2Cl2 + Cl2 → 2CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
2.Сульфохлорирование алканов – реакция Рида
RH + SO2 + Cl2 → RSO2Cl + HCl
CH₄ + SO₂ + Cl₂ → CH₃SO₂Cl + HCl
3.Нитрование – (рекция Коновалова)
R–H + HNO3 → R–NO2 + H2O
CH₄ + HNO₃ → CH₃NO₂ + H₂O
10.
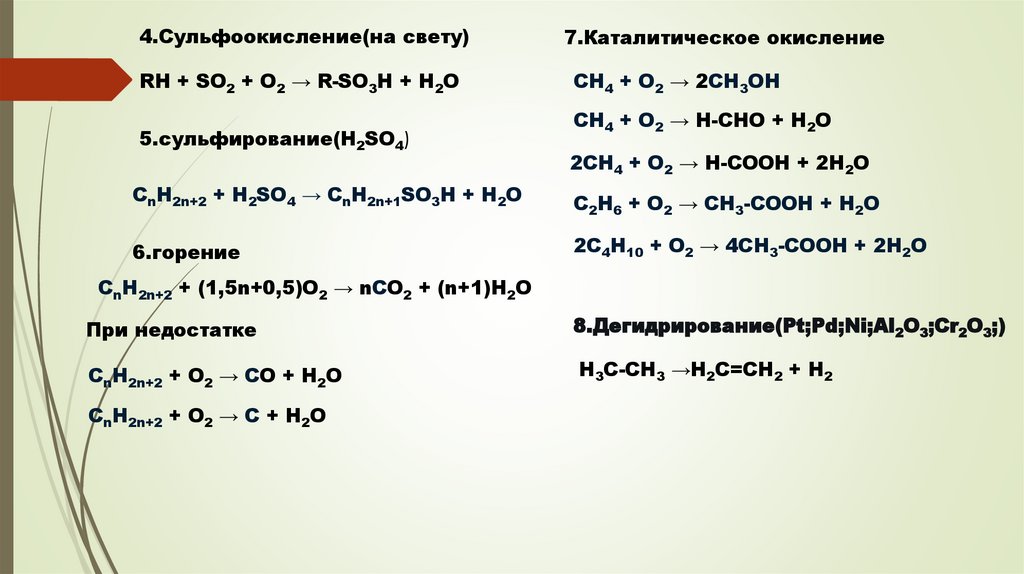
4.Сульфоокисление(на свету)7.Каталитическое окисление
RH + SO2 + O2 → R-SO3H + H2O
CH4 + O2 → 2CH3OH
5.сульфирование(H2SO4)
CH4 + O2 → H-CHO + H2O
2CH4 + O2 → H-COOH + 2H2O
CnH2n+2 + H2SO4 → CnH2n+1SO3H + H2O
C2H6 + O2 → CH3-COOH + H2O
6.горение
2C4H10 + O2 → 4CH3-COOH + 2H2O
CnH2n+2 + (1,5n+0,5)O2 → nCO2 + (n+1)H2O
При недостатке
8.Дегидрирование(Pt;Pd;Ni;Al2O3;Cr2O3;)
CnH2n+2 + O2 → CO + H2O
H3C-CH3 →H2С=CH2 + H2
CnH2n+2 + O2 → C + H2O
11.
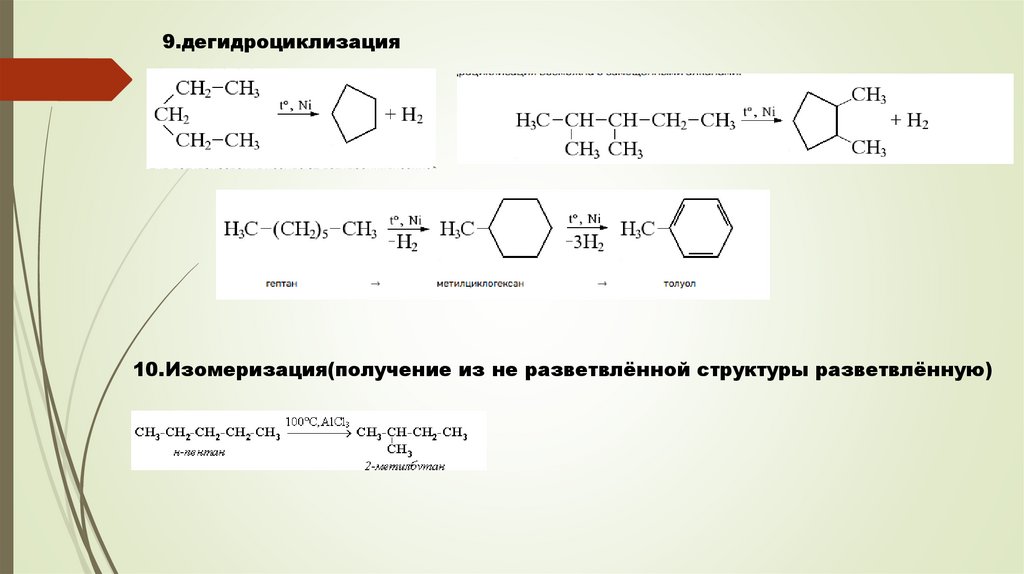
9.дегидроциклизация10.Изомеризация(получение из не разветвлённой структуры разветвлённую)
12.
11.Крекинг(ломание большого алкана на алкан и алкен поменьше)C₁₀H₂₂ (декан) → C₈H₁₈ (октан) + C₂H₄ (этилен)
C₁₀H₂₂ (декан) → C₅H₁₂ (пентан) + C₅H₁₀ (пентен)
Специфические свойства метана
1.Пиролиз метана
CH4 → С + 2H2 (при 1000°C)
2CH4 → С2H2 + 3H2 (при 1500°C)
2.Конверсия метана
CH4 + H2O → CO + 3H2
CH4 + CO2 →2CO + 2H2










 Химия
Химия








