Похожие презентации:
Этические аспекты проведения доклинических исследований
1. Лекция 2 ЭТИЧЕСКИЕ АСПЕКТЫ ПРОВЕДЕНИЯ ДОКЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
2. Этические проблемы в системе доклинических и клинических испытаний ЛС
Цель доклинических исследований ЛС – получениенаучными методами оценки и доказательств их эффективности
и безопасности.
Доклинические исследования включают в себя химические.
Физические,
биологические.
Микробиологические,
фармакологические,
токсикологические
и
другие
экспериментальные исследования.
Доклинические исследования в Украине проводятся согласно
международным правилам лабораторной практики – Good
Laboratory Practice – GLP – это процедуры и требования в
отношении оценок ЛС и использования экспериментальных
животных при этом.
Доклинические
исследования
ЛС
проводятся
в
соответствии с международными правилами, с максимальной
гуманностью умерщвления и проведения самих экспериментов.
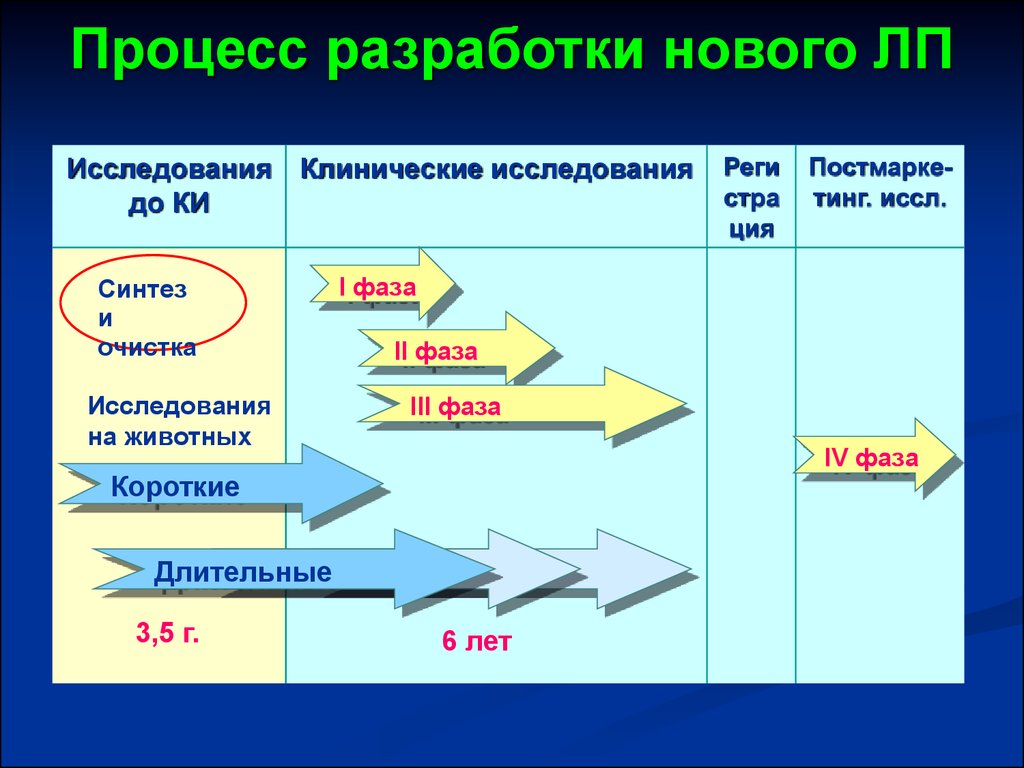
3. Процесс разработки нового ЛП
Исследования Клинические исследованиядо КИ
Синтез
и
очистка
Исследования
на животных
Постмаркетинг. иссл.
І фаза
ІІ фаза
ІІІ фаза
ІV фаза
Короткие
Длительные
3,5 г.
Реги
стра
ция
6 лет
4. Регулирование исследований
Исследования наживотных:
Клинические
исследования:
Закон
Закон
Украины «О защите
животных от жестокого
обращения», 2006 (раздел ІІІ,
ст.26)
Нормативное
Украины «О
лекарственных средствах»,
1996, (ст.7, 8)
регулирование (приказы, инструкции)
Европейская конвенция о
защите
позвоночных
животных,
которые
используются
для
исследовательских и других
научных целей, 1986
Хельсинская декларация
Рекомендации для врачей по
проведению
биомедицинских
исследований с участием человека
в качестве объекта исследования
Всемирная Медицинская
Ассоциация, 1964-2004
5. Этические принципы
Обоснованность (необходимость)исследований. Альтернативные
методы
Возможность получить в ходе
исследования необходимый
результат (результативность)
Адекватность количества
исследуемых
Минимизация риска, дискомфорта
Проведение исследований в
соответствии с GLP, GCP
6.
Требования этичности эксперимента-
-
-
-
-
В принципе использование животных для научных целей
нежелательно;
- по возможности следует применять методы, не требующие
использования животных;
При существующем уровне знаний использование животных является
неизбежным;
Моральный долг ученого – гуманно относиться к подопытным
животным, по возможности не причинять им боли и неудобств и
постоянно стремиться изыскивать способы поучения того же
результата без привлечения живых животных;
- животным, предназначенным для медико-биологических
исследований, следует обеспечивать наилучшие из возможных
условия их содержания.
В последнее время для решения этических проблем руководствуются
концепцией «трех R» Рассела и Берча: замена (replacement),
уменьшение (reduction), повышение качества (refinement).
7. Принцип «трех R»
Замена ("replacement") - переход, по меревозможности, на использование вместо
животных математических моделей,
компьютерного моделирования и
биологических систем в искусственных
условиях или замена высокоразвитых
животных на те, что стоят на более низком
уровне эволюционного развития
Сокращение ("reduction") - снижение
количества животных, используемых в
исследованиях, до минимума,
необходимого для получения достоверных
результатов
Смягчение ("refinement") - использование
более щадящих методик для снижения боли
и страданий животных
8.
9.
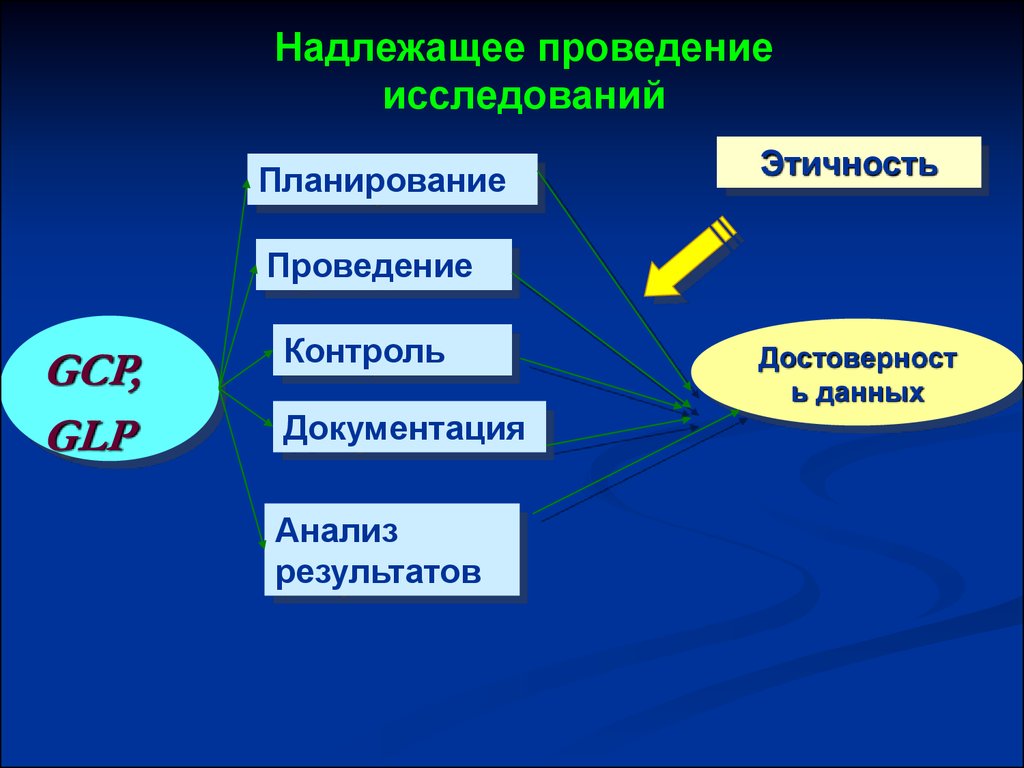
Надлежащее проведениеисследований
Планирование
Этичность
Проведение
GCP,
GLP
Контроль
Документация
Анализ
результатов
Достоверност
ь данных
10. Альтернативные методы экспериментирования
--
-
-
-
улучшенная система хранения и использования информации, а также
обмен информацией об экспериментах, уже проведенными над
животными, во избежание повторения таких процедур;
использование физических и химических приемов, а также прогнозов,
основанных на физических и химических свойствах молекул;
- использование математических и компьютерных моделей, в том
числе моделирование количественных отношений типа «структура –
действие»; моделирование биохимических и физиологических
процессов;
использование in vitro-методов, в том числе подклеточных фракций,
кратковременного хранения слоев ткани, суспензии клеток, а также
клеточное и органотипичное выращивание;
использование низших организмов с ограниченной
чувствительностью;
использование позвоночных животных на ранних этапах их онтогенеза;
эксперименты с участием людей, включая участников-добровольцев,
для выявления побочных эффектов, после выведения ЛС на рынок.
11. «Чем полнее будет проделан опыт на животных, тем менее часто больным придется быть в положении опытного объекта со всеми печальными послед
«Чем полнее будет проделан опыт наживотных, тем менее часто больным
придется быть в положении опытного
объекта со всеми печальными
последствиями»
И.П. Павлов
Необходимость проведения ДИ ЛС
- Проведенные исследования на животных в соответствии с
-
-
современными требованиями являются основой для оценки их
безопасного использования в медицинской практике;
Эксперименты на животных необходимы для развития медикобиологических наук, поскольку позволяют лучше понимать
законы и механизмы жизненных процессов;
Изучение повреждающего действия исследуемого препарата на
организм экспериментальных животных позволяет определить,
какие органы и ткани наиболее чувствительны к данному
веществу и на что следует обратить особое внимание при
клинических испытаниях.
12. Этический комитет – гарант соблюдения этичности при проведении исследований
Все исследования (доклинические иклинические) могут проводиться только
после их одобрения этическим комитетом
Закон Украины «О защите
животных от жестокого
обращения», 2006 (раздел ІІІ,
ст.26)
Закон Украины «О лекарственных
средствах», 1996, (ст.7, 8)
Цель Комитета:
содействовать внедрению современных этических стандартов и
соблюдению принципов высокой морали при проведении
исследований с привлечением человека (пациента/волонтера) и
животных, защита достоинства и здоровья человека, а также
обеспечения гуманного отношения к животным
13. Рекомендации к составу ЭК
Не менее 5 человекЛица обоего пола и разного возраста,
а также наличие в составе ЭК:
доклинические исследования:
врача-ветеринара с опытом
работы с лаб. животными,
отвечающего за содержание
животных в учреждении
научного сотрудника учреждения
с опытом работы с лаб.
животными
лицо, представляющее интересы
общества относительно
содержания и использования
животных (не сотрудник
учреждения)
клинические
исследования:
1 человека, не
являющегося научным
сотрудником
1 человека, не
являющегося сотрудником
клинической базы, где
проводится исследование
ЭК ведет список своих членов с указанием их квалификации
14. Деятельность ЭК
Одобрение исследований (планпроведения, этичность, квалификация
исследователей, пригодность помещений,
внесение изменений)
Мониторинг соблюдения этичности
выполнения исследований
Регламентация каждого этапа деятельности (СОП)
Ведение документации по рассмотрению
исследований и ее архивирование
Открытость и доступность для всех
заинтересованных сторон (исследователь,
спонсор)
Возможность привлечения к своей работе
независимых экспертов по специальным вопросам
Обучение членов ЭК
15. ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Фармакологическая активностьдействующего
вещества
(первичная
и
вторичная
фармакодинамика;
фармакология безопасности);
Фармакокинетика
(абсорбция,
распределение,
метаболизм,
выведение);
Токсикология – определение
потенциального
риска
при
применении человеком.
16.
Внедрение фармакологических препаратовв клинику – поэтапный процесс, который
включает в себя оценку данных безопасности,
полученных в результате исследований на
животных и в клинических исследованиях
Данная информация является важной для
установления стартовой дозы при проведении
клинических
исследований,
а
также
определения параметров мониторинга в
клинике потенциальных побочных реакций
ICH Guideline M3(M) Maintenance of the
ICH guideline on non-clinical safety studies for
the conduct of human clinical trials for
pharmaceuticals
17. ГРУППЫ ЛС, ДЛЯ КОТОРЫХ НЕОБХОДИМО ПРОВЕДЕНИЕ ДИ
Новые ЛС;Препараты – генерики;
ЛС, для которых внесены изменения,
требующие новой регистрации;
ЛС растительного происхлждения;
ЛС биологического происхождения;
Радиофармацевтические средства.
18. НОВЫЕ ЛС
ВИДЫ ТОКСИКОЛОГИЧЕСКИХИССЛЕДОВАНИЙ:
-острая
токсичность (одноразовое введение);
-хроническая токсичность (многоразовое
введение);
-репродуктивная токсичность;
-генотоксичность;
-канцерогенность;
-специфические виды токсичности
(иммунотоксичность, местнораздражающее
действие, аллергенность, риск для окружающей
среды).
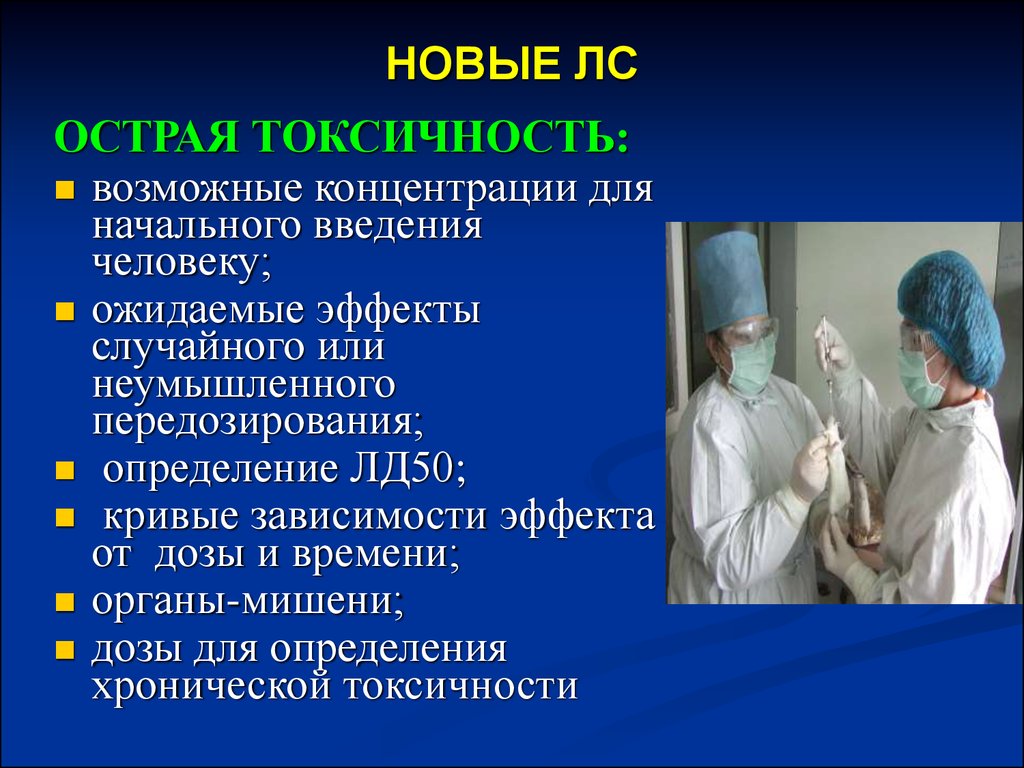
19.
НОВЫЕ ЛСОСТРАЯ ТОКСИЧНОСТЬ:
возможные концентрации для
начального введения
человеку;
ожидаемые эффекты
случайного или
неумышленного
передозирования;
определение ЛД50;
кривые зависимости эффекта
от дозы и времени;
органы-мишени;
дозы для определения
хронической токсичности
20.
НОВЫЕ ЛСХРОНИЧЕСКАЯ ТОКСИЧНОСТЬ:
- зависимость от дозы и длительности
экспозиции;
- определение органов-мишеней;
- оценка видовой чувствительности;
- обратимость выявленных нарушений.
21.
НОВЫЕ ЛСЭМБРИОТОКСИЧНОСТЬ И
ТЕРАТОГЕННОСТЬ НОВЫХ ЛС
проводят в случае, если ЛС
предлагается для использования
при беременности
ИССЛЕДОВАНИЯ ГОНАДОТОКСИЧНОСТИ НЕ
ПРОВОДЯТСЯ В СЛУЧАЕ:
-доказано отсутствие системного действия ЛС
на организм;
-препарат используется женщинами
недетородного возраста.
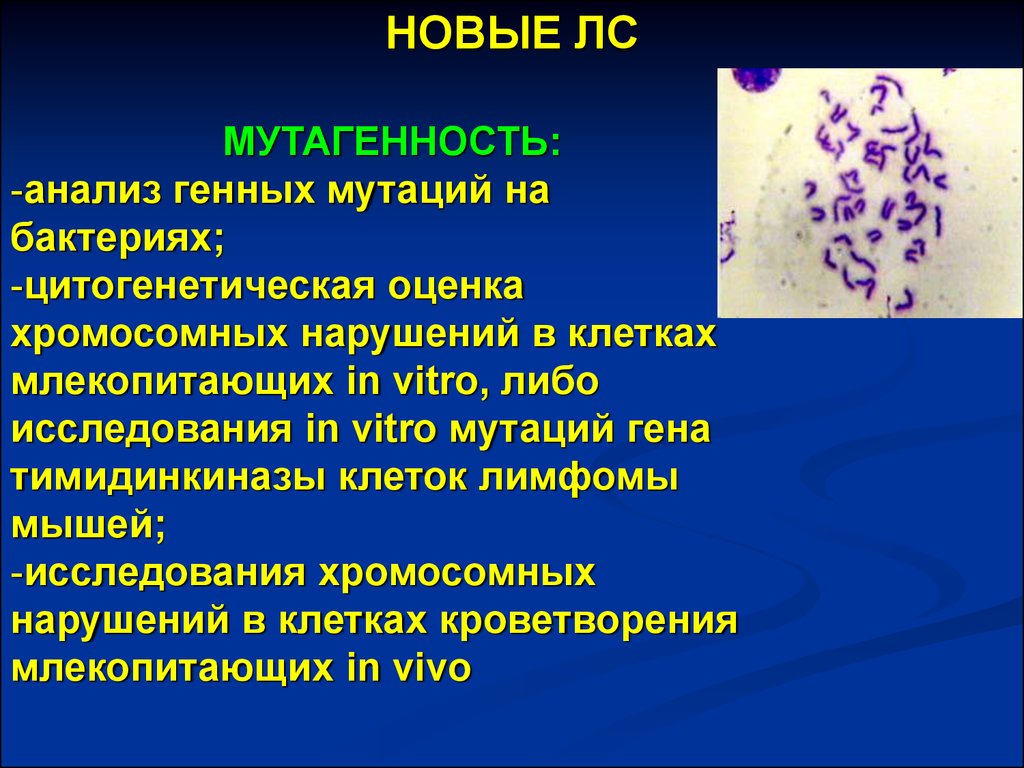
22.
НОВЫЕ ЛСМУТАГЕННОСТЬ:
-анализ генных мутаций на
бактериях;
-цитогенетическая оценка
хромосомных нарушений в клетках
млекопитающих in vitro, либо
исследования in vitro мутаций гена
тимидинкиназы клеток лимфомы
мышей;
-исследования хромосомных
нарушений в клетках кроветворения
млекопитающих in vivo
23.
НОВЫЕ ЛСКАНЦЕРОГЕННЫЙ ПОТЕНЦИАЛ:
Исследования проводят если:
-получен позитивный результат в отношении
мутагенности нового ЛС;
-ЛС планируется использовать на протяжении 6
месяца и более;
-ЛС используется частыми и длительными
курсами при хронических заболеваниях.
24.
НОВЫЕ ЛСКАНЦЕРОГЕННЫЙ ПОТЕНЦИАЛ: (продолжение)
- ЛС относится к классу веществ с канцерогенным
действием;
-структура-активность указывает на риск
канцерогенеза;
-наличие неопластических изменений при
изучении токсичности препарата при повторных
введениях;
-«удержание» тканью на протяжении длительного
времени вещества/метаболита, что приводит к
развитию местной реакции, либо других
патофизиологических изменений.
25.
НОВЫЕ ЛСВ случае местного применения
(кожа, глаза), а также при условии
гарантии отсутствия системного
действия
ЛС,
проводят
доклинические
исследования
ТОЛЬКО
местных
эффектов
(местнораздражающее действие,
сенсибилизирующие,
фотосенсибилизирующие,
канцерогенные) при нанесении
препарата на кожу/слизистые.
26.
РЕЗУЛЬТАТЫ ТОКСИКОЛОГИЧЕСКИХИССЛЕДОВАНИЙ:
-данные комплексных токсикологических
исследований;
-установление органов-мишеней;
-зависимость «доза – эффект»;
-обратимость выявленных эффектов.
27.
РЕЗУЛЬТАТЫ ФАРМАКОЛОГИЧЕСКИХИССЛЕДОВАНИЙ:
- количественные показатели
эффективности (ЕД 50);
-кривая зависимости «доза – эффект»;
-сравнения с данными активности
известного ЛС (референс – препарат);
-данные про системное
фармакологическое действие;
-влияние исследуемого ЛС на
функциональные показатели основных
физиологических систем.
28.
НОВЫЕ ЛСФАРМАКОЛОГИЯ БЕЗОПАСНОСТИ
Установления влияния ЛС на основные
функции организма:
-ССС;
-Дыхательная система;
-ЦНС;
-Мочеполовая система;
-Вегетативная нервная система;
-ЖКТ.
29.
НОВЫЕ ЛСФАРМАКОКИНЕТИКА
Исследования фармакокинетических
параметров должны предоставить
данные про метаболизм и выведение
действующего
вещества
из
организма
животного
при
одноразовом и повторном введении
ЛС.
30.
НОВЫЕ ЛСИсследования распределения исследуемого ЛС
в тканях при повторном введении
проводятся если:
- после одноразового введении полупериод жизни
метаболитов в органах превышает полупериод
эллиминации из плазмы.
-уровень вещества/метаболита в системном
кровообращении при повторном введении выше чем
данный показатель при одноразовом введении.
-данные кратковременных исследований токсичности,
распределения в тканях при одноразовом введении, а
также фармакологического исследования выявили
непредвиденные гистологические изменения;
-ЛС, разработано для специфической доставки к
конкретной мишени.
31.
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ - ГЕНЕРИКИдоклинические исследования токсичности и
фармакологической спецефичности и
эффективности не проводят если
предоставлены:
-
-
-
данные, которые доказывают эквивалентность
препарата сравнения на стадии фарацевтической
разработки;
данные эквивалентности лекарственного препарата
– генерика;
подтверждено соответствие заявленного ЛС
действующему оригинальному препарату данными и
монографичми Экспертного центра МОЗ Украины.
32.
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ - ГЕНЕРИКИВ других случаях изучается:
-острая токсичность в сравнении с референспрепаратом (оригинальным) на ОДНОМ виде
животных, ОДНОГО пола (кривые зависимости
“доза – эффект”, ЛД50, ЕД50, ЛТ50, ЕТ50; данные
микроскопии внутренних органов;
-сравнение фармакологической активности
исследуемого ЛС-генерика с оригинальным с
использованием адекватной модельной
патологии.
33.
ИЗМЕНЕНИЯ В ЛС, ТРЕБУЮЩИЕ НОВОЙРЕГИСТРАЦИИ:
-изменения действующих веществ;
-изменения терапевтических
показаний;
-изменения дозирования,
лекарственной формы и способа
применения.
34.
ИЗМЕНЕНИЯ В ЛСДоклинические исследования в объеме,
установленном для новых дейтсвующих веществ
проводятся если:
-изменение одного или нескольких действующих веществ в
препарате;
-удаление из состава препарата одного или нескольких
действующих веществ;
-количественные изменения действующих веществ;
-замена действующего веществаина на его солевое, либо
изомерное производное с таким же терапевтическим
действием;
-замена изомеров и их смесей;
-замена веществ биологического происхождения на
вещества, прлученные химическим синтезом.
35.
ИЗМЕНЕНИЯ В ТЕРАПЕВТИЧЕСКИХ ПОКАЗАНИЯХЛСВ
случае,
если
изменения
терапевтических
показаний,
т.е.
расширение
показаний
касаются
другой терапевтической области
(лечение, диагностика. профилактика,
исследуется
терапевтическая
специфическая
активность
на
нескольких адекватных модельных
патологиях, включающих данные о
динамике эффекта.
36.
ИЗМЕНЕНИЯ В ЛС, КАСАЮЩИЕСЯ ДОЗИРОВАНИЯ ЛСИ СПОСОБА ПРИМЕНЕНИЯ
-Проводится сравнительное исследование
фармакологической эффективности на нескольких
адекватных моделях, включающих иследования
динамики эффекта *.
* Фармакологические
исследования не
проводятся. если
изменения связаны с
увеличением дозирования.
-Токсичность при однократном и повторном введении в
сравнении с препаратом сравнения/путем введения**.
** Токсикологические исследования не проводят, если
изменения связаны с уменьшением
дозирования
37.
ЛС РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯЛекарственные средства растительного
поисхождения,
которые
содержат
растительное сырье, не описанное в
Европейской
фармакопее/или
в
Государственной фармакопее СССР (XI
издания),
подлежат
доклиническому
исследованию
в
объеме,
предусмотренном для новых ЛС.
38.
ЛС РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ1. Традиционные в Украине ЛС из растительного
сырья
для
перорального
применения,
безопасность которых подтверждена на
протяжении не менее 10 лет, не подлежат
доклиническим исследованиям.
2. Новые показания к применению, или новые
лекарственные формы хорошо изученных
традиционных
ЛС
растительного
происхождения
требуют
изучения
фармакологической
эффективности
на
нескольких
адекватных
модельных
патологиях, включающих данные динамики
эффекта.
39.
ЛС РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯВ
случае,
если
растительные
сборы
содержат
хорощо
известные
в
Украине
составляющие,
безопасность которых. не
вызывает
сомнения,
доклинические
исследования
не
проводятся.
В
случае,
если
растительные
сборы
изготовлены
из
растительного
сырья,
содержащего
сильнодействующие
вещества, с возможным
риском
для
здоровья
(согласно
списку),
доклинические
исследования
проводятся в полном
объеме.
40.
ОТЧЕТ ПРОДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
1.Все
данные
должны
быть
статистически обработаны.
2.Необходимо
предоставить
интерпретацию
полученных
и
обработанных данных, а также
обосновать выводы.
3.Отчет о ДИ, должен содержать
табличные
данные
по
всем
исследуемым
показателям
от
начала
до
завершения
эксперимента.



































 Медицина
Медицина








