Похожие презентации:
Химическая термодинамика. Лекция 2
1.
ГОУ ВПО «Донбасская Национальная академия строительства иархитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов 1 курса
Направление подготовки – 08.03.01 Строительство
Составил:
Ташкинов Ю.А.
Макеевка, 2019
1
2.
Химическая Термодинамикараздел химии, изучающий взаимные превращения
энергии, теплоты и работы в термодинамических
системах разных типов, переходы энергии из одной
формы в другие и от одной совокупности тел к другим, а
также возможность, направление и глубину
осуществления химических и фазовых процессов в
данных условиях.
Изучением тепловых эффектов реакций занимается
термохимия. В термохимии тепловой эффект
реакции обозначается Q и выражается в кДж.
2
3.
Состояние системы определяетсятермодинамическими параметрами
состояния – температурой, давлением,
концентрацией, объемом и т. д. Система
характеризуется, кроме того, такими свойствами
как внутренняя энергия U, энтальпия H,
энтропия S, энергия Гиббса G.
3
4.
В химии чаще всего рассматриваютизобарические процессы (P = const), и тепловой
эффект в этом случае называют изменением
энтальпии системы или энтальпией процесса:
Qp= ΔH
ΔH = ΔU + P ΔV
4
5.
Энтальпия имеет размерность энергии (кДж).Ее величина пропорциональна количеству
вещества; энтальпия единицы количества
вещества (моль) измеряется в кДж∙моль–1.
В термодинамической системе выделяющуюся
теплоту химического процесса условились
считать отрицательной (экзотермический
процесс, ΔH < 0), а поглощение системой
теплоты соответствует эндотермическому
процессу, ΔH > 0.
5
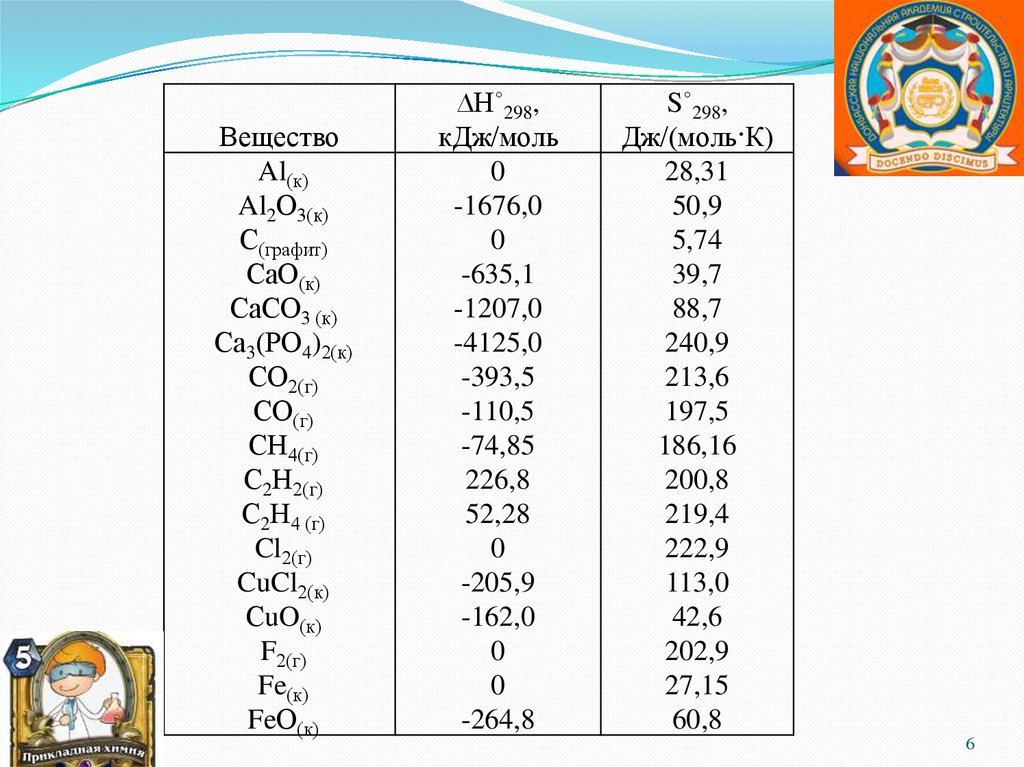
6.
ВеществоAl(к)
Al2О3(к)
С(графит)
СаО(к)
СаСО3 (к)
Са3(РО4)2(к)
СО2(г)
СО(г)
СН4(г)
С2Н2(г)
С2Н4 (г)
Cl2(г)
CuCl2(к)
СuO(к)
F2(г)
Fe(к)
FeО(к)
∆Н˚298,
кДж/моль
0
-1676,0
0
-635,1
-1207,0
-4125,0
-393,5
-110,5
-74,85
226,8
52,28
0
-205,9
-162,0
0
0
-264,8
S˚298,
Дж/(моль·К)
28,31
50,9
5,74
39,7
88,7
240,9
213,6
197,5
186,16
200,8
219,4
222,9
113,0
42,6
202,9
27,15
60,8
6
7.
Закон Гесса:«Тепловой эффект (энтальпия) процесса зависит только
от начального и конечного состояния и не зависит от
пути перехода его из одного состояния в другое».
Тепловой эффект химической реакции равен сумме
теплот образования всех продуктов реакции минус
сумма теплот образования всех реагентов:
Qp= Q обр.(продуктов) - Q обр.(реагенты)
7
8.
Следствия закона Гесса1) Тепловой эффект реакции равняется разности сумм
теплот образования конечных продуктов реакции и
исходных веществ с учетом стехиометрических
коэффициентов этих веществ в уравнении реакции:
Hреакц = (ni H)обрпродукт - (ni H)обр исх
2) Тепловой эффект реакции сгорания равняется
разности сумм теплот сгорания конечных продуктов
реакции и исходных веществ с учетом
стехиометрических коэффициентов этих веществ в
уравнении реакции сгорания:
Нреак= (ni Н)сгорпрод - (ni Н)сгорисх
G реакц
об р
об р
n i G 298,прод n i G 298,исх
8
9.
Энтропия (мольная) - S - это количественная мера беспорядка(неупорядоченности) системы. Она измеряется в Дж/моль К; чем это
величина большее тем беспорядок в системе больше. Расчет
изменения энтропии в системе производится по формуле (4.8):
S = nSпрод - nSисх
При Т=const P = const эта энергия называется энергией Гиббса, или
изобарно-изотермическим потенциалом, который является
функцией состояния
G= H - T S
В случаях, если V и T постоянные - эта энергия носит название
энергии Гельмгольца, или изохорно-изотермического
потенциала, который тоже является функцией состояния при
определенных условиях
ΔF= ΔU - TΔS
9
10.
1011.
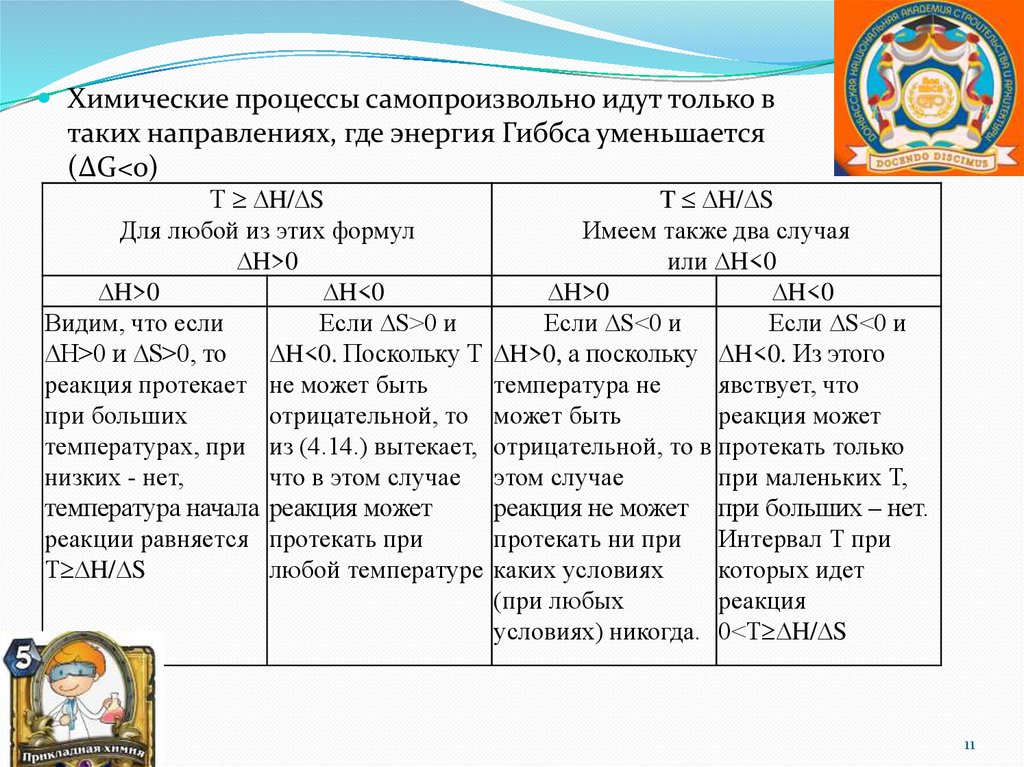
Химические процессы самопроизвольно идут только втаких направлениях, где энергия Гиббса уменьшается
(ΔG<0)
Т H/ S
Для любой из этих формул
H>0
H>0
H<0
Видим, что если
Если S>0 и
H>0 и S>0, то
H<0. Поскольку Т
реакция протекает не может быть
при больших
отрицательной, то
температурах, при из (4.14.) вытекает,
низких - нет,
что в этом случае
температура начала реакция может
реакции равняется протекать при
Т H/ S
любой температуре
T H/ S
Имеем также два случая
или H<0
H>0
H<0
Если S<0 и
Если S<0 и
H>0, а поскольку H<0. Из этого
температура не
явствует, что
может быть
реакция может
отрицательной, то в протекать только
этом случае
при маленьких Т,
реакция не может при больших – нет.
протекать ни при Интервал Т при
каких условиях
которых идет
(при любых
реакция
условиях) никогда. 0<Т H/ S
11
12.
Пример12












 Химия
Химия








