Похожие презентации:
Химическая связь
1. Лекция 3. Химическая связь
Лектор – доцент кафедры общей инеорганической химии Тюменова
Светлана Ивановна
2. План лекции
1. Теории химической связи2. Основное и возбуждённое состояние электронов в
атоме
3. Типы химических связей
4. Механизм образования химической связи
5. Основные характеристики химической связи
6. Гибридизация орбиталей. Геометрическая форма
молекул
7. Ионная связь
8. Металлическая связь
9. Водородная связь
3.
1. Теории химической связиТеория химической связи Бертоле: в основе
химической связи лежит чисто гравитационное
притяжение атомов
Теория химической связи Берцелиуса: между атомами в молекулах и кристаллах действуют силы электростатического притяжения
1748-1822
1799-1848
4.
В.КоссельГ.Льюис
(1888 - 1956)
(1875 - 1946)
5.
Г.Н.Льюис и В.Коссель, 1916Согласно электронной теории валентности,
атомы, образуя связи, приближаются к
наиболее устойчивой (т.е. имеющей наиболее
низкую энергию) электронной конфигурации.
Атомы могут достичь этого двумя способами.
приобретение или
потеря электронов
обобществление
электронов
6.
Правило октета - когда атом какого либоэлемента образует химическую связь,
обретая, теряя, обобществляя электроны,
его электронная конфигурация становится
такой же, как у атома благородного газа,
расположенного в конце того же периода,
что и данный элемент, либо в конце
предыдущего периода.
7.
октет электроновкислород
водород
вода
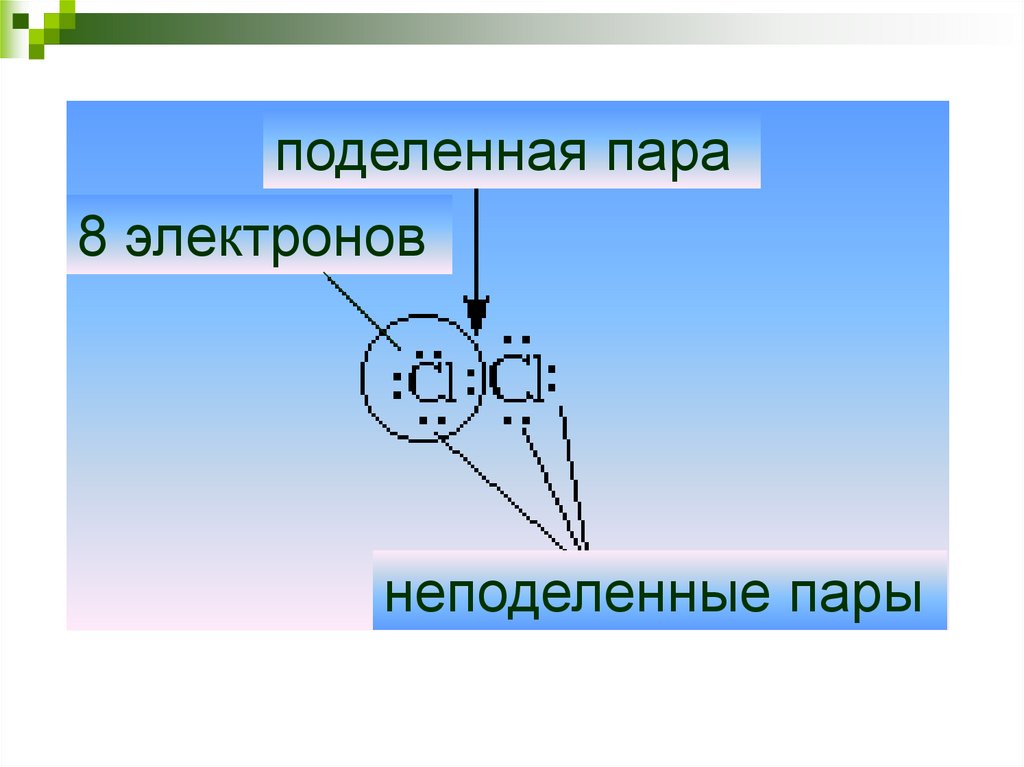
8.
поделенная пара8 электронов
неподеленные пары
9. Современная теория химической связи базируется на трех основных методах:
метод валентных связей ВС описывает химическую связьчисто качественно, объясняя её образование возникновением общей пары электронов
метод молекулярных орбиталей МО описывает
химическую связь количественно, предполагая, что все
электроны всех атомов молекулы образуют общее
электронное облако, т.е. атомные орбитали объединяются
в молекулярные.
метод отталкивания электронных пар (метод валентных
углов) позволяет получить представление о пространственной конфигурации молекул
10.
Химическая связь – вид межатомныхвзаимодействий в молекулах, ионах,
кристаллах, характеризуемый
определенной энергией,
обуславливающих существование двухи многоатомных соединений.
11. 2. Основное и возбуждённое состояние электронов в атоме
12. В ряде случаев с целью увеличения валентных возмож-ностей перед образованием химической связи атом перехо-дит в «возбужденное
В ряде случаев с целью увеличения валентных возможностей перед образованием химической связи атом переходит в «возбужденное состояние». При этом происходит«распаривание» электронов на валентном уровне.
В → В*
B: 2s22p1
В max = 3
2p
2p
2s
B*: 2s12p2
2s
S → S* → S**
S:3s23p4
Вmax =6
S*:3s23p33d1
3d
3p
3s
S**:3s13p33d2
3d
3d
3p
3p
3s
3s
Энергия, поглощенная при переходе в возбужденное состояние, полностью
компенсируется энергией, которая выделяется при образовании химической связи
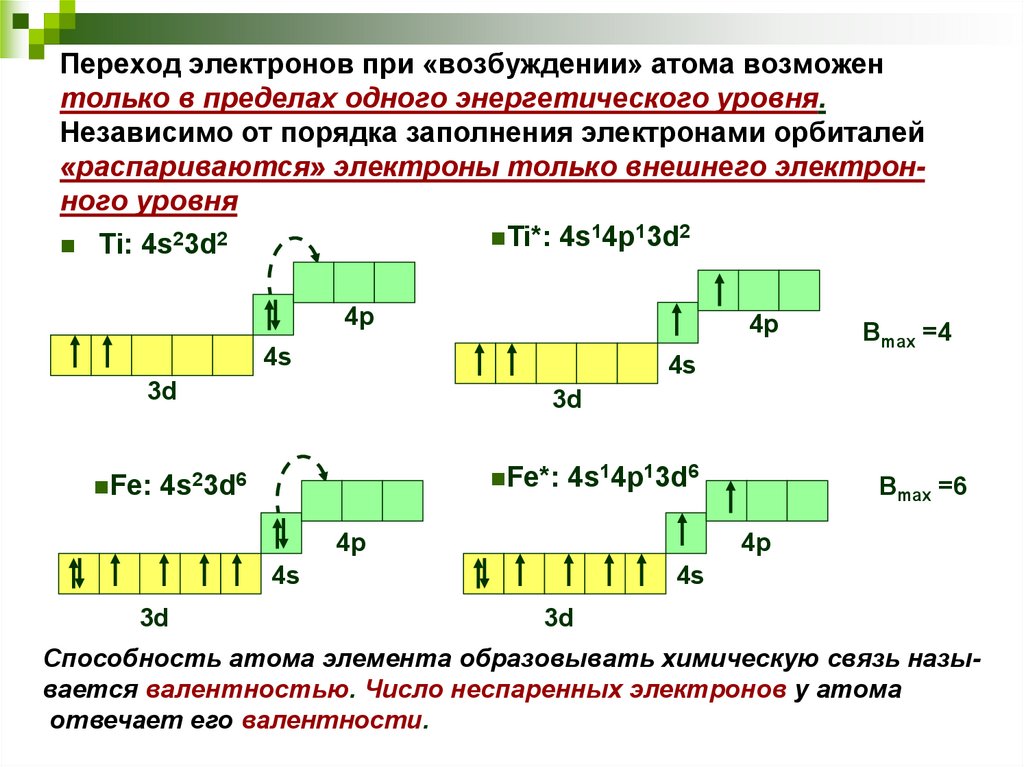
13. Переход электронов при «возбуждении» атома возможен только в пределах одного энергетического уровня. Независимо от порядка
заполнения электронами орбиталей«распариваются» электроны только внешнего электронного уровня
Ti*: 4s14p13d2
Ti: 4s23d2
4p
4p
4s
4s
3d
Fe:
3d
Fe*:
4s23d6
4s14p13d6
4p
Вmax =6
4p
4s
3d
Вmax =4
4s
3d
Способность атома элемента образовывать химическую связь называется валентностью. Число неспаренных электронов у атома
отвечает его валентности.
14. 3.Типы химических связей (ВС)
Тип химической связи определяется степенью смещенияобщей электронной плотности к ядру одного из атомов.
Мерой смещения является ОТНОСИТЕЛЬНАЯ
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ АТОМА.
Относительная электроотрицательность (ЭО) – это
способность атома элемента оттягивать на себя
электроны, осуществляющие химическую связь
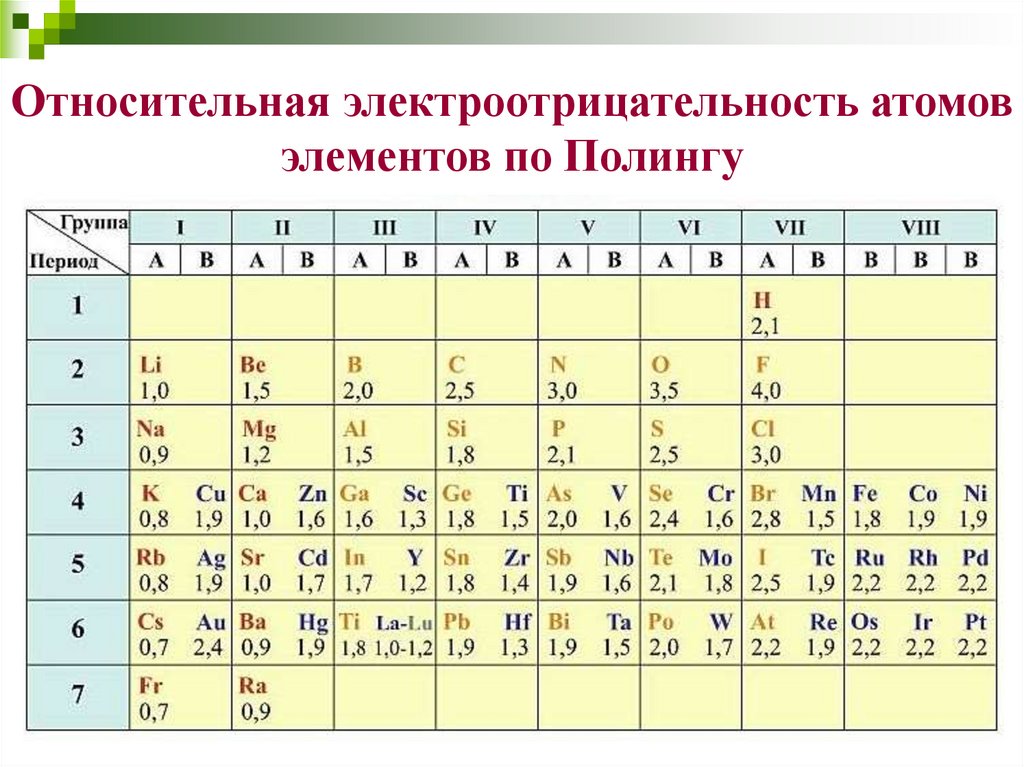
15.
Относительная электроотрицательность атомовэлементов по Полингу
16.
Химическая связьИонная
ΔЭО > (2)- условно ионная)
Ковалентная
ΔЭО ≤ (2)
Осуществляется за счет
электростатического притяжения
ионов
Осуществляется за счет
общей пары электронов
Неполярная
ΔЭО=0
Н
Н
ΔЭО=2,1-2,1=0
Полярная
(2)>ΔЭО>0
Cs+ FΔЭО= 4,1-0,86 = 3,24
+
Н Сl
ΔЭО= 3,0-2,1>0
δ+
δ-
17. Зависимость между Δэ.о. и степенью смещения общего электронного облака (%ионности)
Δ 0Э.О.
0,1 1
1,2 1,4 1,7 2,1 2,7 3,0
%
ион.
14
30
0
21
42
51
60
85
98
18. Характер связей между атомами в молекулах
Ковалентная неполярная – общееэлектронное облако расположено
симметрично относительно ядер атомов.
Ковалентная полярная – общее
электронное облако смещено к более
элетроотрицательному атому меньше, чем на
50%.
Ионная - общее электронное облако
смещено к более элетроотрицательному
атому больше, чем на 50%.
19. Электроны, принимающие участие в образовании связи называются валентными.
4. Механизм образования химической связиЭлектроны, принимающие участие в образовании связи
называются валентными.
У s- и р-элементов валентными являются электроны
внешнего энергетического уровня.
У d- и f- элементов – s-электроны внешнего и d-электроны
предвнешнего уровня.
Na 1s22s22p63s1
Mg 1s22s22p6 3s2
1s22s22p4
O
As 1s22s22p63s23p64s23d104p3
Sc 1s22s22p63s23p64s23d1
Mo 1s22s22p63s23p64s23d104p6 5s14d5
Pm 1s22s22p63s23p64s23d104p65s24d105p66s25d14f4
Eu 1s22s22p63s23p64s23d104p65s24d105p66s25d14f6
20.
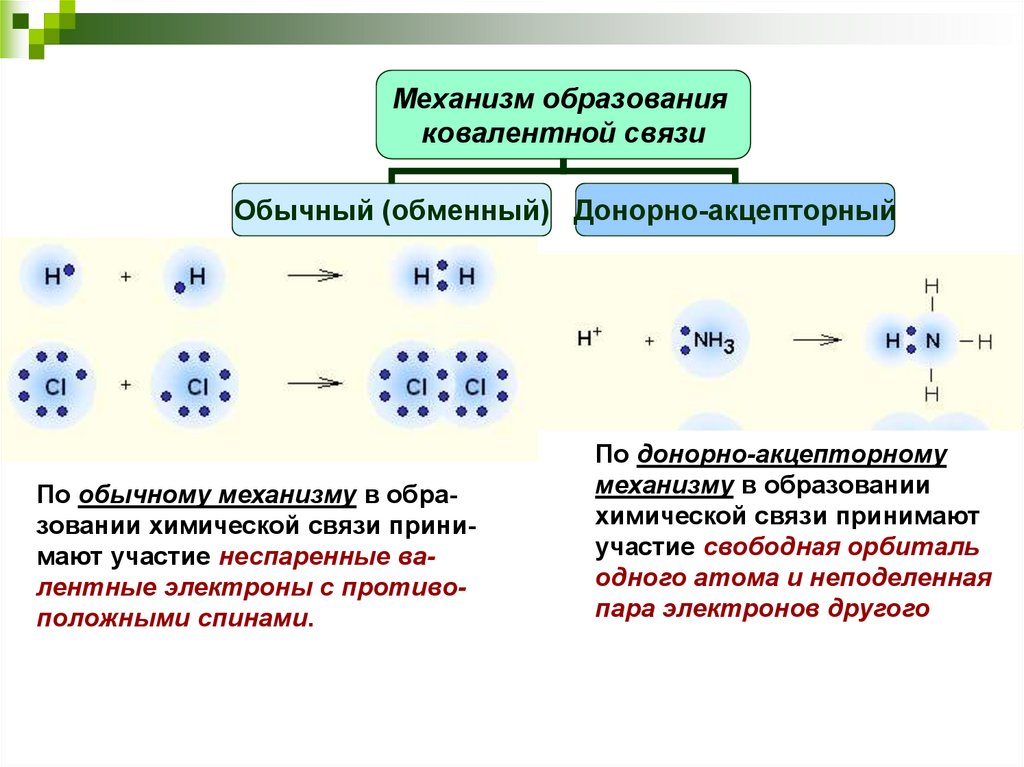
Механизм образованияковалентной связи
Обычный (обменный) Донорно-акцепторный
По обычному механизму в образовании химической связи принимают участие неспаренные валентные электроны с противоположными спинами.
По донорно-акцепторному
механизму в образовании
химической связи принимают
участие свободная орбиталь
одного атома и неподеленная
пара электронов другого
21. Степень окисления – это условный заряд атома элемента в соединении, вычисленный, исходя из предположения, что соединение
состоит из ионов.HCl
δ+
δ-
1s1, валентность 1, ЭО=2,1
Сl …3s23p5, ЭО=3, валентность 1,
Степень окисления водорода +1
Степень окисления хлора -1
H
N2
N2 …
2s22p3
Валентность 3,
Степень окисления 0
22. 5. Основные характеристики химической связи
Химическая связь характеризуетсяэнергией, длиной и валентным углом.
Энергия связи – это количество энергии,
затрачиваемой на ее разрыв.
Длина связи l – это расстояние между ядрами
атомов, образующих связь.
l
23. Валентные углы – углы между линиями, соединяющими центры атомов в направлении действия между ними химической связи.
Валентные углы в молекулах метана, аммиака и воды24.
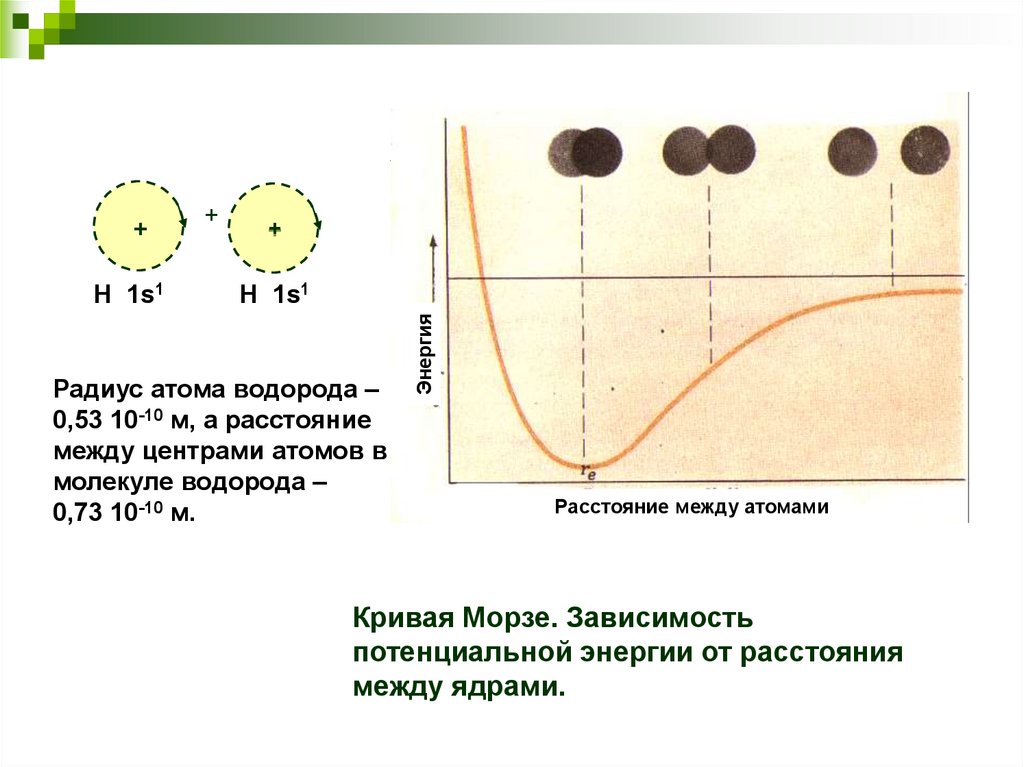
H 1s1+
+
H 1s1
Радиус атома водорода –
0,53 10-10 м, а расстояние
между центрами атомов в
молекуле водорода –
0,73 10-10 м.
Энергия
+
Расстояние между атомами
Кривая Морзе. Зависимость
потенциальной энергии от расстояния
между ядрами.
25. Основные свойства ковалентной связи
Химическая связь, образованная паройэлектронов, обобществляемых между
двумя соседними атомами, называется
ковалентной связью.
1. Насыщаемость - это свойство атомов образовывать
ограниченное число ковалентных связей, вследствие чего
молекулы имеют определенный состав.
2. Направленность – cвойство ковалентной связи,
обусловленное ее образованием в направлении
максимального перекрывания электронных облаков.
26.
Кратность связи определяется количеством электронныхпар, осуществляющих связь
3.
Н
О
N
+Н
→ Н-Н кратность 1
+О
→ О=О
кратность 2
+N
→N≡N
кратность 3
Моле
кула
Длина
связи, нм
Кратнос
ть связи
Энергия
связи,
кДж/моль
H2
F2
O2
N2
0,073
0,142
0,121
0,110
1
1
2
3
432
155
498
942
27.
4. Поляризуемость связи – способностьмолекулы с неполярной или
малополярной связью становиться
полярной под действием внешнего поля.
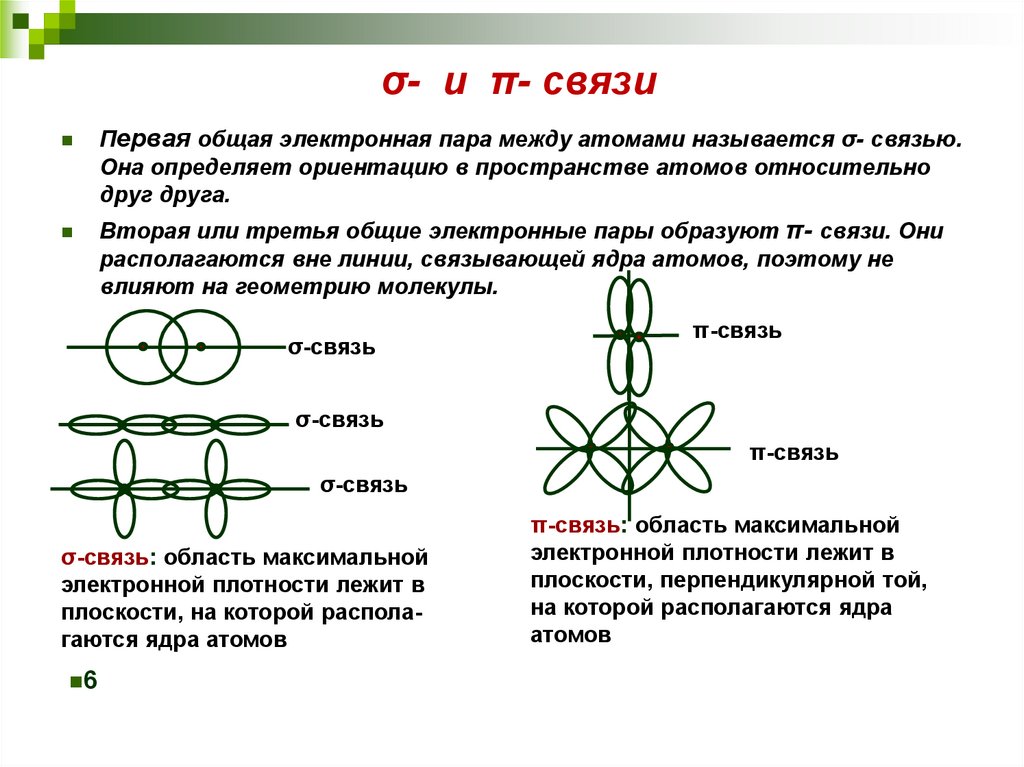
28. σ- и π- связи
Первая общая электронная пара между атомами называется σ- связью.Она определяет ориентацию в пространстве атомов относительно
друг друга.
Вторая или третья общие электронные пары образуют π- связи. Они
располагаются вне линии, связывающей ядра атомов, поэтому не
влияют на геометрию молекулы.
σ-связь
π-связь
σ-связь
π-связь
σ-связь
σ-связь: область максимальной
электронной плотности лежит в
плоскости, на которой располагаются ядра атомов
6
π-связь: область максимальной
электронной плотности лежит в
плоскости, перпендикулярной той,
на которой располагаются ядра
атомов
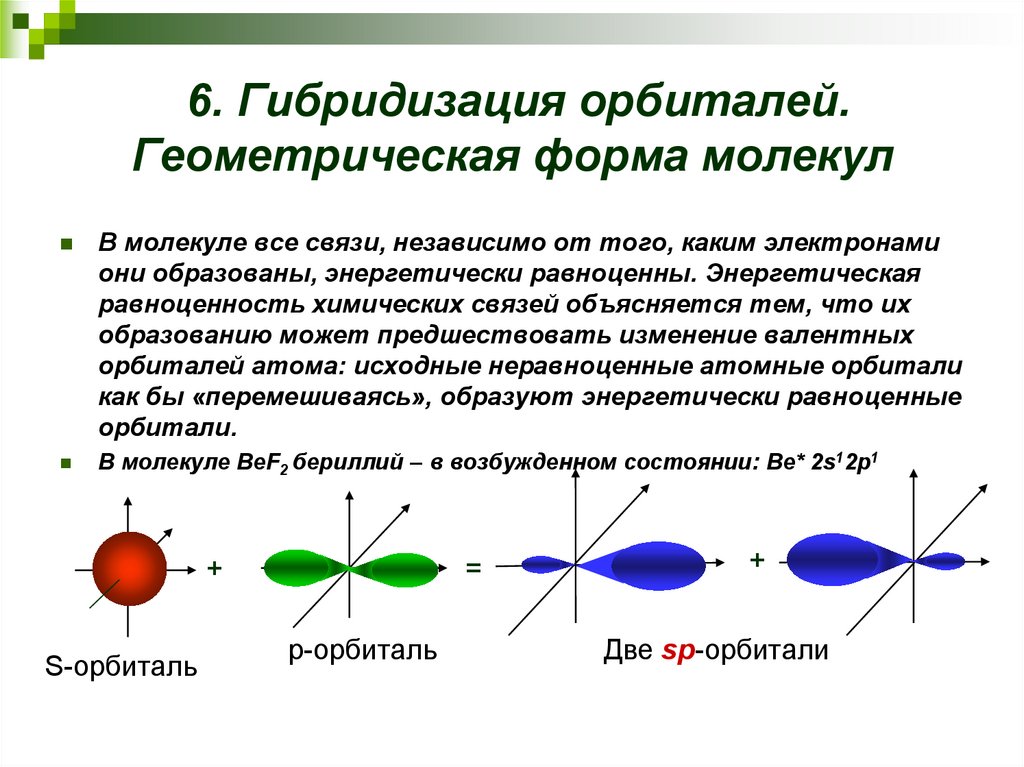
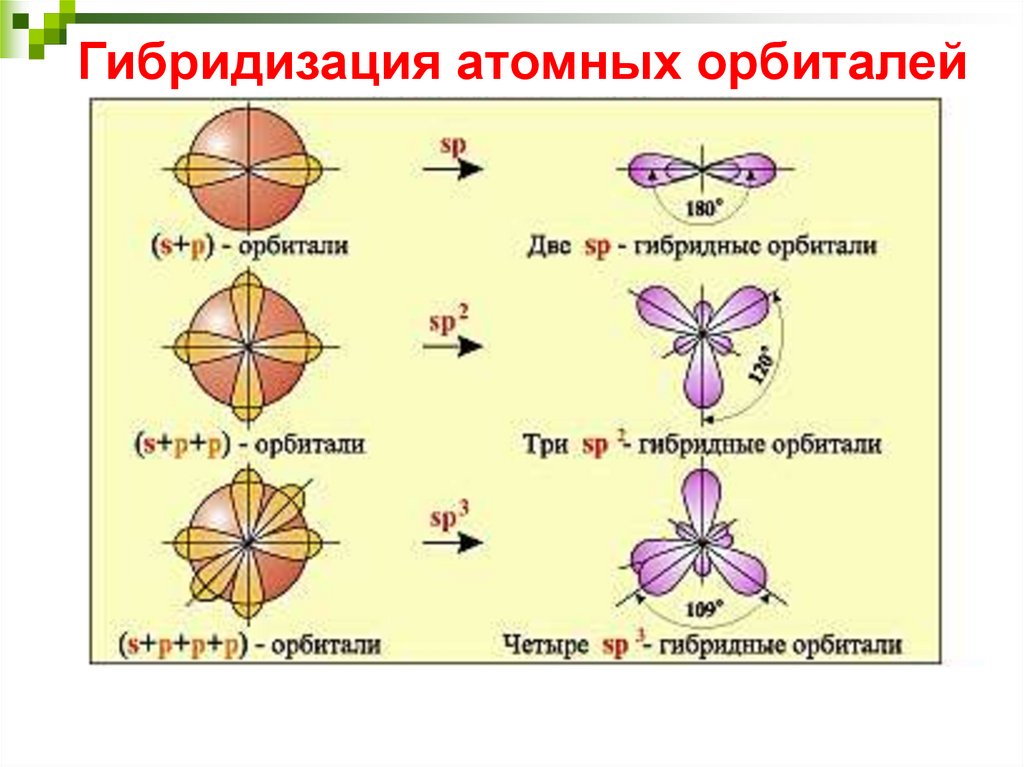
29. 6. Гибридизация орбиталей. Геометрическая форма молекул
В молекуле все связи, независимо от того, каким электронамиони образованы, энергетически равноценны. Энергетическая
равноценность химических связей объясняется тем, что их
образованию может предшествовать изменение валентных
орбиталей атома: исходные неравноценные атомные орбитали
как бы «перемешиваясь», образуют энергетически равноценные
орбитали.
В молекуле BeF2 бериллий – в возбужденном состоянии: Be* 2s12p1
+
S-орбиталь
=
р-орбиталь
+
Две sр-орбитали
30.
Гибридизация – это формальный прием,посредством которого можно предсказать
геометрическую форму молекулы.
Согласно гибридизации во многих молекулах
некоторые атомные орбитали, принимающие участие
в образовании ковалентных связей, смешиваются
между собой (гибридизуются), при этом образуются
новые, гибридные атомные орбитали с тем же общим
количеством электронов, и свойствами, и энергией,
промежуточной между энергией негибридных
орбиталей.
31.
При гибридизации происходит перераспределениеэлектронной плотности, которое требует затрат энергии.
В результате гибридизации электронное облако
вытягивается по направлению к взаимодействующему
атому , благодаря чему увеличивается его перекрывание с
электронными облаками последнего. Это приводит к
образованию более прочной связи и следовательно к
дополнительному выделению энергии, которое
компенсирует затраты энергии на гибридизацию.
В гибридизации принимают участие неспаренные
электроны, образующие σ-связь и неподеленные пары
электронов, находящиеся на внешнем электронном уровне.
32. Характер гибридизации
BeF2 - бериллий 2-валентный, находится в возбужденном состоянииBe …2s22p0
Be* …2s12p1
2p
2p
sp-гибридизация
2s
2s
BF3 - бор 3-валентный, находится в возбужденном состоянии
B …2s22p1,
B*
…2s12p2
sp2-гибридизация
2p
2p
2s
2s
NH3 – азот 3-валентный, находится в нормальном состоянии
N …2s22p3
3
sp -гибридизация
2p
2s
C2H2 HC≡CH – углерод 4-хвалентный, находится в возбужденном состоянии.
В тройной связи одна-σ-связь и две π-связи.
ππ
С
…2s22p2
C*…2s12p3
2p
2s
sp-гибридизация
2p
2s
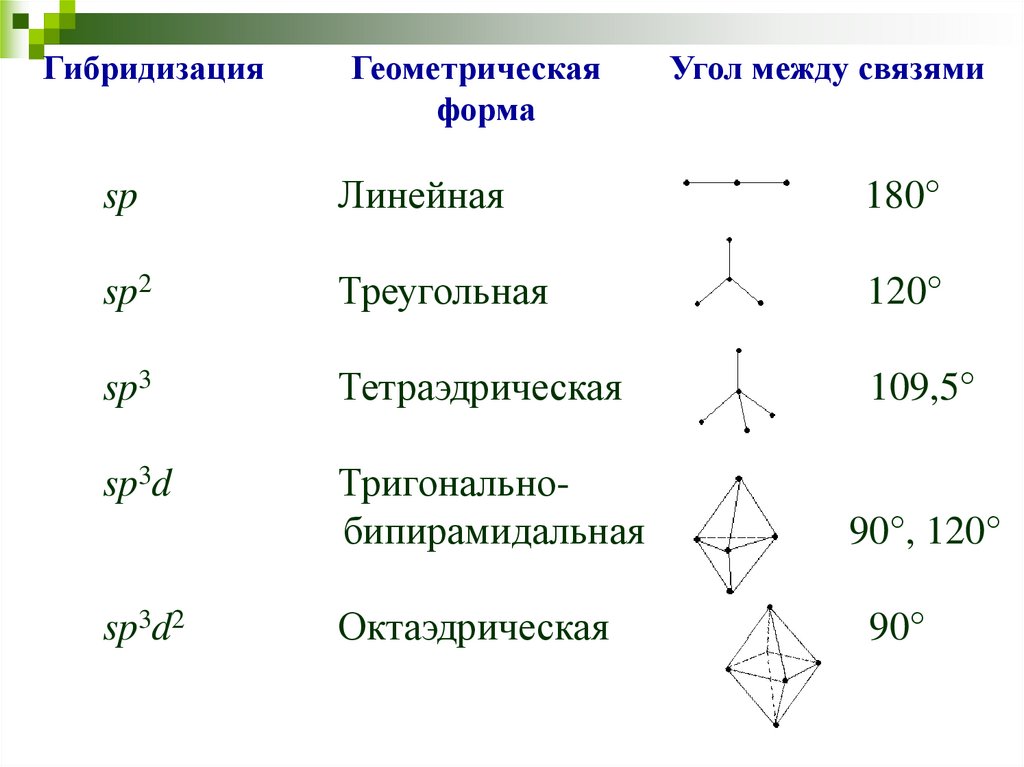
33.
ГибридизацияГеометрическая
форма
Угол между связями
sp
Линейная
180°
sp2
Треугольная
120°
sp3
Тетраэдрическая
109,5°
sp3d
Тригональнобипирамидальная
90°, 120°
sp3d2
Октаэдрическая
90°
34.
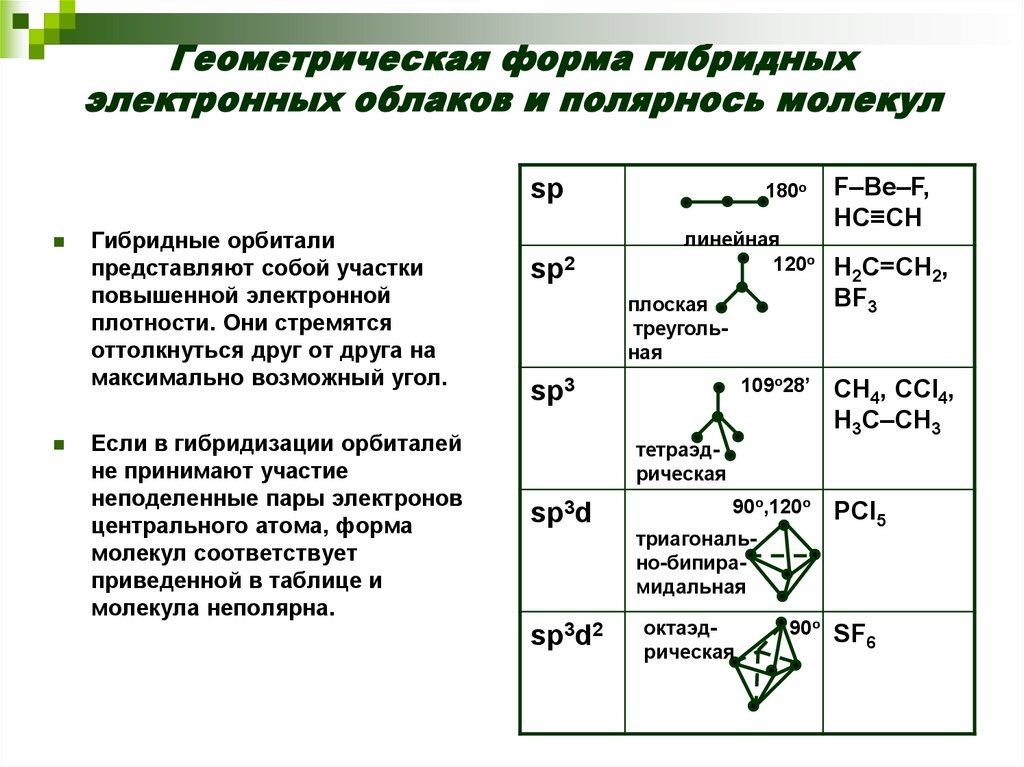
Гибридизация атомных орбиталей35. Геометрическая форма гибридных электронных облаков и полярнось молекул
spГибридные орбитали
представляют собой участки
повышенной электронной
плотности. Они стремятся
оттолкнуться друг от друга на
максимально возможный угол.
Если в гибридизации орбиталей
не принимают участие
неподеленные пары электронов
центрального атома, форма
молекул соответствует
приведенной в таблице и
молекула неполярна.
sp2
180o
линейная
120o
плоская
треугольная
109o28’
sp3
F–Be–F,
HC≡CH
H2C=CH2,
BF3
CH4, CCl4,
H3C–CH3
тетраэдрическая
sp3d
sp3d2
90o,120o
триагонально-бипирамидальная
октаэдрическая
90o
PCl5
SF6
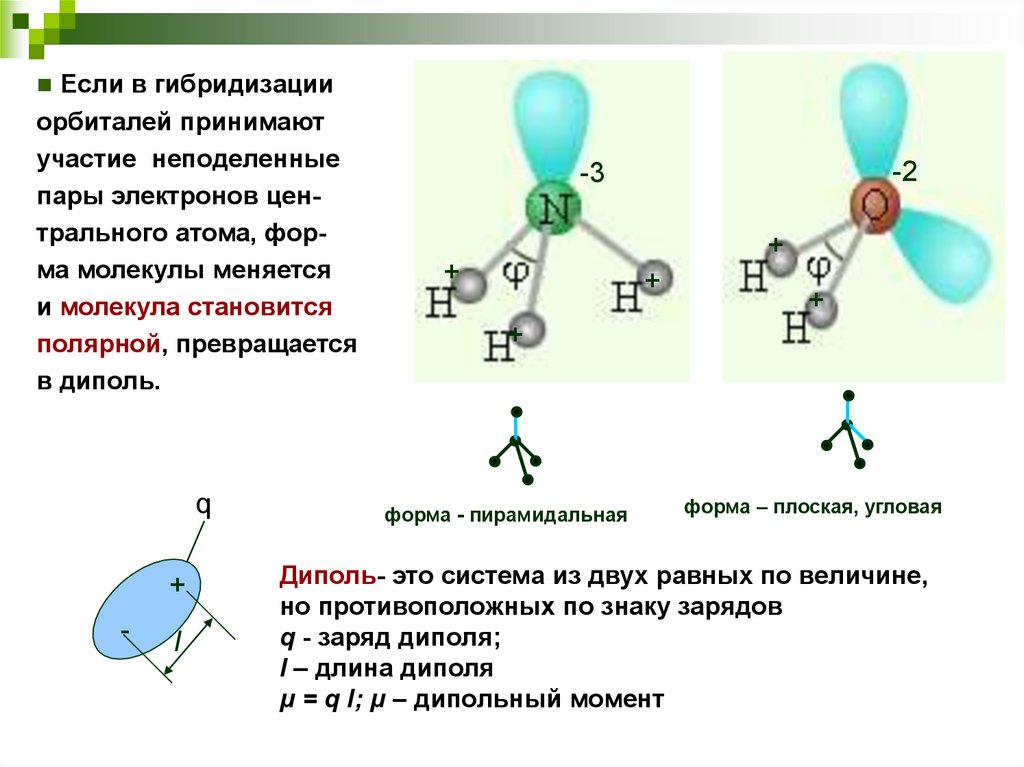
36.
Если в гибридизацииорбиталей принимают
участие неподеленные
пары электронов центрального атома, форма молекулы меняется
и молекула становится
полярной, превращается
в диполь.
q
+
-
l
-2
-3
+
+
+
+
+
форма - пирамидальная
форма – плоская, угловая
Диполь- это система из двух равных по величине,
но противоположных по знаку зарядов
q - заряд диполя;
l – длина диполя
μ = q l; μ – дипольный момент
37.
Дипольные моменты молекулМолекула
Аргон
Ar
Диоксид углерода
CO2
Хлороводород
HCl
Аммиак
NH3
Диоксид серы
SO2
Хлорбензол
C6H5Cl
Вода
H2O
Дип.
момент,
Дебай
0
0
1.05
1.48
1.63
1.67
1.84
Структура
Неполярная
+
+ молекула
σ-
σ
σ
O=C=O
σ+
σ+ σH-Cl
H
σ- :N H σ+
σ
O
H+
+
σS
σ
σ
O
σ+ σCl
Hσ+
σ:O
H σ+
38.
ОПРЕДЕЛЕНИЕ ГЕОМЕТРИЧЕСКОЙ ФОРМЫМОЛЕКУЛЫ
1. Привести графическую формулу молекулы
и определить валентность её центрального
атома.
2. Для центрального атома показать
графическое распределение электронов по
орбиталям, соответствующее его
валентности.
3. Справа налево зачеркнуть (убрать
условно) такое количество неспаренных
электронов, которое соответствует числу
π связей.
4. Оставшиеся занятые s-, p- и d- орбитали
образуют гибридное электронное облако.
5. Расположение в пространстве его ветвей,
использованных для образование σ- связей,
определяет геометрическую форму
молекулы.
39.
7. Ионная связьХимическая связь, образованная за счет
кулоновских сил притяжения между
противоположно заряженными ионами,
называется ионной связью.
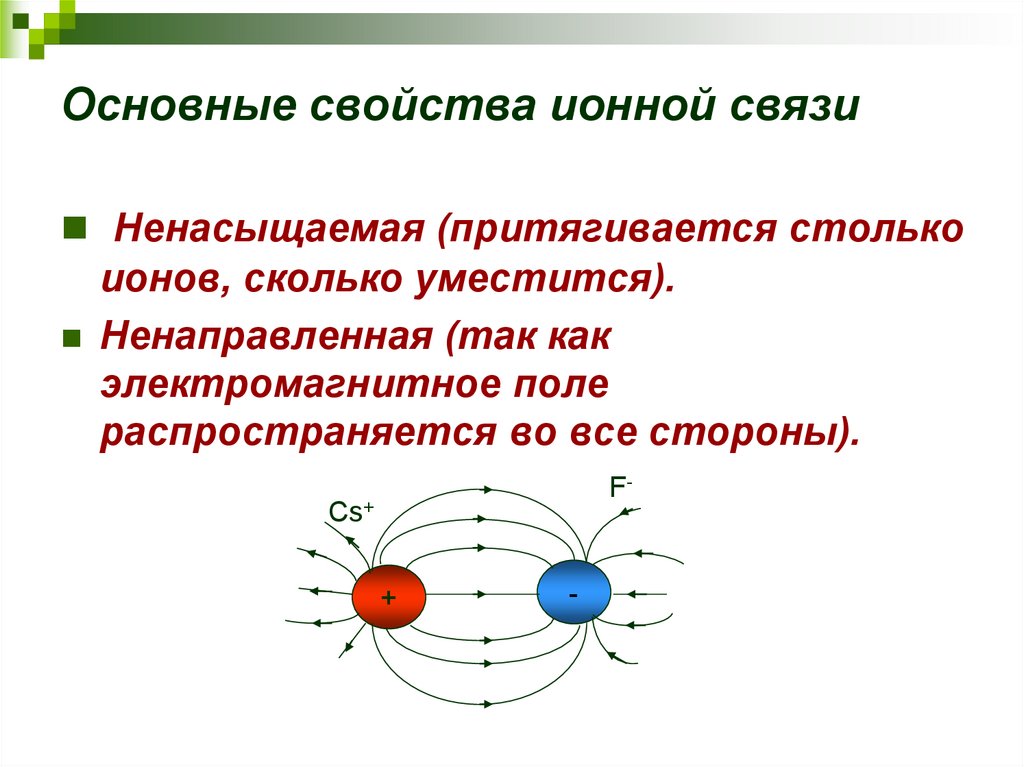
40. Основные свойства ионной связи
Ненасыщаемая (притягивается столькоионов, сколько уместится).
Ненаправленная (так как
электромагнитное поле
распространяется во все стороны).
F-
Cs+
+
-
41.
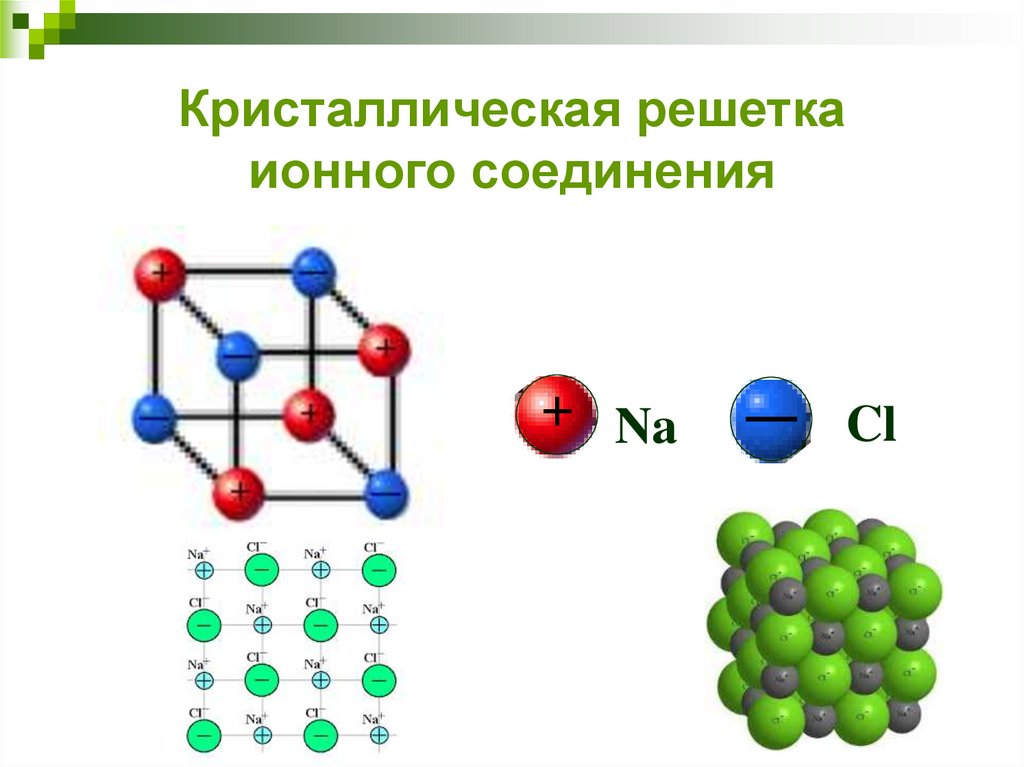
Кристаллическая решеткаионного соединения
Na
Cl
42.
Устойчивость ионных соединенийБольшинство ионных соединений
устойчивы в виде кристаллических
решеток.
Энергия кристаллической решетки –
энергия, необходимая для
соединения одного моля катионов и
анионов, находящихся в
газообразном состоянии, в
кристаллическую решетку.
43.
+Na (г)
+
Сl
(г)
=
+
Na Cl
(тв)
Энергия решетки = -787 кДж/моль
Понижение энергии решетки –
повышение устойчивости ионного
соединения
44.
ТестЭлементы, находящиеся в одной
группе и подгруппе, обладают
одинаковым числом
1. протонов
2. нейтронов
3. энергетических уровней
4. валентных электронов
45. Тест Элементы, находящиеся в одной группе и подгруппе, обладают одинаковым числом
1. протонов2. нейтронов
3. энергетических уровней
4. валентных электронов
46. Тест Элементы, находящиеся в одной группе и подгруппе, обладают одинаковым числом
В молекуле сероводородавсе связи
1. ковалентные неполярные
2. ковалентные полярные
3. донорно – акцепторные
4. ионные
47. В молекуле сероводорода все связи
1. ковалентные неполярные2. ковалентные полярные
3. донорно – акцепторные
4. ионные
48. В молекуле сероводорода все связи
В подгруппах сувеличением порядкового
номера элемента ЭО
1. увеличивается
2. уменьшается
3. изменяется периодически
4. не изменяется
49. В подгруппах с увеличением порядкового номера элемента ЭО
1. увеличивается2. уменьшается
3. изменяется периодически
4. не изменяется
50. В подгруппах с увеличением порядкового номера элемента ЭО
Степень ионности связейвозрастает в ряду
1. Na2O, BaO, CO2
2. H20, CH4, CaH2
3. BH3, BeH2, LiH
4. CCl4, NaCl, MgCl2
51. Степень ионности связей возрастает в ряду
1. Na2O, BaO, CO22. H20, CH4, CaH2
3. BH3, BeH2, LiH
4. CCl4, NaCl, MgCl2
52. Степень ионности связей возрастает в ряду
Другие типы химической связи•Металлическая связь
•Водородная связь
•Вандерваальсовы силы
53.
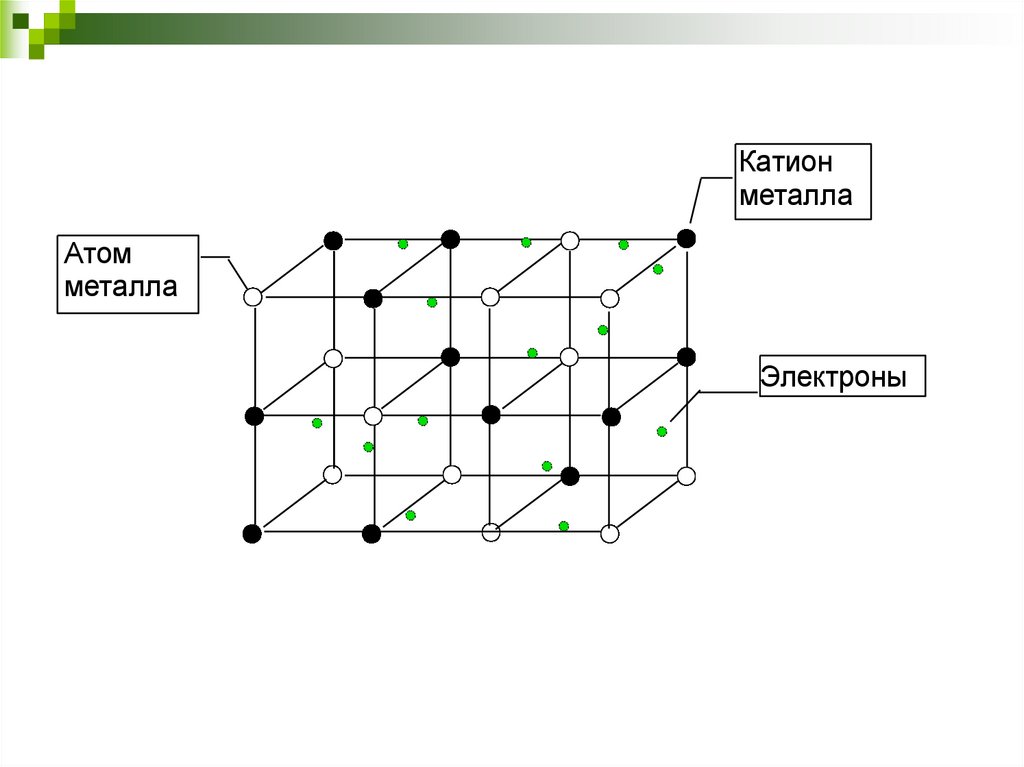
8. Металлическая связьМеталлическая связь - химическая связь между
атомами в металлическом кристалле, возникающая
за счёт обобществления их валентных электронов.
В твердом состоянии металлы состоят из
положительно
заряженных
ионов,
плотно
упакованных в кристаллическую решетку и
удерживаемых вместе свободными электронами,
которые создают вокруг ионов «электронный
газ».
54.
Катионметалла
Атом
металла
Электроны
55.
56.
9. Водородная связьОбразование водородной связи
обусловлено тем, что в результате сильного
смещения электронной пары к
электроотрицательному атому атом
водорода, обладающий эффективным
положительным зарядом, может
взаимодействовать с другим
электроотрицательным атомом (F, O, N,
реже Cl, Br, S).
57.
Водородная связь - форма ассоциациимежду электроотрицательным
атомом и атомом водорода H,
связанным ковалентно с другим
электроотрицательным атомом
В качестве электроотрицательных
атомов могут выступать N, O или F.
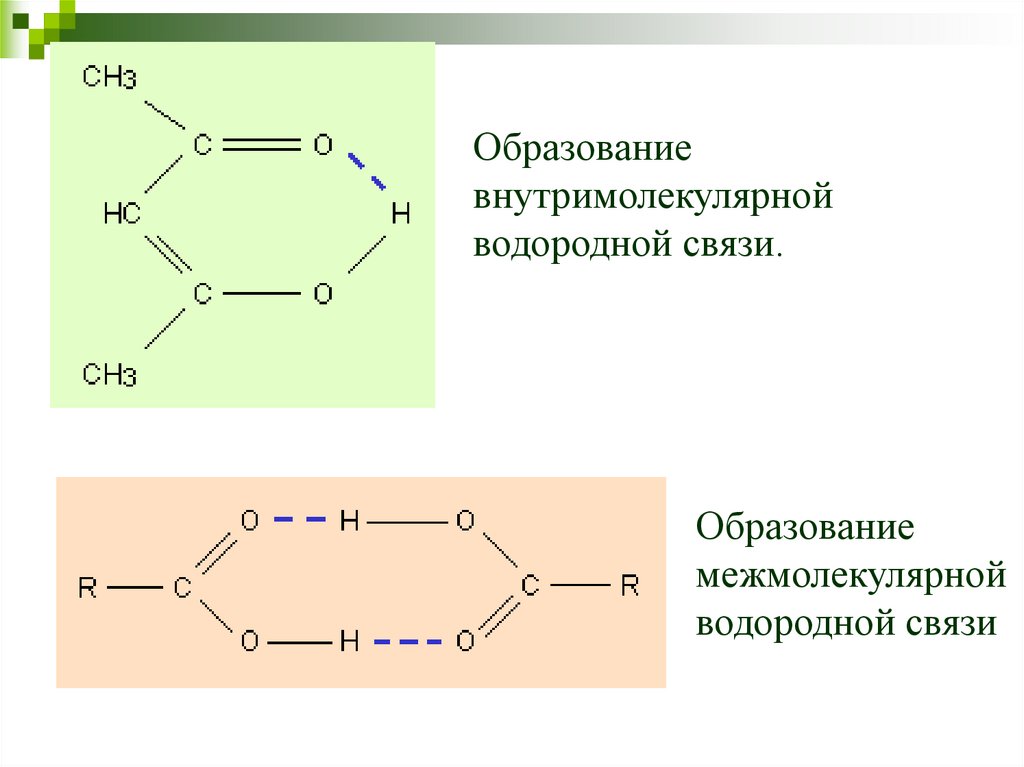
Водородные связи могут быть
межмолекулярными или
внутримолекулярными
58.
Образованиевнутримолекулярной
водородной связи.
Образование
межмолекулярной
водородной связи
59.
Слабые и сильные водородные связиЭнергия связи,
кДж/моль
Слабые водородные связи
(водородные связи в воде,
10-30
аммиаке, метаноле)
Сильные водородные связи
(существуют в ионах:
водороддифтор-ион [F-H-F]гидратированный
гидроксид-ион [OH-H-OH]- )
400
Длина
связи, нм
30
23-24
60. Слабые и сильные водородные связи
Вопросы к лекции1.
2.
3.
4.
5.
6.
Дайте определение понятию «химическая связь». Каковы два
обязательных условия образования ковалентной связи. Покажите на
примере образования молекулы водорода из атомов.
Какая связь называется ковалентной неполярной? Приведите схемы
образования связей в молекулах бромоводорода и брома. Как
называется механизм образования связи для этих случаев?
Какую связь называют ионной? Почему она является предельным
случаем ковалентной связи? Приведите схему образования хлорида
натрия.
Какая связь называется металлической? Каковы ее особенности?
Водородная связь относится к связи между атомами в молекуле
соединения или к взаимодействию между молекулами? Приведите
пример водородной связи.
Дайте определение понятию длина связи. Как изменяется длина связи
между атомами в молекулах фтороводорода, хлороводорода,
бромоводорода, иодоводорода. Объясните, используя графические
формулы для этих соединений и учитывая их положение в
периодической системе
61. Вопросы к лекции
7.Какая характеристика служит мерой полярности молекулы? Какона определяется? Каковы пределы ее значений для неполярных
и полярных молекул?
8.Дайте определение понятию степень окисления. Всегда ли
численно совпадают степень окисления и валентность.
Графические формулы воды и перекиси водорода: Н-О-Н и
Н-О-О-Н соответственно. Каковы валентность и степень окисления
атома кислорода в этих соединениях. Для ответа используйте
значения ОЭО атомов элементов.
9. Какие механизмы образования химической связи вы знаете?
10.Покажите схему образования ковалентной связи по донорноакцепторному механизму на примере иона аммония.
11. Приведите схемы перекрывания р-электронных облаков при
образовании σ-связи и π-связи. Приведите графическую формулу
молекулы азота. Сколько σ- и π-связей в молекул азота,
кислорода, этилена, ацетилена, ортофосфорной кислоты?















































 Химия
Химия








