Похожие презентации:
Законы химии. Массовая доля вещества в растворе. Решение задач. (Лекция 3)
1.
Лекция 3.«Основные законы химии.
Массовая доля вещества в растворе.
Решение задач»
1
2.
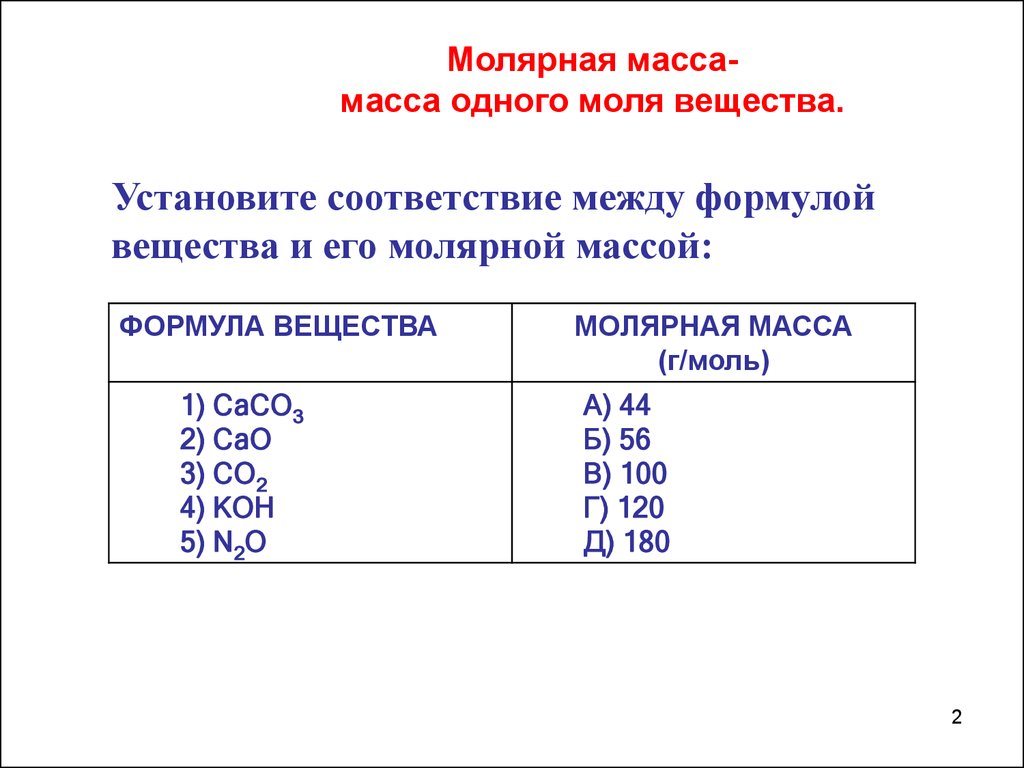
Молярная массамасса одного моля вещества.Установите соответствие между формулой
вещества и его молярной массой:
ФОРМУЛА ВЕЩЕСТВА
1) СаСО3
2) СаО
3) СО2
4) КОН
5) N2О
МОЛЯРНАЯ МАССА
(г/моль)
А) 44
Б) 56
В) 100
Г) 120
Д) 180
2
3.
Моль. Молярная масса.Масса вещества. Взаимосвязь.
m
v
(1)
M
m M ·v (1а)
m
M (1б )
v
3
4.
Задача 1Масса 2.5 моль вещества составляет 45 г.
Назвать вещество.
m
v
(1)
M
m M ·v (1а)
m
M (1б )
v
4
5.
Задача 2Сколько моль поваренной соли содержится в
1пачке массой 1кг ?
m
v
(1)
M
m M ·v (1а)
m
M (1б )
v
5
6.
Задача 3- Мама! Принеси мне пожалуйста 8 моль воды!
- Детка! А можно в граммах?
m
v
(1)
M
m M ·v (1а)
m
M (1б )
v
6
7.
Задача 4Пословица: «Чтобы узнать друга, нужно съесть с
ним пуд соли». Сколько лет понадобится, чтобы узнать
друга, если пуд = 16 кг, дневная норма потребления
соли ≈ 4 г? Сколько моль NaCI будет съедено? (5лет, 5
мес. и 25дн., 273.5 моль)
m
v
(1)
M
m M ·v (1а)
m
M (1б )
v
7
8.
Для газов:Закон Авогадро (1811г.)
Равные объемы газов при одинаковых
температуре и давлении содержат
одинаковое число молекул
Амедео Авогадро
(1776-1856)
Итальянский физик и химик.
Установил, что вода имеет
химическую формулу Н2О,
ввел термин «молекула».
Следствия:
1. Одинаковое число молекул (а, значит, и моль!!)
различных газов при одинаковых условиях занимают
одинаковый объем
2. Для равных объемов газов:
m1 M 1
m2 M 2
( P и Т const )
8
9.
Следствия:3. Число молекул в одном моле любого газа равно
6,02·1023.
4. Один моль любого газа при нормальных
условиях (Т=273К, Р=101.325 кПа) занимает один и тот
же объем – 22.4 л !!!!!!!!
22.4 л / моль
9
10.
Моль. Молярная масса.(для газов)
m
v
(1)
M
Vгаза
газа
(2)
22.4
Vгаза 22.4 газа (2а)
10
11.
Задача 5Сколько моль воздуха человек
вдыхает за сутки (~ 2.5 л- вдыхаем,
в минуту ~ 8 дыханий) ?
11
12.
Задача 61. Масса 1 л оксида серы (IV) при н. у:
1) 0,35 г
2) 1,43 г
3) 2,86 г
4) 3,57 г
12
13.
Задача 7Взяты равные массы кислорода О2, водорода Н2 и
метана СН4 при одинаковых условиях. Отношение
объемов этих газов соответственно равно:
1) 1:16:2
2) 16:1:8
3) 1:1:1
4) 2:8:1
13
14.
Задача 8Какие объемы оксидов серы (IV) и (VI) при
н. у. будут иметь одинаковую массу?
1) 46 и 65 л
2) 65 и 46 л
3) 46 и 36,8 л
4) 17,99 и 22,4 л.
14
15.
Растворы15
16.
Объем и плотность раствораплотность раствора
(г / мл, г / см , кг / л, кг / дм , т / м )
3
m
(3)
V
m ·V (3а)
V
m
(3б )
3
3
Задача 1. Рассчитать (в мл)
объем 2465 г раствора серной
кислоты ( пл.= 1.45 г/мл)
Задача 2. Можно ли поднять
ведро ртути объемом 8 л
( пл.=13.6 г/см3)?
16
17.
Способы выражения концентраций растворов1. Процентная
«% - сотая часть чего угодно !»
17
18.
1. Процентная – масса вещества в 100 г раствора%
m (в-ва)
m (р-ра)
·100%
(4)
Процентная концентрация выражается числом, граммов
растворенного вещества, содержащимся в 100 граммах раствора:
95 г Н2О + 5 г NaCl = 100 г Получим 5 %-ный раствор NaCl
18
19.
Задача 9К 140г воды добавили 13г соли. Рассчитать w%
полученного раствора.
19
20.
%m (в-ва)
m (р-ра)
·100%
(4)
Производные формулы (4)
m( в ва)
m р ра %
100
Или:
m( в ва) m р ра % 0.01 (4б )
20
21.
Задача 10Сколько г вещества содержится в:
а) 150г 3% раствора (пл.=1)
б) 315г 7% раствора (пл.=1)
в) 400г 0.9% раствора (пл.=1)
г) 80г 7% раствора (пл.=1)
21
22.
Для растворов с другой плотностью, с учетомформулы 3а:
m ·V (3а)
получим:
m( в ва) V р ра % 0.01 (4в )
22
23.
Задача 11Сколько г вещества содержится в:
а) 120мл 4% раствора (пл.=1.04)
б) 300мл 7% раствора (пл.=1.1)
в) 400мл 17% раствора (пл.=1.15)
г) 90мл 27% раствора (пл.=1.3)
23
24.
Соединим формулу (1)m
v
(1)
M
с формулами (4б,4в)
m( в ва) m р ра % 0.01 (4б )
m( в ва) V р ра % 0.01 (4в )
24
25.
Получим:m р ра · %·0.01
M
(5)
V р ра · %·0.01
M
(6)
Иными словами, можно сразу рассчитать число моль
вещества в растворе, что весьма удобно при решении
задач!!
25
26.
Задача 12Сколько моль вещества содержится в:
а) 400мл 0.9% раствора NaCl (пл.=1)
б) 200мл 5% раствора Fe2(SO4)3 (пл.=1.03)
в) 1500мл 33% раствора Н2SO4 (пл.=1.44)
26
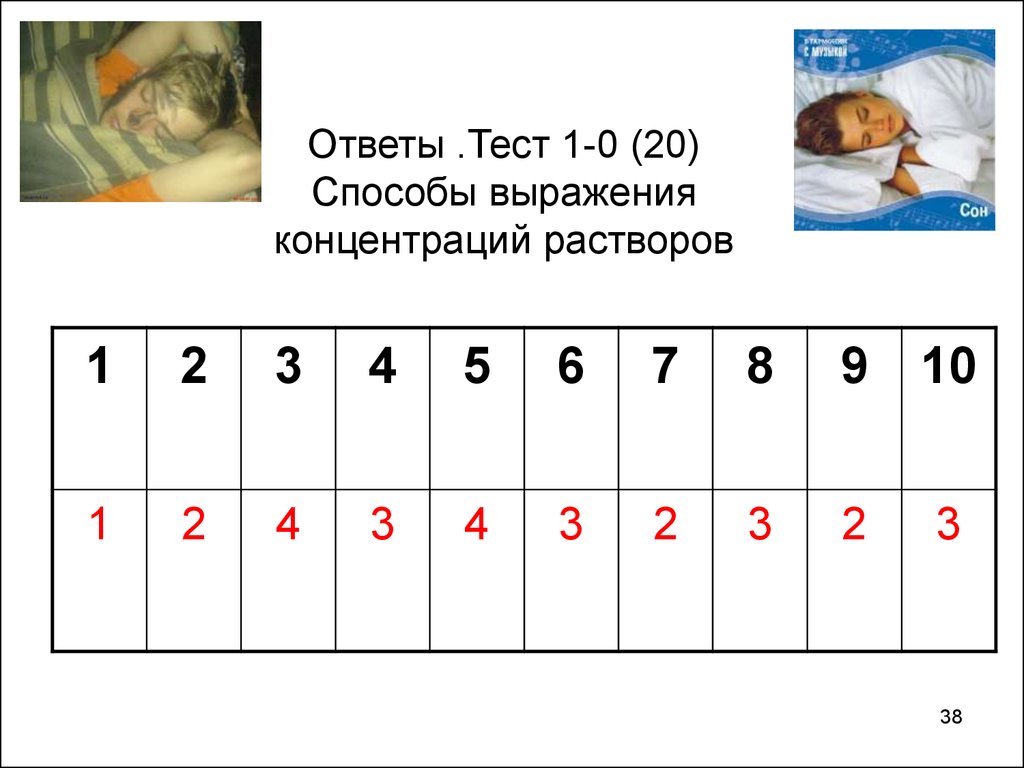
27. Тест 1-0 (20) Способы выражения концентраций растворов (один вариант ответа)
2728.
1. Массовая доля вещества в растворепоказывает сколько:
1) г вещества содержится в 100 г р-ра
2) г вещества содержится в 100 мл
раствора
3) граммов вещества содержится в
1000 мл раствора
4) моль вещества содержится в 1 кг
раствора
28
29.
2. Молярная концентрацияпоказывает сколько моль
вещества содержится в :
1) 100 мл раствора
2) 1 л раствора
3) 1 кг раствора
4) 1 кг растворителя
29
30.
3. Запись: «3М раствор глюкозы»означает, что глюкозы содержится:
1) в 100 мл раствора 3 моль
2) в 100 мл раствора 0.3 моль
3) в 1 кг раствора 3 моль
4) в 1 л раствора 3 моль
30
31.
4. Запись: «0,89%-ный раствор NaCl»означает, что: NaCl содержится:
1) в 1 л раствора 0,89 г
2) в 100 мл раствора 0,89 г
3) в 100 г раствора 0,89 г
4) в 1 кг раствора 0,89 г
31
32.
5. Смешали 300 г 15% и 200 г 25%растворов глюкозы. Массовая доля
вещества в полученном растворе равна:
1) 15 %
2) 18 %
3) 20 %
4) 19 %
32
33.
6.При некоторых заболеваниях в кровьвводят 0,89 % NaCl. Определите массу
соли, введенную в организм при вливании
400 мл этого раствора (плотность = 1 г/мл).
1) 35,6
2) 0,356
3) 3,56
4) 0.00356
33
34.
7. Терапевтическая доза адреналинасоставляет 0,5 мл 0,1% раствора в
сутки. Рассчитайте массу (г)
адреналина за недельный курс
лечения (плотность раствора = 1 г/мл).
1) 0,35
2) 0,0035
3) 0,035
4) 3.5
34
35.
8. Какой объем (мл) 30% раствораН2О2 и воды необходимо взять для
приготовления 500 мл 3%-ного
раствора Н2О2 (плотность растворов
принять равной 1 г/мл).
1) 5,00 мл 30% Н2О2 и 495 мл воды
2) 0,50 мл 30% Н2О2 и 499.5 мл воды
3) 50,00 мл 30% Н2О2 и 450 мл воды
4) 25,00 мл 30% Н2О2 и 475 мл воды
35
36.
9. Для приготовления 503.65 мл 0.5 Мраствора HCIO2 нужно взять 15%-ный
раствор этого же вещества объемом ____
и _____ мл воды
1) 11.5 мл 15% HCIO2 и 492.15 мл воды
2) 115 мл 15% HCIO2 и 388.65 мл воды
3) 1.15 мл 15% HCIO2 и 502.50 мл воды
4) 0.15 мл 15% HCIO2 и 503.50 мл воды
36
37.
10. Смешали 140 мл раствора фосфорнойкислоты с массовой долей 30% и 160 мл
20% -го раствора того же вещества. См
кислоты в полученном растворе равна
________
1) 1.517 моль/л
2) 3.517 моль/л
3) 2.517 моль/л
4) 0.517 моль/л
37
38. Ответы .Тест 1-0 (20) Способы выражения концентраций растворов
12
3
4
5
6
7
8
9
10
1
2
4
3
4
3
2
3
2
3
38
39.
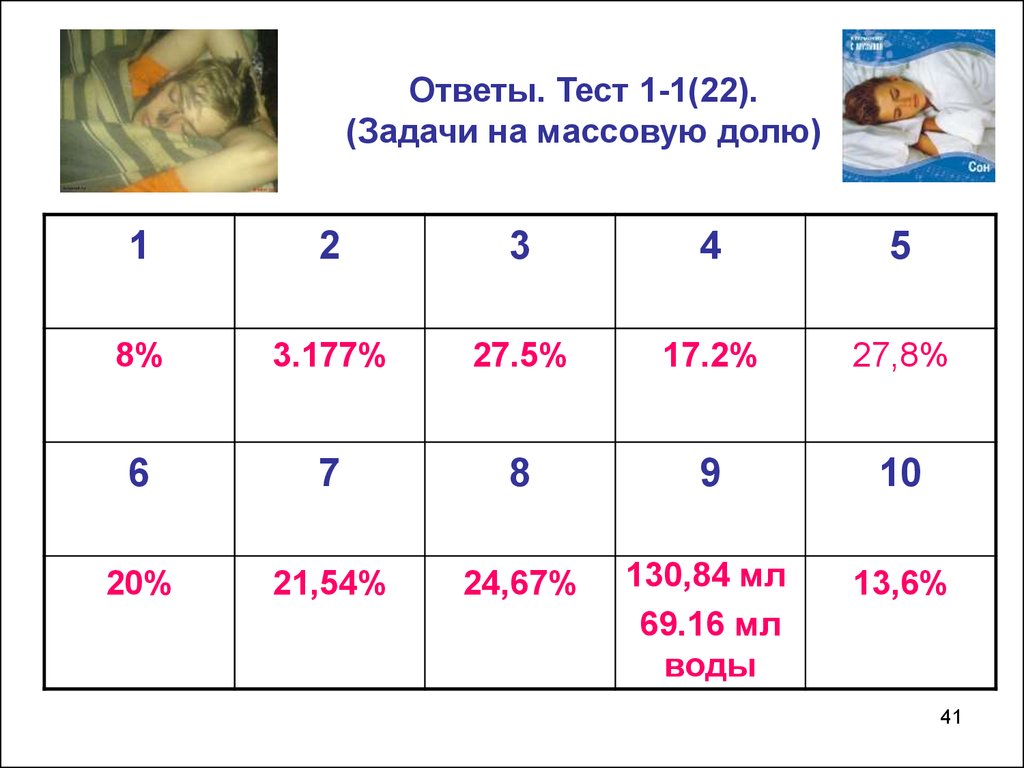
Тест 1-1(22).Задачи на массовую долю
1. К 200 г 10%-го раствора КСl добавили 50 г воды. Чему равна
массовая доля КСI в полученном растворе?
2. Масса соли, которая вводится в организм при вливании
353 г физиологического раствора ( 0,9% раствор NaCI)
равна ________
3. Смешали 120 г раствора серной кислоты с массовой долей
20% и 40 г 50%-го раствора того же вещества. Массовая доля
кислоты в полученном растворе равна ________
4. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl.
Массовая доля хлорида натрия в образовавшемся растворе
равна _________
5. Из 180 мл 25%-ного раствора вещества (ρ = 1,1 г/мл)
выпарили 20 мл воды. Массовая доля вещества во вновь
полученном растворе равна ________
39
40.
6.В 120 мл воды растворили 30 г вещества. Массовая доля
вещества в полученном растворе равна ________
7.
В 120 мл (ρ = 1,2 г/мл) 15%-ного раствора вещества
растворили еще 12 г этого же вещества. Массовая доля
вещества во вновь полученном растворе равна ________
8.
В 250 г 5%-ного раствора сульфата меди (II)
растворили еще 125 г медного купороса. Массовая доля
соли в полученном растворе равна ________
9.
Для приготовления 200 мл 20%-ного раствора вещества
с плотностью 1,05 г/мл нужно взять 30%-ный раствор этого
же вещества с плотностью 1,07 г/мл объемом ____ и ___
воды
10. Слили два раствора одного и того же вещества:
160 г 15%-ного и 140 г 12%-ного. Массовая доля вещества
во вновь полученном растворе равна ________
40
41.
Ответы. Тест 1-1(22).(Задачи на массовую долю)
1
2
3
4
5
8%
3.177%
27.5%
17.2%
27,8%
6
7
8
9
10
20%
21,54%
24,67%
130,84 мл
69.16 мл
воды
13,6%
41







































 Химия
Химия








