Похожие презентации:
Атомы
1.
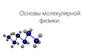
АтомыАтом— это электрически
нейтральная
микрочастица, состоящая
из положительного ядра и
окружающей его
электронной оболочки.
Размеры атома порядка
10
10 м.
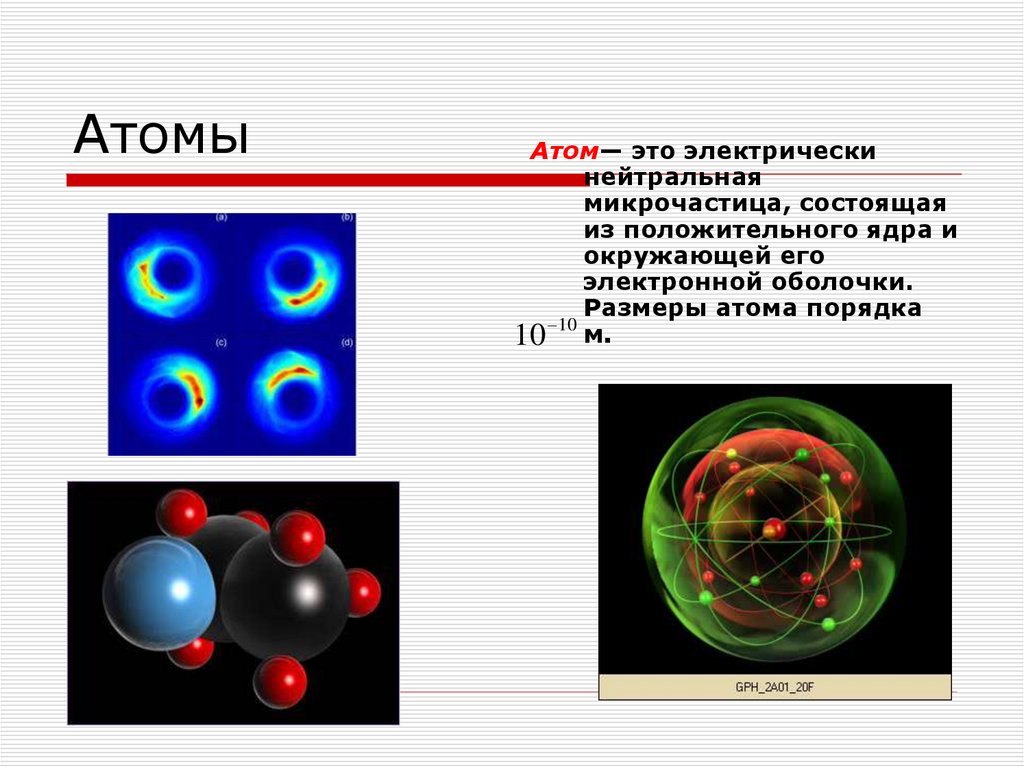
2. Диффузия
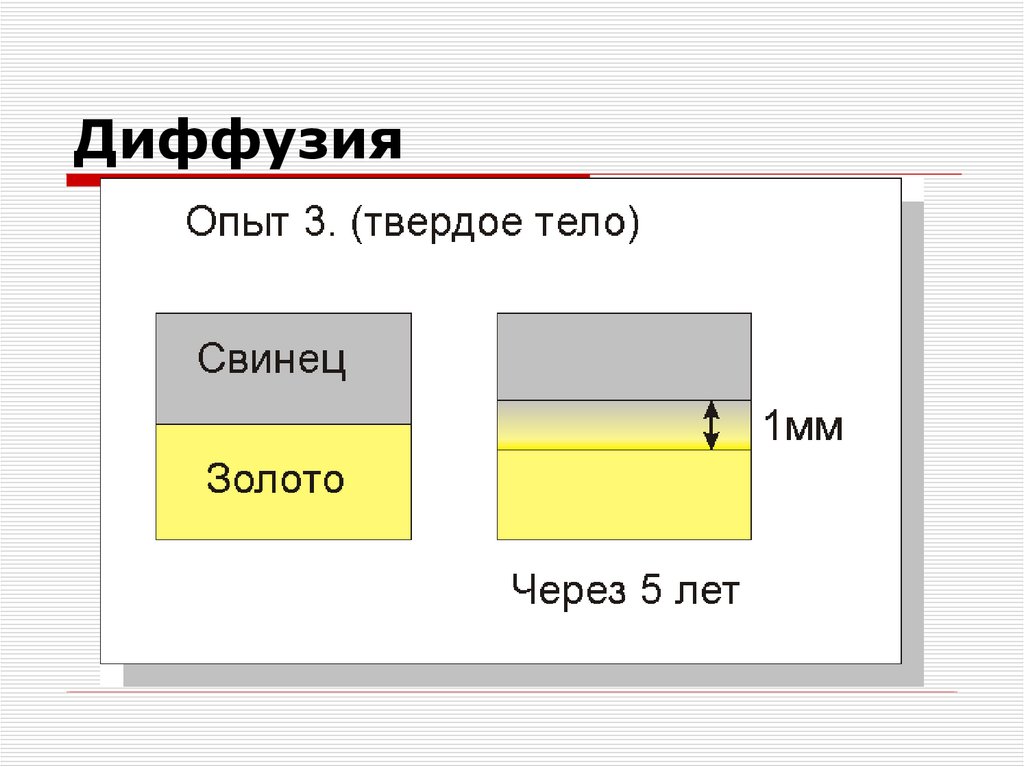
3. Диффузия
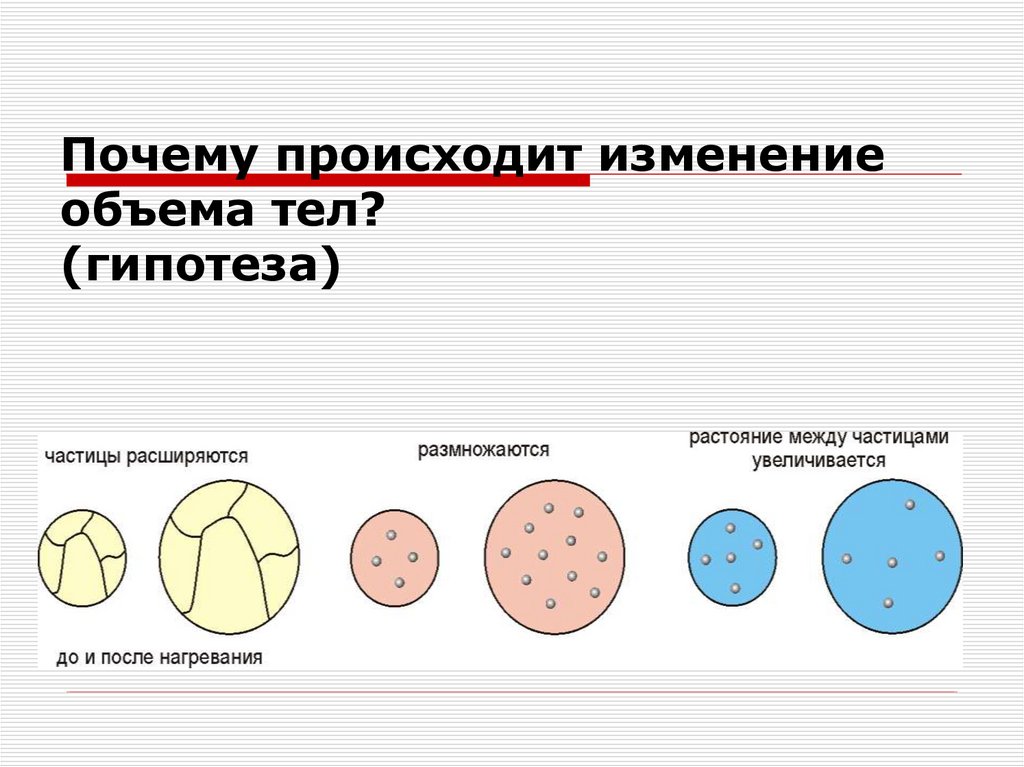
4. Почему происходит изменение объема тел? (гипотеза)
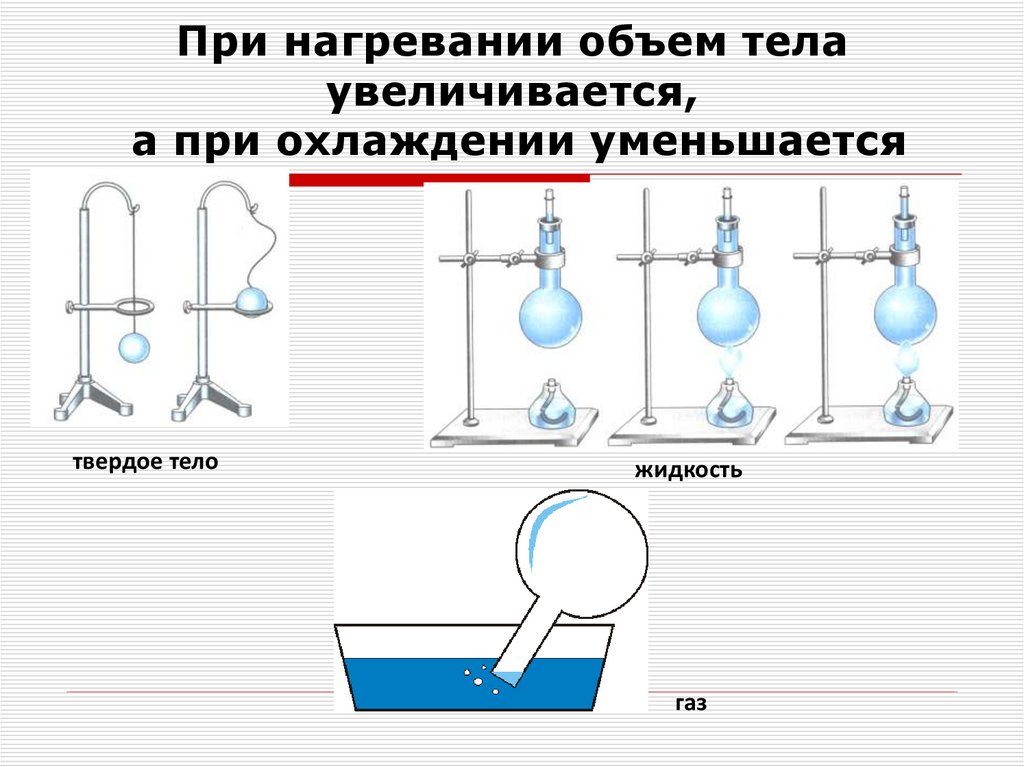
5. При нагревании объем тела увеличивается, а при охлаждении уменьшается
твердое теложидкость
газ
6. Агрегатные состояния вещества
газообразноежидкое
твёрдое
пар
вода
лёд
7.
1. Физические величины,характеризующие молекулы:
1. Относительная
молекулярная масса
2. Количество вещества
3. Молярная масса
8. Масса молекулы. Количество вещества
9.
1. Относительная молекулярная массаОтносительной
молекулярной (или
атомной) массой
вещества Мr называют
отношение массы
молекулы (или атома) mo
данного вещества к 1/12
массы атома углерода
moc:
mo
Mr
1
moc
12
Относительные молекулярные
массы определяют по таблице
Менделеева.
Например:
Мr(CO2) = 12 + 2 ∙ 16 = 44
Мr(Н2О) = 2 ∙ 1 + 16 = 18
10.
Основные понятиямолекулярно-кинетической теории
– Относительная молекулярная
масса;
– количество вещества;
– постоянная Авогадро;
– молярная масса.
11.
Основные понятиямолекулярно-кинетической теории
Массу частицы, измеренную
в а.е.м. (атомная единица
массы), принято называть
относительной атомной (или
молекулярной) массой.
12.
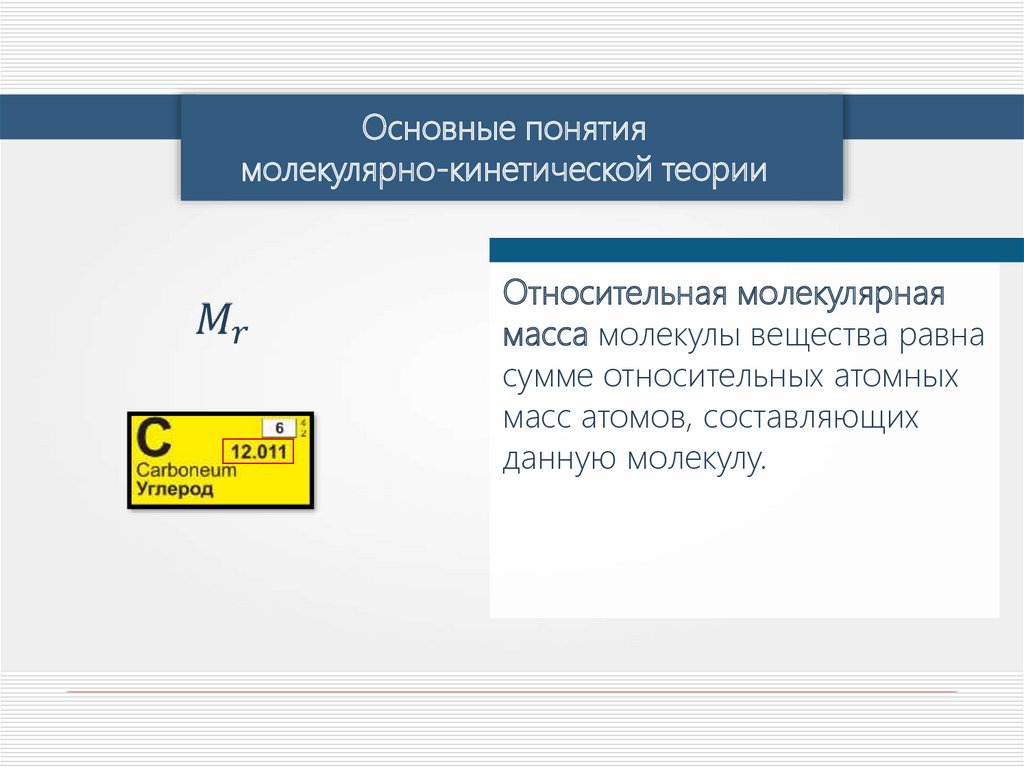
Основные понятиямолекулярно-кинетической теории
Относительная молекулярная
масса молекулы вещества равна
сумме относительных атомных
масс атомов, составляющих
данную молекулу.
13.
14.
2. Количество веществаКоличество вещества
– это физическая
величина равная
отношению числа
молекул N в данном
теле к постоянной
Авогадро NА, т.е. к
числу молекул в 1
моль вещества:
N
.
NA
Единица количества
вещества – 1 моль.
Один моль – это количество
вещества, в котором
содержится столько же
молекул или атомов,
сколько атомов
содержится в 12 г
углерода.
Постоянная Авогадро – число
атомов в 1 моль вещества
или в 12 г углерода:
NA ≈ 6 ∙ 1023 моль-1
15.
16.
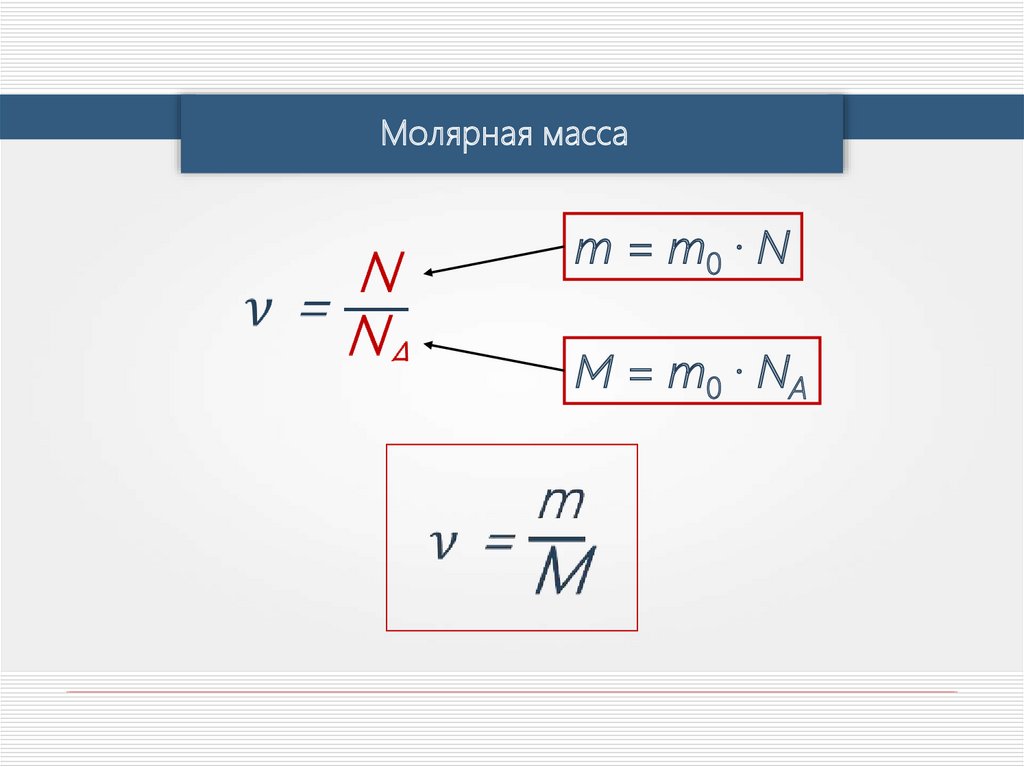
3. Молярная массаМолярная масса М –
это масса вещества,
взятого в количестве 1
моль.
Молярная масса равна
произведению массы
молекулы на
постоянную Авогадро:
М moNA.
Единица измерения
молярной массы в
“СИ” – кг/моль.
Связь молярной массы
с молекулярной:
М = 10-3 Мr кг/моль
Например:
М(CO2) = 44∙10-3 кг/моль.
М(Н2О) = 18 ∙10-3 кг/моль.
17.
Число Авогадро — числомолекул в одном моле
любого вещества или число
атомов в одном моле
простого вещества.
Амедео Авогадро
1776–1856 гг.
18.
Молярная масса (M) равна массе вещества, взятогов количестве 1 моль.
19.
Другие формулыМасса вещества:
Количество
вещества:
Число молекул:
Плотность:
m m
V
0N
m
M
m
N
N
N
A
A
m M
nm
0
N
Концентрация:n
V
Масса молекулы:
V
M
m0
NA
20.
Молярная массаm0 — масса одной молекулы вещества.
M = m0 · N A
m — масса любого количества вещества.
m = m0 · N
21.
Молярная массаm = m0 · N
M = m0 · NA













 Физика
Физика