Похожие презентации:
Уравнение Клапейрона. Уравнение Менделеева-Клапейрона. Газовые законы ( изопроцессы)
1.
Уравнение КлапейронаУравнение МенделееваКлапейрона
Газовые законы ( изопроцессы)
Тема урока
2.
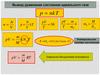
Универсальная газовая постоянная RNA k = R
R=8,31 Дж / (моль·К)
Уравнение Менделеева - Клапейрона
pV m
NAk
T
M
3.
ИзопроцессыС помощью уравнения МенделееваКлапейрона можно исследовать газовые
процессы:
если масса газа m= Const и один из
макропараметров P, V или Т не меняются ,
а два остальных меняются,
такие процессы называются
изопроцессами.
4.
m= Const1. Изотермический процесс - процесс
изменения состояния термодинамической
системы при постоянной температуре .
Если Т =const, то
Закон Бойля-Мариотта
Для данной массы газа произведение
давления газа на его объем постоянно, если
температура газа не
меняется: p1V1=p2V2 при Т = const
5.
Изотермы в разных осях координатp1V1=p2V2
при Т = const
6.
2. Изохорный процесс-процесс изменениясостояния термодинамической системы при
постоянном объеме.
Закон Шарля
m= Const
Ecли V = const , то
Давление данной массы газа при постоянном
объеме прямо пропорционально абсолютной
температуре:
7.
Изохоры в разных осях координат8.
3. Изобарный процесс процесс изменения состояниятермодинамической системы при
постоянном давлении .
m= Const
Закон Гей-Люссака
Объем данной массы газа при постоянном
давлении прямо пропорционален
абсолютной температуре:
9.
Изобары в разных осях координат10.
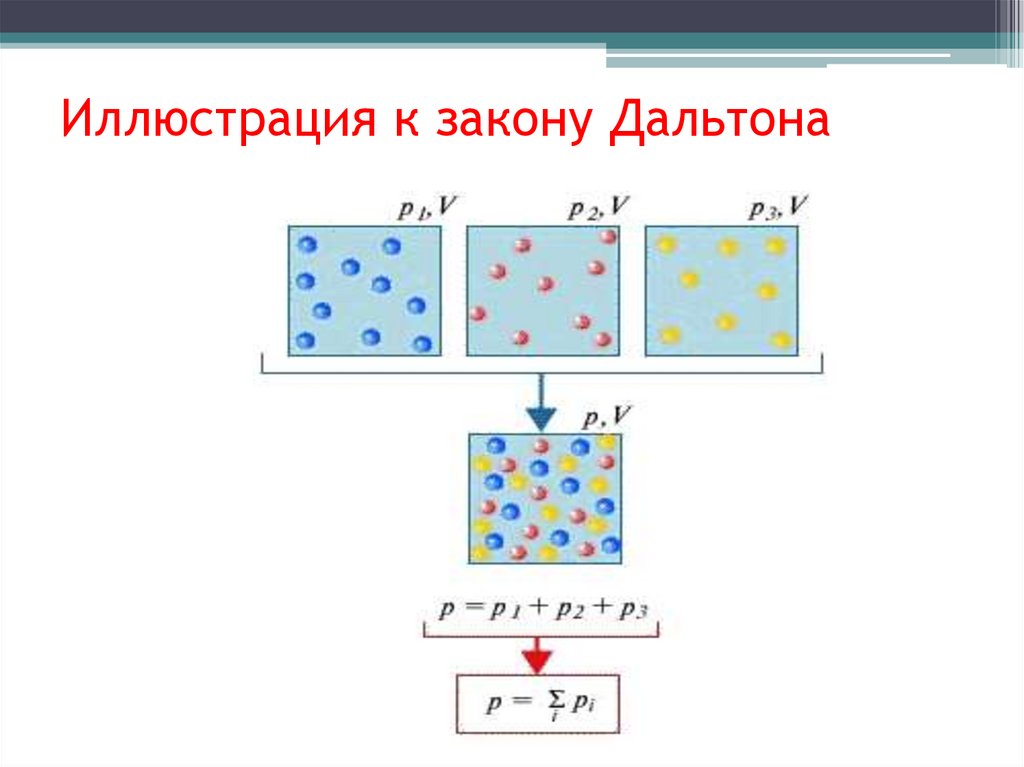
Закон Дальтона• Если идеальный газ является смесью
нескольких газов, то согласно закону
Дальтона, давление смеси идеальных
газов равно сумме парциальных
давлений входящих в нее газов.
• Парциальное давление - это такое
давление, которое производил бы газ,
если бы он один занимал весь объем,
равный объему смеси.










 Физика
Физика