Похожие презентации:
Соли аммония
1.
Соли аммония2.
3.
Соли аммонияИон аммония по размерам и заряду близок к ионам
щелочных металлов, поэтому соли аммония
похожи на соли щелочных металлов.
ФИЗИЧЕСКИЕ СВОЙСТВА
Кристаллические вещества.
Белого цвета.
Хорошо растворяются в воде. Их растворение
в воде сопровождается поглощением тепла.
Качественная реакция на ион аммония –
взаимодействие солей с растворами щелочей:
NH4NO3 + NaOH = NaNO3 + NH3 + H2O
характерный резкий запах аммиака
4.
5.
6.
3.Разложение солей аммония принагревании
а)Соли летучих кислот:
NH4Cl = NH3 + HCl
(NH4)2CO3 = 2NH3 + CO2 + H2O
7.
3.Разложение солей аммонияпри нагревании
б) Cоли нелетучих кислот:
(NH4)2SO4 = NH4HSO4 + NH3
(NH4)3PO4 = (NH4)2HPO4 + NH3
без нагревания
(NH4)2HPO4 = NH4H2PO4 + NH3 при нагревании
8.
3.Разложение солей аммонияпри нагревании
в) Соли с анионом-окислителем:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
NH4NO3 = N2O + 2H2O
NH4NO2 = N2 + 2H2O
9.
10.
11.
12.
13.
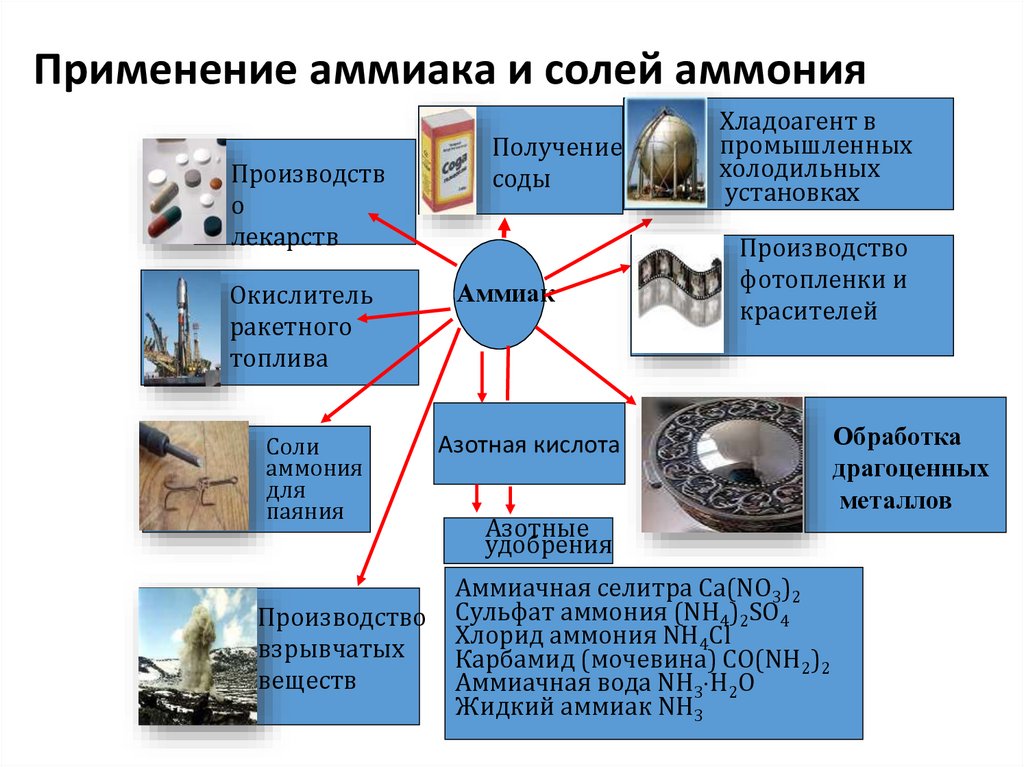
Применение аммиака и солей аммонияПроизводств
о
лекарств
Окислитель
ракетного
топлива
Соли
аммония
для
паяния
Производство
взрывчатых
веществ
Получение
соды
Аммиак
Хладоагент в
промышленных
холодильных
установках
Производство
фотопленки и
красителей
Азотная кислота
Азотные
удобрения
Аммиачная селитра Ca(NO3)2
Сульфат аммония (NH4)2SO4
Хлорид аммония NH4Cl
Карбамид (мочевина) CO(NH2)2
Аммиачная вода NH3 H2O
Жидкий аммиак NH3
Обработка
драгоценных
металлов












 Химия
Химия








