Похожие презентации:
Обмен аминокислот. Дезаминирование и трансаминирование аминокислот. Обезвреживание аммиака. Образование и выведение мочевины
1. Обмен аминокислот. Дезаминирование и трансаминирование аминокислот. Обезвреживание аммиака. Образование и выведение мочевины.
Лекция для специальности 31.05.01 Лечебное дело подготовленадоцентом кафедры общей и биологической химии ТГМУ О. А. Артюковой
2016 – 2017 учебный год
2. Основные вопросы лекции:
1. Роль белков в питании человека. Азотистый баланс и его виды.2. Катаболизм белков.
3. Пул аминокислот в клетке.
4. Прямое окислительное дезаминирование аминокислот.
5. Трансаминирование аминокислот. Роль аминотрансфераз.
6. Введение аминокислот в общий путь катаболизма и глюконеогенез.
7. Судьба безазотистого остатка аминокислот. Кетогенные и гликогенные
аминокислоты. Синтез заменимых аминокислот. Глюкозо-аланиновый
цикл: схема, место протекания, биологическая роль.
8. Токсичность аммиака, пути его образования и способы утилизации.
9. Цикл мочевинообразования
10. Количество выводимой мочевины/сут.
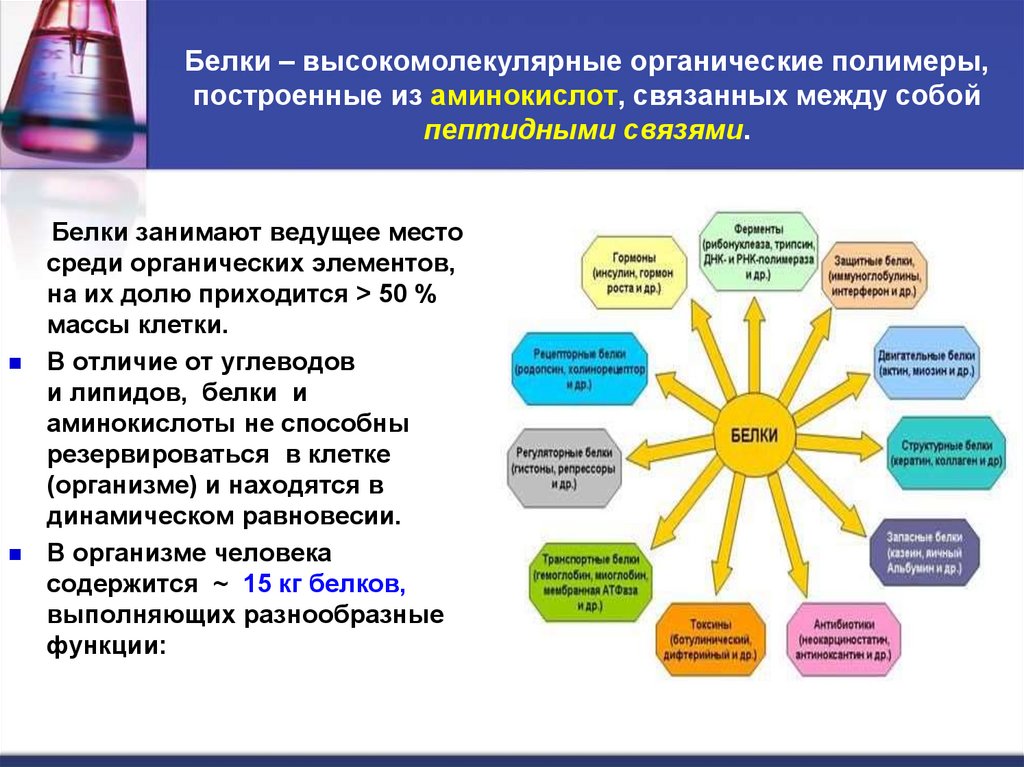
3. Белки – высокомолекулярные органические полимеры, построенные из аминокислот, связанных между собой пептидными связями.
Белки занимают ведущее местосреди органических элементов,
на их долю приходится > 50 %
массы клетки.
В отличие от углеводов
и липидов, белки и
аминокислоты не способны
резервироваться в клетке
(организме) и находятся в
динамическом равновесии.
В организме человека
содержится ~ 15 кг белков,
выполняющих разнообразные
функции:
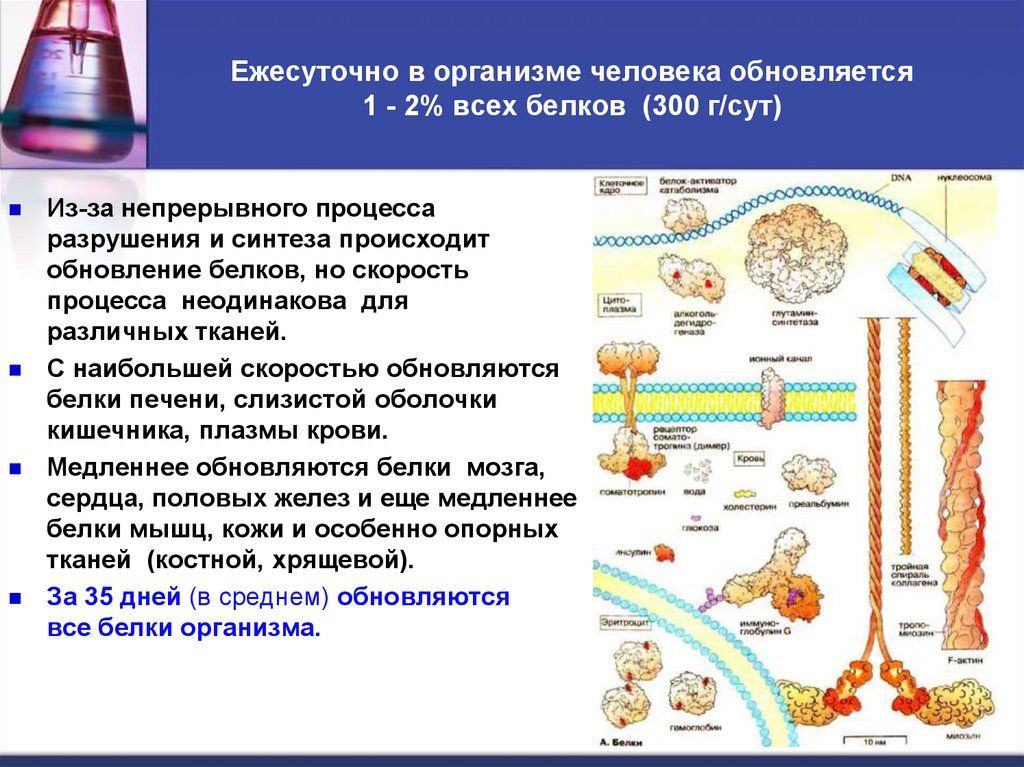
4. Ежесуточно в организме человека обновляется 1 - 2% всех белков (300 г/сут)
Из-за непрерывного процессаразрушения и синтеза происходит
обновление белков, но скорость
процесса неодинакова для
различных тканей.
С наибольшей скоростью обновляются
белки печени, слизистой оболочки
кишечника, плазмы крови.
Медленнее обновляются белки мозга,
сердца, половых желез и еще медленнее
белки мышц, кожи и особенно опорных
тканей (костной, хрящевой).
За 35 дней (в среднем) обновляются
все белки организма.
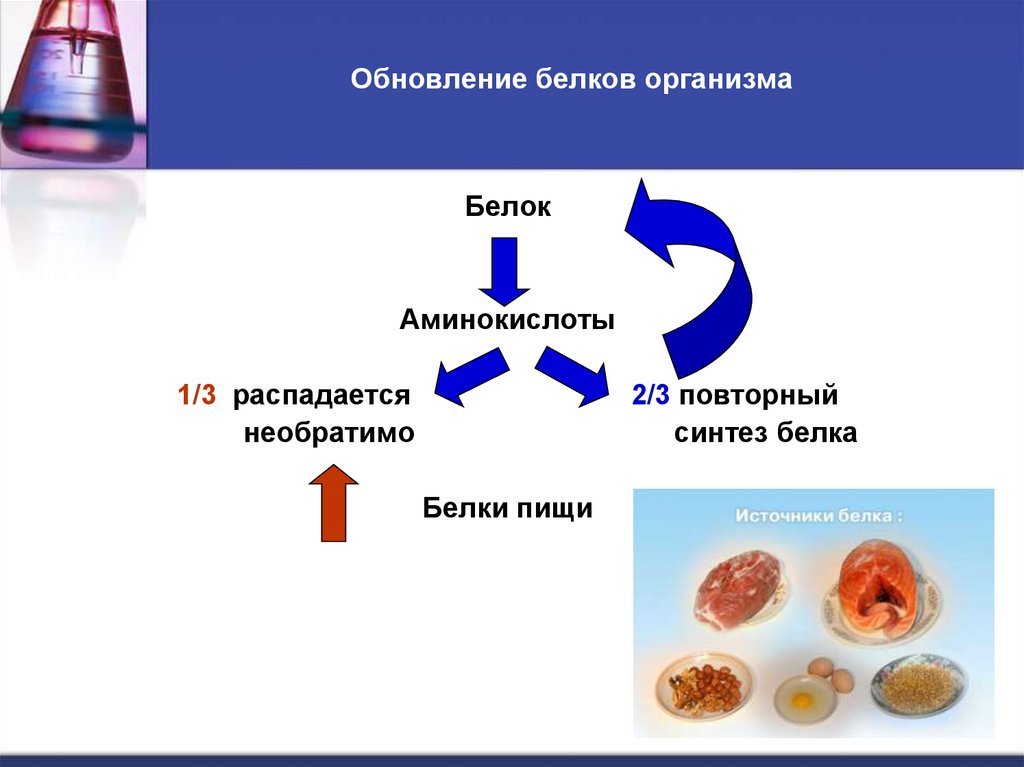
5. Обновление белков организма
БелокАминокислоты
1/3 распадается
необратимо
2/3 повторный
синтез белка
Белки пищи
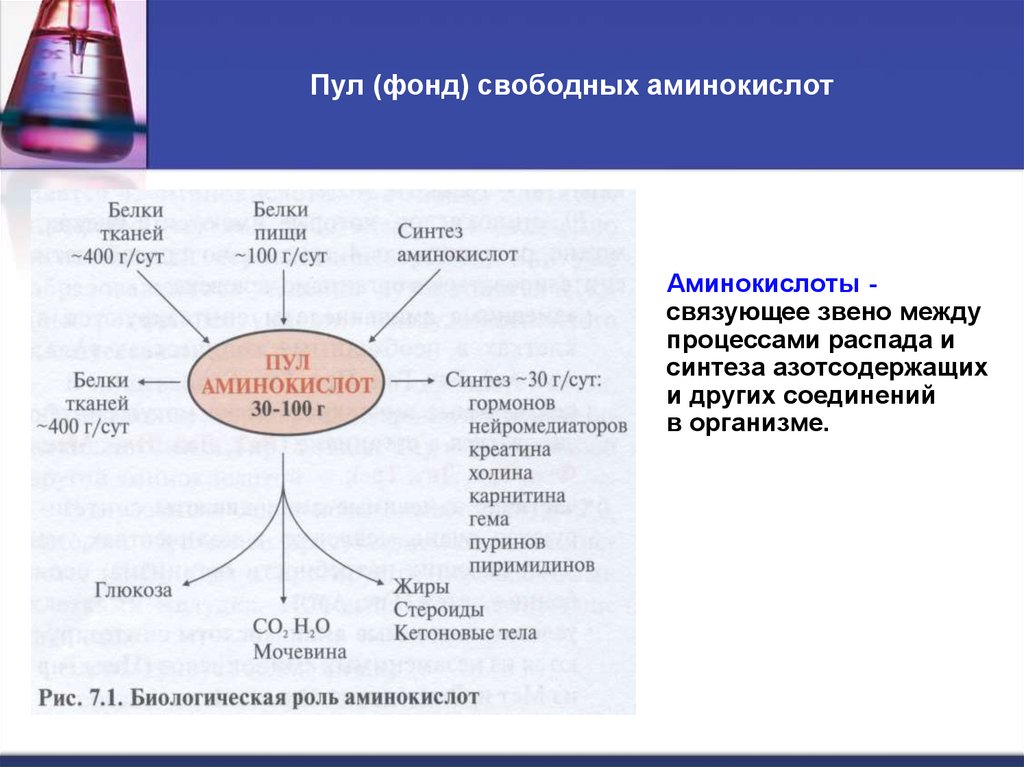
6. Пул (фонд) свободных аминокислот
Аминокислоты связующее звено междупроцессами распада и
синтеза азотсодержащих
и других соединений
в организме.
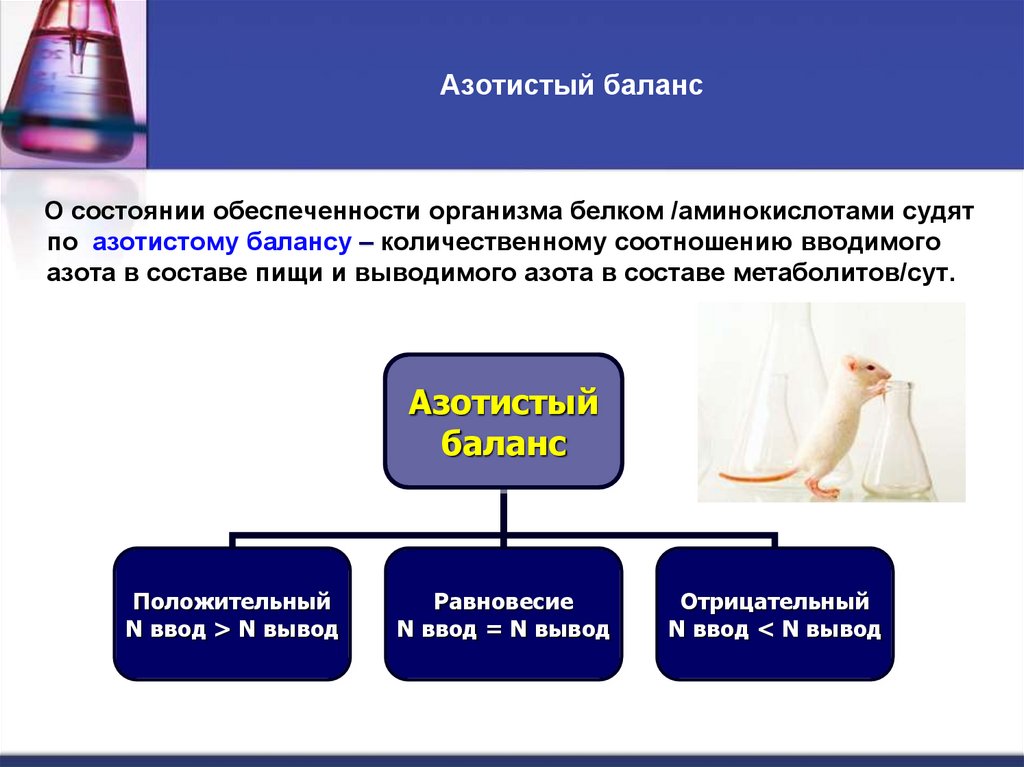
7. Азотистый баланс
О состоянии обеспеченности организма белком /аминокислотами судятпо азотистому балансу – количественному соотношению вводимого
азота в составе пищи и выводимого азота в составе метаболитов/сут.
Азотистый
баланс
Положительный
N ввод > N вывод
Равновесие
N ввод = N вывод
Отрицательный
N ввод < N вывод
8.
Факторы, влияющиена интенсивность
азотистого обмена
Экзогенные
Характер питания
Количество
пищевого белка
Эндогенные
Возраст, физиология,
состояние ЖКТ и др.
Качественный
состав пищевого
белка
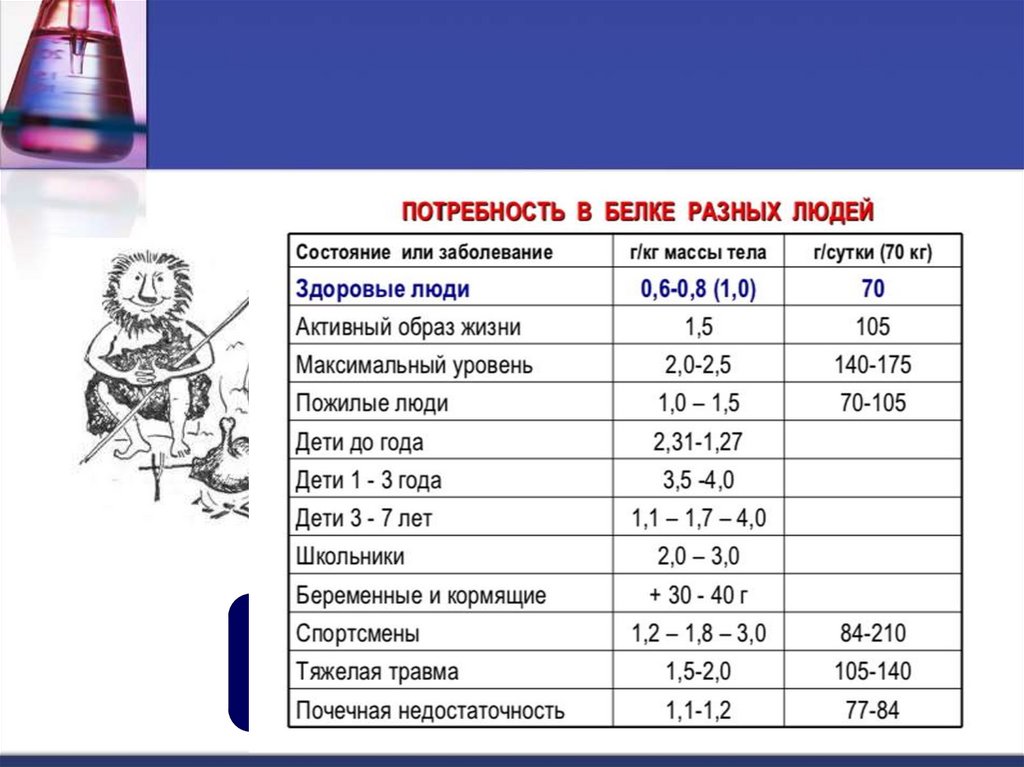
9. Поступление белков с пищей
Белковое голоданиеприводит к распаду белков собственных тканей (резерва нет!):
- печени
- плазмы крови
- слизистой оболочки ЖКТ
- мышц.
Образующиеся при распаде белков аминокислоты обеспечивают
синтез белков клетки, ферментов, гормонов, БАВ.
Избыток белка в рационе приводит:
1) к увеличению выведения конечных продуктов азотистого обмена,
2) к усилению гнилостных процессов в ЖКТ.
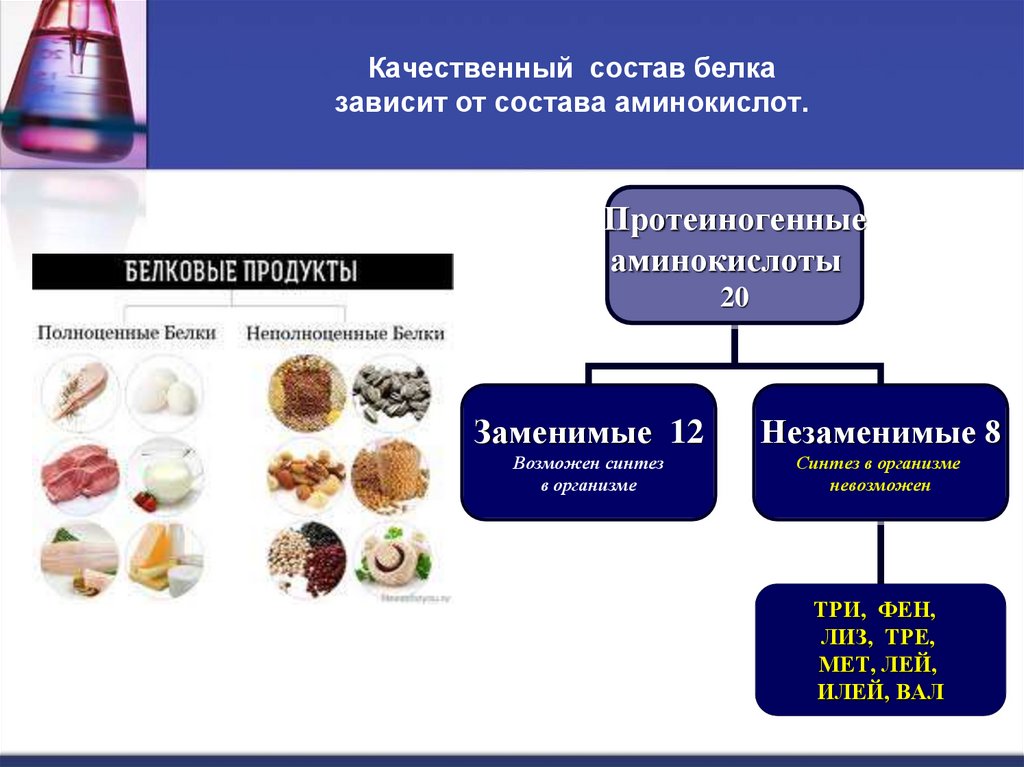
10. Качественный состав белка зависит от состава аминокислот.
Протеиногенныеаминокислоты
20
Заменимые 12
Незаменимые 8
Возможен синтез
в организме
Синтез в организме
невозможен
ТРИ, ФЕН,
ЛИЗ, ТРЕ,
МЕТ, ЛЕЙ,
ИЛЕЙ, ВАЛ
11. Биологическая ценность белка определяется его аминокислотным составом.
Чем ближе аминокислотный составпищевого белка к аминокислотному
составу нашего организма,
тем выше его ценность
Белки животного происхождения
более ценные!
Эталонный белок –белок куриного яйца.
12. Недостаточность белка в рационе. Квашиоркор -
форма белковой недостаточности,развивающаяся при однообразном питании
продуктами растительного происхождения
с малым содержанием белка.
Встречается среди населения стран
тропического и субтропического пояса
Африки, Латинской Америки и
Юго-Восточной Азии.
Этим заболеванием страдают
преимущественно дети в возрасте 1 - 5 лет.
Проявления: отставание в росте,
поражение печени, кожи, атония мышц и т.п.
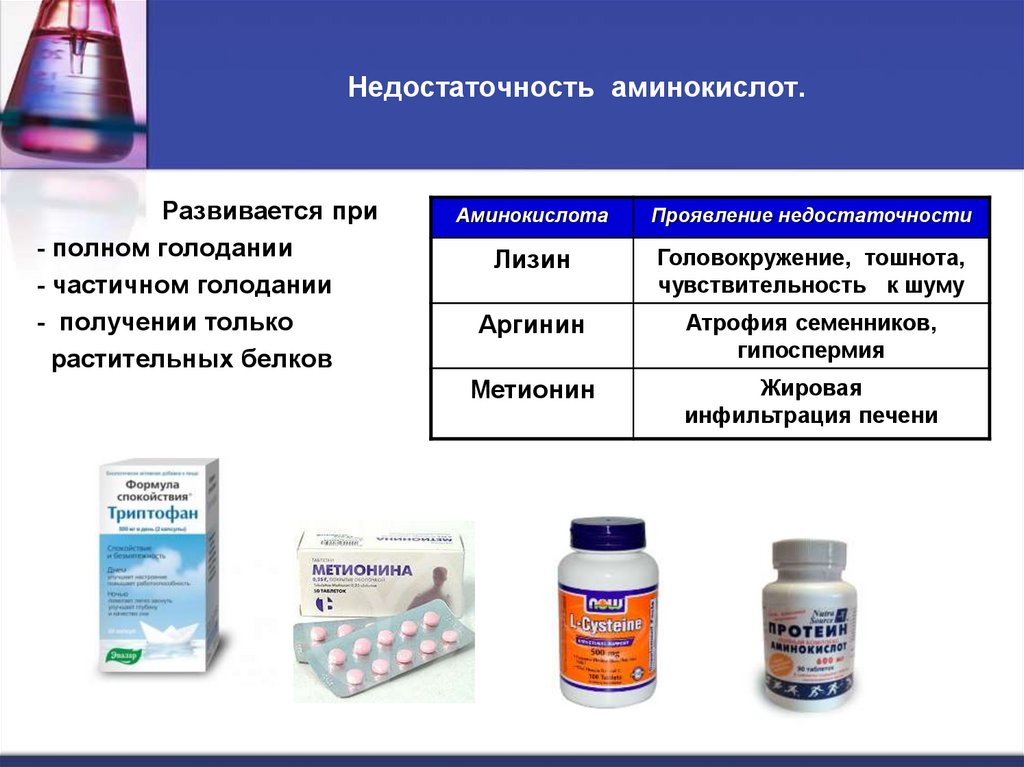
13. Недостаточность аминокислот.
Развивается при- полном голодании
- частичном голодании
- получении только
растительных белков
Аминокислота
Проявление недостаточности
Лизин
Головокружение, тошнота,
чувствительность к шуму
Аргинин
Атрофия семенников,
гипоспермия
Метионин
Жировая
инфильтрация печени
14. Протеолиз – распад белков до аминокислот.
Протеолитические ферменты, осуществляющие гидролиз пептиднойсвязи, объединяют термином пептидазы.
Экзопептидазы - отщепляют по одной аминокислоте с N или С конца
полипептидной цепи;
Эндопептидазы – воздействуют на связи внутри полипептидной цепи
(протеиназы или протеазы).
Для усвоения организмом пищевых белков необходимо их полное
расщепление до аминокислот в желудочно-кишечном тракте
(всасываются только аминокислоты, т.к. лишены антигенных свойств)
В ЖКТ происходит тотальный протеолиз, благодаря
- набору ферментов
- оптимуму рН
- регуляции последовательности процессов.
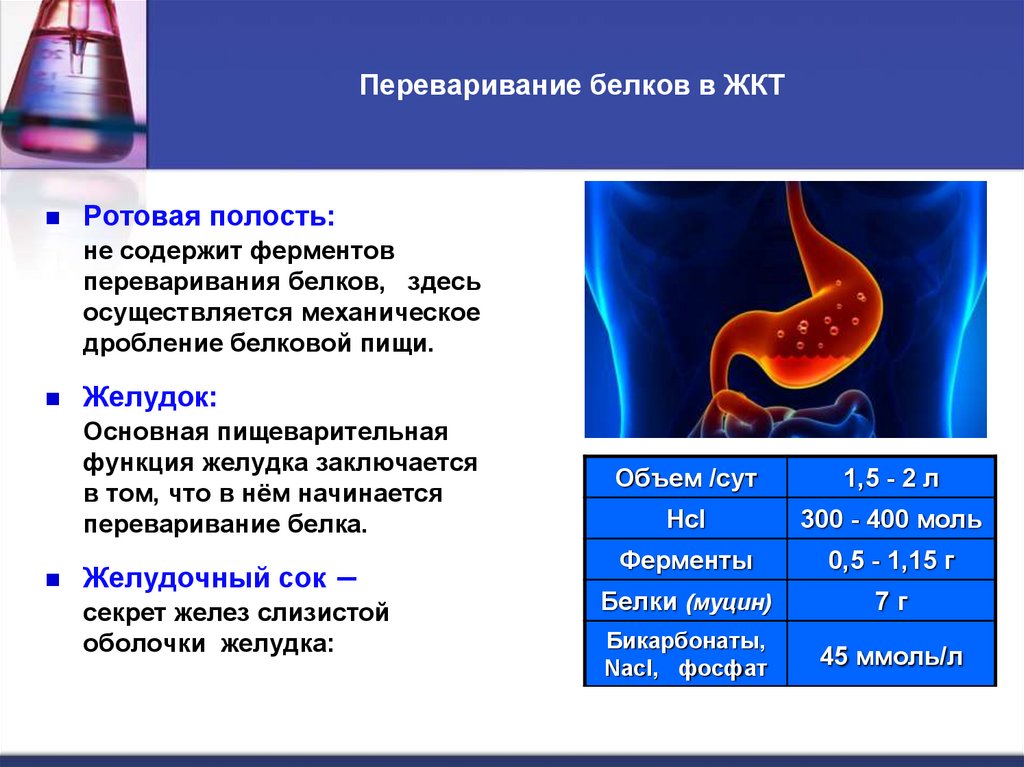
15. Переваривание белков в ЖКТ
Ротовая полость:не содержит ферментов
переваривания белков, здесь
осуществляется механическое
дробление белковой пищи.
Желудок:
Основная пищеварительная
функция желудка заключается
в том, что в нём начинается
переваривание белка.
Желудочный сок –
секрет желез слизистой
оболочки желудка:
Объем /сут
1,5 - 2 л
Hcl
300 - 400 моль
Ферменты
0,5 - 1,15 г
Белки (муцин)
7г
Бикарбонаты,
Nacl, фосфат
45 ммоль/л
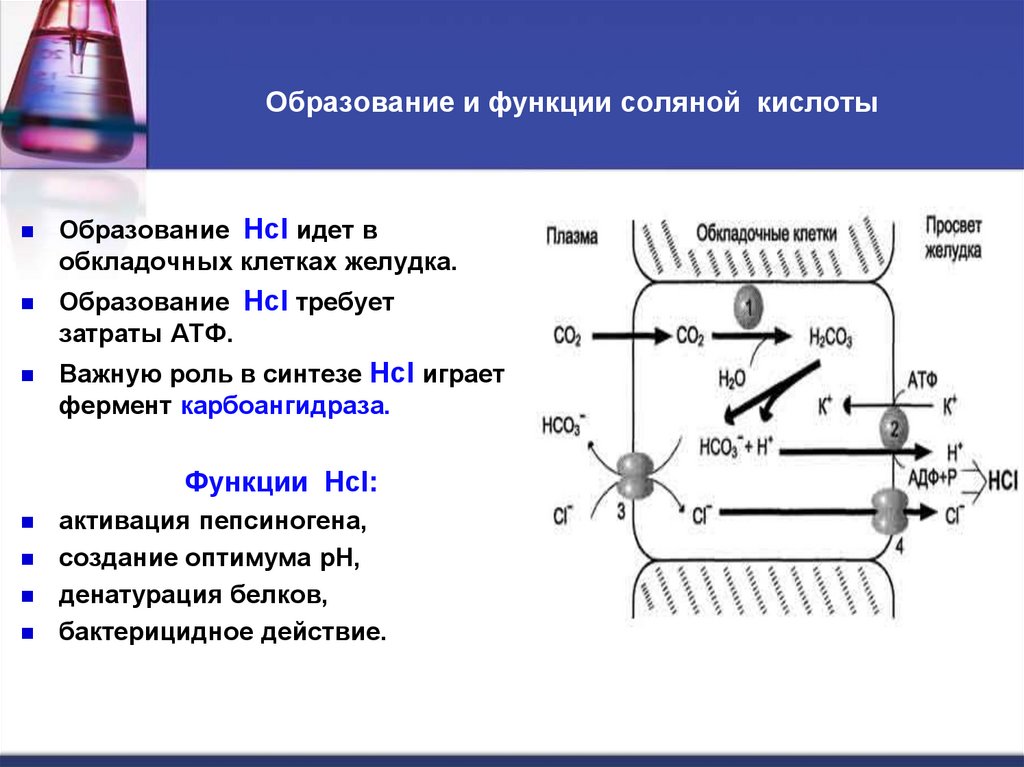
16. Образование и функции соляной кислоты
Образование Hcl идет вобкладочных клетках желудка.
Образование Hcl требует
затраты АТФ.
Важную роль в синтезе Hcl играет
фермент карбоангидраза.
Функции Hcl:
активация пепсиногена,
создание оптимума рН,
денатурация белков,
бактерицидное действие.
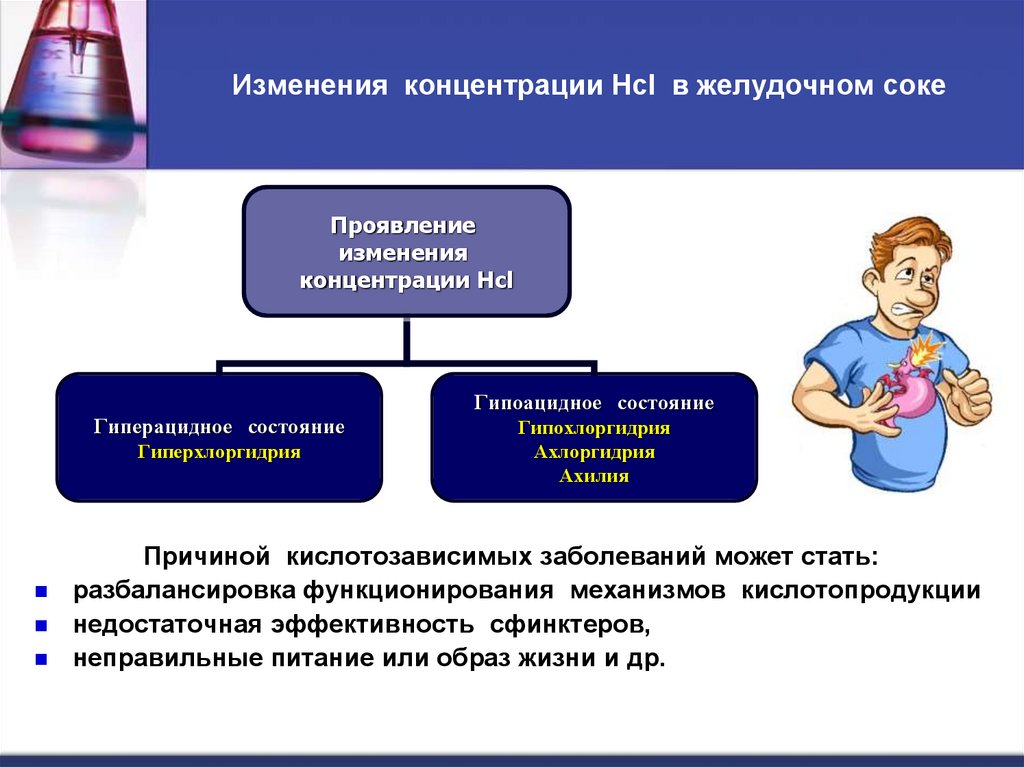
17. Изменения концентрации Hcl в желудочном соке
Проявлениеизменения
концентрации Hcl
Гипоацидное состояние
Гиперацидное состояние
Гиперхлоргидрия
Гипохлоргидрия
Ахлоргидрия
Ахилия
Причиной кислотозависимых заболеваний может стать:
разбалансировка функционирования механизмов кислотопродукции
недостаточная эффективность сфинктеров,
неправильные питание или образ жизни и др.
18. Ферменты желудочного сока
ПепсинОбразуется из профермента
пепсиногена путем
частичного протеолиза.
Оптимум рН 1-2.
Пепсин - эндопептидаза,
осуществляет гидролиз
пептидных связей
внутри белковой молекулы,
образованных аминокислотами:
ГЛУ, АСП,ТИР,ФЕН.
19. Ферменты желудочного сока.
Гастриксин– эндопептидаза,
оптимум рН 3,2-3,5. Образуется из
пепсиногена, гидролизует внутренние
пептидные связи с образованием
коротких пептидов.
Реннин (сычужный фермент) –
эндопептидаза, оптимум рН 4,5;
вызывает створаживание молока
в присутствии Са2+. Есть только у детей
грудного возраста. В желудке взрослых
людей реннина нет, молоко створаживается
под действием НСl, пепсина.
Пепсин, реннин и гастриксин имеют сходство по первичной
структуре, что указывает на их происхождение от общего
гена-предшественника.
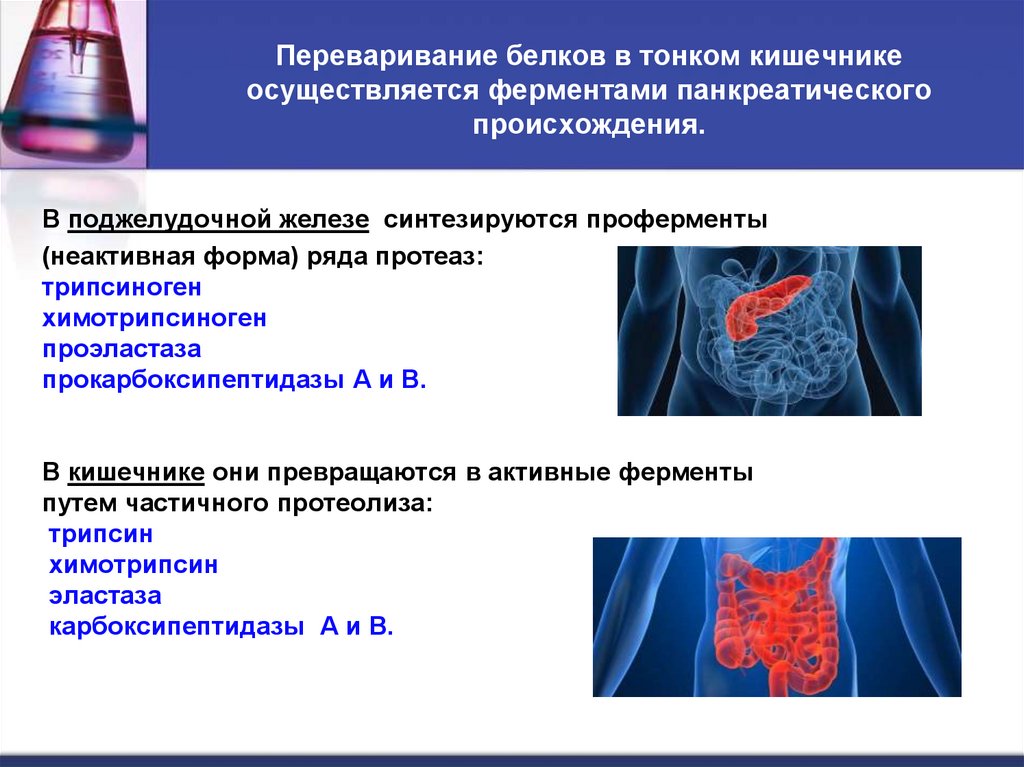
20. Переваривание белков в тонком кишечнике осуществляется ферментами панкреатического происхождения.
В поджелудочной железе синтезируются проферменты(неактивная форма) ряда протеаз:
трипсиноген
химотрипсиноген
проэластаза
прокарбоксипептидазы А и В.
В кишечнике они превращаются в активные ферменты
путем частичного протеолиза:
трипсин
химотрипсин
эластаза
карбоксипептидазы А и В.
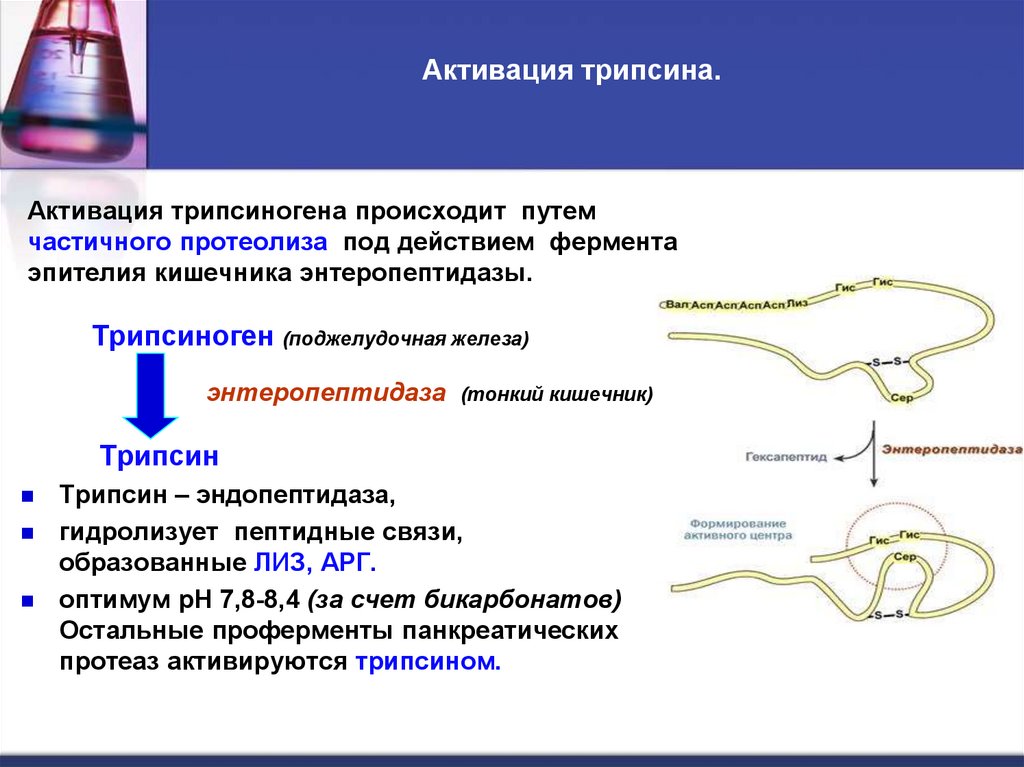
21. Активация трипсина.
Активация трипсиногена происходит путемчастичного протеолиза под действием фермента
эпителия кишечника энтеропептидазы.
Трипсиноген (поджелудочная железа)
энтеропептидаза
(тонкий кишечник)
Трипсин
Трипсин – эндопептидаза,
гидролизует пептидные связи,
образованные ЛИЗ, АРГ.
оптимум рН 7,8-8,4 (за счет бикарбонатов)
Остальные проферменты панкреатических
протеаз активируются трипсином.
22. Ферменты кишечного сока синтезируются клетками тонкого кишечник в активной форме. (оптимум рН 6,5 - 8,3)
Аминопептидазыпоследовательно отщепляют
N-концевые аминокислоты
пептидной цепи.
Дипептидазы
расщепляют дипептиды
на аминокислоты.
В результате
последовательного действия
всех пищеварительных протеаз
большинство пищевых белков
расщепляется до аминокислот.
23. Защита клеток ЖКТ от действия протеаз.
Защита клеток ЖКТ от действия протеаз.Протеолитические ферменты образуются в виде неактивных
предшественников и активируются после секреции в просвете ЖКТ.
Место синтеза и место действия фермента пространственно разделены!
Протеазы не контактируют с белками клеток.
Каждая клетка содержит на наружной поверхности мембраны
полисахариды, которые не расщепляются протеазами и тем самым
защищают клетку от их действия.
Разрушение клеточных белков
протеазами происходит при
язвенной болезни желудка и
двенадцатиперстной кишки.
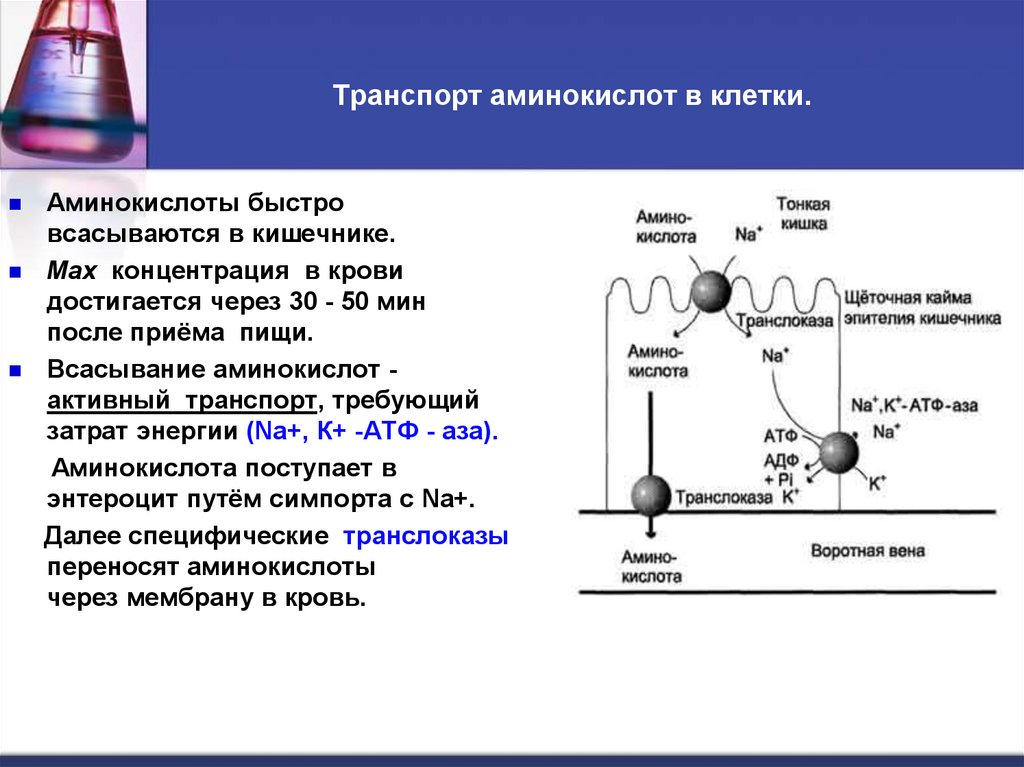
24. Транспорт аминокислот в клетки.
Аминокислоты быстровсасываются в кишечнике.
Max концентрация в крови
достигается через 30 - 50 мин
после приёма пищи.
Всасывание аминокислот активный транспорт, требующий
затрат энергии (Nа+, К+ -АТФ - аза).
Аминокислота поступает в
энтероцит путём симпорта с Na+.
Далее специфические транслоказы
переносят аминокислоты
через мембрану в кровь.
25. Нарушение переваривания белков и транспорта аминокислот.
Продукты полностью переваренного белка (аминокислоты) лишеныантигенных свойств и иммунных реакций не вызывают.
Небольшую долю продуктов переваривания белка составляют
короткие пептиды, которые могут всасываться.
Возникает иммунная реакция на приём белка.
Целиакия характеризуется повышенной чувствительностью
к глютену (белку клейковины зёрен злаков). Глютен оказывает
токсическое действие на слизистую оболочку тонкой кишки, что
приводит к её патологическим изменениям и нарушению всасывания.
Цистинурия, болезнь Хартнапа возникают вследствие дефекта
переносчиков нейтральных аминокислот в кишечнике. У больных
нарушены транспорт аминокислот и их метаболизм в клетках.
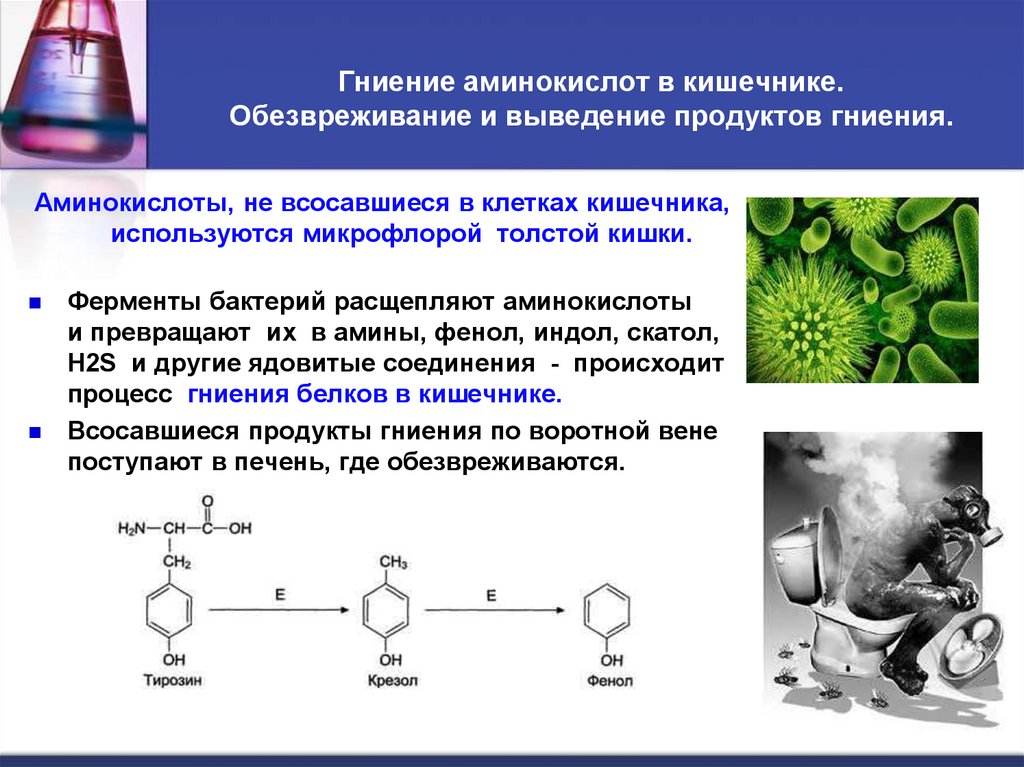
26. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения.
Аминокислоты, не всосавшиеся в клетках кишечника,используются микрофлорой толстой кишки.
Ферменты бактерий расщепляют аминокислоты
и превращают их в амины, фенол, индол, скатол,
Н2S и другие ядовитые соединения - происходит
процесс гниения белков в кишечнике.
Всосавшиеся продукты гниения по воротной вене
поступают в печень, где обезвреживаются.
27. Применение протеолитических ферментов и их ингибиторов.
При снижении секреторнойфункции ЖКТ назначаются
препараты ферментов.
Патология, обусловленная или
сопровождающаяся чрезмерной
активацией ферментных систем
(острый панкреатит ) требует
лечения ингибиторами трипсина.
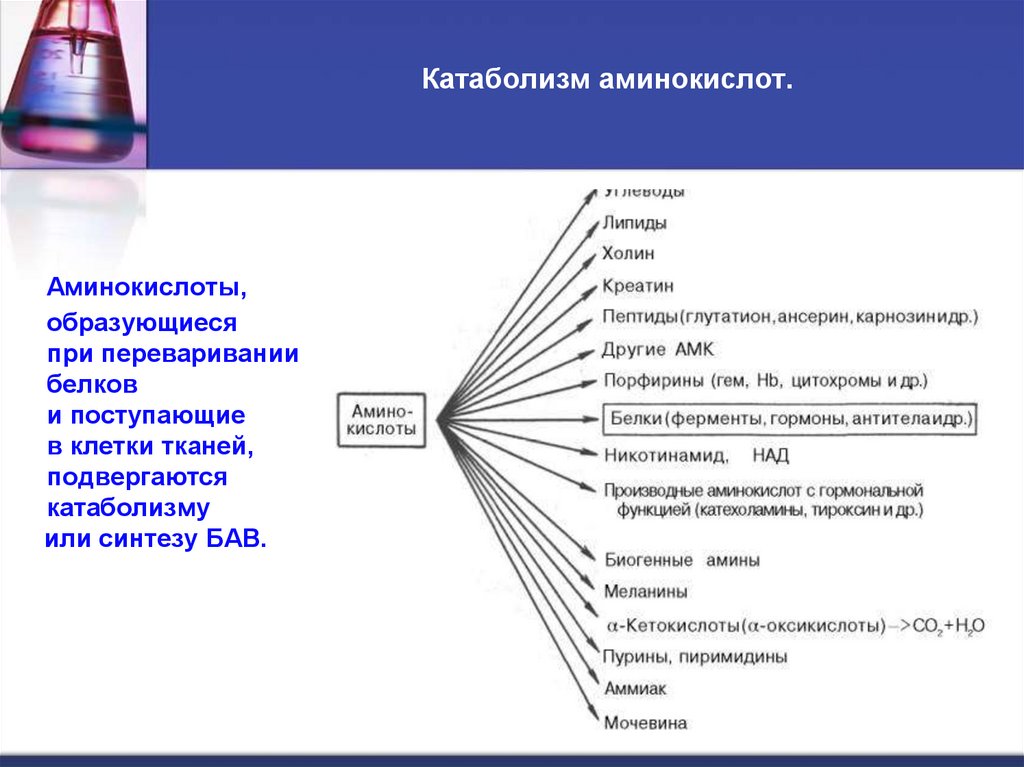
28. Катаболизм аминокислот.
Аминокислоты,образующиеся
при переваривании
белков
и поступающие
в клетки тканей,
подвергаются
катаболизму
или синтезу БАВ.
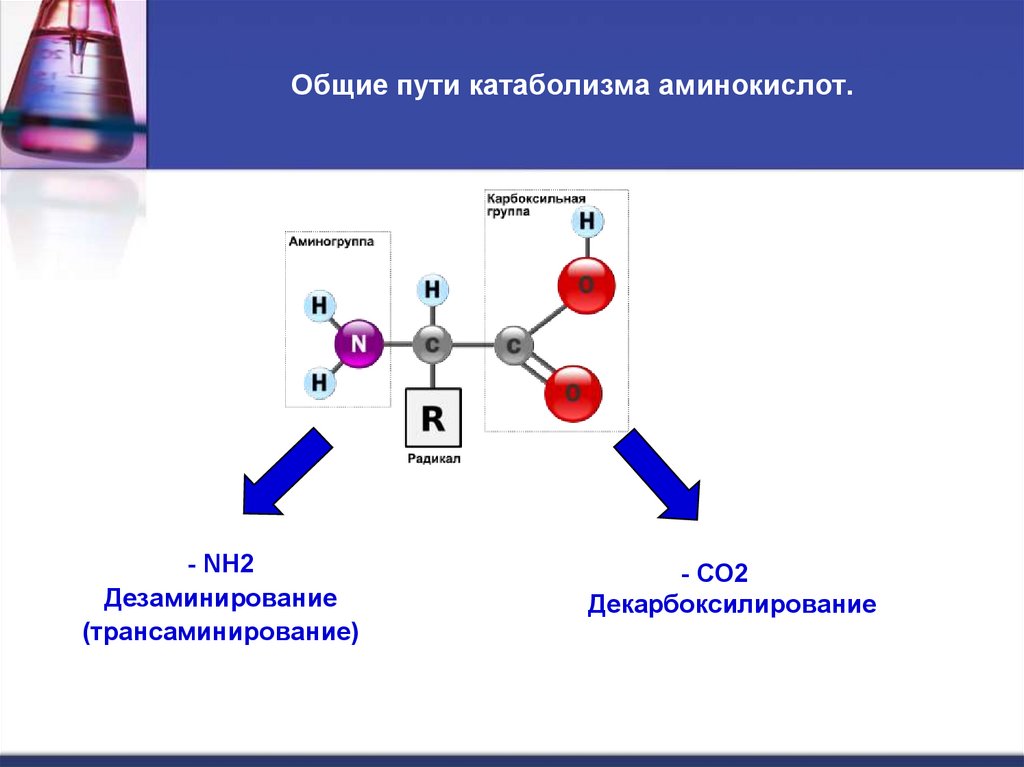
29. Общие пути катаболизма аминокислот.
- NH2Дезаминирование
(трансаминирование)
- СО2
Декарбоксилирование
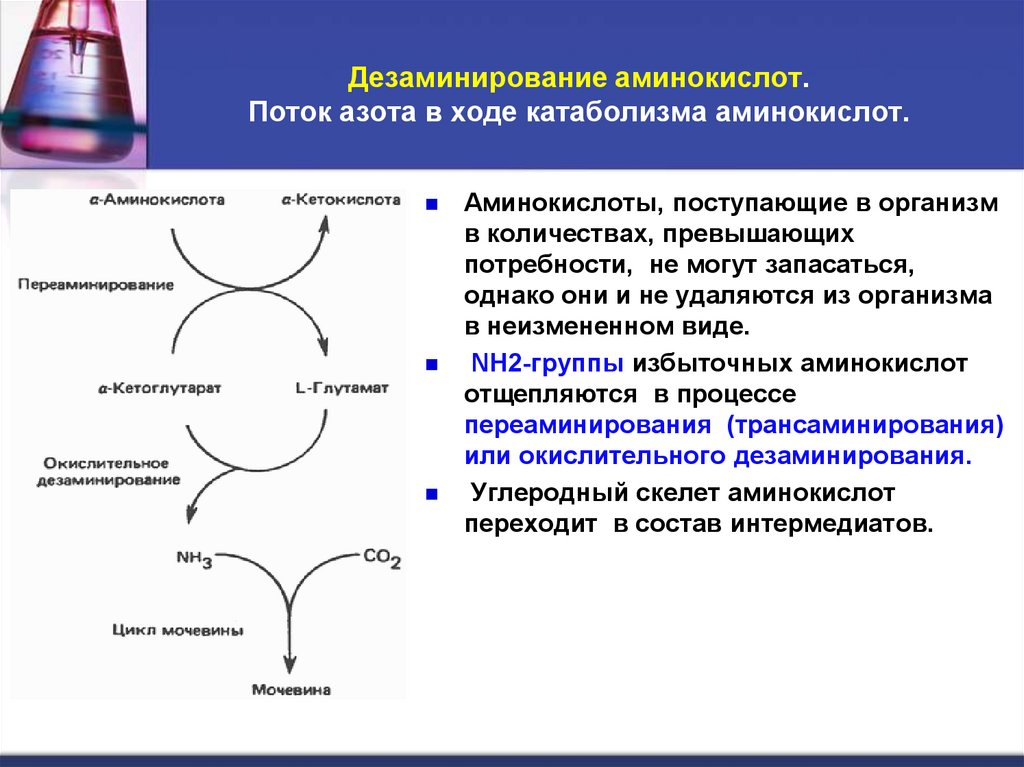
30. Дезаминирование аминокислот. Поток азота в ходе катаболизма аминокислот.
Аминокислоты, поступающие в организмв количествах, превышающих
потребности, не могут запасаться,
однако они и не удаляются из организма
в неизмененном виде.
NH2-группы избыточных аминокислот
отщепляются в процессе
переаминирования (трансаминирования)
или окислительного дезаминирования.
Углеродный скелет аминокислот
переходит в состав интермедиатов.
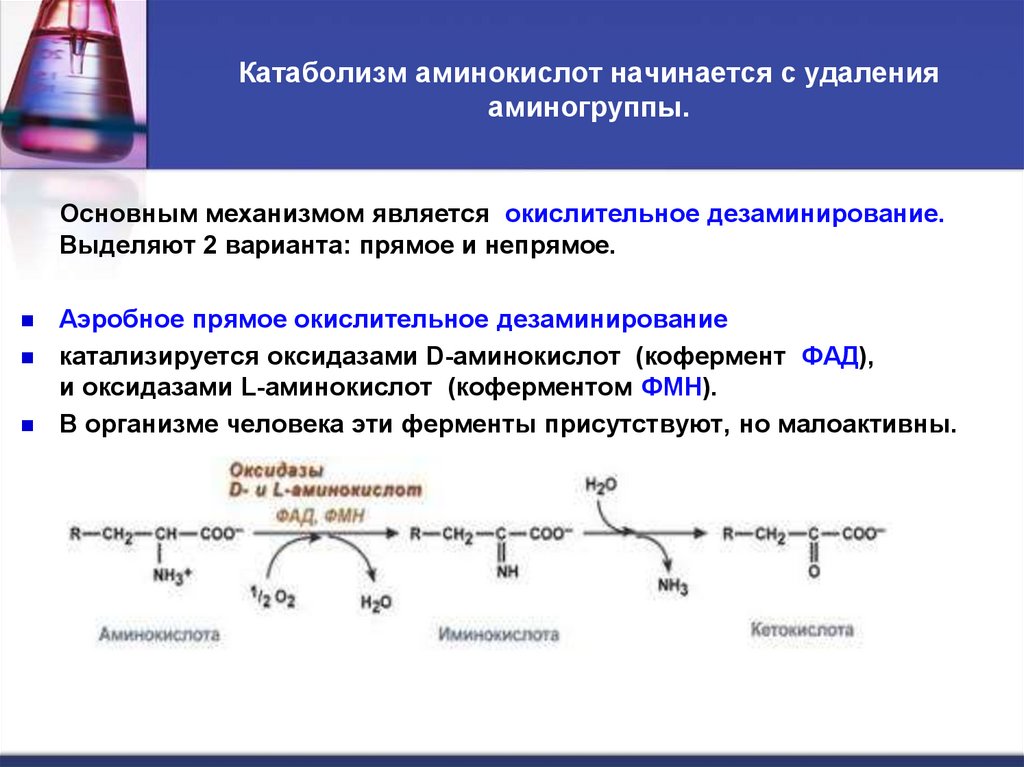
31. Катаболизм аминокислот начинается с удаления аминогруппы.
Основным механизмом является окислительное дезаминирование.Выделяют 2 варианта: прямое и непрямое.
Аэробное прямое окислительное дезаминирование
катализируется оксидазами D-аминокислот (кофермент ФАД),
и оксидазами L-аминокислот (коферментом ФМН).
В организме человека эти ферменты присутствуют, но малоактивны.
32. Анаэробное прямое окислительное дезаминирование
Анаэробное прямое окислительное дезаминированиевозможно только для ГЛУ,
катализируется глутаматдегидрогеназой.
Фермент имеется в митохондриях всех клеток (кроме мышц!)
Этот тип дезаминирования связан с трансаминированием.
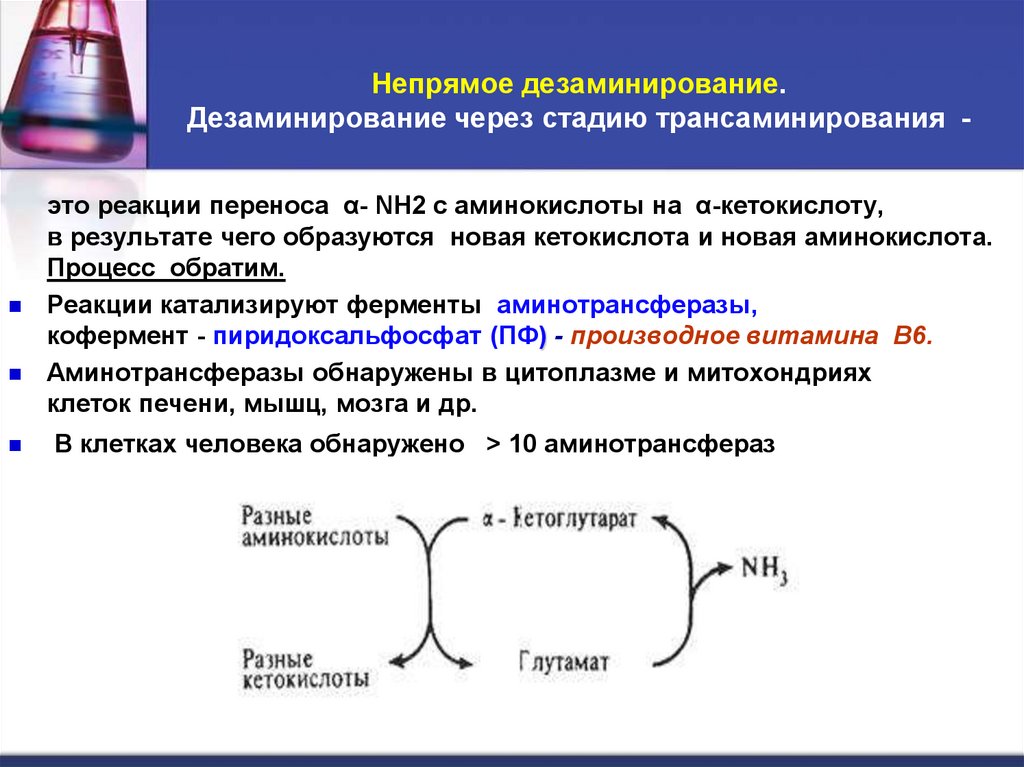
33. Непрямое дезаминирование. Дезаминирование через стадию трансаминирования -
это реакции переноса α- NH2 с аминокислоты на α-кетокислоту,в результате чего образуются новая кетокислота и новая аминокислота.
Процесс обратим.
Реакции катализируют ферменты аминотрансферазы,
кофермент - пиридоксальфосфат (ПФ) - производное витамина В6.
Аминотрансферазы обнаружены в цитоплазме и митохондриях
клеток печени, мышц, мозга и др.
В клетках человека обнаружено > 10 аминотрансфераз
34. Химизм процесса трансаминирования
Особенности и значение процесса:Процесс идет через образование промежуточных соединений
(шиффовых оснований) без высвобождения NH3.
1-я стадия непрямого окислительного дезаминирования.
Углеродный остаток аминокислот может включаться
в ЦТК (образование ЩУК, α-кетоглутарата).
Возможен синтез 10 заменимых аминокислот.
Общую теорию механизма трансаминирования
разработали советские биохимики во главе
с академиком А.Е. Браунштейном (1937).
35. В наиболее значимых реакциях трансаминирования участвуют аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ)
36. Клинико-диагностическое значение определения активности аминотрансфераз крови.
В крови определяют активность аланинаминотрансферазы (АлАТ, АЛТ),аспартатаминотрансферазы (АсАТ, АСТ)
- с целью диагностики заболеваний,
- с целью прогноза течения заболевания,
- с целью контроля за эффективностью лечения.
В норме активность ферментов в крови очень низкая!
АЛТ 0,1–0,68 мкмоль/мл/час
АСТ 0 - 0,45 мкмоль/мл/час
Коэффициент де Ритиса
АСТ/АЛТ = 1,33 (норма)
37. Локализация аминотрансфераз в клетке
Причины повышения активностиаминотрансфераз в крови:
↑ АЛТ свидетельствует о
нарушении проницаемости
клеточной мембраны
(активация ПОЛ, незначительные
повреждения клеток, воспаление).
Цитоплазма: АЛТ > АСТ
Митохондрии: АСТ > АЛТ
↑ АСТ свидетельствует о
нарушении целостности
клеточных органелл, цитолизе.
(гибель клеток, некроз тканей).
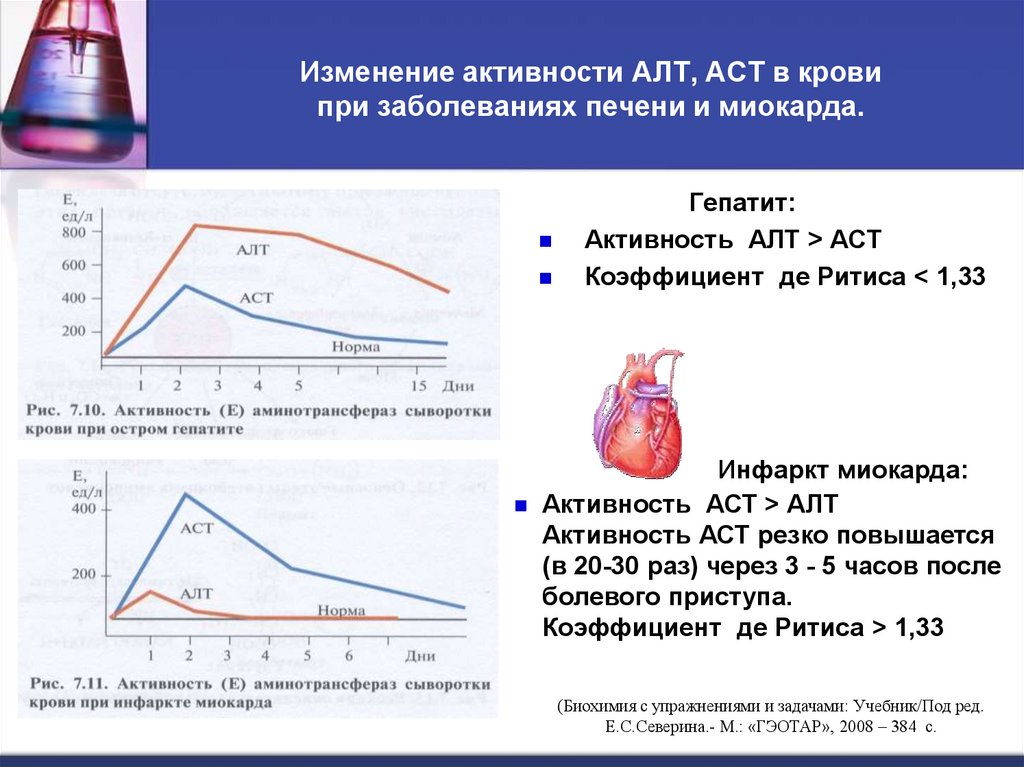
38. Изменение активности АЛТ, АСТ в крови при заболеваниях печени и миокарда.
Гепатит:Активность АЛТ > АСТ
Коэффициент де Ритиса < 1,33
Инфаркт миокарда:
Активность АСТ > АЛТ
Активность АСТ резко повышается
(в 20-30 раз) через 3 - 5 часов после
болевого приступа.
Коэффициент де Ритиса > 1,33
(Биохимия с упражнениями и задачами: Учебник/Под ред.
Е.С.Северина.- М.: «ГЭОТАР», 2008 – 384 с.
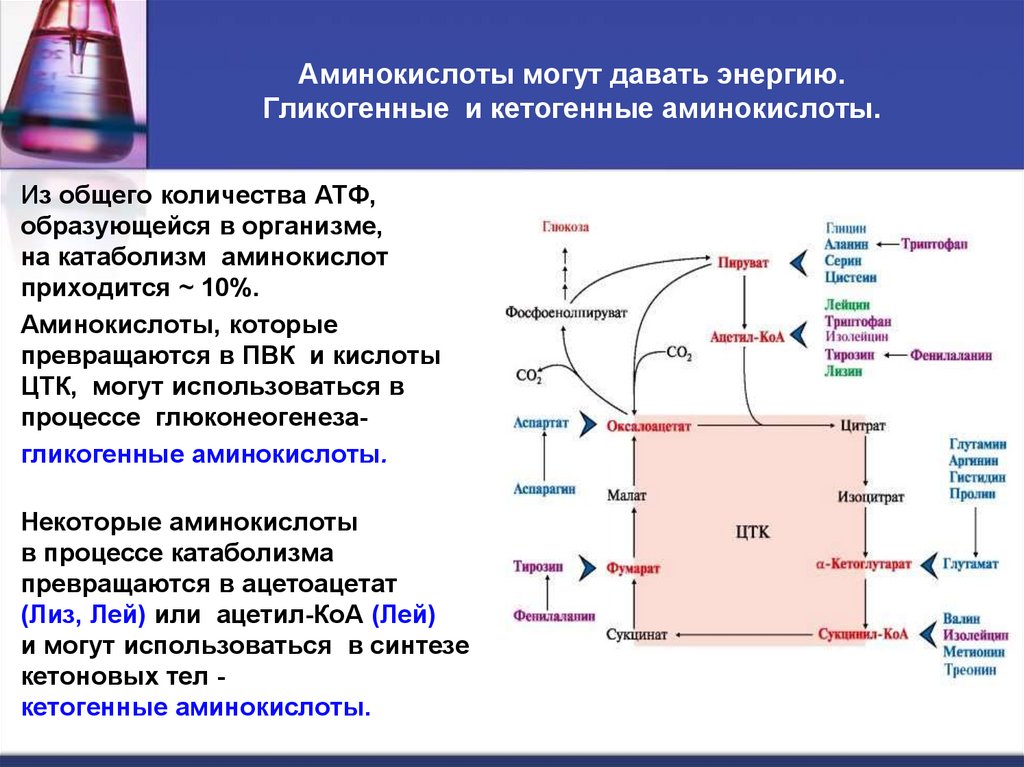
39. Аминокислоты могут давать энергию. Гликогенные и кетогенные аминокислоты.
Из общего количества АТФ,образующейся в организме,
на катаболизм аминокислот
приходится ~ 10%.
Аминокислоты, которые
превращаются в ПВК и кислоты
ЦТК, могут использоваться в
процессе глюконеогенезагликогенные аминокислоты.
Некоторые аминокислоты
в процессе катаболизма
превращаются в ацетоацетат
(Лиз, Лей) или ацетил-КоА (Лей)
и могут использоваться в синтезе
кетоновых тел кетогенные аминокислоты.
40. Глюкозо - аланиновый цикл
Ведущее место в глюконеогенезе принадлежит аланину,который превращается в пируват путём трансаминирования.
При голодании и физической работе в организме функционирует
глюкозо – аланиновый цикл (подобен циклу Кори для лактата).
Работа цикла препятствует отравлению организма, так как в мышцах
нет ферментов, утилизирующих аммиак.
При тренировке мощность цикла значительно возрастает.
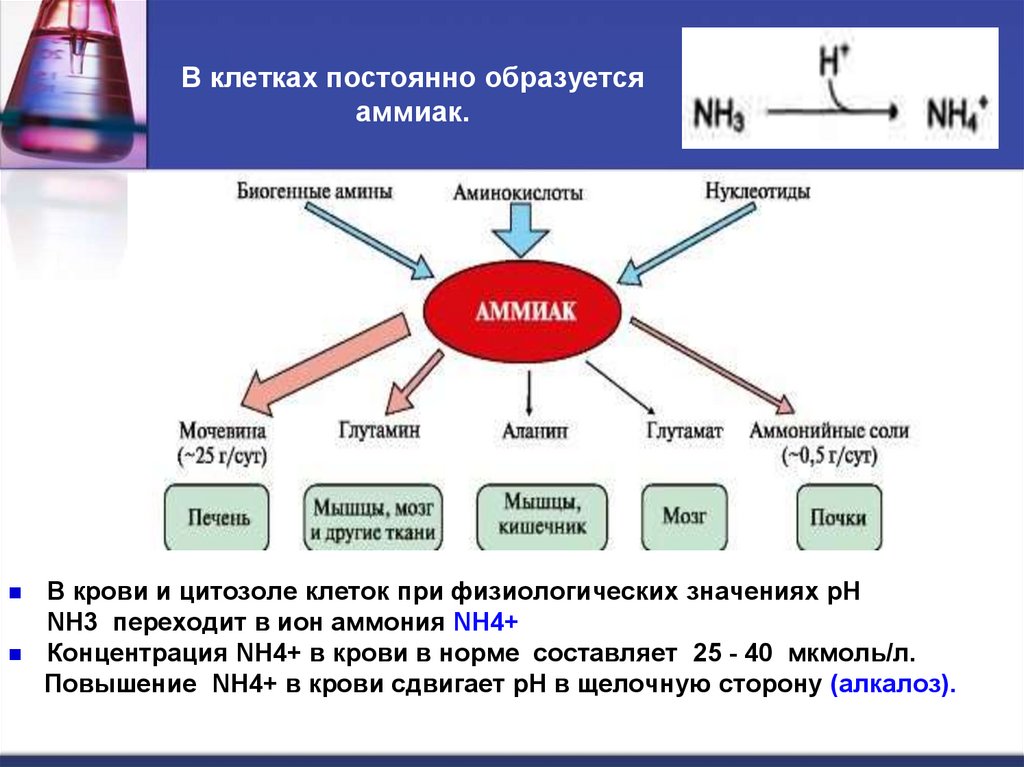
41. В клетках постоянно образуется аммиак.
В крови и цитозоле клеток при физиологических значениях рНNH3 переходит в ион аммония NH4+
Концентрация NH4+ в крови в норме составляет 25 - 40 мкмоль/л.
Повышение NH4+ в крови сдвигает рН в щелочную сторону (алкалоз).
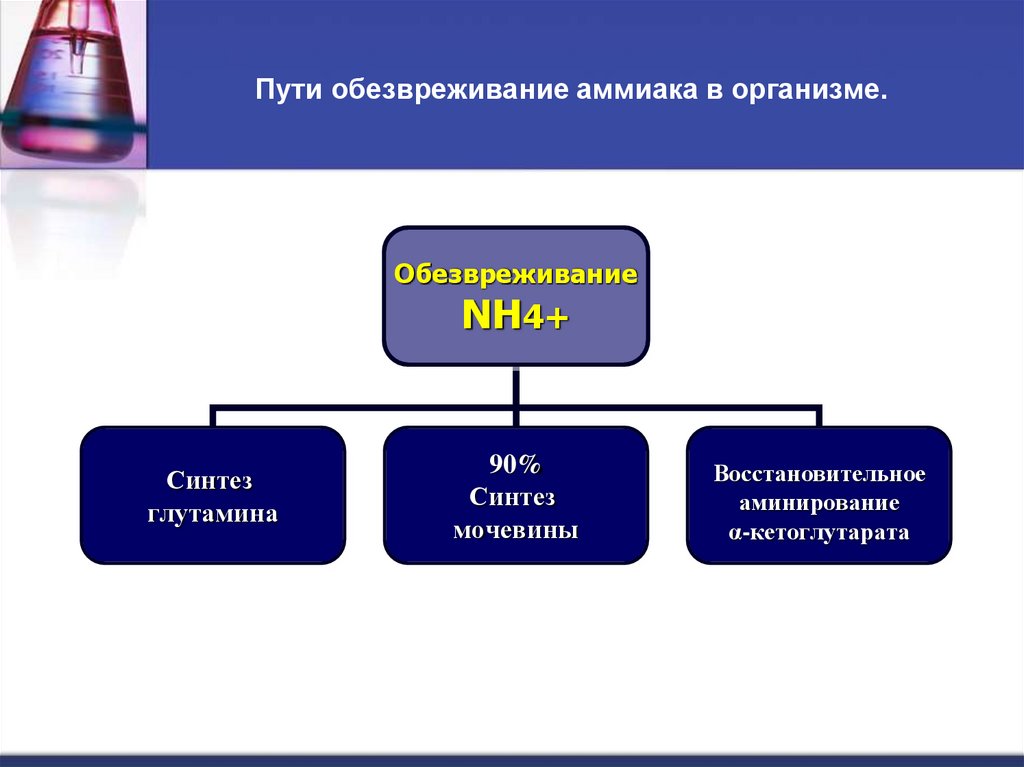
42. Пути обезвреживание аммиака в организме.
ОбезвреживаниеNH4+
Синтез
глутамина
90%
Синтез
мочевины
Восстановительное
аминирование
α-кетоглутарата
43. Токсичность аммиака.
При алкалозе увеличивается сродство гемоглобинак О2, что приводит к гипоксии тканей и развитию
гипоэнергетических состояний.
Связывание аммиака при синтезе глутамата вызывает
отток α-кетоглутарата из ЦТК, при этом понижается
образование АТФ (гипоэнергетическое состояние).
Накопление NH4+ в цитозоле влияет на мембранный
потенциал и работу внутриклеточных ферментов
(конкурирует с ионными насосами для Na+ и K+).
Продукт связывания NH4+ с ГЛУ ( глутамин) —
является осмотически активным веществом, что
приводит к задержке воды в клетках и вызывает отёки.
В ЦНС может вызвать отёк мозга, кому, смерть.
44. Восстановительное аминирование α-кетоглутарата с образованием глутаминовой кислоты..
Восстановительное аминирование α-кетоглутаратас образованием глутаминовой кислоты..
Процесс возможен в мозге под действием глутаматдегидрогеназы.
Однако этот путь обезвреживания NH4+ протекает с незначительной
скоростью.
45. Синтез глутамина - одним из важных способов утилизации аммиака в нервной и мышечной тканях, почках, печени.
Глутаминсинтетаза локализована в митохондриях клеток.Образование большого количества Глу(н) обеспечивает высокие
концентрации его в крови (0,5 - 0,7 ммоль/л).
Глу(н) проникает через клеточные мембраны путем облегченной
диффузии, легко попадает в клетки, где есть потребность в NH2-группах.
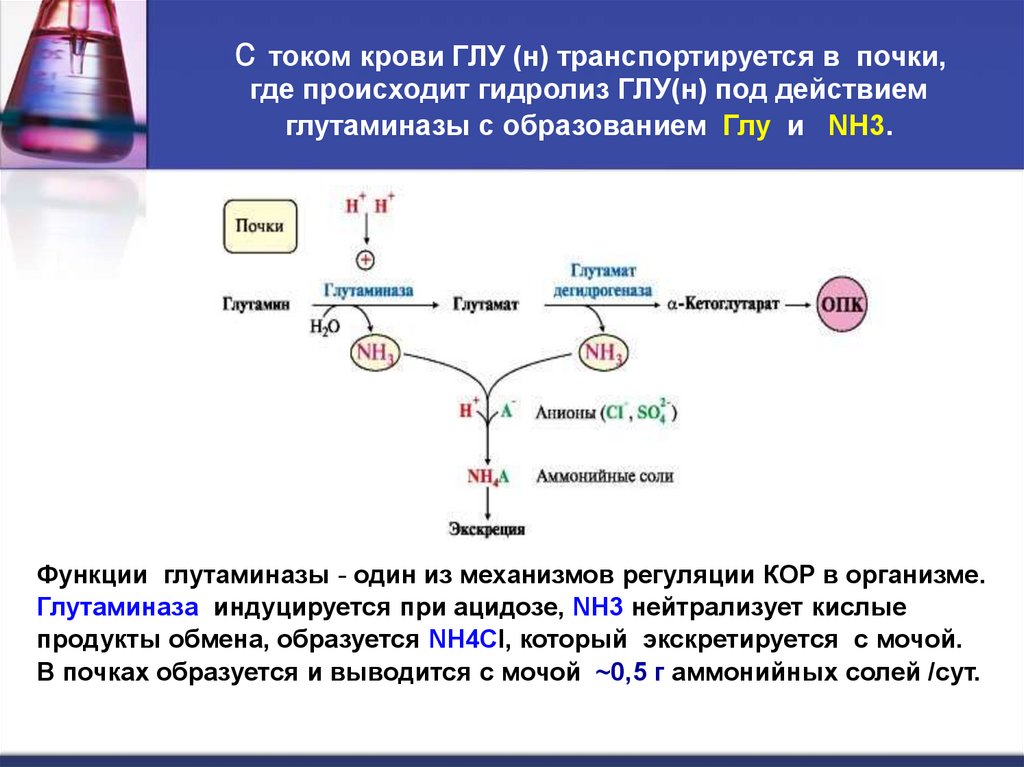
46.
С током крови ГЛУ (н) транспортируется в почки,где происходит гидролиз ГЛУ(н) под действием
глутаминазы с образованием Глу и NH3.
Функции глутаминазы - один из механизмов регуляции КОР в организме.
Глутаминаза индуцируется при ацидозе, NH3 нейтрализует кислые
продукты обмена, образуется NH4Cl, который экскретируется с мочой.
В почках образуется и выводится c мочой ~0,5 г аммонийных солей /сут.
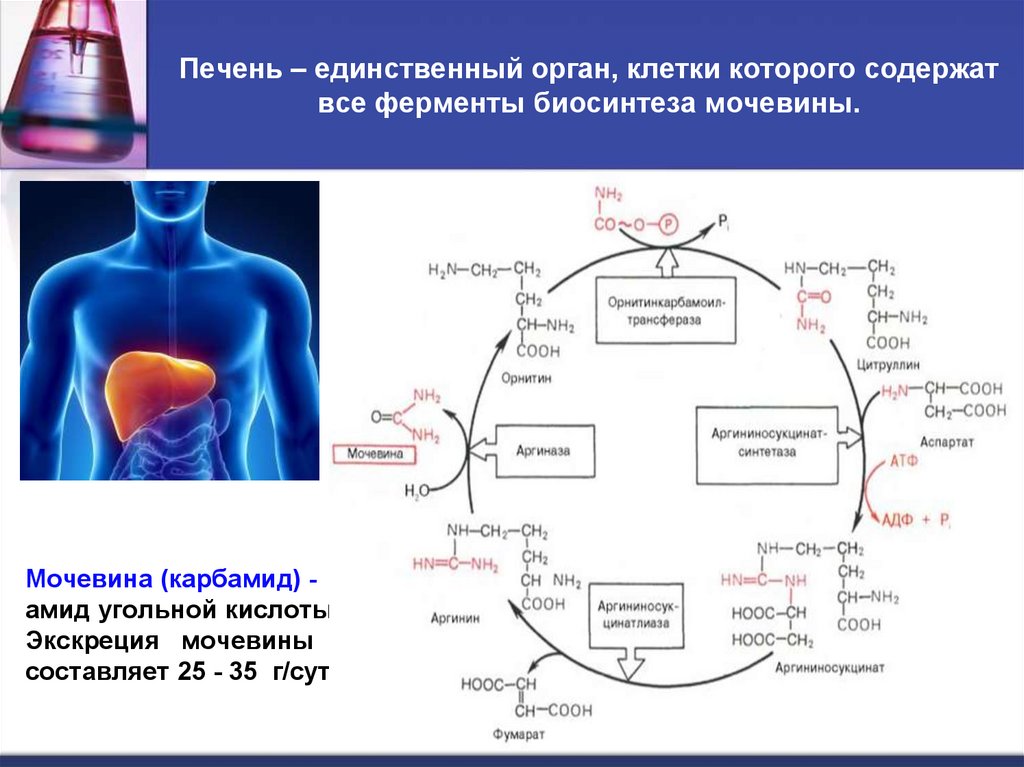
47. Печень – единственный орган, клетки которого содержат все ферменты биосинтеза мочевины.
Мочевина синтезируется только в печени(установлено в опытах И. П. Павлова).
В 40-х годах XX века Г. Кребс и К. Гензелейт
установили, что синтез мочевины
представляет собой циклический процесс,
состоящий из нескольких стадий,
ключевым соединением которого является
орнитин, поэтому процесс получил
название орнитиновый цикл.
Мочевина (карбамид) амид угольной кислоты.
Экскреция мочевины
составляет 25 - 35 г/сут
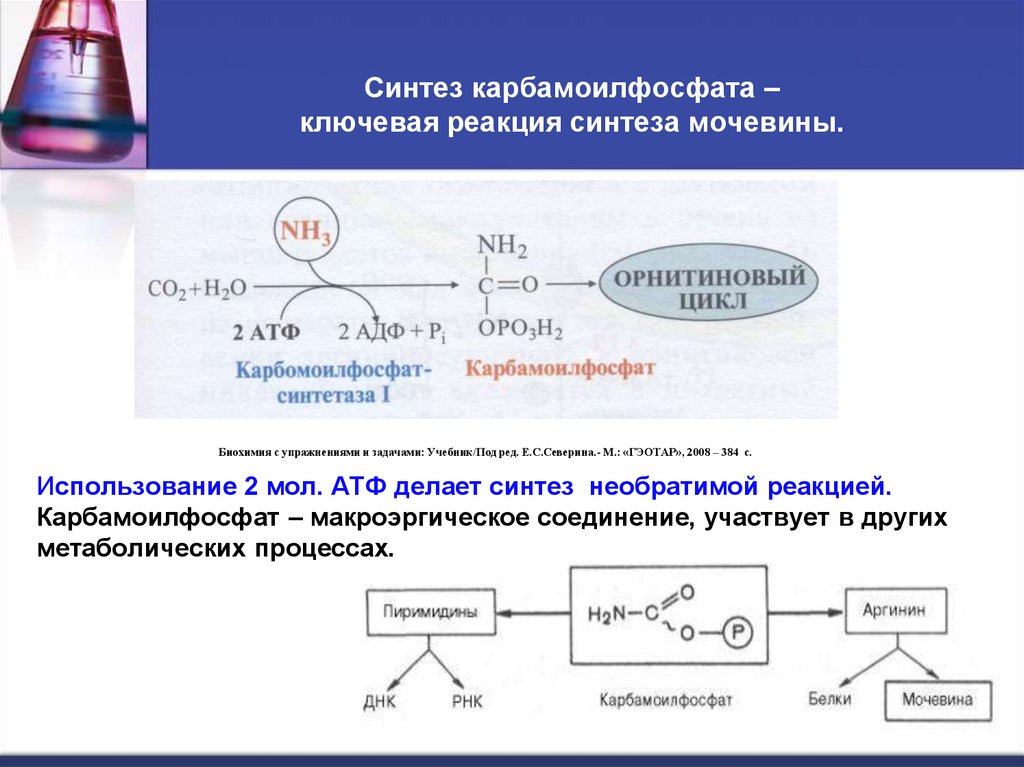
48. Синтез карбамоилфосфата – ключевая реакция синтеза мочевины.
Биохимия с упражнениями и задачами: Учебник/Под ред. Е.С.Северина.- М.: «ГЭОТАР», 2008 – 384 с.Использование 2 мол. АТФ делает синтез необратимой реакцией.
Карбамоилфосфат – макроэргическое соединение, участвует в других
метаболических процессах.
49. Цитруллин – аминокислота, которая не кодируется генетически
Под действием орнитинкарбамоилтрансферазы карбамоильная группапереносится на орнитин, образуется цитруллин.
Первые реакции процесса происходят в митохондриях гепатоцитов.
Цитруллин транспортируется в цитозоль, где и осуществляются
дальнейшие превращения.
50. Аспартат – источник NH2–группы.
Аргининосукцинатсинтетаза связывает цитруллин с аспартатоми образует аргининосукцинат (аргининоянтарная кислота).
Затрачивается 1 АТФ, но используется энергия 2 макроэргических связей
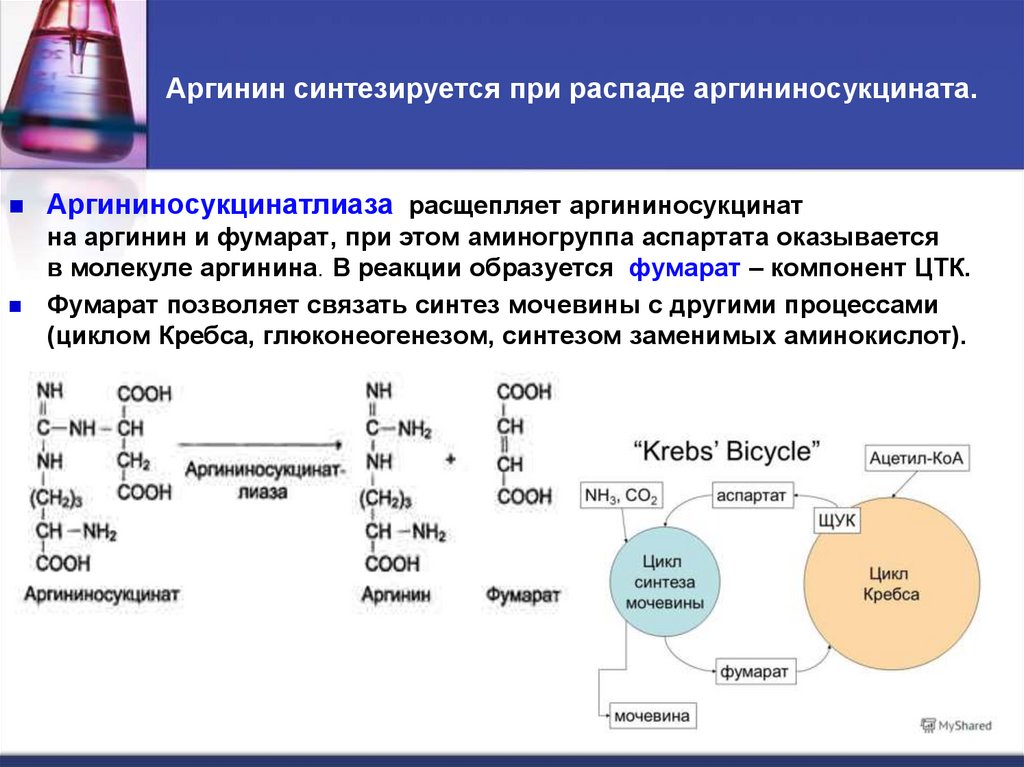
51. Аргинин синтезируется при распаде аргининосукцината.
Аргининосукцинатлиаза расщепляет аргининосукцинатна аргинин и фумарат, при этом аминогруппа аспартата оказывается
в молекуле аргинина. В реакции образуется фумарат – компонент ЦТК.
Фумарат позволяет связать синтез мочевины с другими процессами
(циклом Кребса, глюконеогенезом, синтезом заменимых аминокислот).
52. Орнитин – аминокислота, которая не кодируется генетически.
Аргинин подвергается гидролизу под действием аргиназы,образуются орнитин и мочевина.
Орнитин взаимодействует с новой молекулой карбамоилфосфата
и цикл повторяется.
Орнитиновый цикл выполняет 2 функции:
1. превращает азот белка в мочевину, что предотвращает накопление NH4+.
2. синтез АРГ и пополнение его фонда в организме.
53. Синтез мочевины – регулируемый процесс.
Быстрая регуляция осуществляется на уровне аллостерическойактивности карбомоилфосфатсинтетазы.
2. Долговременная регуляция обусловлена индукцией синтеза ферментов.
1.
Эффективность работы орнитинового цикла при нормальном питании
и умеренных физических нагрузках составляет 60% его мощности.
-
Увеличение скорости синтеза мочевины происходит при
длительной физической работе,
голодании,
патологиях с распадом белков тканей,
избыточном белковом питании.
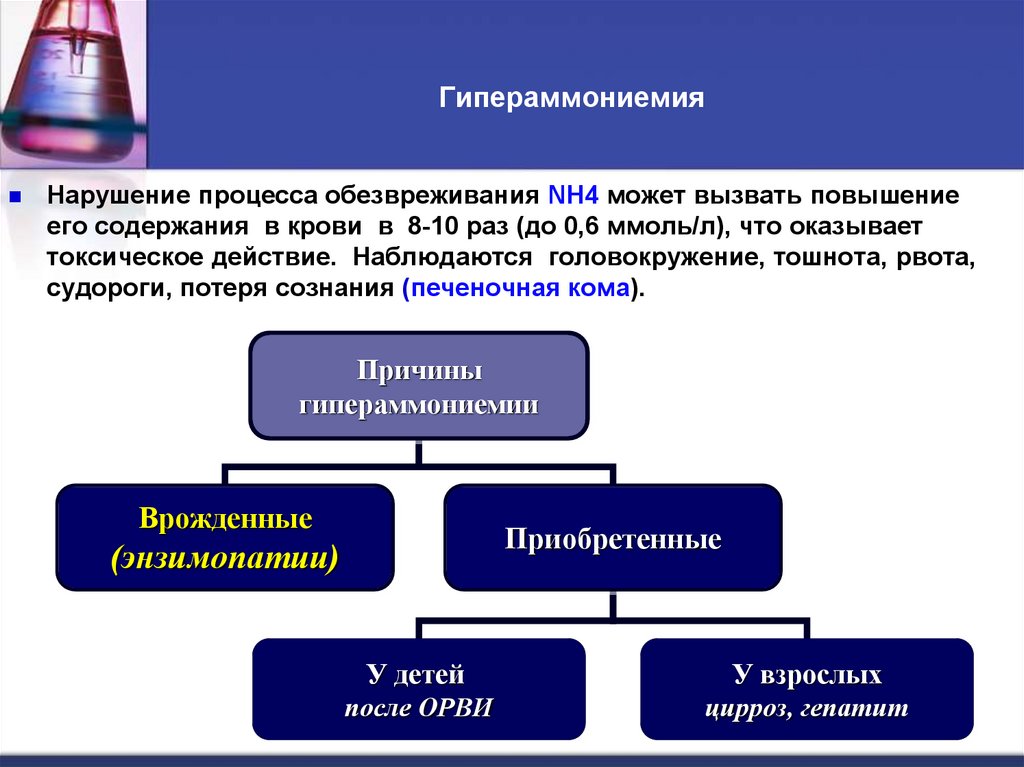
54. Гипераммониемия
Нарушение процесса обезвреживания NH4 может вызвать повышениеего содержания в крови в 8-10 раз (до 0,6 ммоль/л), что оказывает
токсическое действие. Наблюдаются головокружение, тошнота, рвота,
судороги, потеря сознания (печеночная кома).
Причины
гипераммониемии
Врожденные
Приобретенные
(энзимопатии)
У детей
У взрослых
после ОРВИ
цирроз, гепатит
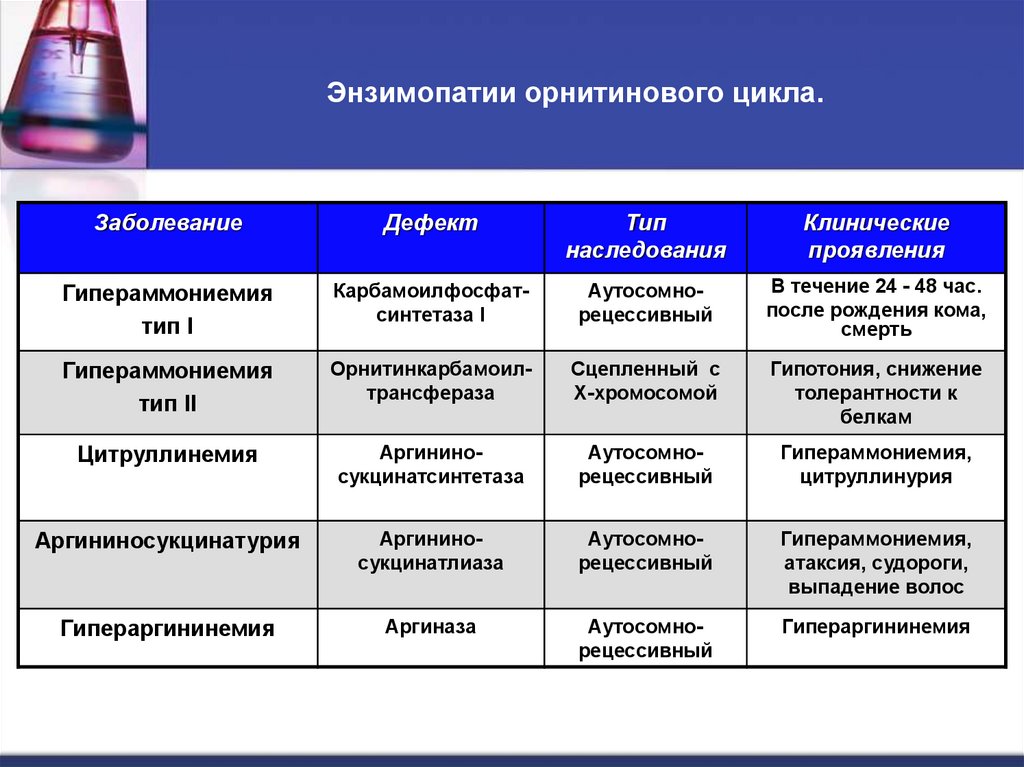
55. Энзимопатии орнитинового цикла.
ЗаболеваниеДефект
Тип
наследования
Клинические
проявления
Гипераммониемия
тип I
Карбамоилфосфатсинтетаза I
Аутосомнорецессивный
В течение 24 - 48 час.
после рождения кома,
смерть
Гипераммониемия
тип II
Орнитинкарбамоилтрансфераза
Сцепленный с
Х-хромосомой
Гипотония, снижение
толерантности к
белкам
Цитруллинемия
Аргининосукцинатсинтетаза
Аутосомнорецессивный
Гипераммониемия,
цитруллинурия
Аргининосукцинатурия
Аргининосукцинатлиаза
Аутосомнорецессивный
Гипераммониемия,
атаксия, судороги,
выпадение волос
Гипераргининемия
Аргиназа
Аутосомнорецессивный
Гипераргининемия
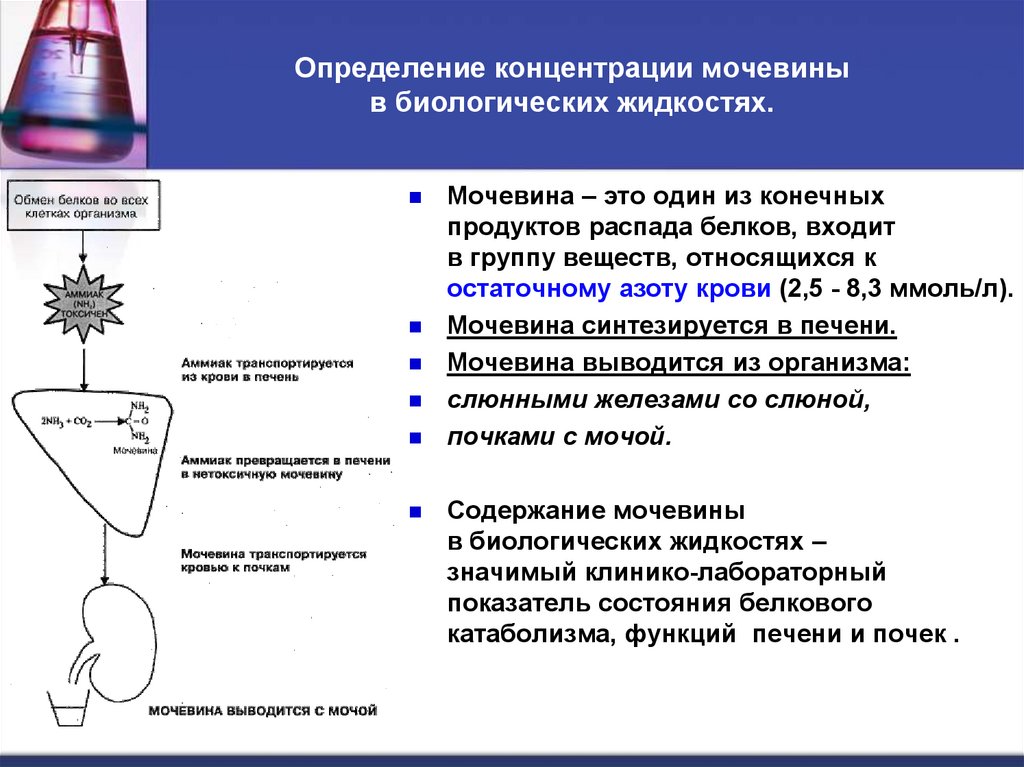
56. Определение концентрации мочевины в биологических жидкостях.
Определение концентрации мочевиныв биологических жидкостях.
Мочевина – это один из конечных
продуктов распада белков, входит
в группу веществ, относящихся к
остаточному азоту крови (2,5 - 8,3 ммоль/л).
Мочевина синтезируется в печени.
Мочевина выводится из организма:
слюнными железами со слюной,
почками с мочой.
Содержание мочевины
в биологических жидкостях –
значимый клинико-лабораторный
показатель состояния белкового
катаболизма, функций печени и почек .
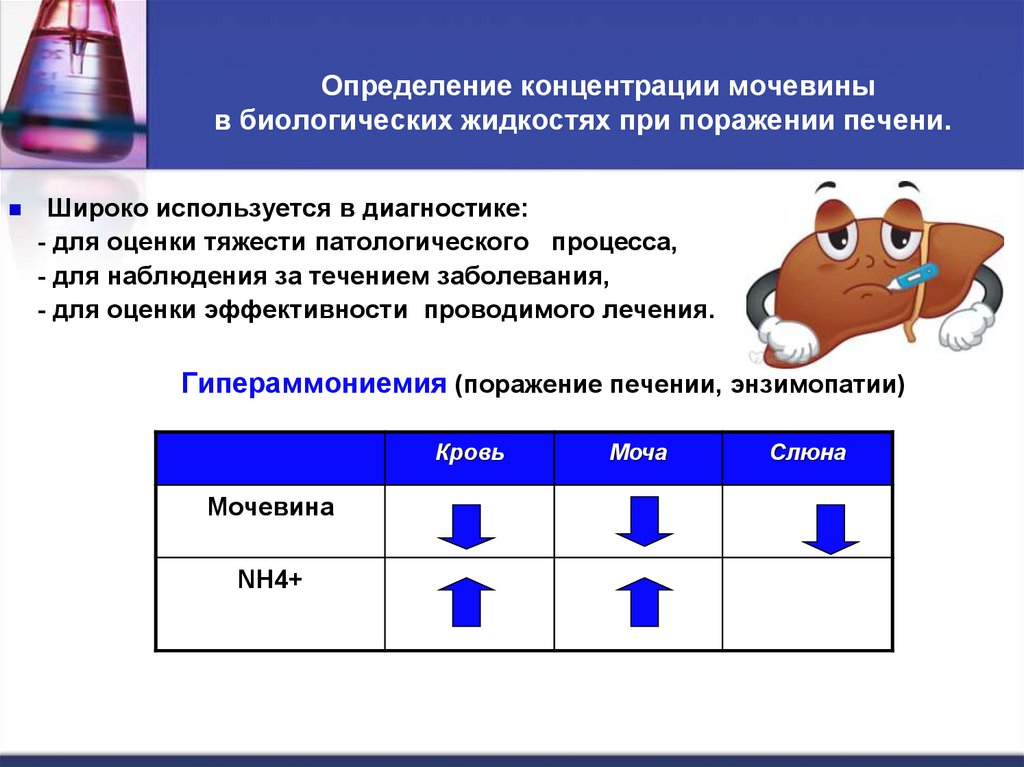
57. Определение концентрации мочевины в биологических жидкостях при поражении печени.
Определение концентрации мочевиныв биологических жидкостях при поражении печени.
Широко используется в диагностике:
- для оценки тяжести патологического процесса,
- для наблюдения за течением заболевания,
- для оценки эффективности проводимого лечения.
Гипераммониемия (поражение печении, энзимопатии)
Кровь
Мочевина
NH4+
Моча
Слюна
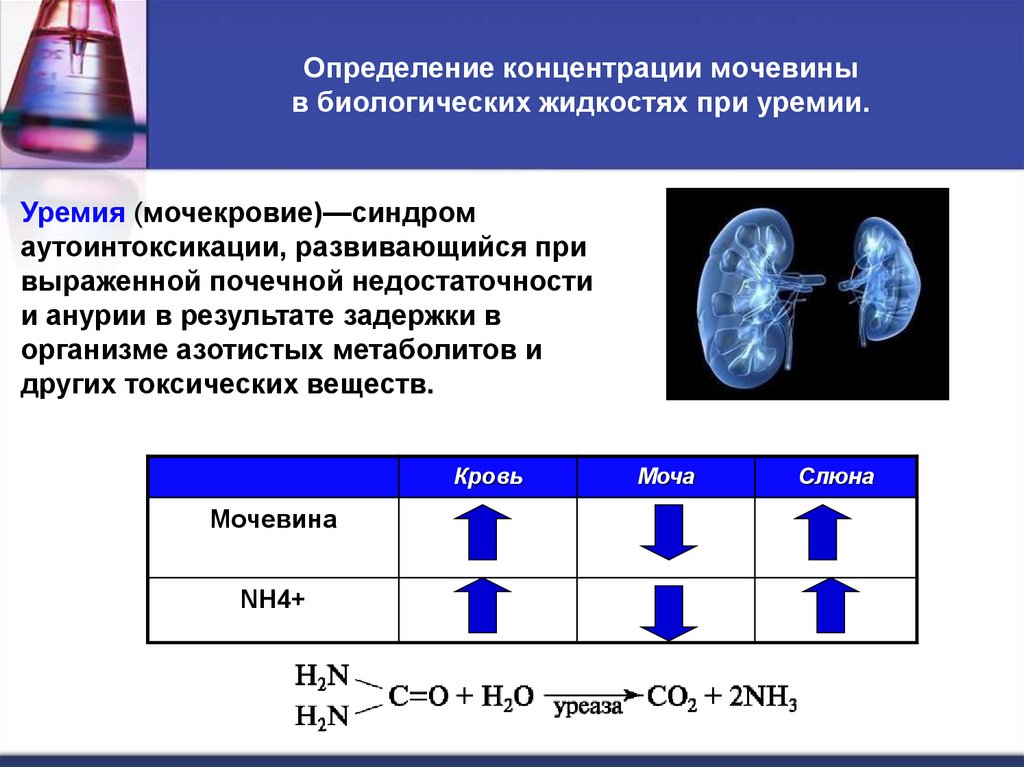
58. Определение концентрации мочевины в биологических жидкостях при уремии.
Определение концентрации мочевиныв биологических жидкостях при уремии.
Уремия (мочекровие)—синдром
аутоинтоксикации, развивающийся при
выраженной почечной недостаточности
и анурии в результате задержки в
организме азотистых метаболитов и
других токсических веществ.
Кровь
Мочевина
NH4+
Моча
Слюна
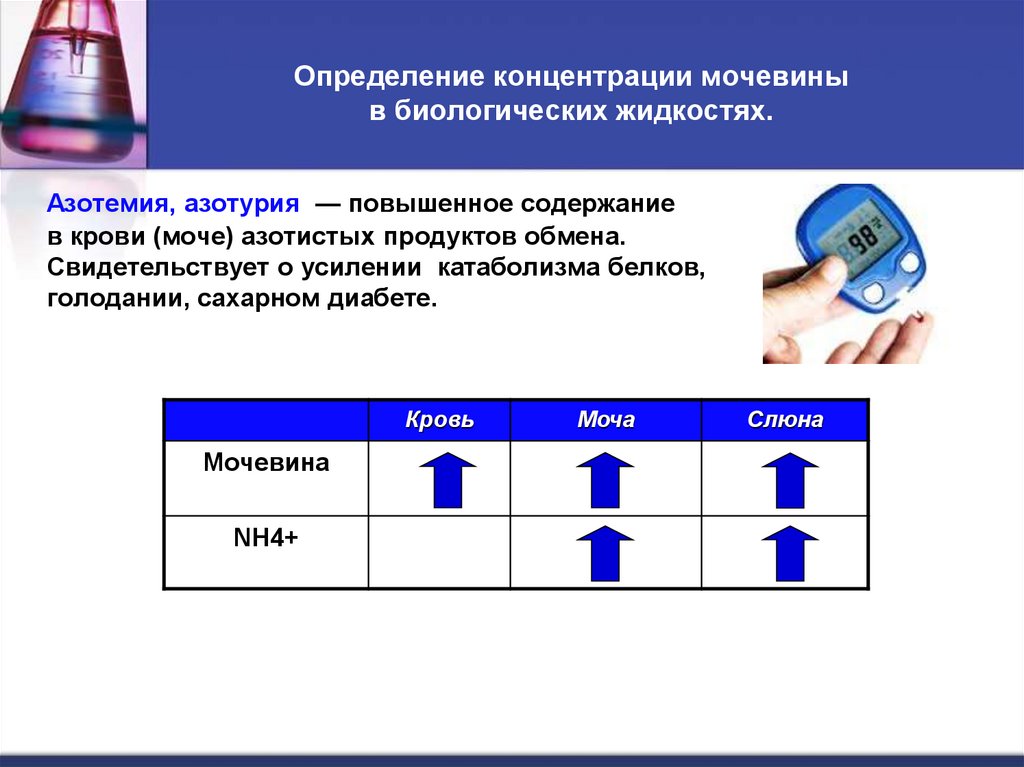
59. Определение концентрации мочевины в биологических жидкостях.
Определение концентрации мочевиныв биологических жидкостях.
Азотемия, азотурия — повышенное содержание
в крови (моче) азотистых продуктов обмена.
Свидетельствует о усилении катаболизма белков,
голодании, сахарном диабете.
Кровь
Мочевина
NH4+
Моча
Слюна


























 Биология
Биология








