Похожие презентации:
Кислоты
1. Кислоты
2. Определение
Кислоты – это сложные вещества, всостав которых входят атомы
водорода и кислотный остаток.
Общая формула:
Нn(КО)m
3.
КОН, CuО, НН22СО
СО33, Nа3РО4 , SО2
Дать определение кислотам.
1.В данном ряду найдите формулу кислоты.
Поясните.
2.Как называется вторая часть формулы?
3
4.
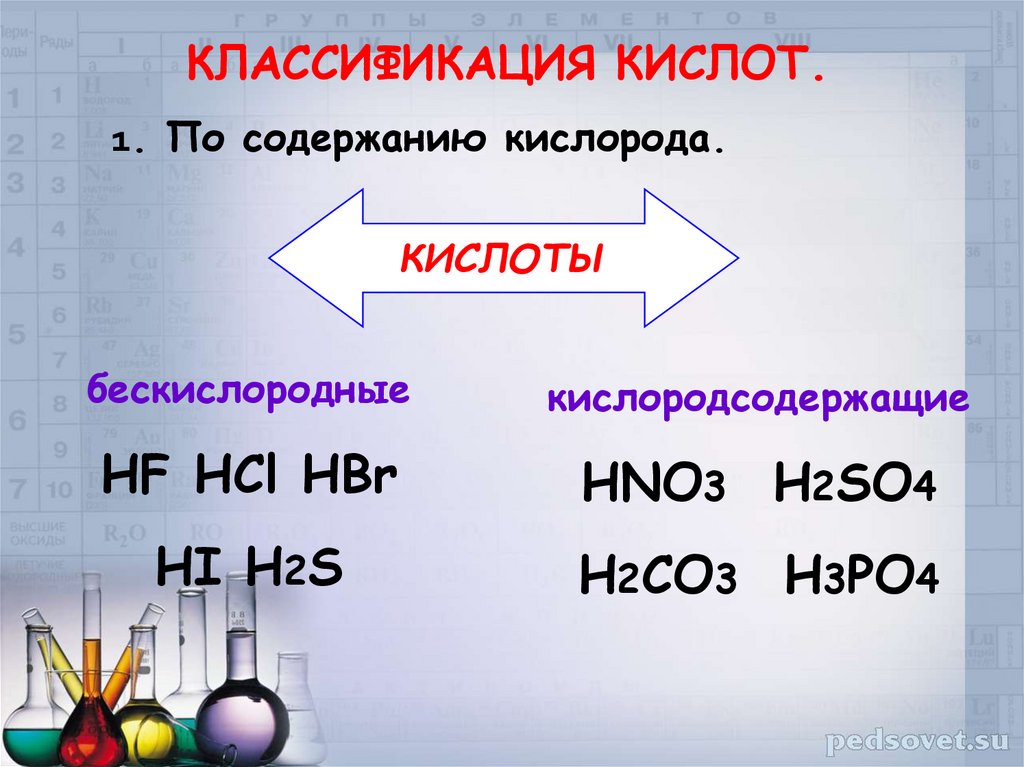
КЛАССИФИКАЦИЯ КИСЛОТ.1. По содержанию кислорода.
КИСЛОТЫ
бескислородные
кислородсодержащие
HF HCl HBr
HNO3 H2SO4
HI H2S
H2CO3 H3PO4
5.
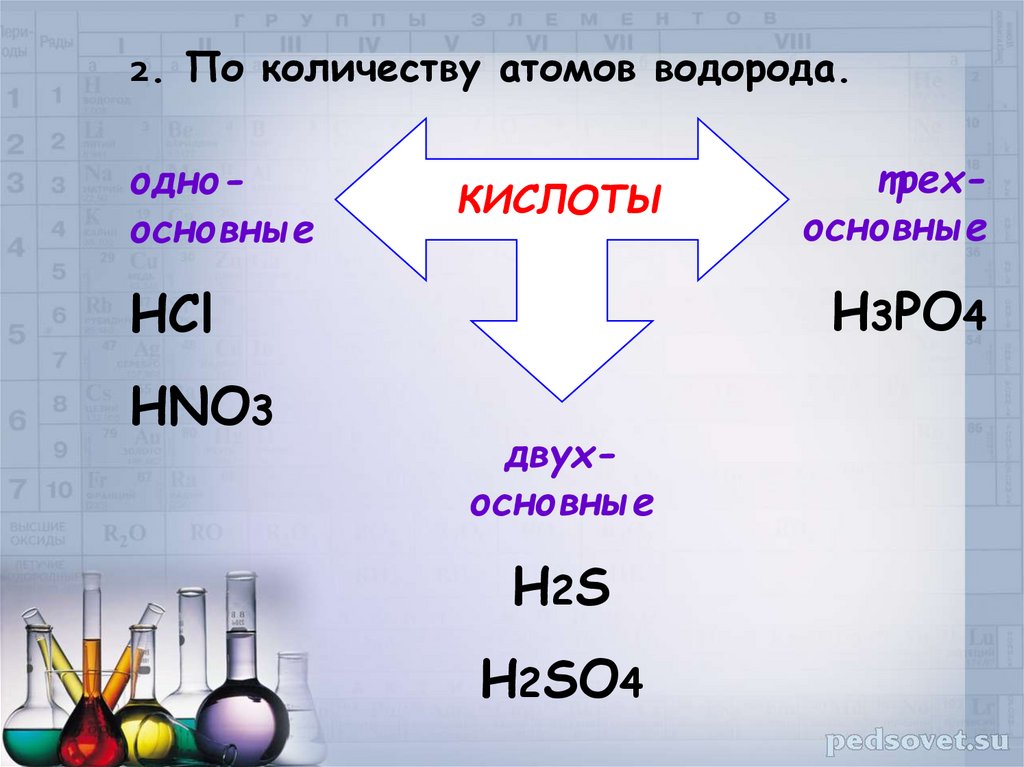
2. По количеству атомов водорода.одноосновные
КИСЛОТЫ
H3PO4
HCl
HNO3
трехосновные
двухосновные
H2S
H2SO4
6. Порядок названий кислот:
1. Каждой кислоте соответствует свой кислотныйоксид.
2. При этом валентность центрального атома в
оксиде и в кислоте совпадают.
Например в оксиде серы:
IV II
SO2
V II
I IV II
в соответствующей кислоте
Н2SO3
I V II
Р2О5 в соответствующей кислоте Н3РО4
Валентность кислотного остатка
определяется по количеству атомов
водорода в кислоте!
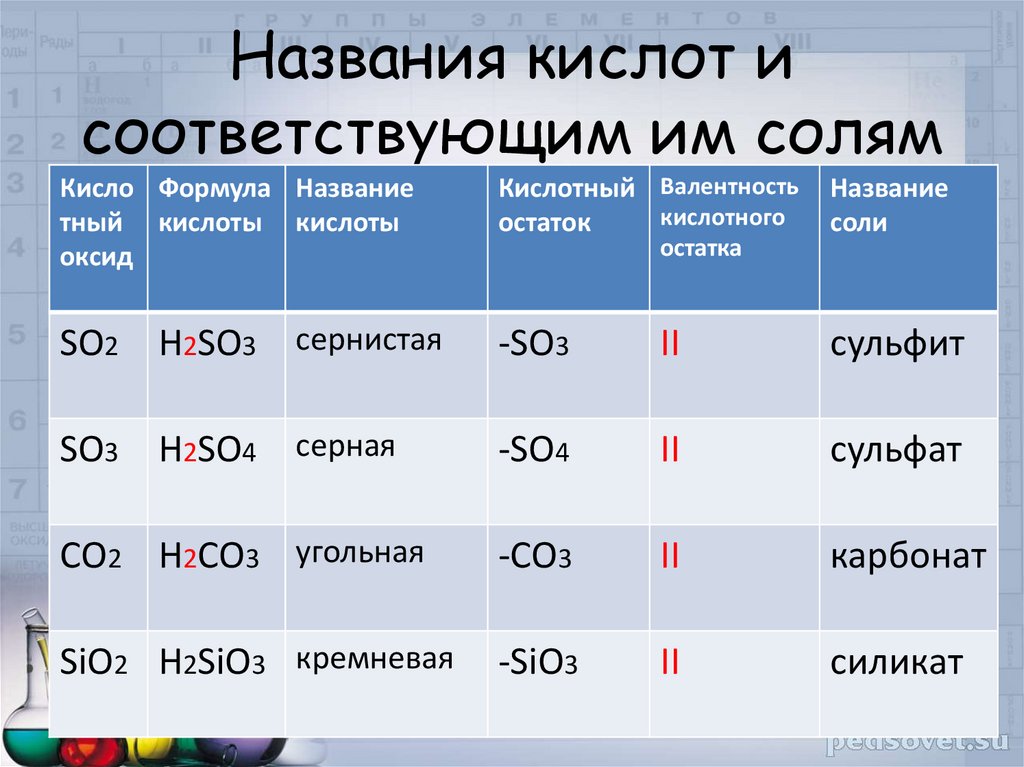
7. Названия кислот и соответствующим им солям
Кисло Формула Названиетный кислоты кислоты
оксид
Кислотный Валентность
кислотного
остаток
Название
соли
SO2 H2SO3 сернистая
-SO3
II
сульфит
SO3 H2SO4 серная
-SO4
II
сульфат
СО2 H2СO3 угольная
-СO3
II
карбонат
SiO2 H2SiO3 кремневая
-SiO3
II
силикат
остатка
8. Названия кислот и соответствующим им солям
Кислотноксид
Формула
кислоты
Название кислоты
Р2О5
N2O5
-
Н3РО4 фосфорная
HNO3 азотная
HCl
соляная
сероводородная
H2S
Кислотный Валентность
остаток
кислотного
остатка
Название
соли
-РО4
-NO3
-Cl
-S
фосфат
нитрат
хлорид
сульфид
III
I
I
II
9. Физические свойства кислот
• При обычных условиях кислоты могутбыть твердыми и жидкими.
• Кислоты –едкие жидкости (кроме
кремневой), с кислым вкусом, без запаха,
разъедают многие вещества.
• Слабые кислоты угольная и сернистая
при обычных условиях тут же
разлагаются на кислотный оксид и воду:
Н2SO3 = SO2 ↑ + H2O
H2CO3 = CO2 ↑+ H2O
10. Получение:
Бескислородные кислоты получают:- Взаимодействием неметалла с
водородом:
Н2 + Сl2 = 2HCl
- Действием на соль более сильной,
или менее летучей кислотой:
FeS + 2HCl = FeCl2 + H2S↑
Полученные газообразные
вещества растворяют в воде.
11. Получение:
Кислородсодержащие кислоты можнополучить:
- Взаимодействием кислотных оксидов
с водой (кроме оксида кремния (IV)):
Р2О5 + 3Н2О = 2Н3РО4
- Действием на соль более сильной
кислотой:
Na2SiO3 +2HCl =2NaCl + H2SiO3↓
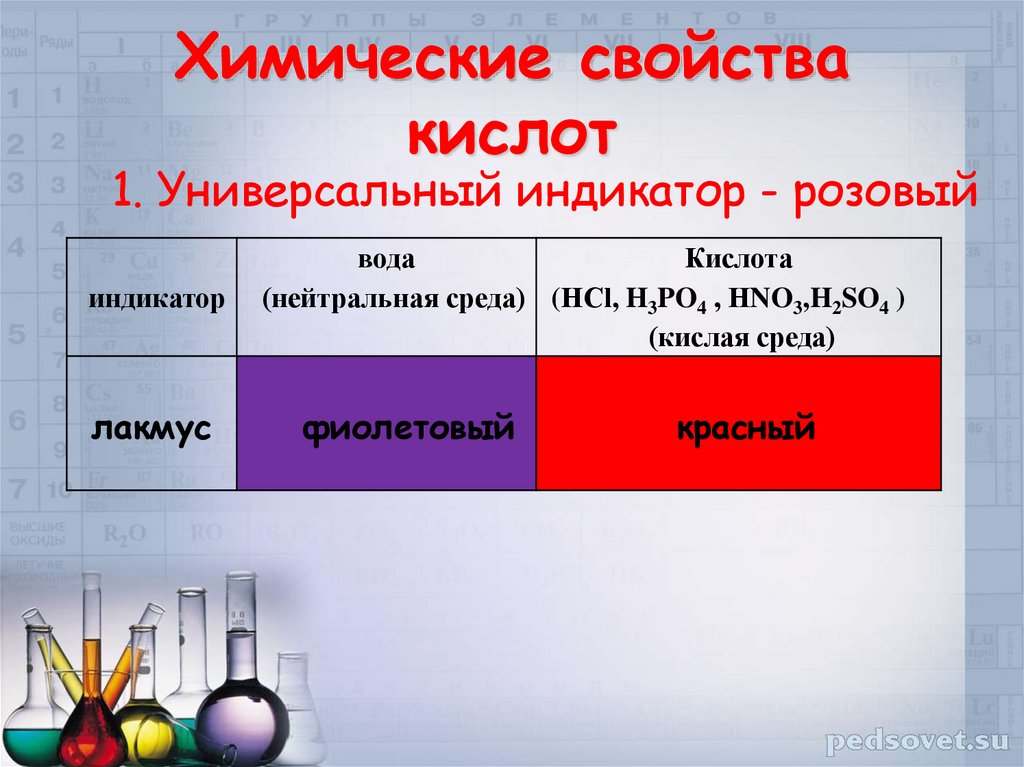
12. Химические свойства кислот
1. Универсальный индикатор - розовыйиндикатор
лакмус
вода
Кислота
(нейтральная среда) (НСl, H3PO4 , НNO3,H2SO4 )
(кислая среда)
фиолетовый
красный
13. Химические свойства кислот:
2. Взаимодействие с металлами:Правило: Металлы, стоящие в ряду
активности металлов до Н,
вытесняют его из кислоты
(исключение составляют
концентрированная серная и любая
азотная).
2НСl + Zn = ZnCl2 + H2
Кислота + Ме = Соль + Н2
14. Химические свойства кислот
3. Взаимодействие с основнымиоксидами:
Правило:При взаимодействии
основных оксидов с кислотами,
образуется соль и вода.
СuO + H2SO4 = CuSO4 + H2O
(реакция идет при нагревании).
15. Химические свойства кислот
4. Взаимодействие кислот соснованиями:
Правило: При взаимодействии
растворимых и нерастворимых
оснований с кислотами, образуется
соль и вода.
Реакция между кислотой и основанием
называется реакцией нейтрализации.
Н2СО3 + 2NaOH = Na2CO3 + 2H2O
16. Химические свойства кислот
5. Взаимодействие с солямиПравило: Более сильная кислота,
вытесняет менее сильную из ее соли.
Ряд активности кислот:
HCl
H2SO4 HNO3 H3PO4 H2SO3 H2CO3
H2S H2SiO3
Примечание: кислоты в ряду расположены по
мере ослабления своей силы.
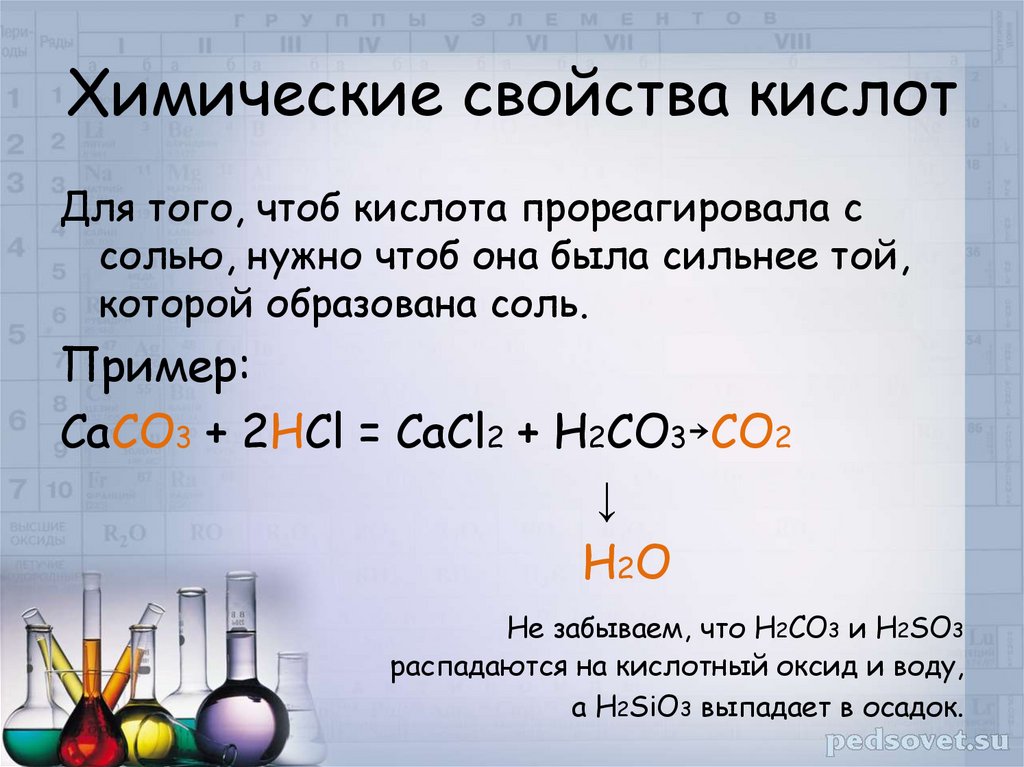
17. Химические свойства кислот
Для того, чтоб кислота прореагировала ссолью, нужно чтоб она была сильнее той,
которой образована соль.
Пример:
СаСО3 + 2НСl = CaCl2 + H2CO3 CO2
↓
H2O
Не забываем, что H2CO3 и H2SO3
распадаются на кислотный оксид и воду,
а H2SiO3 выпадает в осадок.
18.
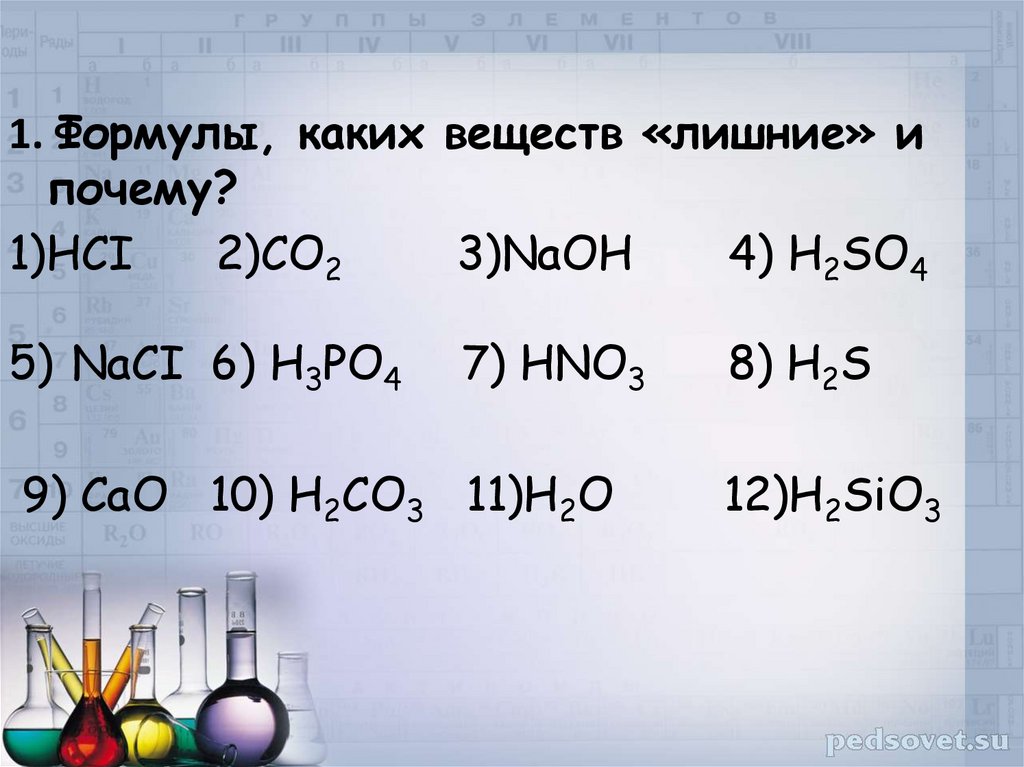
1. Формулы, каких веществ «лишние» ипочему?
1)HCI
2)CO2
3)NaOH
4) H2SO4
5) NaCI 6) H3PO4
7) HNO3
9) СаО 10) H2CO3 11)Н2О
8) H2S
12)Н2SiO3
19.
ФормулыНазвания
H2СО3
СОЛЯНАЯ
HСl
УГОЛЬНАЯ
H2SO4
ФОСФОРНАЯ
HNO3
СЕРНАЯ
H3PO4
АЗОТНАЯ
19
20.
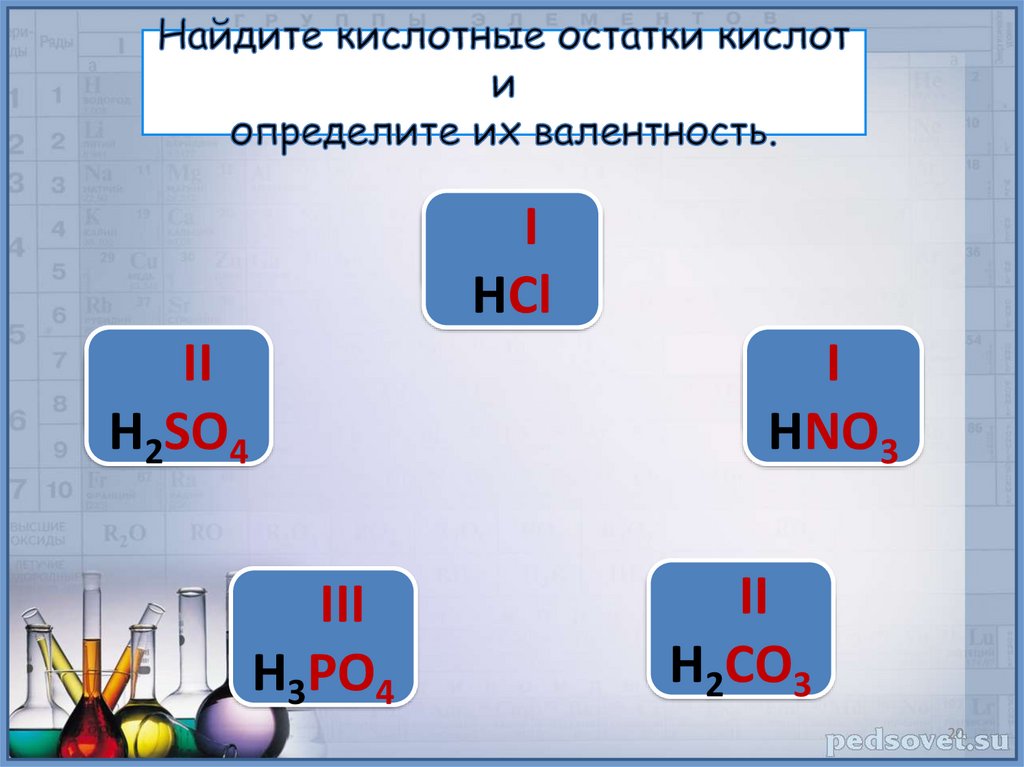
HСlIHСl
II
H2SO4
H2SO4
III
H3PO4
H3PO4
I
HNO3
HNO3
II
H2СО3
H2СО3
20
21. Закрепление:
Составьте формулы солей:- Нитрата свинца (II)
- Сульфата натрия
- Карбоната кальция
- Фосфата калия
- Сульфита алюминия
- Хлорида магния
- Бромида серебра (I)
- Сульфида натрия
22. Закрепление:
С какими из перечисленных веществбудет взаимодействовать соляная
кислота: оксид углерода (IV),
сульфид калия, оксид магния,
гидроксид алюминия, ртуть, сульфит
лития, железо? Напишите
соответствующие уравнения реакций.
23. Закрепление:
Осуществите цепочки превращений:S SO2 H2SO3 Li2SO3 SO2 MgSO3 MgSO4
P P2O K3PO4 H3PO4 Ca3(PO4)2 CaSO4
C CO2 CaCO3 CaO Ca(OH)2 Ca(NO3)2
















 Химия
Химия








