Похожие презентации:
Химические свойства кислот и способы их получения
1. Химические свойства кислот способы их получения
2.
Что нас объединяет?3.
Кислоты— это сложные вещества,
состоящие из атомов водорода,
способных замещаться на атомы
металлов, и кислотного остатка.
H nR
где R – кислотный остаток
с валентностью = n(числу атомов H)
4.
Формулы, каких веществ «лишние» ипочему?
1) HCI
CO2
NaOH
2) NaCI
H3PO4
3) СаО
H2CO3
HNO3
Н2О
H2SO4
H2S
SiO2
5. Дать название кислотам:
HCIH2SO4
H3PO4
HNO3
H2S
H 2SO3
H2CO3
Н2SiO4
6. Химические свойства кислот - взаимодействие с металлами
Химические свойства кислот взаимодействие с металламикислота + металл (до H) = соль +H2
Ряд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
Zn + 2 HCl = ZnCl2 + H2
Cu + 2 HCl
7.
Химические свойства кислотвзаимодействие с основными
оксидами
(р.обмена)
Кислота + основный оксид = соль + вода
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
8.
Химические свойства кислот взаимодействие с основаниями –(р.обмена)
реакция нейтрализации
кислота + основание = соль + вода
H3PO4 + 3NaOH = Na3PO4 + 3H2O
Реакция нейтрализации – это реакция обмена
между кислотой и основанием.
9.
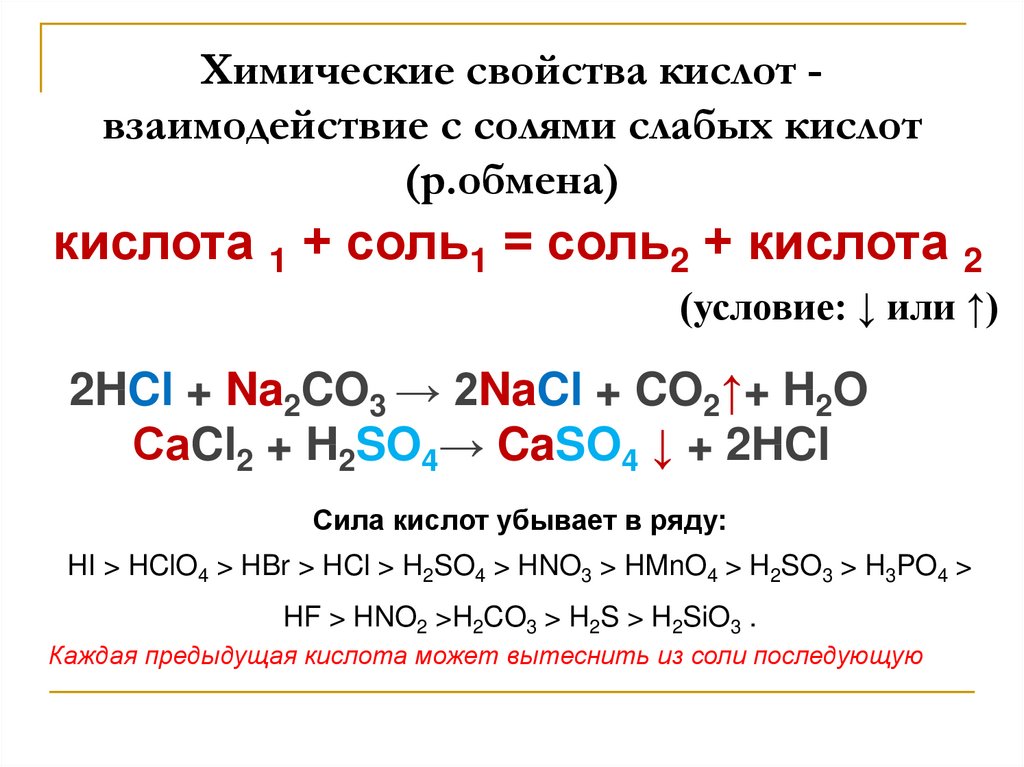
Химические свойства кислот взаимодействие с солями слабых кислот(р.обмена)
кислота 1 + соль1 = соль2 + кислота 2
(условие: ↓ или ↑)
2HCl + Na2CO3 → 2NaCl + CO2↑+ H2O
СaCl2 + H2SO4→ CaSO4 ↓ + 2HCl
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 >
HF > HNO2 >H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
10.
КИСЛОТА+ индикатор
+
изменение окраски
Ме (в ряду активности до Н) соль + Н2
+ основный оксид
соль + Н2О
+ основание соль + Н2О (реакция
нейтрализации)
+ соль более слабой кислоты новая
соль + новая кислота (условие: ↓ или ↑)
11. Способы получения кислот
бескислородныекислородсодержащие
HCl, HBr, HI, HF, H2S
HNO3, H2SO4 и другие
ПОЛУЧЕНИЕ
1. Взаимодействие
неметаллов
H2 + Cl2 = 2HCl
H2 + S =H2S
1. Кислотный оксид + вода
= кислота
SO3 + H2O = H2SO4
Исключение SiO2 + H2O
2. Реакция обмена между солью и более сильной кислотой
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl ↑
K2SiO3 + 2 HCl = 2 KCl + H2SiO3 ↓
12. Закрепление знаний
Про какие химические свойства кислотвы сегодня узнали, перечислить.
Какие металлы не взаимодействуют с
кислотами?
Как можно получить бескислородные
кислоты?
Каким способом нельзя получить
кремниевую кислоту?
Какие реакции называются реакциями
нейтрализации?
13.
Задание.Составьте возможные уравнения реакций
перечисленных веществ с раствором серной
кислоты.
I вариант – LiOH, SiO2
II вариант – Ba(NO3)2, Cu
III вариант – K2O, NaNO3
IV вариант – Mg, HCl
14.
Домашнее заданиесмотри в ЭЖД!













 Химия
Химия








