Похожие презентации:
21. Кислоты. Определение кислот
1. Кислоты
Химия8 класс
И. Жикина
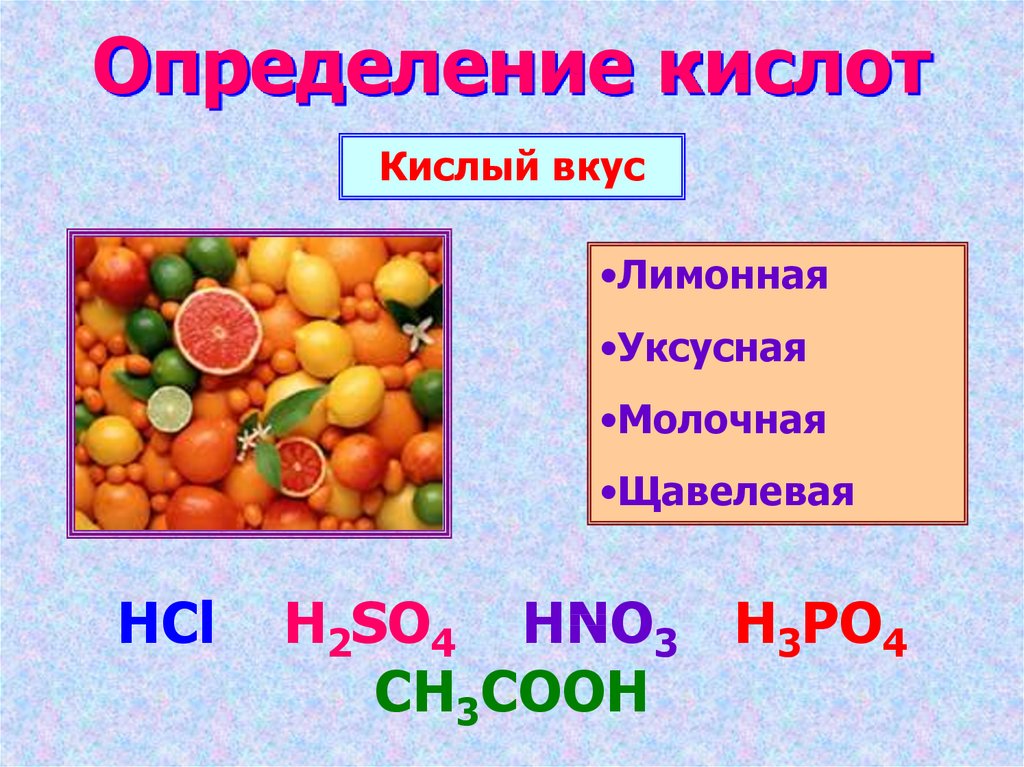
2. Определение кислот
Кислый вкус•Лимонная
•Уксусная
•Молочная
•Щавелевая
HCl
H2SO4 HNO3 H3PO4
CH3COOH
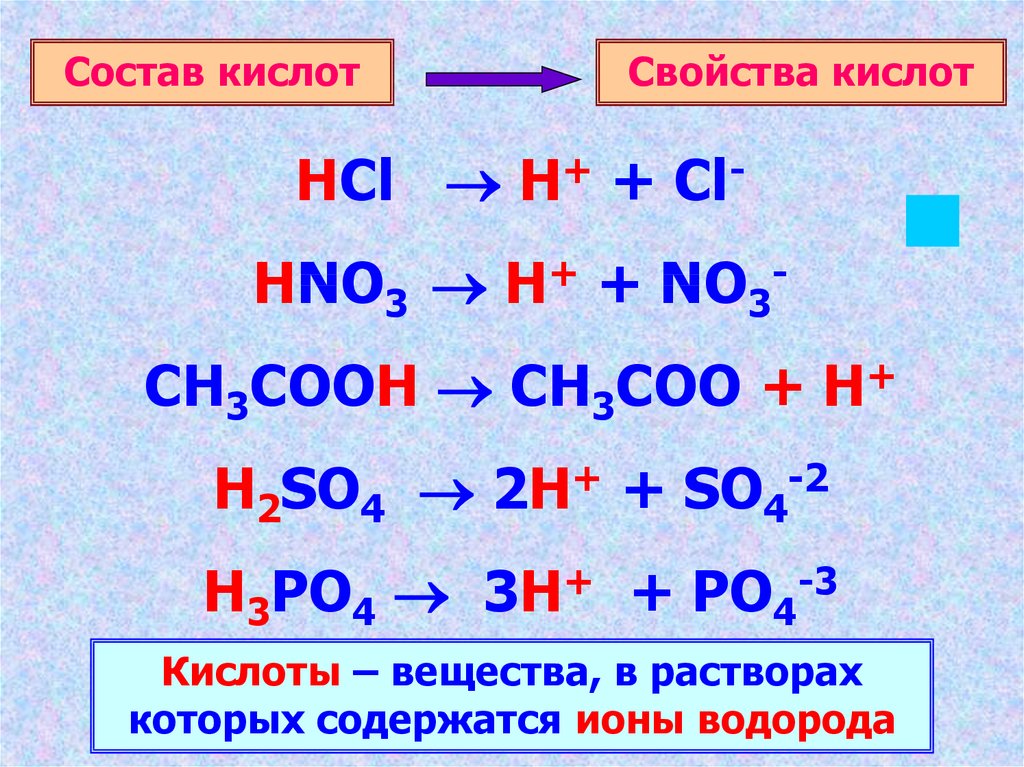
3.
Состав кислотСвойства кислот
HCl H+ + ClHNO3 H+ + NO3CH3COOH CH3COO + H+
H2SO4 2H+ + SO4-2
H3PO4 3H+ + PO4-3
Кислоты – вещества, в растворах
которых содержатся ионы водорода
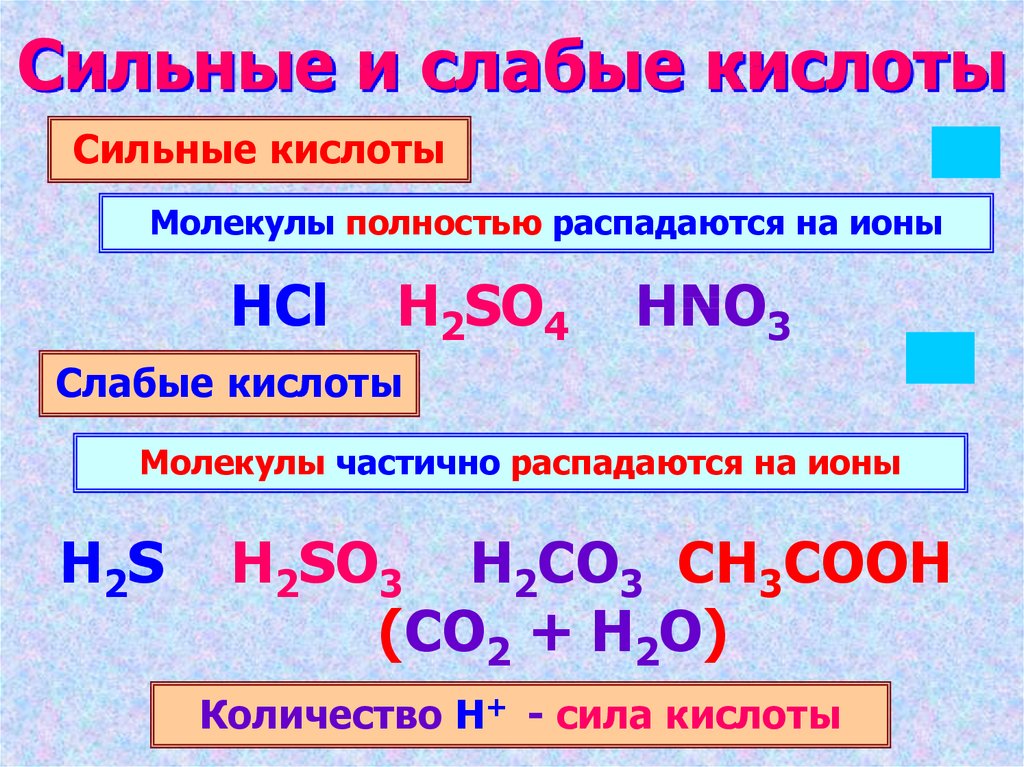
4. Сильные и слабые кислоты
Сильные кислотыМолекулы полностью распадаются на ионы
HCl
H2SO4
HNO3
Слабые кислоты
Молекулы частично распадаются на ионы
H2S
H2SO3 H2CO3 CH3COOH
(CO2 + H2O)
Количество Н+ - сила кислоты
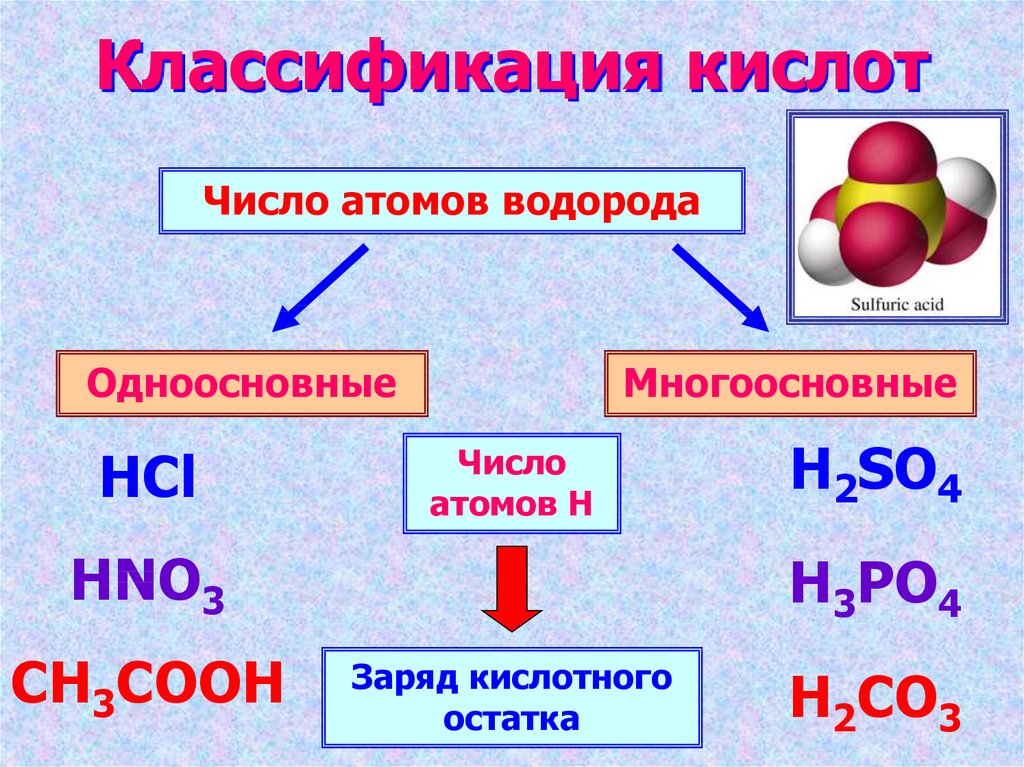
5. Классификация кислот
Число атомов водородаОдноосновные
HCl
Многоосновные
Число
атомов Н
HNO3
CH3COOH
H2SO4
H3PO4
Заряд кислотного
остатка
H2CO3
6.
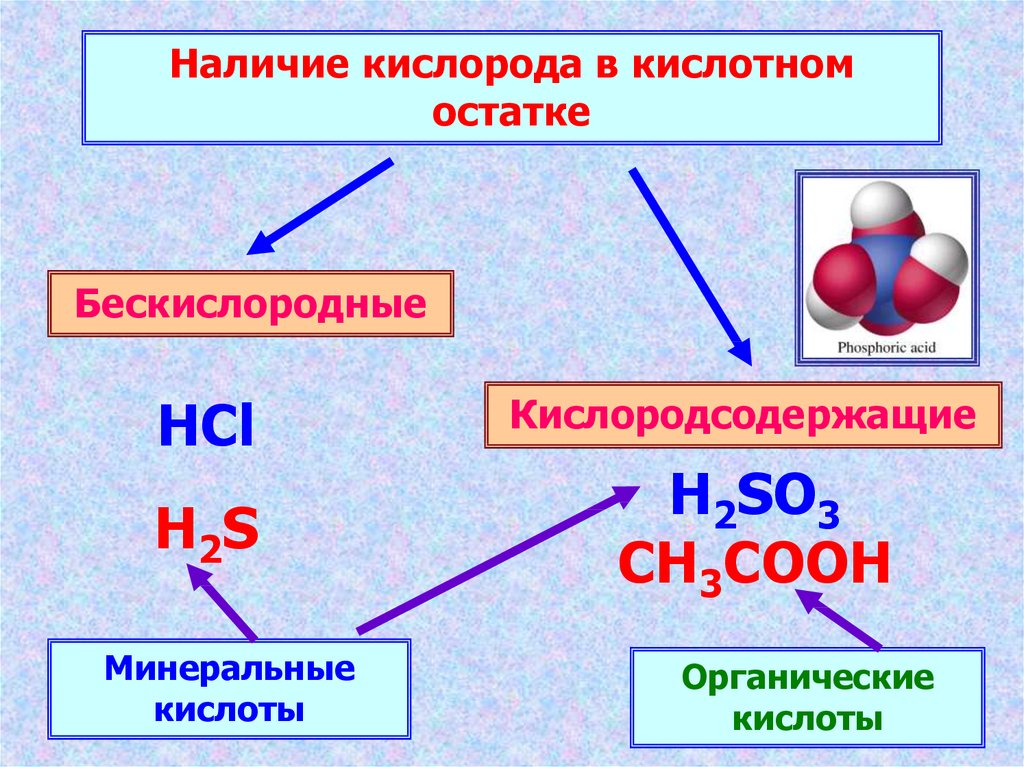
Наличие кислорода в кислотномостатке
Бескислородные
HCl
H2S
Минеральные
кислоты
Кислородсодержащие
H2SO3
CH3COOH
Органические
кислоты
7.
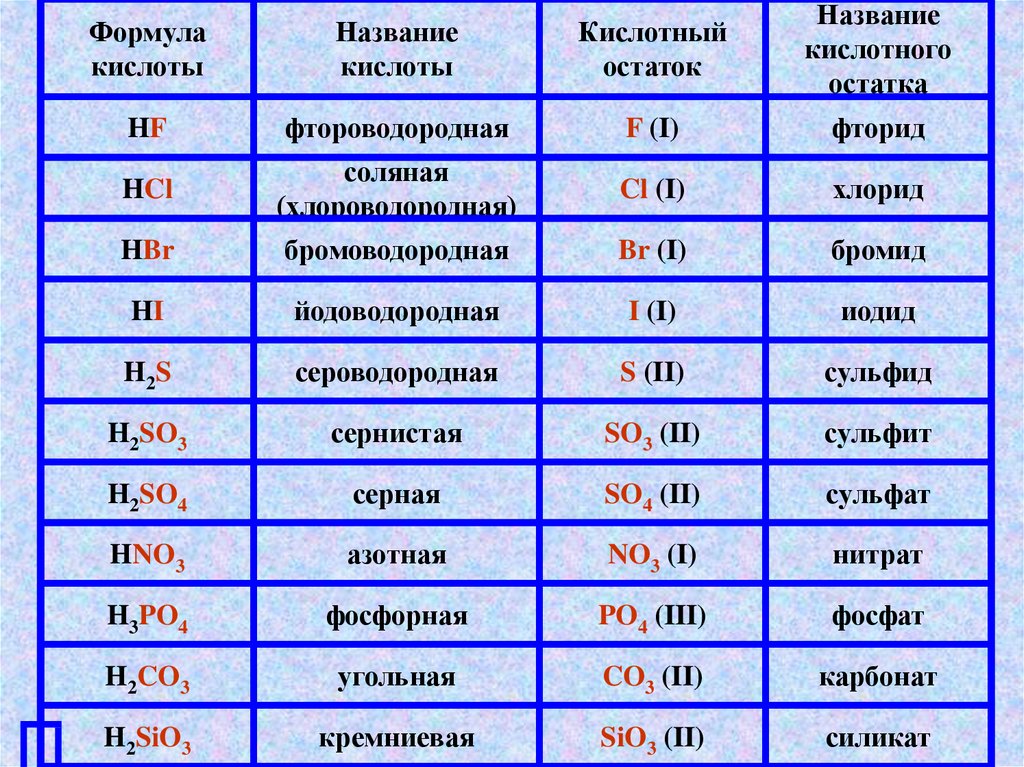
Формулакислоты
Название
кислоты
Кислотный
остаток
Название
кислотного
остатка
HF
фтороводородная
F (I)
фторид
HCl
соляная
(хлороводородная)
Cl (I)
хлорид
HBr
бромоводородная
Br (I)
бромид
HI
йодоводородная
I (I)
иодид
H2 S
сероводородная
S (II)
сульфид
H2SO3
сернистая
SO3 (II)
сульфит
H2SO4
серная
SO4 (II)
сульфат
HNO3
азотная
NO3 (I)
нитрат
H3PO4
фосфорная
PO4 (III)
фосфат
H2CO3
угольная
CO3 (II)
карбонат
H2SiO3
кремниевая
SiO3 (II)
силикат
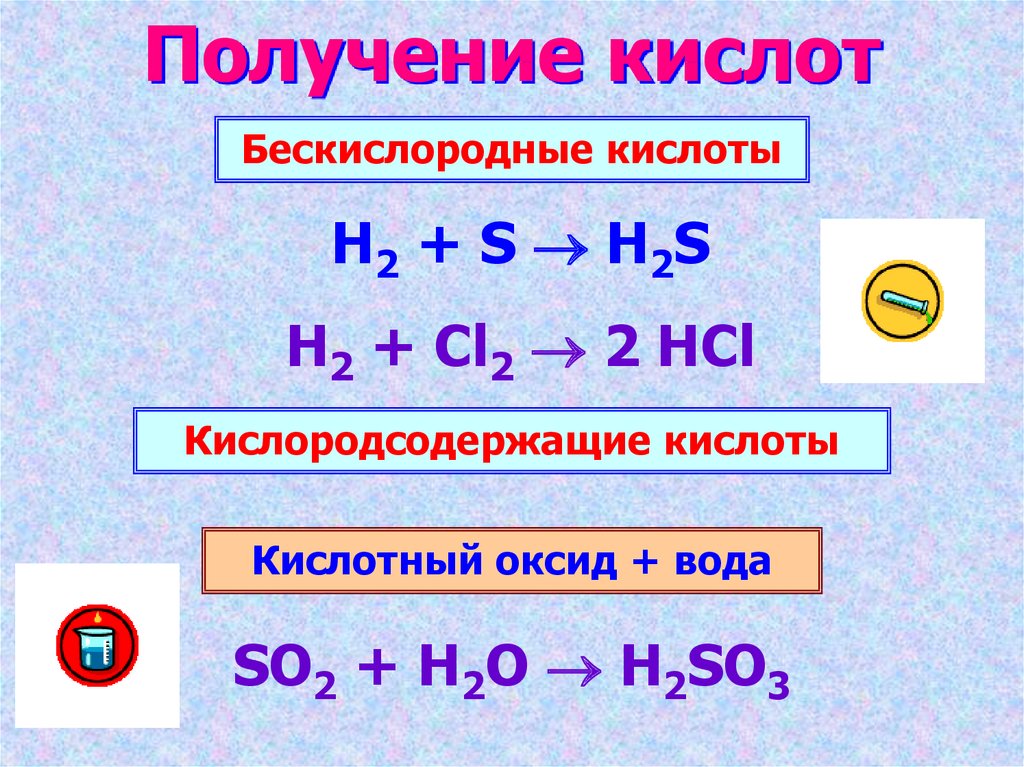
8. Получение кислот
Бескислородные кислотыH2 + S H2S
H2 + Cl2 2 HCl
Кислородсодержащие кислоты
Кислотный оксид + вода
SO2 + H2O H2SO3
9.
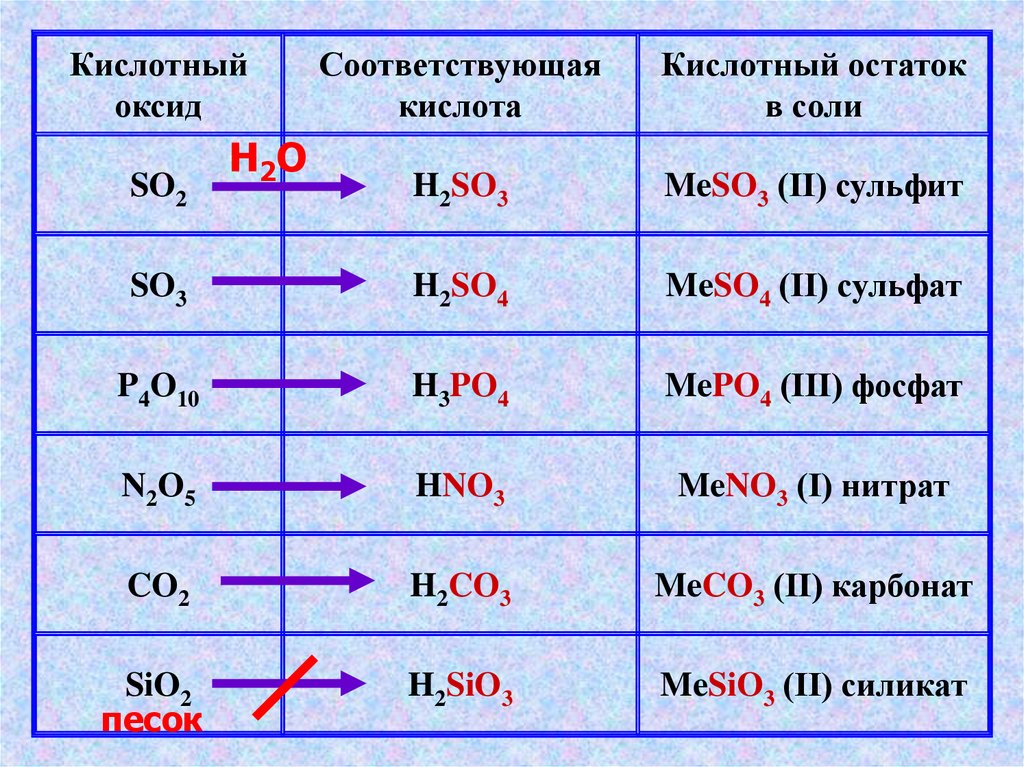
Кислотныйоксид
Соответствующая
кислота
Кислотный остаток
в соли
H2SO3
MeSO3 (II) сульфит
SO3
H2SO4
MeSO4 (II) сульфат
P4O10
H3PO4
MePO4 (III) фосфат
N2O5
HNO3
MeNO3 (I) нитрат
CO2
H2CO3
MeCO3 (II) карбонат
SiO2
песок
H2SiO3
MeSiO3 (II) силикат
SO2
H2O
10. Физические свойства кислот
Кислый вкусПлотность больше
плотности воды
Разъедающее
действие
Вода, раствор
питьевой соды
11.
Сначала вода, потом кислота –иначе случится большая беда!
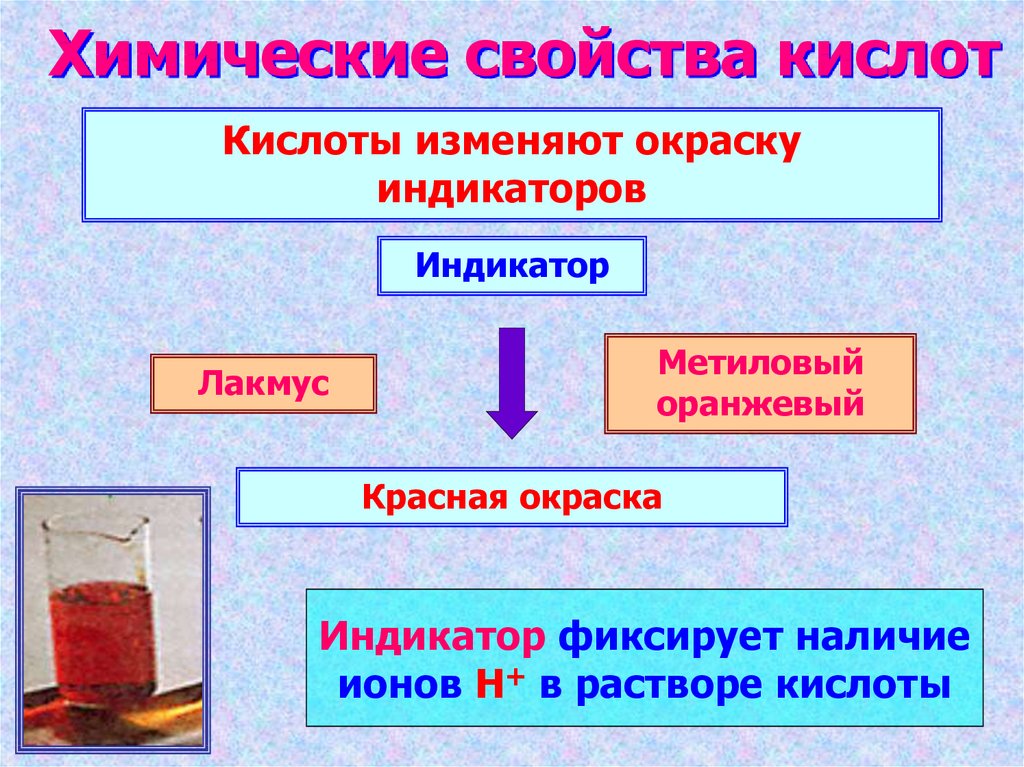
12. Химические свойства кислот
Кислоты изменяют окраскуиндикаторов
Индикатор
Лакмус
Метиловый
оранжевый
Красная окраска
Индикатор фиксирует наличие
ионов Н+ в растворе кислоты
13.
Кислоты реагируют с металлами, стоящимив ряду активности до водорода
Zn + 2HCl ZnCl2 + H2
Zn0 – 2e Zn+2
H+1
+ 1e
H0
Восстановитель,
окисляется
Окислитель,
восстанавливается
Взаимодействие металла с кислотой является
окислительно-восстановительной реакцией
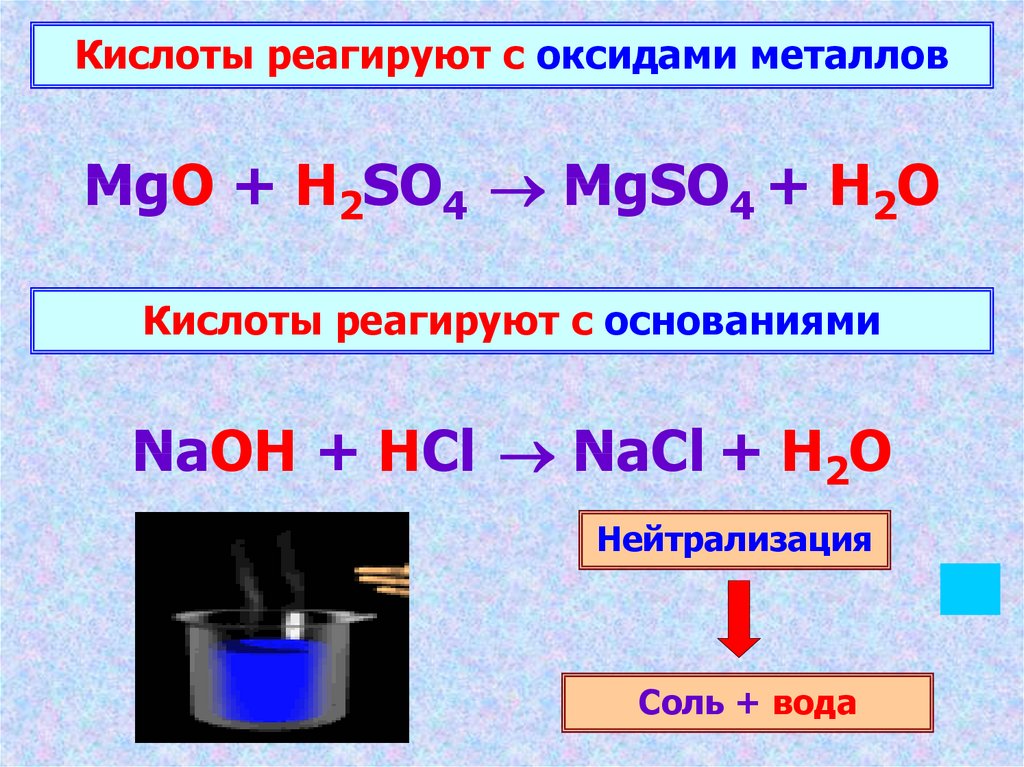
14.
Кислоты реагируют с окcидами металловMgO + H2SO4 MgSO4 + H2O
Кислоты реагируют с основаниями
NaOH + HCl NaCl + H2O
Нейтрализация
Соль + вода




 Химия
Химия








