Похожие презентации:
Решение экспериментальных задач по теме «металлы»
1.
Практическая работа № 4Тема: Решение экспериментальных
задач по теме «металлы».
Цель: Отработать на практике
умение распознавать соединения
металлов на основе качественных
реакций, закрепить знания по теме
«гидролиз».
2.
Ход работы:Эксперимент
Наблюдения
Уравнения
реакций (в
молекулярном,
полном и
сокращенном
ионном виде).
Выводы
Задача 1
1. В пробирку
добавили FeSO4 и
NaOH
FeSO4 + NaOH=
2. В пробирку
добавили MgSO4
и NaOH
MgSO4 + NaOH=
3.
Цвета осадков:Fe(OH)2
Mg(OH)2
4.
Пример составления уравненийреакций:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
2+
2-
+
-
+
2-
Fe + SO4 + 2Na + 2OH = Fe(OH)2 + 2Na + SO4
2+
-
Fe + 2OH = Fe(OH)2
5.
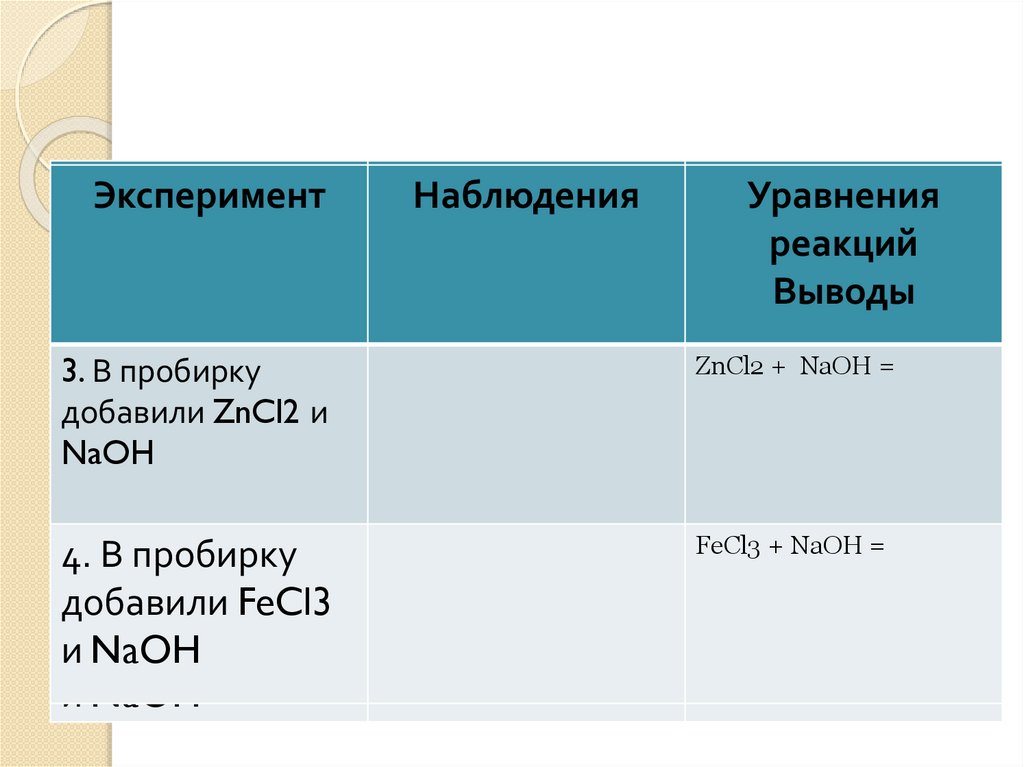
ЭкспериментНаблюдения
Уравнения
реакций
Выводы
3. В пробирку
добавили ZnSO4
ZnCl2 ии
NaOH
ZnCl2 + NaOH =
Задача
2
4. В пробирку
1.
В пробирку
добавили
FeCl3
добавили
и NaOH FeCl3
и NaOH
FeCl3 + NaOH =
6.
Цвета осадков:Zn(OH)2
Fe(OH)3
7.
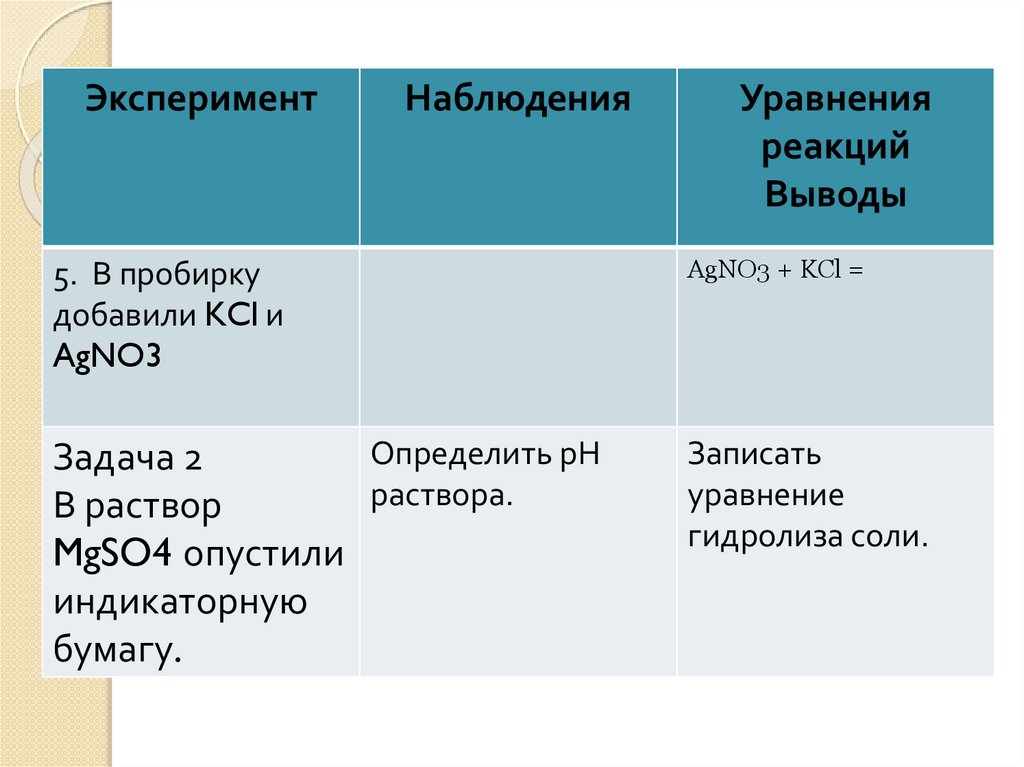
ЭкспериментНаблюдения
Уравнения
реакций
Выводы
5. В пробирку
добавили KCl и
AgNO3
AgNO3 + KCl =
Определить рН
Задача 2
раствора.
В раствор
MgSO4 опустили
индикаторную
бумагу.
Записать
уравнение
гидролиза соли.
8.
Цвет осадка:AgCl
9.
Пример составления уравнениягидролиза соли, которая
образована слабым основанием и
сильной кислотой
10.
Гидролиз хлорида меди (II)Гидролиз идет ПО КАТИОНУ соли
11.
Гидролиз хлорида меди (II)Ионное уравнение
Молекулярное уравнение










 Химия
Химия








