Похожие презентации:
Оксиды
1.
оксиды{
Номенклатура.
Классификация.
Способы получения.
Физические и химические
свойства.
2.
ОКСИДЫ – это сложные вещества, состоящиеиз 2-х элементов, один из которых кислород.
CaO – оксид кальция
MgO –оксид магния
CO-оксид углерода (II),монооксид углерода
CO2 – оксид углерода (IV), диоксид углерода
SO2 – оксид серы ( IV), диоксид серы
SO3- оксид серы (VI), триоксид серы
MnO –оксид марганца(II)
MnO2- оксид марганца (IV), диоксид марганца
3.
ИЗ ПРИВЕДЕННЫХ ФОРМУЛВЕЩЕСТВ ВЫБЕРИТЕ ФОРМУЛЫ
ОКСИДОВ И НАЗОВИТЕ ИХ:
H2S, Na2O, HCl, ZnO, CH4,
Al2O3, Mg(OH)2, SiO2, NH3,
P2O5, H2SO4, B2O3, CrO, Cr2O3,
K2O, BaO
4.
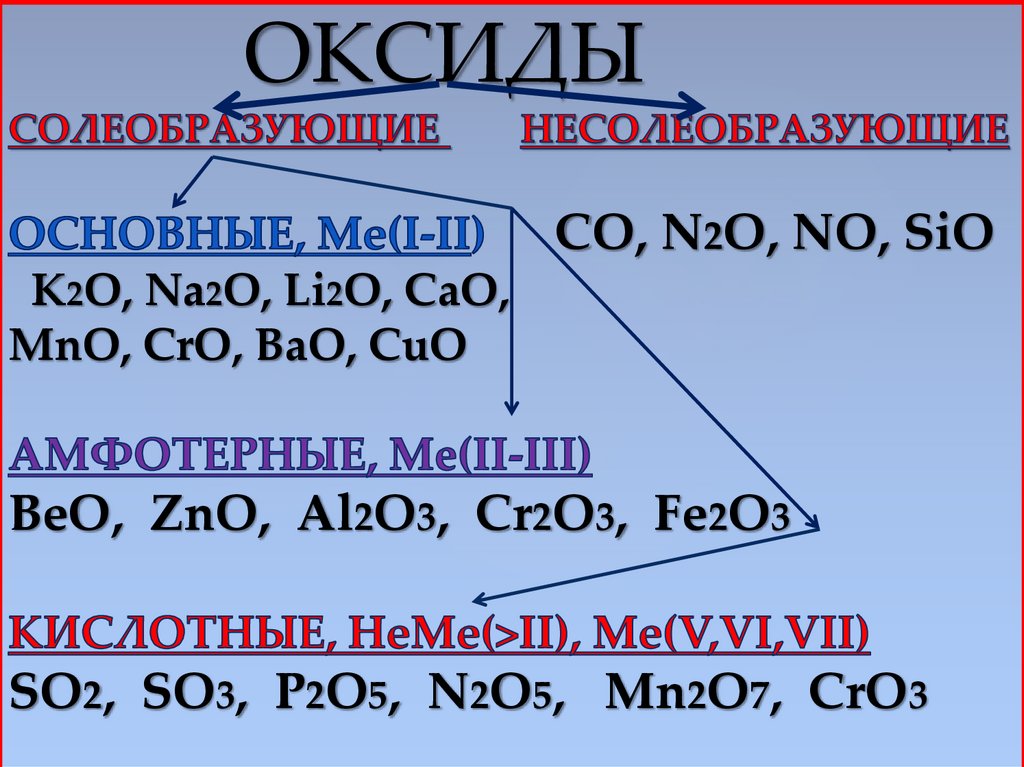
ОКСИДЫCO, N2O, NO, SiO
K2O, Na2O, Li2O, CaO,
MnO, CrO, BaO, CuO
BeO, ZnO, Al2O3, Cr2O3, Fe2O3
SO2, SO3, P2O5, N2O5, Mn2O7, CrO3
5.
ЭТО ТАКИЕОКСИДЫ, КОТОРЫМ СООТВЕТСТВУЮТ
ГИДРОКСИДЫ -ОСНОВАНИЯ.
(Образованы металлами с валентностью I-II)
Li2O –LiOH (гидроксид лития)
Na2O - NaOH (гидроксид натрия)
CaO - Ca(OH)2 (гидроксид кальция)
BaO - Ba(OH)2 (гидроксид бария)
MnO - Mn(OH)2 (гидроксид марганца (II) )
CuO – Cu(OH)2 (гидроксид меди (II) )
6.
ЭТО ТАКИЕ ОКСИДЫ,КОТОРЫМ СООТВЕТСТВУЮТ ГИДРОКСИДЫ –
КИСЛОТЫ
CO2 - H2CO3 угольная к-та
SO2 - H2SO3 сернистая к-та
SO3 - H2SO4 серная к-та
P2O5 – H3PO4 ортофосфорная к-та
N2O3 - HNO2 азотистая к-та
N2O5 - HNO3 азотная к-та
Mn2O7 - HMnO4 марганцевая к-та
CrO3 - HCrO4 хромовая к-та
SiO2 – H2SiO3 кремниевая кислота
7.
Выберите из приведенных формулнесолеобразующие оксиды:
Na2O, CuO, NO, CO2, N2O, SO3, CO, MgO, SiO
Выберите из приведенных формул
основные оксиды:
P2O5, Li2O, Mn2O7, CaO, SO2, BaO, SiO2, CuO
Выберите из приведенных формул
кислотные оксиды:
K2O, CO2, ZnO, P2O5, CrO3, FeO, Cl2O7, SO3
8.
ФИЗИЧЕСКИЕ свойства оксидовCuO - черного цвета, Fe2O3-бурого цв.
HgO - оранжевого цвета
СaO, ZnO, Al2O3, BaO, MgO - белого цвета
P2O5 - белого цвета
SiO2 – прозрачный
– H2O, SO3
CO, CO2, SO2, NO –бесцветные
NO2 – бурый газ
9.
1.Горение простых и сложных веществ:2Mg + O2 = 2MgO
4Li + O2 = 2Li2O
S + O2 = SO2
4P + 5O2 = 2P2O5
CH4 +2O2 = CO2 + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
10.
1.Нерастворимых основанийCu(OH)2 = CuO + H2O
2.Кислот
H2SO3= SO2 + H2O
3.Солей
CaCO3 = CaO + СO2
11.
§40 (до химических свойств),стр.135, №1, 2(а- д), 3
тесты 1, 2, 3, 5(подробно)
12.
N20, CaO, N2O5, Al2O3, SO2, V2O5, CO,BaO, CO2, NO, Fe2O3, ZnO, BeO, B2O3,
Na2O, CuO, SiO2, MgO, SiO, Cr2O7
Несолеобразующие:
Основные:
Амфотерные:
Кислотные:
Назовите оксиды.
13.
H2SO4HNO3
H3PO4
HNO2
H2CO3
H2SO3
HMnO4
H2SiO3
угольная к-та
сернистая к-та
азотная к-та
фосфорная к-та
серная к-та
азотистая к-та
кремниевая -та
марганцевая к-та
14.
1.При окислении атмосферного азота образуется оксид азота (II).2.При горении железа в кислороде образуется железная окалина
Fe3O4 – смесь двух оксидов FeO*Fe2O3.
3.При горении аммиака образуется оксид азота (II) и вода.
4.При окислении оксида серы (IV) кислородом на катализаторе
при повышенных температуре и давлении образуется оксид
серы(VI).
15.
5.Металлы, проявляющие переменную валентность, при непосредственномвзаимодействии с кислородом обычно проявляют валентность =II.
Составить уравнения реакций окисления никеля, хрома, свинца, ртути.
6.При горении угля в избытке кислорода образуется оксид углерода (IV), а
при недостатке кислорода – оксид углерода (II). Составить уравнения
реакций.
16.
ХИМИЧЕСКИЕ СВОЙСТВА1.Оксиды
Li, Na, K, Cs, Rb, Ca, Ba, Sr
взаимодействуют с водой,
образуя растворимые
основания - щелочи
CaO + H2O = Ca(OH)2
17.
2.С кислотами,образуя соли
BaO + 2HCl = BaCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
Al2O3 +6HNO3 =2Al(NO3)3+ 3H2O
18.
Кислотные оксиды1.Со щелочами, образуя соли
CO2 + Ca(OH)2 = CaCO3↓ + H2O
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
19.
2.С ВОДОЙ,образуя кислоты
SO2 + H2O = H2SO3
SO3 + H2O = H2SO4
P2O5 + H2O = H3PO4
N2O5 + H2O = HNO3
CO2 + H2O = H2CO3
SiO2 + H2O ≠
20.
3.Основные и кислотныеоксиды взаимодействуют
между собой, образуя соли
CaO + CO2 = CaCO3
MgO + SO2 = MgSO3
Na2O + SiO2 = Na2SiO3
21.
Я знаю, чтоОксиды бывают……
Основным оксидам соответствуют…
Кислотным оксидам соответствуют…
Оксиды получают при горении….
Разложении…
Основные оксиды взаимодействуют c ...
Кислотные оксиды взаимодействуют c..
Оксиды взаимодействуют между…
22.
1.Составьте уравнения реакций взаимодействия с водой2.Составьте уравнения реакций взаимодействия:
и
;
с
;
с
.
3.Составьте уравнения реакций взаимодействия:
и
и
и
4.Составьте уравнения реакций взаимодействия:
и
и
;
и
23.
Домашнее задание§ 40, конспект, стр.135,
№ 2,3,4
задания на слайде 21
выполнить






















 Химия
Химия








