Похожие презентации:
Соли. Тема 3
1.
СОЛИ2.
1. Что такое соли?Что мы
узнаем?
2. Составление химических формул солей
по их названиям
3. Определение растворимости солей по
таблице растворимости
4. Примеры и некоторые свойства солей,
применяющихся в повседневной жизни
2
3.
1. Что такое соли?4.
Какие вещества называются солями?• Соли – сложные вещества, состоящие из атомов металлов и
кислотных остатков
4
5.
Соли – продукты реакции нейтрализацииОснование + Кислота Соль + H2O
NaOH + HCl = NaCl + H2O
NaOH + H3PO4 = NaH2PO4 + H2O
2NaOH + H3PO4 = Na2HPO4 + 2H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O
Cu(OH)2 + HNO3 = (CuOH)NO3 + H2O
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
5
6.
Классификация солейСОЛИ
Средние
Кислые
Основные
Средние соли – соли, в которых все атомы водорода соответствующей кислоты
замещены на атомы металла
NaCl
Na2SO4
Na3PO4
Кислые соли – соли, в которых атомы водорода кислоты замещены частично
NaHSO4 Na2HPO4 NaH2PO4
Основные соли – соли, в которых группы ОН соответствующего основания частично
замещены на кислотные остатки
MgOHCl
Al(OH)2NO3
7.
Другие способы получения солейМеталл + Кислота Соль + H2
Zn + 2HCl ZnCl2 + H2
Основной оксид + Кислота Соль + H2О
CuO + 2HNO3 Cu(NO3)2 + H2O
Кислотный оксид + Основание Соль + H2О
CO2 + 2NaOH Na2CO3 + H2O
7
8.
2. Составление химическихформул солей по их названиям
9.
Составление названий солей• Название кислотного остатка (в именительном падеже) + название металла
(в родительном падеже)
Хлорид цинка
Карбонат натрия
• Если валентность металла переменная, то ее обязательно указывают в
названии соли
Нитрат железа (III)
Сульфат меди (II)
9
10.
Названия некоторых кислот и их солейФормулы
Названия кислот
Названия солей
HCl
Хлороводородная (соляная) кислота
Хлориды
HF
Фтороводородная (плавиковая) кислота
Фториды
HI
Иодоводородная кислота
Иодиды
Н2S
Сероводородная кислота
Сульфиды
H2SO4
Серная кислота
Сульфаты
H2SO3
Сернистая кислота
Сульфиты
HNO3
Азотная кислота
Нитраты
HNO2
Азотистая кислота
Нитриты
Н2СО3
Угольная кислота
Карбонаты
H2SiO3
Кремниевая кислота
Силикаты
Н3РО4
Фосфорная кислота
Фосфаты
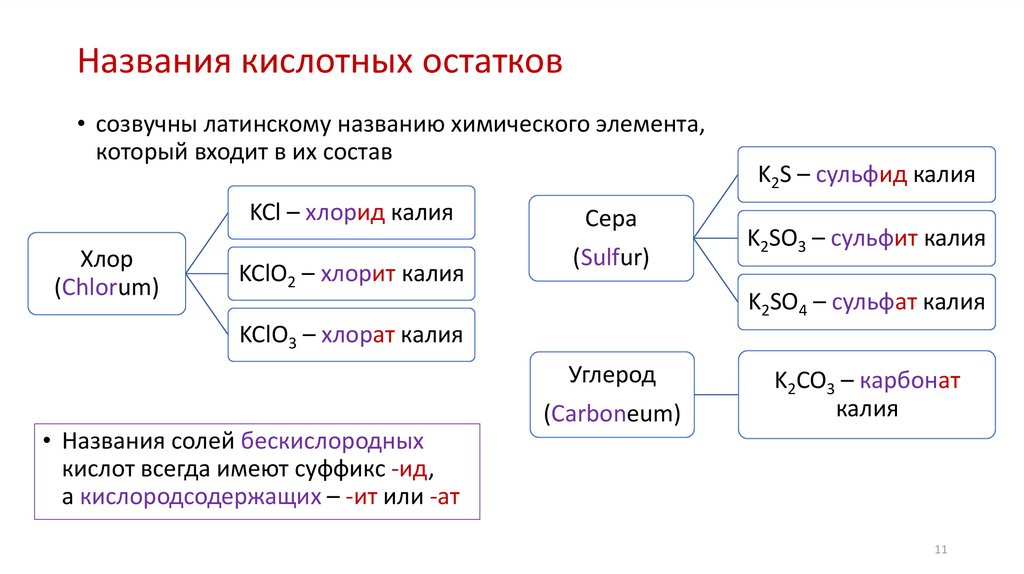
11.
Названия кислотных остатков• созвучны латинскому названию химического элемента,
который входит в их состав
KCl – хлорид калия
Хлор
(Chlorum)
KClO2 – хлорит калия
Сера
(Sulfur)
K2S – сульфид калия
K2SO3 – сульфит калия
K2SO4 – сульфат калия
KClO3 – хлорат калия
Углерод
• Названия солей бескислородных
кислот всегда имеют суффикс -ид,
а кислородсодержащих – -ит или -ат
(Carboneum)
K2CO3 – карбонат
калия
11
12.
Названия солейСредние соли
Кислотный остаток – название Ме в родительном падеже – (валентность Ме)
Fe(NO3)3 – нитрат железа (III)
AlCl3 – хлорид алюминия
Na2SO4 – сульфат натрия
Кислые соли
Гидро(кислотный остаток) – название Ме в родительном падеже – (валентность Ме)
NaHSO4 – гидросульфат натрия
NaH2PO4 – дигидрофосфат натрия
Основные соли
Кислотный остаток – гидроксо(название Ме в родительном падеже) – (валентность
Ме)
MgOHCl – хлорид гидроксомагния
Al(OH)2NO3 – нитрат дигидроксоалюминия
12
13.
Составление формул солей по названиям• Формулы солей составляют аналогично формулам оксидов, уравнивая число
единиц валентности металла и кислотного остатка
• Пример. Карбонат натрия – соль угольной кислоты
• Na одновалентен, а кислотный остаток СО3 двухвалентен, значит, на 1
кислотный остаток приходятся 2 атома натрия:
Na2CO3
• Если в состав соли входит несколько кислотных остатков
кислородсодержащей кислоты (например, NO3, РО4), то их заключают в
скобки, за которыми ставят индекс, обозначающий их число
Нитрат меди (II)
Cu(NO3)2
Фосфат кальция
Са3(РО4)2
13
14.
Алгоритм составления формул солей по названиямПоследовательность действий
Записываем символы металла (на
первом месте) и кислотного остатка,
указываем их валентности
Находим наименьшее общее кратное
двух числовых значений валентности
Находим индексы, поделив наименьшее
общее кратное на числовое значение
валентности
Записываем индексы после символов
металла и кислотного остатка
Примеры составления формул
Сульфат алюминия Карбонат кальция
III II
Al SO4
II II
Ca CO3
III и II 6
II и II
2
6 : III = 2 (Al)
2 : II = 1 (Ca)
6 : II = 3 (SO4)
2 : II = 1 (CO3)
Al2(SO4)3
CaCO3
14
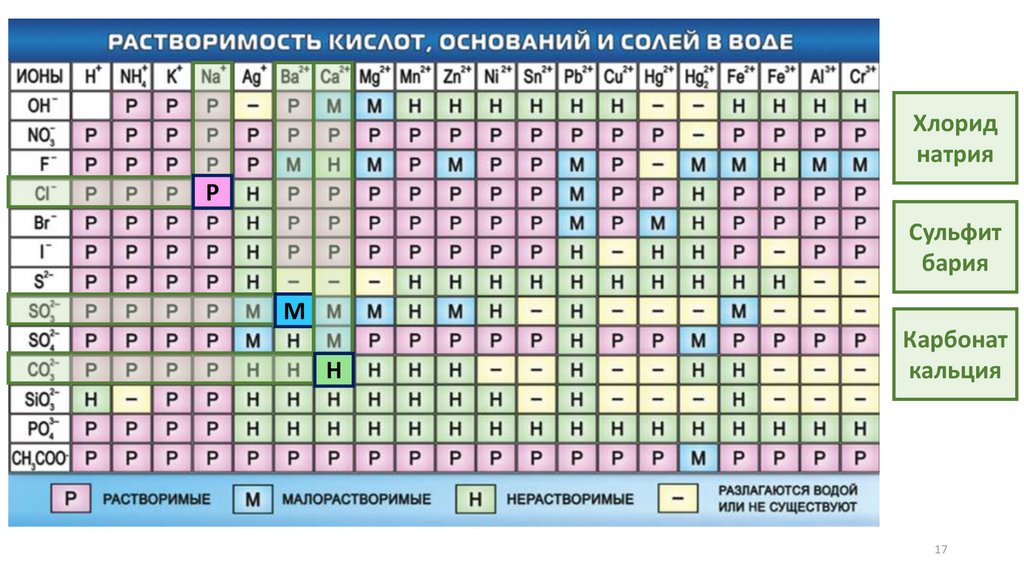
15.
3. Определение растворимостисолей по таблице растворимости
16.
H+OH–
Основания
Соли
Кислоты
16
17.
Хлориднатрия
Р
Сульфит
бария
М
Н
Карбонат
кальция
17
18.
4. Примеры и некоторыесвойства солей, применяющихся
в повседневной жизни
19.
Хлориды – соли соляной кислоты• Хлорид натрия NaCl
• Поваренная соль,
каменная соль, галит
• Приправа к пище, средство, предохраняющее
пищевые продукты от порчи
• Сырье для получения хлора, соляной кислоты,
едкого натра и карбоната натрия (соды)
• В красильном деле, мыловарении и др.
• В медицине – плазмозамещающие жидкости,
физиологический раствор
19
20.
Хлориды – соли соляной кислоты• Хлорид калия КCl
• Удобрение
• Растворы для инъекций
• Хлорид кальция СаCl2
• Охлаждающие смеси
• Кровоостанавливающее средство, при
аллергических заболеваниях и др.
20
21.
Карбонаты – соли угольной кислоты• Карбонат натрия Na2СО3
• Кальцинированная сода, бельевая сода
• Производство стиральных порошков, мыла и чистящих
средств
• Производство стекла и чугуна
• Смягчение воды или полного устранение ее жесткости
• Текстильная и нефтяная промышленность
• Использование в быту
21
22.
Карбонаты – соли угольной кислоты• Карбонат натрия кристаллогидрат
Na2СО3∙10Н2О
• Декагидрат карбоната натрия,
кристаллическая сода, стиральная сода
• Изготовления печатных плат, свечей
• Гальваника, химическая аналитика
• Обезжиривания рам, алюминиевых
поверхностей, экранов кинескопов
• Нейтрализация технических стоков
22
23.
Карбонаты – соли угольной кислоты• Гидрокарбонат натрия NaНСО3
• Чайная сода, питьевая или пищевая сода
• Производство красителей, пенопластов, бытовой химии
• Производство резиновых подошв, искусственной кожи,
текстиля
• Хлебопечение, производство кондитерских изделий,
приготовление газированных напитков
• Нейтрализатор химических ожогов кислотами, для
снижения кислотности желудочного сока, для
дезинфекции зубов и десен при зубных болях
• Для чистки поверхностей
23
24.
Карбонаты – соли угольной кислоты• Карбонат кальция СаСО3
• Кальцит
Известняк
• Архитектура и строительство
• Производство соды,
минеральных удобрений,
стекла, сахара, бумаги,
бетона
• В металлургии как флюс
Дмитриевский собор во Владимире,
выполненный из мячковского известняка:
общий вид и фрагмент скульптурного
декора
24
25.
Карбонаты – соли угольной кислоты• Карбонат кальция СаСО3
• Кальцит
Мел
• Производство мелованной бумаги,
используемой в полиграфии для печати
качественных иллюстрированных изданий
• Производство извести, портландцемента
• Производство зубной пасты
• Кормовая добавка в животноводстве
• Производство школьных мелков
25
26.
Карбонаты – соли угольной кислоты• Карбонат кальция СаСО3
• Кальцит
Мрамор
• Строительство и архитектура
• Скульптура
• Производство штукатурки, бетона
Микеланджело. Пиета
(Оплакивание Христа)
(1498–1500), каррарский
мрамор
Рим. Собор Святого
Петра
Мраморный дворец в Санкт-Петербурге
(1768–1785). Построен по проекту
итальянского архитектора Антонио
Ринальди (1710–1794)
Цветные мраморы использованы в
облицовке фасада и для украшения
интерьеров
27.
Сульфаты – соли серной кислоты• Сульфат кальция СаSО4
• Гипс, алебастр, селенит
• Медицина (гипсовые повязки)
• Строительство и архитектура
(сухая штукатурка, плиты и панели
для перегородок, гипсовые камни,
архитектурные детали и др.)
Алебастровый ритуальный
сосуд из гробницы
Тутанхамона, приблизительно
XIV в. до н. э.
Сувенир из селенита.
Кунгур
27
28.
Сульфаты – соли серной кислоты• Сульфат меди СuSО4
• Сульфат меди кристаллогидрат
СuSО4∙5Н2О
• Медный купорос
• Сырье для получения других
соединений меди
• Безводный сульфат – хороший
влагопоглотитель
• В сельском хозяйстве медный купорос
– антисептик, фунгицид и медносерное удобрение
• Используется в строительстве,
медицине, изготовлении красок
28
29.
Нитраты – соли азотной кислоты• Нитрат калия КNО3
• Калиевая селитра, калийная
селитра, индийская селитра,
соль Петра
• Удобрение в сельском хозяйстве
• Производство дымного пороха и пиротехнических изделий
• В пищевой промышленности применяется в качестве
консерванта E252
• В оптическом стекловарении для обесцвечивания и
осветления технических хрустальных стекол и придания
прочности изделиям из стекла
29
30.
Нитраты – соли азотной кислоты• Нитрат натрия NaNО3
• Натриевая селитра, натронная селитра,
чилийская селитра
• Удобрение в сельском хозяйстве
• Производство взрывчатых веществ и
пиротехнических смесей, ракетного топлива
• В пищевой, стекольной,
металлообрабатывающей промышленности
30
31.
Нитраты – соли азотной кислоты• Нитрат аммония NH4NО3
• аммонийная селитра, аммиачная
селитра
• Удобрение в сельском хозяйстве
• Производство взрывчатых веществ
• В промышленности и горном деле
31
32.
Перманганаты – соли марганцевой кислоты• Перманганат калия КМnО4
• Марганцовка
• Антисептическое средство в медицине для полоскания горла,
промывания ран и желудка при отравлении,
обработки ожогов
• Щелочной раствор перманганата калия хорошо отмывает
лабораторную посуду от жиров и других органических
веществ
• Используется в сельском хозяйстве (удобрение,
обеззараживание грунта, борьба с вредителями)
32






























 Химия
Химия








