Похожие презентации:
Соли. Классификация солей. Способы получения. Физические и химические свойства
1.
Частное Учреждение Образовательная ОрганизацияВысшего Образования
Медицинский Университет «РЕАВИЗ»
Выполнил: Студент Группы 127
Стоматологического факультета
Гладышева И.Е,
Проверил: Киселева О.Н
Самара, 2019г.
2.
1.2.
3.
4.
5.
6.
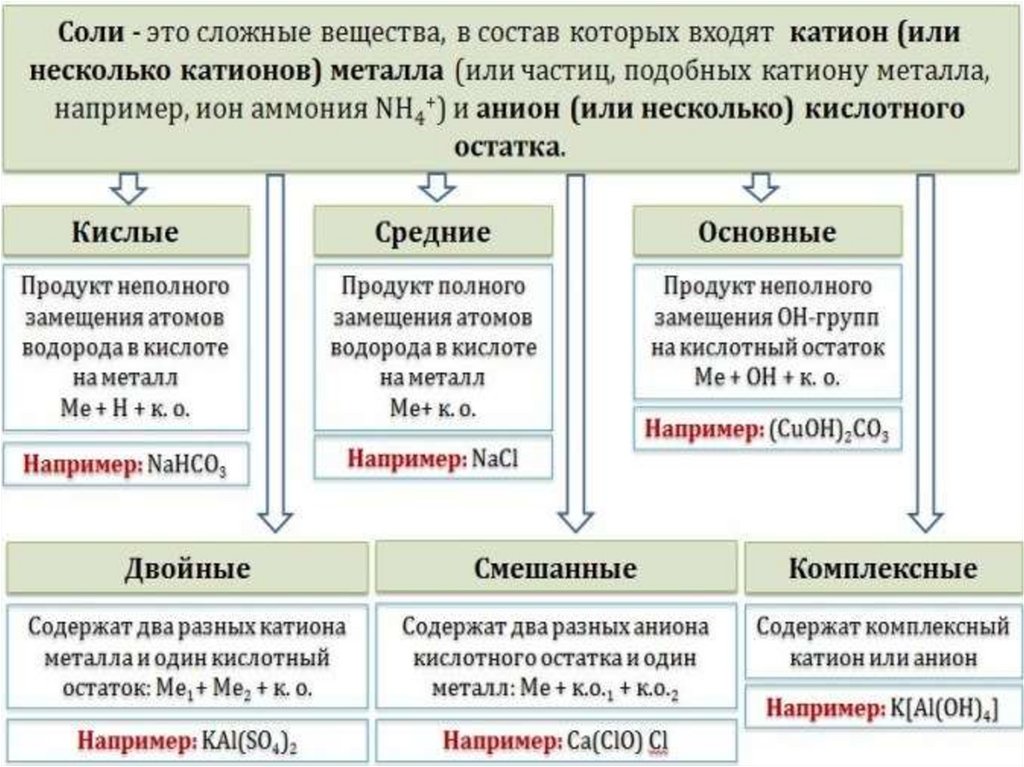
Что такое соль
Классификация солей
Способы получения
Физические свойства
Химические свойства солей
Применение солей в народном хозяйстве
3.
Солями называются сложные веществаформула молекулы которых, состоит из
атомов металлов и кислотных остатков
(иногда могут содержать водород).
Например, NaCl – хлорид натрия,
СаSO4 – сульфат кальция и т. д.
где М – металл, Ас – кислотный остаток, n – число атомов металла,
равное заряду иона кислотного остатка, m – число ионов кислотного
остатка, равное заряду иона металла.
4.
5.
Исключением являются соли аммония, в которых с кислотнымиостатками связаны не атомы металла, а частицы NH4+. Примеры
типичных солей приведены ниже.
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
(NH4)2SO4 – сульфат аммония.
6.
Названия солей составляются из названия кислотного остатка иназвания металла. Главным в названии является кислотный остаток.
Соль
кислоты
какой Кислотный
остаток
Валентность
остатка
Название солей
Примеры
Азотная HNO3
NO3-
I
нитраты
Ca(NO3)2
кальция
нитрат
Кремниевая
H2SiO3
SiO32-
II
силикаты
Na2SiO3
натрия
силикат
Серная H2SO4
SO42-
II
сульфаты
PbSO4 сульфат свинца
Угольная H2CO3 CO32-
II
карбонаты
Na2CO3
натрия
Фосфорная
H3PO4
III
фосфаты
AlPO4
алюминия
PO43-
карбонат
фосфат
В верхней части таблицы приведены кислородсодержащие кислотные
остатки, в нижней – бескислородные.
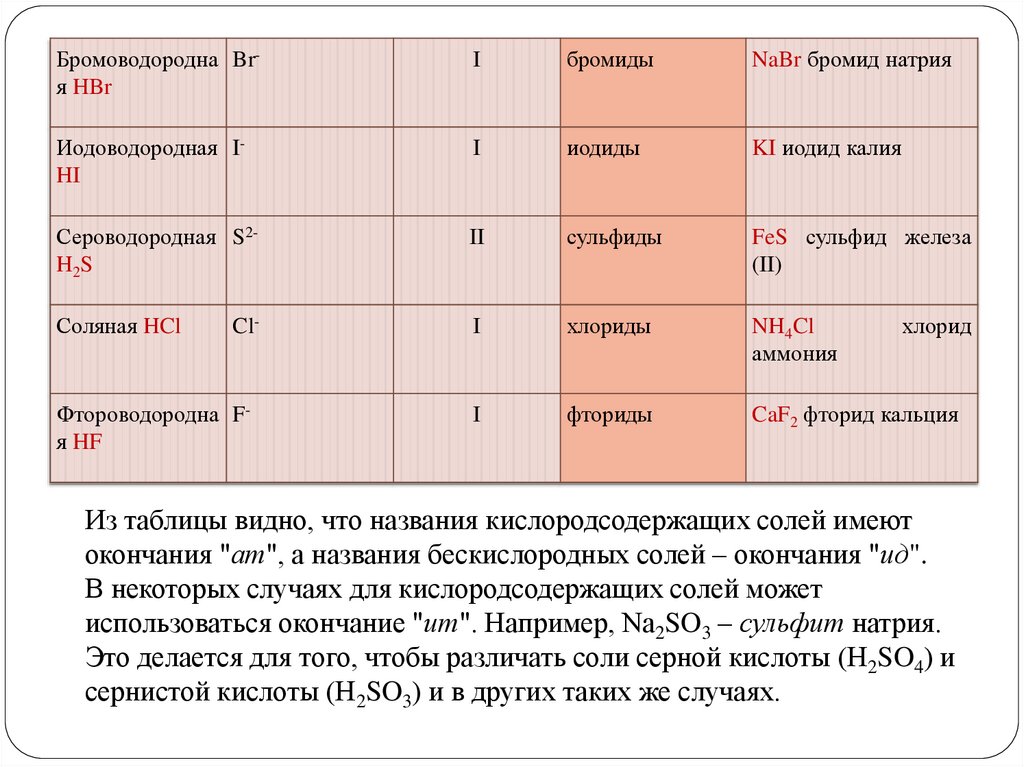
7.
Бромоводородна Brя HBrI
бромиды
NaBr бромид натрия
Иодоводородная IHI
I
иодиды
KI иодид калия
Сероводородная S2H2S
II
сульфиды
FeS сульфид железа
(II)
Соляная HCl
I
хлориды
NH4Cl
аммония
I
фториды
CaF2 фторид кальция
Cl-
Фтороводородна Fя HF
хлорид
Из таблицы видно, что названия кислородсодержащих солей имеют
окончания "ат", а названия бескислородных солей – окончания "ид".
В некоторых случаях для кислородсодержащих солей может
использоваться окончание "ит". Например, Na2SO3 – сульфит натрия.
Это делается для того, чтобы различать соли серной кислоты (H2SO4) и
сернистой кислоты (H2SO3) и в других таких же случаях.
8.
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены наатомы металла. Пример. 2KOH + H2CO3 = K2CO3 + 2H2O
карбонат калия
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они
получаются при нейтрализации основания избытком кислоты.
Пример. NaOH + H2CO3 = NaHCO3 + H2O
гидрокарбонат натрия
Осно́вные соли — гидроксогруппы основания (OH-) частично замещены кислотными
остатками.
Пример. Mg(OH)2 + HCl = MgOHCl + H2O
гидроксохлорид магния
Двойные соли — в их составе присутствует два различных катиона, получаются
кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми
анионами, т.е состоят из различных атомов металлов и общего кислотного остатка
Пример. K2SO4 + Al2(SO4)3 = 2KAl(SO4)2
сульфат алюминия - калия
9.
Смешанные соли — состоят из общего металла и различных кислотных остатков .Пример. CuOHNO3 + CH3COOH = CuCH3COONO3 + H2O
нитрат-ацетат меди (II)
Гидратные соли (кристаллогидраты) — в их состав входят молекулы
кристаллизационной воды.
Комплексные соли — в их состав входит комплексный катион или комплексный
анион. Содержат сложные ионы.
K4 [Fe(CN)6]
жёлтая кровяная соль
10.
Соли получают при химическом взаимодействиисоединений различных классов и простых веществ.
1. Реакция
нейтрализации:
Ca(OH)2 + H2CO3 =
= CaCO3 + 2H2O
карбонат
кальция
2. Взаимодействие
металлов с
неметаллами:
3. Взаимодействие
металлов с
кислотами:
2Al + 3S = Al2S3
Zn + 2HCl = ZnCl2 + H2
сульфид
алюминия
хлорид
цинка
11.
4. Взаимодействие основныхоксидов с кислотными оксидами.
CaO + SiO2 = CaSiO3
силикат
кальция
5. Взаимодействие оснований с
кислотными оксидами.
Ca(OH)2 + CO2 = CaCO3 + H2O
карбонат
кальция
12.
Соли, за небольшим исключением,являются твёрдыми
кристаллическими веществами
различного цвета.
По растворимости в воде их делят на:
• растворимые
• малорастворимые
• нерастворимые
13.
1)2)
Соли взаимодействуют:
C простыми веществами – металлами и неметаллами.
со сложными – кислотами, основаниями и солями.
1. С металлами:
CuSO4 + Fe = FeSO4 + Cu
сульфат
меди (II)
сульфат
железа (II)
2. С неметаллами:
2KI + Br2 = 2KBr + I2
иодид
калия
бромид
калия
14.
3. С кислотами:4. С щелочами:
2NaCl + H SO4 =
хлорид натрия 2
FeCl2 + 2NaOH =
= Na2SO4 + 2HCl
сульфат натрия
хлорид железа (II)
5. С солями:
AgNO3 + KCl =
нитрат серебра
=AgCl + KNO3
=Fe(OH)2 + 2NaCl
хлорид натрия
хлорид серебра
15.
Соли соляной кислоты. Из хлоридов больше всегоиспользуют хлорид натрия и хлорид калия.
Хлорид натрия (поваренную соль) выделяют из озерной и
морской воды, а также добывают в соляных шахтах.
Поваренную соль используют в пищу. В промышленности
хлорид натрия служит сырьём для получения хлора,
гидроксида натрия и соды.
Хлорид калия используют в сельском хозяйстве как
калийное удобрение.
Соли серной кислоты. В строительстве и в медицине
широко используют полуводный гипс, получаемый при
обжиге горной породы (дигидрат сульфата кальция).
Будучи смешан с водой, он быстро застывает, образуя
дигидрат сульфата кальция, то есть гипс.
Декагидрат сульфата натрия используют в качестве сырья
для получения соды.
16.
Соли азотной кислоты. Нитраты больше всего используют вкачестве удобрений в сельском хозяйстве. Важнейшим из них
является нитрат натрия, нитрат калия, нитрат кальция и
нитрат аммония. Обычно эти соли называют селитрами.
Соли угольной кислоты. Карбонат кальция используют в
качестве сырья для получения извести.
Карбонат натрия (соду) применяют в производстве стекла и
при варке мыла.
Карбонат кальция в природе встречается и в виде известняка,
мела и мрамора.















 Химия
Химия








