Похожие презентации:
Основы электрохимии. Электрохимические процессы
1.
http://www.kgasu.ru/images/material-images/10%20Elektrokhimiya.ppt
2.
ОСНОВЫЭЛЕКТРОХИМИИ
Электрохимические процессы
3.
Электрохимия - это наука, котораяизучает процессы,
либо протекающие с возникновением
электрического тока,
либо вызванные электрическим
током.
4.
5.
6.
Второй способ проведения ОВРГальванический элемент Якоби- Даниэля
электродные процессы:
_
e
Zn
(-) A: Zn0 – 2e
Cu
(+) K: Cu2+(р-р) + 2e
Zn2+(р-р)
Cu0
Zn + Cu2+ = Zn2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
ZnSO4 CuSO4
Краткая схема Г.Э.:
(-) А: Zn| ZnSO4|| CuSO4|Cu (+)K
7.
8.
Электродвижущая сила (ЭДС)E
ок ль
в ль
9.
Возникновение электродного потенциалаMez+(металл)
Mez+(раствор)
Cu
Zn
+φ
+φ
∆ φ = φ+
∆ φ = φ–
электродный потенциал
–φ
–φ
10.
При изучении потенциалов различных электродных процессовустановлено, что их величины зависят от трех факторов:
1) от природы веществ - участников электродного процесса,
2) от соотношения между концентрациями этих веществ и
3) от температуры системы.
Эту зав-сть выражает
(В. Нернст, 1889 г.):
RT
Ox
2 ,3
lg
nF Re d
0
0 ,059
Ox
lg
Re d
n
0
Me n
Me 0
0 ,059
lg Me n
n
0
11.
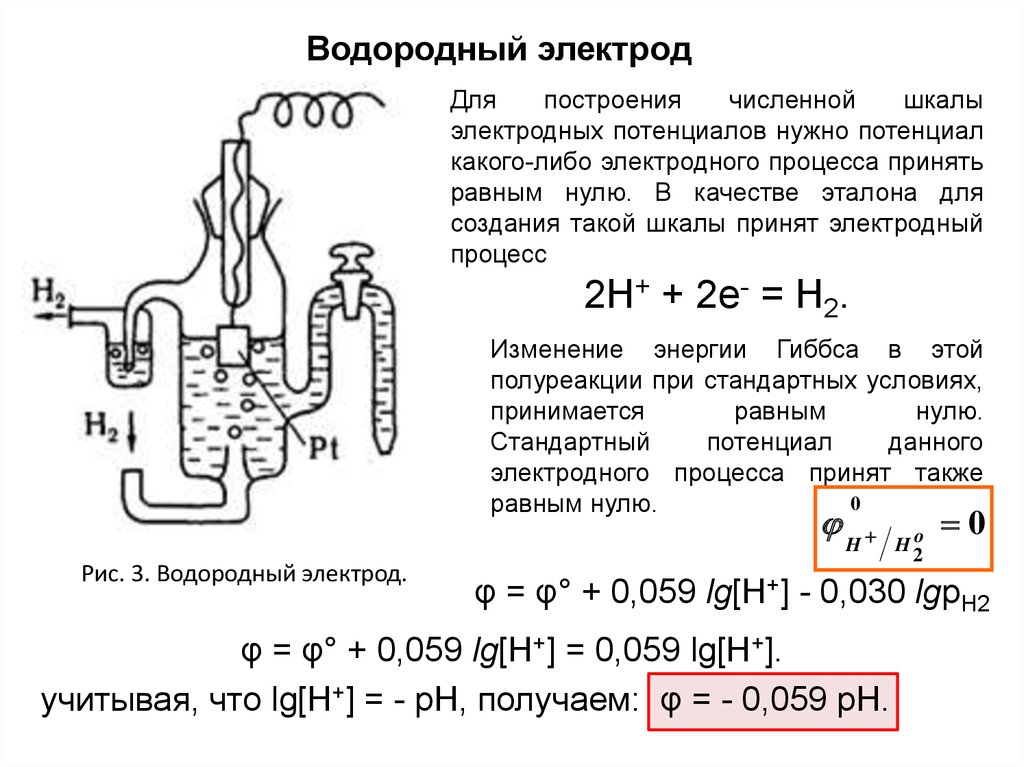
Водородный электродДля
построения
численной
шкалы
электродных потенциалов нужно потенциал
какого-либо электродного процесса принять
равным нулю. В качестве эталона для
создания такой шкалы принят электродный
процесс
2Н+ + 2е- = Н2.
Изменение энергии Гиббса в этой
полуреакции при стандартных условиях,
принимается
равным
нулю.
Стандартный
потенциал
данного
электродного процесса принят также
0
равным нулю.
H
Рис. 3. Водородный электрод.
Ho
2
0
φ = φ° + 0,059 lg[H+] - 0,030 lgpH2
φ = φ° + 0,059 lg[H+] = 0,059 lg[H+].
учитывая, что lg[H+] = - рН, получаем: φ = - 0,059 рН.
12.
13.
Pt, H2 | H2SO4 || H2SO4 | H2, Ptφ1 = - 0,059 рН1
φ2 = - 0,059 рН2
E 0 ,059 pH
14.
Задача 1. Определить знаки электродов в гальван. эл-теCo|CoCI2||AICI3|AI, указать анод и катод, объяснить механизм
возникновения тока в данном элементе.
Решение:
0
Co
0 ,27 B
2
/ Co0
0Al 3 / Al 0 1,66 B
е–
А(-)
(+)К
Возникновение эл.тока в данном ГЭ связано с разной поляризацией
электродов и протеканием ОВР.
15.
• С.Б. Бурухин, О.А. Ананьева• «Введение в электрохимию»
16. Физические типы кристаллических решеток
• В зависимости от природы частиц,находящихся в узлах кристаллической
решетки, и от характера сил
взаимодействия между частицами
различают четыре типа кристаллических
решеток и соответственно четыре типа
кристаллов: ионные, атомные,
металлические и молекулярные.
17. Типы кристаллов
• Ионные кристаллыВ узлах кристаллической решетки
располагаются ионы разных знаков.
Силы взаимодействия между ними
являются в основном
электростатическими - кулоновского
происхождения.
18. Типы кристаллов
• Атомные кристаллы• В узлах кристаллической решетки
размещаются нейтральные атомы.
Связь, объединяющая в кристалле (а
также и в молекуле) нейтральные
атомы, ковалентная.
19. Типы кристаллов
• Характерные примеры атомныхкристаллов – алмаз и графит.
• Абсолютно идентичные по химической
природе (элемент С из 6 группы), они
совершенно различаются
кристаллическим строением:
20. АЛМАЗ ГРАФИТ
21. Типы кристаллов
• Металлические кристаллы• Во всех узлах кристаллической
решетки расположены положительные
ионы металла. Между ними
беспорядочно, подобно молекулам
газа, движутся электроны –
электронный газ.
22. Типы кристаллов
• Молекулярные кристаллы• В узлах кристаллической решетки
помещаются определенным образом
ориентированные молекулы. Силы связи
между молекулами в кристалле имеют ту
же природу, что и силы притяжения между
молекулами
• Ван-дер-Ваальса – или водородная связь.
23. Типы кристаллов
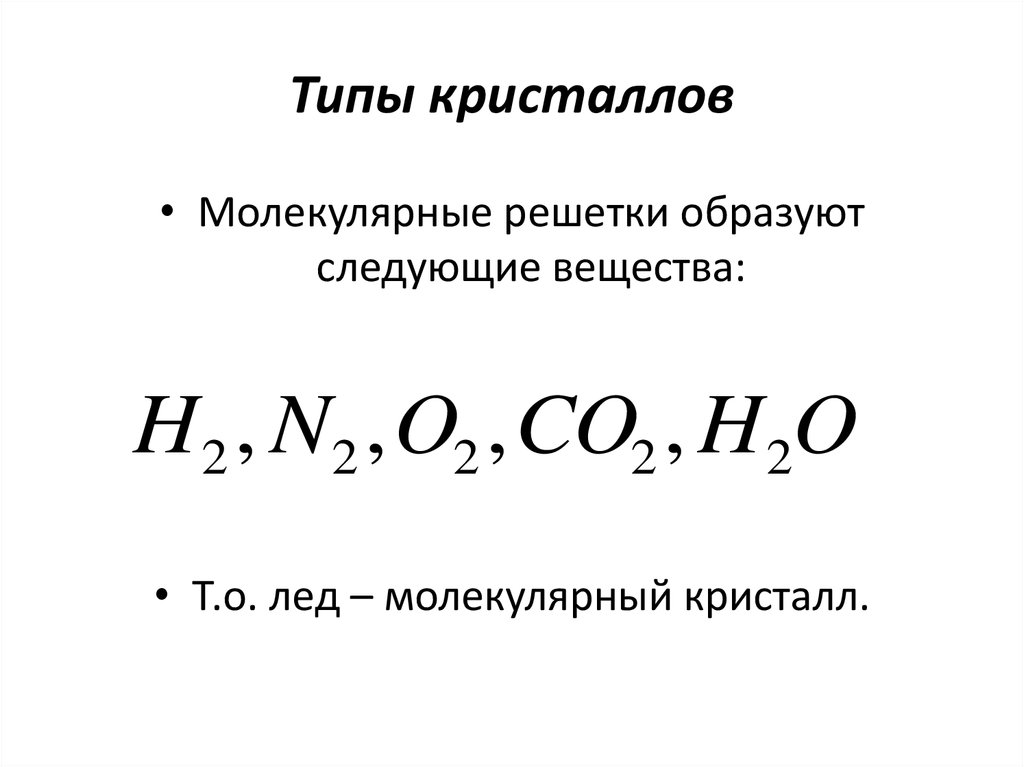
• Молекулярные решетки образуютследующие вещества:
H 2 , N2 , O2 , CO2 , H 2O
• Т.о. лед – молекулярный кристалл.





















 Химия
Химия