Похожие презентации:
Нептуний
1.
НЕПТУНИЙ2.
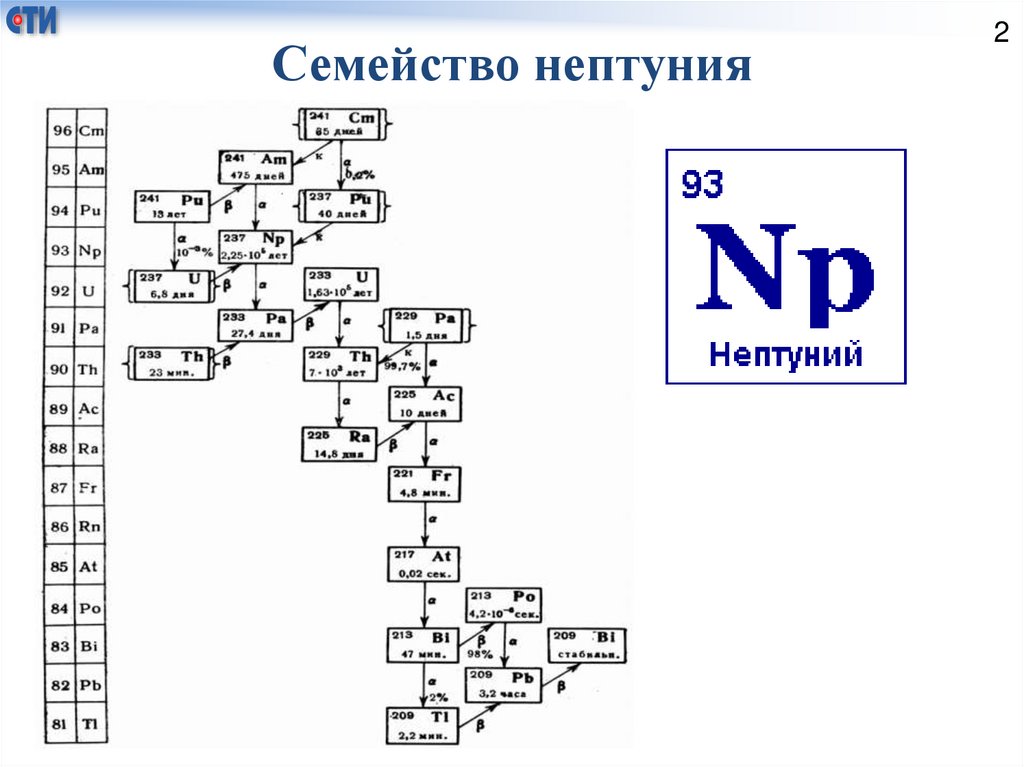
Семейство нептуния2
3.
3Нептуний (лат. Neptunium), Np, искусственно полученный
радиоактивный химический элемент семейства актиноидов;
• атомный номер 93
• атомная масса 237,0482.
Открыт в 1940 году американскими учеными Э. M.
Макмилланом и Ф. X. Эйблсоном, которые установили, что
изотоп урана 239U, образующийся при облучении 238U
нейтронами, быстро распадается, испуская β-частицу, и
превращается в изотоп элемента с атомным номером 93.
Название происходит от планеты Нептун.
4.
4К 1973 году получено 15 изотопов Нептуния; самый
долгоживущий 237Np (α-излучатель, Т½ = 2,14·106 лет).
В исследовательских работах широко используется βрадиоактивный изотоп 239Np (Т½ = 2,346 сут).
Изотоп 237Np в результате последовательных
превращений дает стабильный изотоп 209Bi; цепочку
этих превращений называют радиоактивным рядом
Нептуния. Ничтожные количества 237Np и 239Np
найдены в урановых рудах, где эти изотопы непрерывно
образуются за счет ядерных реакций урана с
нейтронами.
Элементарный Нептуний - ковкий, сравнительно
мягкий металл с серебристым блеском; плотность около
20 г/см3, tпл 640°C.
5.
СвойстваКонфигурация трех внешних электронных оболочек
атома Np 5s25p65d105f46s26d17s2; при образовании его
химических соединений участвуют 5f-, 6d- и 7s-электроны.
По химическим свойствам Нептуний во многом сходен с
ураном и плутонием. В соединениях имеет степени
окисления от +2 до +7. В растворах Нептуний образует
ионы Np3+, Np4+, NpO2+ (наиболее устойчив), NpO22+ и
NpO53-. Ионы Нептуния склонны к гидролизу и
комплексообразованию.
Весомые количества изотопа 237Np образуются в
качестве побочного продукта при производстве плутония в
ядерных реакторах за счет ядерных реакций урана с
нейтронами. Используется Нептуний в основном для
научно-исследовательских целей.
5
6.
Нептуний - хрупкий серебристо-белый металл. Известен в трех6
полиморфных модификациях:
• ниже 280 °С устойчива a-форма с орторомбической решеткой (а = 0,472 нм, b
= 0,488 нм, с = 0,666 нм, пространств. группа Pmcn);
• в интервале 280-576 °С устойчива р-форма с тетрагональной решеткой (а =
0,489 нм, с = 0,338 нм);
• выше 576 °С существует модификация с кубической гранецентрированной
решеткой (а = 0,343 нм).
• т.пл. 639 °С, т.кип. 4082 °С;
• рентгеновская плотность 20,45 г/см3;
• С0р 29,62 Дж/(моль.К);
• DH0возг 561 кДж/моль;
• S0298 50,45 Дж/(моль.К);
• Нептуний в интервале 1700-1950 К: lgp(мм рт.ст.) = -22370/T + 5,196;
металлич. нептуний парамагнитен.
• Нептуний весьма реакционноспособен, растворяется в разб. НСl с
образованием ионов Np3+ в присутствии восстановителей или Np4+ в
присутствии воздуха. При нагревании нептуния в атмосфере Н2
образуются гидриды переменного состава NpH2+x (х = 0-0,7), а также NpH3черные кристаллы с металлическим блеском (а = 0,3771 нм, с = 0,6713 нм).
7.
Д и о к с и д NpO2
Получают прокаливанием гидроксида, нитрата, оксалата, ацетата, пероксида и др. соед.
Нептуний в любой степени окисления при 600-800 °С, окислением нептуния
на воздухе при 800-1000 °С или восстановлением высших оксидов нептуния оксидом
углерода.
Оксид Np3O8 получают нагреванием гидроксида NpO2OH.xH2O в токе О2 при 300-450 °С.
Оксиды нептуния в твердом состоянии реагируют с оксидами щелочных и щелочноземельных металлов, образуя нептунаты (IV,V,VI,VII), напр. Na2NpO4, Li5NpO6.
Т р и ф т о р и д NpF3 и трихлорид NpCl3
синтезируют взаимод. NpO2 соотв. с эквимолярной смесью Н2 с HF (при 500 °C и Н2 с
ССl4 при 350 °С);
Т р и б р о м и д NpBr3 и т р и и о д и д NpI3
p-цией NpO2 с избытком смеси Аl соотв. с АlВr3 при 350-400 °С или АlI3 при 500 °С.
Нагреванием NpO2 в токе HF при 500 °С, ССl4 при 450-530 °С или взаимод. NpO2 с
АlВr3 при 350 °С получают соответствующие тетрагалогениды NpX4 (X = F, Cl, Вr).
Т е т р а ф т о р и д NpF4
плохо раств. в воде и орг. р-рителях;
при 500 °С восстанавливается Н2 до NpF3,
с F2 выше 250 °С образует г е к с а ф т о р и д NpF6 (в парообразном состоянии
бесцветный).
Для NpF6 т.пл. 55 °С, т. кип. 55,18°С;
давление пара 27 кПа (273 К), 167 кПа (298 К);
на свету разлагается;
бурно реагирует с водой.
7






 Химия
Химия








